
ISSN 1666-7948
Revista Electrónica de Ciencia y Educación
Departamento de Química Biológica FCEN-UBA IQUIBICEN

ISSN 1666-7948
Revista Electrónica de Ciencia y Educación
Departamento de Química Biológica FCEN-UBA IQUIBICEN
¿Sirve la investigación básica? Las células CAR-T
Silvina Gazzaniga
Departamento de Química Biológica. Facultad de Ciencias Exactas y Naturales. Universidad de Buenos Aires
La inmunoterapia es un tratamiento que potencia o suprime el funcionamiento del sistema inmunitario para que este pueda detectar y atacar las células cancerosas o mejorar una enfermedad autoinmune, respectivamente.
Las células CAR-T (del inglés, Chimeric Antigen Receptor T Cells) son una estrategia avanzada de inmunoterapia celular que implica la modificación genética de linfocitos T autólogos para que expresen receptores quiméricos, capaces de reconocer específicamente antígenos presentes en la superficie de la célula blanco. Este enfoque ha mostrado resultados particularmente prometedores en el tratamiento de leucemias hematológicas y linfomas, como la leucemia linfoblástica aguda de células B y el linfoma difuso de células B grandes. La introducción de estos receptores quiméricos permite que las células T reprogramadas reconozcan antígenos tumorales, como el CD19, en la superficie de las células malignas, desencadenando una respuesta inmunitaria dirigida. Pero este gran avance en las terapias contra el cáncer no se hubiese concretado sin paciencia y ciencia básica experimental. Los primero estudios fueron iniciados por Zelig Eshhar, en 1993 en el Instituto Weizmann en Israel pero esta primera generación de células CAR-T no eran capaces de persistir en el organismo ni generar un efecto clínico [1]. Recién en 2002 se desarrollaron las primeras células CAR-T capaces de sobrevivir, proliferar y destruir células de cáncer de próstata in vitro [2]. Finalmente en 2017 se convirtieron en terapias aprobados por la Administración de Drogas y Medicamentos de EE. UU y son conocidas actualmente como tisagenlecleucel y axicabtagene ciloleucel.
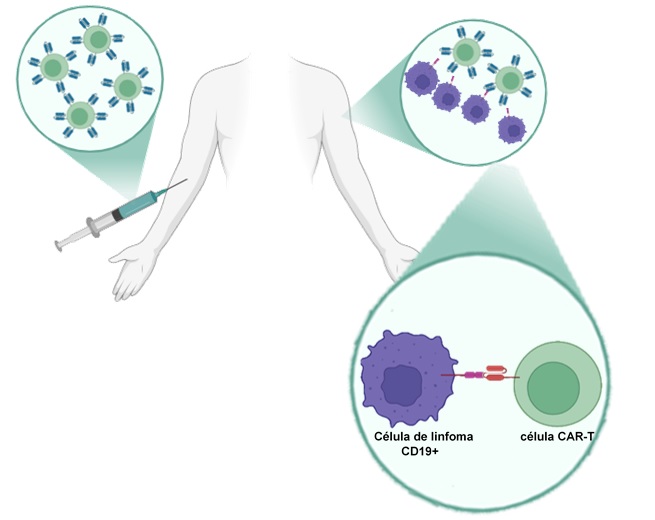
La modificación de las células T generalmente se realiza mediante la transducción de un vector viral que introduce el gen codificante para el receptor CAR en el genoma de las células T del paciente. Estas células una vez que se activaron, no solo destruyen la célula blanco sino que se dividen como un linfocito T activado normal. De hecho se ha observado que son capaces de mantenerse por al menos una década por observaciones en pacientes de los primeros ensayos clínicos [3]. Sin embargo, la terapia con células CAR-T no está exenta de desafíos. Los efectos secundarios más relevantes incluyen el síndrome de liberación de citoquinas, un fenómeno inflamatorio (del que escuchamos hablar durante la pandemia de COVID-19) que resulta de la activación masiva de las células T y la liberación de citoquinas proinflamatorias, lo que puede causar un cuadro clínico que varía desde fiebre hasta shock multiorgánico. La neurotoxicidad también es un efecto adverso significativo, que se manifiesta como disfunción cognitiva, confusión y convulsiones.
Los desafíos por superar incluyen la necesidad de una infraestructura compleja para la fabricación personalizada de las células CAR-T, el costo elevado del tratamiento y la posibilidad de recaídas debido a la pérdida de expresión del antígeno blanco. Además, se deben optimizar los protocolos de tratamientos en curso para la expansión de esta terapia a otros tipos de cáncer. Un obstáculo significativo en la terapia para tumores sólidos es la complejidad en la identificación de antígenos tumorales específicos y la presencia de un microambiente inmunosupresor. Pero las fronteras para estas terapias se expanden aún más allá del cáncer. Nuevas ideas surgen para el empleo de células CAR-T en insuficiencia cardíaca y enfermedades autoinmunes, entre otras [4, 5].
En conclusión, las células CAR-T representan una de las terapias más avanzadas en el campo de las inmunoterapias celulares. No obstante, persisten retos relacionados con la accesibilidad, la gestión de efectos adversos y la expansión de su uso a otros tipos de patologías, lo que requiere de mucha investigación adicional para el desarrollo de nuevas generaciones de CAR y optimización de los protocolos terapéuticos.
Como mensaje final, me quedo con las palabras del Dr. Carl June, de la Facultad de Medicina Perelman de la Universidad de Pensilvania: «Apoyar la ciencia es esencial para hacer posibles futuras curas» [6].
Referencias:
1. Marcus A, Eshhar Z (2011). Tumor-specific allogeneic cells for cancer therapy. Expert opinion on biological therapy, 11: 1551–1554. https://doi.org/10.1517/14712598.2011.628934
2. Maher J, Brentjens R, Gunset G et al. (2002)Human T-lymphocyte cytotoxicity and proliferation directed by a single chimeric TCRζ /CD28 receptor. Nat Biotechnol 20: 70–75. https://doi.org/10.1038/nbt0102-70.
3. Melenhorst JJ, Chen GM, Wang M, Porter DL., Chen C, Collins MA, Gao P, Bandyopadhyay S, Sun H, Zhao Z, Lundh S, Pruteanu-Malinici I, Nobles CL, Maji S, Frey NV, Gill, SI, Loren AW, Tian, L, Kulikovskaya I, Gupta M, … June CH. (2022). Decade-long leukaemia remissions with persistence of CD4+ CAR T cells. Nature, 602: 503–509. https://doi.org/10.1038/s41586-021-04390-6).
4. Rurik JG, Tombácz I, Yadegari A, Méndez Fernández PO, Shewale SV, Li L, Kimura T, Soliman OY, Papp TE, Tam YK, Mui BL, Albelda SM, Puré E, June CH, Aghajanian H, Weissman D, Parhiz, H, Epstein JA. (2022). CAR T cells produced in vivo to treat cardiac injury. Science (New York, N.Y.), 375: 91–96. https://doi.org/10.1126/science.abm0594.
5. Baker DJ, Arany Z, Baur JA et al. (2023) CAR T therapy beyond cancer: the evolution of a living drug. Nature 619: 707–715. https://doi.org/10.1038/s41586-023-06243-w.
6. https://www.pennmedicine.org/news/news-blog/2023/august/carl-june-on-the-boundless-potential-of-car-t-cell-therapy, accesado 01/04/2025.
 ISSN 1666-7948 www.quimicaviva.qb.fcen.uba.ar |
Revista QuímicaViva Volumen 24, Número 1, Abril de 2025 |
Publicado en:
Vol 24, Nro 1
Abril de 2025
Identificador: E0289
DOI:10.62167/qv.e0289
Tipo: Editorial
Contacto: Silvina Gazzaniga