
ISSN 1666-7948
Revista Electrónica de Ciencia y Educación
Departamento de Química Biológica FCEN-UBA IQUIBICEN

ISSN 1666-7948
Revista Electrónica de Ciencia y Educación
Departamento de Química Biológica FCEN-UBA IQUIBICEN
Evaluación del potencial antimicrobiano del extracto y fracciones de Lafoensia acuminata (Ruiz & Pav) DC
Diana Carolina Corzo Barragán y Doris Gutiérrez Hernández
Jardín Botánico de Bogotá José Celestino Mutis, Bogotá, Colombia.
Resumen
El Guayacán de Manizales (Lafoensia acuminata) es conocida comúnmente por su uso ornamental en zonas urbanas de Bogotá D.C. Sin embargo, debido al desconocimiento de otros posibles usos, se evaluó su potencial antimicrobiano y se analizó el perfil fitoquímico. Las hojas secas fueron sometidas a maceración con etanol al 96%. La metodología seguida se basó en un estudio biodirigido, lo que implicó realizar un fraccionamiento secuencial con disolventes orgánicos (hexano, cloroformo, acetato de etilo y etanol) del extracto crudo. El extracto y las fracciones fueron evaluadas frente a Staphylococcus aureus, Pseudomona aeruginosa y Candida sp. Las fracciones en acetato de etilo y en etanol fueron las más activas, por lo cual, se sometieron a un nuevo fraccionamiento mediante una columna líquida al vacío con sílica gel. Este proceso permitió obtener 9 subfracciones a partir de la fracción en etanol identificadas como Fr-EtOH y 11 subfracciones obtenidas a partir de la fracción de acetato de etilo identificadas como Fr-AcOEt. De las cuales, se destacaron Fr-EtOH-3 y Fr-AcOEt-6 como las más activas frente a los microorganismos evaluados cuya concentración mínima inhibitoria fue de 7.5 mg/mL tanto para P. aeruginosa como para S. aureus. Estos resultados sugieren un nuevo potencial de uso para la especie, ya que, se ha evidenciado su actividad antimicrobiana contra distintas cepas de microorganismos. Estos hallazgos podrían abrir nuevas perspectivas para el aprovechamiento en aplicaciones farmacéuticas o cosméticas y posiblemente, en otros campos aún por explorar.
Palabras clave: actividad antibacteriana; extracto etanólico; difusión en agar; Guayacán de Manizales; productos naturales.
Evaluation of the antimicrobial potential of the extract and fractions of Lafoensia acuminata (Ruiz & Pav) DC
Summary
Guayacán de Manizales (Lafoensia acuminata) is commonly known for its ornamental use in urban areas of Bogotá D.C. However, due to the lack of knowledge of other possible uses, its antimicrobial potential was evaluated, and the phytochemical profile was analyzed. Dry leaves were macerated with 96% ethanol. The methodology followed was based on a bioguided study, which involved performing sequential fractionation of the crude extract with organic solvents (hexane, chloroform, ethyl acetate and ethanol). The extract and fractions were evaluated against Staphylococcus aureus, Pseudomona aeruginosa and Candida sp. The fractions in ethyl acetate and ethanol were the most active, therefore, they were summited to a new fractionation using a vacuum liquid column with silica gel. This process allowed to obtain 9 subfractions from ethanol fraction (Fr-EtOH) and 11 subfractions from ethyl acetate fraction (Fr-AcOEt). The subfrations Fr-EtOH-3 and Fr-AcOEt-6 stood out as the most active against the microorganisms evaluated, with minimum inhibitory concentration of 7.5 mg/mL for both P. aeruginosa and S. aureus. These results suggest a new potential use for the species, since its antimicrobial activity against different strains of microorganisms has been demonstrated. These findings could open new prospects for use in pharmaceutical or cosmetic applications and, possibly in other fields yet to be explored.
Keywords: ethanolic extract, agar diffusion, Guayacán de Manizales, natural products
Introducción
Las plantas han sido utilizadas por el hombre desde la antigüedad con diferentes propósitos, como alimento, en la elaboración de herramientas, para tratar sus dolencias, entre otros. Muchos de los usos tradicionales de las plantas han sido corroborados por la ciencia, al encontrar los compuestos responsables de las propiedades que se les reconocían. Algunos de estos compuestos siguen siendo utilizados como medicamentos efectivos en el tratamiento de diferentes enfermedades. Uno de los ejemplos que se pueden citar es la morfina que desde 1820 fue aislada del opio (Papaver somniferum) y actualmente, se utiliza como un potente analgésico. A partir de su estructura, se obtuvo un derivado semisintético conocido como oxicodona, compuesto analgésico con un menor efecto narcótico [1].
A pesar de los avances alcanzados en la química sintética, la representación de los productos naturales en los medicamentos que se encuentran en el mercado sigue siendo muy destacado, yasea, porque las moléculas naturales son efectivas o porque se pueden encontrar compuestos líderes a partir de los cuales se pueden obtener derivados semisintéticos o compuestos sintéticos inspirados en las estructuras naturales [2]. Esto demuestra la importancia de la quimiodiversidad de los organismos naturales y el potencial de las especies vegetales que no han sido estudiadas como fuentes de nuevas entidades moleculares. Por tanto, la biodiversidad en flora resulta muy importante teniendo en cuenta que también estará representada en diversidad química. De tal manera, que la biodiversidad de Colombia [3] es un recurso que puede ser aprovechado de manera sostenible. En ese sentido, los estudios fitoquímicos resultan importantes porque buscan aislar e identificar metabolitos secundarios, responsables de diferentes propiedades de las plantas y mediante bioensayos identifica su actividad biológica, entre las que se encuentran, actividad antimicrobiana, insecticida, fungicida, citotóxica, antinflamatoria, entre otras [4].
Los microorganismos como hongos y bacterias causan infecciones a los humanos y el uso indiscriminado de antibióticos ha conducido a que éstos hayan desarrollado resistencia a algunos de los medicamentos [5]. Por lo anterior, es necesario buscar nuevas sustancias con la capacidad de actuar sobre dichos microorganismos [6,7]. En la búsqueda de estos nuevos compuestos, la bioprospección de productos vegetales es una estrategia para evaluar el potencial de las plantas con diferentes propósitos y con ello encontrar nuevas fuentes de compuestos químicos aprovechables en diferentes industrias y darle un uso distinto a los ya reportados o conocidos culturalmente para una especie.
Colombia es el segundo país con mayor biodiversidad de flora [3], lo que se traduce en diversidad química de los metabolitos secundarios que producen las plantas. Esto significa que las especies vegetales son una fuente de compuestos naturales bioactivos que se pueden aprovechar con diferentes propósitos, como materias primas con ingrediente activos o realizar nuevos desarrollos con base en las estructuras moleculares para la obtención de nuevas entidades químicas que pueden llegar a convertirse en nuevos medicamentos, agroquímicos [8]. La importancia de investigar en los productos naturales se ve reflejado en el número de nuevos medicamentos aprobados en los últimos años, de los cuales un 54% son sustancias de origen natural o estructuras relacionadas (derivados semisintéticos y compuestos miméticos) [9].
El arbolado de la ciudad de Bogotá D.C. cuenta con especies nativas entre las cuales se encuentra el Guayacán de Manizales cuyo nombre científico es Lafoensia acuminata (Ruiz & Pav.) DC. es una especie nativa de los Andes, de la familia Lythraceae, su uso principal es como ornamental, esta especie se destaca por su amplia distribución y por la importancia para la conservación de biodiversidad de insectos y aves [10] y se ha observado que es altamente resistente a la contaminación y por su capacidad en la captura de carbono (CO2) [11].
Algunas especies de la familia presentan reportes relacionados con su composición química [12,13,14]. Lafoensia pacari ha sido usada en medicina tradicional para el tratamiento de úlceras gástricas, heridas y fiebre; los reportes de actividad biológica han mostrado propiedades antimicrobianas, antivirales, citotóxicas [15;16,17]. El extracto etanólico de las hojas de L. acuminata mostró inhibición del crecimiento de E. coli, S. aureus y Candida sp.[18]. Debido a estos antecedentes, en la presente investigación se evaluó el potencial antimicrobiano del extracto etanólico y sus fracciones a partir de las hojas sobre cepas de bacterias de importancia clínica.
Materiales y métodos
Material vegetal
El material vegetal utilizado en el estudio fue colectado en el arbolado público de la ciudad de Bogotá (CISB 881). Se seleccionaron hojas sanas, las cuales fueron limpiadas y secadas en un horno con corriente de aire caliente a 40°C. El material seco se redujo en tamaño y se sometió a maceración con etanol al 96% por 8 días en una relación (1:10). Posteriormente, se filtró y se concentró a presión reducida en rotoevaporador (Heidolph) a 40 °C.
Extracto y su fraccionamiento
El extracto crudo de hojas se obtuvo por medio de la maceración con etanol al 96% el cual, se sometió a fraccionamiento secuencial con disolventes de distinta polaridad: hexano (Fr-Hex), cloroformo (Fr-CH3Cl), acetato de etilo (Fr-AcOEt) y etanol (Fr-EtOH).
Marcha fitoquímica
La marcha fitoquímica del extracto crudo se realizó siguiendo el protocolo establecido por [19]. Los ensayos realizados para la detección de alcaloides fueron Draggendorff, Wagner, Hagger; Para triterpenos y esteroides se usaron las pruebas de Lieberman-Buchard, Salkowski; Para fenólicos se utilizó cloruro férrico, para taninos se realizó la prueba de gelatina sal, saponinas se evaluó con la prueba de espuma, para flavonoides se hizo la prueba de Shinoda y Leucoentocianidinas, Baljet se usó para determinar compuestos lactónicos, Erlich para cumarinas y reacciones acido-base para establecer la presencia de quinonas.
Ensayos de actividad antibacteriana del extracto crudo y fracciones
La actividad antimicrobiana de los extractos vegetales se evaluó mediante el bioensayo de difusión en agar en pozos. En el ensayo se utilizaron cepas bacterianas de Staphylococcus aureus (ATCC 6538) y Pseudomonas aeruginosa (ATCC 25922) y una levadura Candida sp. las cuales fueron suministrados por el banco de microorganismos del Jardín Botánico de Bogotá. Las bacterias se reactivaron en agar nutritivo y fueron incubadas a 35 ± 2 °C por 24 horas y Candida sp se reactivó en agar PDA y se incubó a 25 ± 2 °C por 48 horas. Una vez el microorganismo creció se tomaron de 2 a 5 colonias con un asa y se diluyó en el tubo que contenía la solución salina estéril al 0.85%, el cual se ajustó por comparación con el patrón 0.5 de Mcfarland. Una vez se obtuvo la suspensión con la concentración adecuada,se realizó siembra masiva usando 100 µL los cuales se dispusieron en cajas con agar Mueller-Hinton y se dejó secar por 10 minutos.
En cada una de las cajas se realizaron pozos de 6 mm en los que se colocaron 15 μL del extracto y fracciones a una concentración de 30 mg/mL disuelto en dimetilsulfóxido (DMSO). Se usó cloranfenicol como control positivo (2 mg/mL) para las bacterias y clotrimazol (100 μg/mL) para Candida sp. El control negativo fue en ambos casos DMSO. Las cajas se dejaron secar por 30 minutos antes de llevar a incubación a las temperaturas requeridas por cada microorganismo. Las lecturas de los halos de inhibición se realizaron a las 24 horas. Cada ensayo se realizó por cuadruplicado.
Los porcentajes de inhibición se calcularon con la siguiente fórmula:

Determinación de la concentración mínima inhibitoria (CMI)
Se determinó la concentración mínima inhibitoria de las fracciones que demostraron mayor capacidad inhibitoria en el crecimiento de los microorganismos evaluados. Se realizó utilizando el método de dilución en agar, mediante el uso de microplacas de 24 pozos. Se realizaron diluciones seriadas del extracto evaluando concentraciones de 30μl/ml, 15μl/ml, 7,5μl/ml, 3,75μl/ml, 1,875 μl/ml y 0,9375 μl/ml. En cada pozo se adicionaron 2 µL del inóculo del microorganismo con 1.5x106 UFC/mL, 2 μL dimetilsulfoxido (DMSO) como control negativo; como control positivo se usó 2 μL de cloranfenicol para bacterias y 2 μL de clotrimazol para Candida sp. Las microplacas se incubaron a 37 °C para bacterias y 25 °C para Candida sp. Las lecturas se realizaron a las 24 h. Cada concentración se evaluó por triplicado.
Análisis estadístico
El análisis estadístico de los datos se realizó en el programa InfoStat versión 2020p. Se realizaron análisis de normalidad mediante la prueba de Shapiro Wilks. A los que mostraron una distribución normal se les realizó Análisis de Varianza o ANOVA para determinar diferencias entre los tratamientos usando la prueba de Tukey con un nivel de significancia del 5% y los datos no paramétricos se analizaron mediante la prueba de Kruskal Wallis igualmente con un nivel de significancia del 5%.
Resultados
Se obtuvieron 35,868 g de extracto crudo que corresponde a un 14,9 % de rendimiento respecto al material vegetal en base seca. En el fraccionamiento realizado, la mayor masa correspondió a la obtenida en etanol, lo que indica que las sustancias que prevalecen en este extracto son principalmente sustancias polares. El análisis fitoquímico del extracto etanólico de hojas de L. acuminata estableció la presencia cualitativa de compuestos fenólicos, taninos, flavonoides, compuestos lactónicos y quinonas (Tabla I).
Tabla I. Análisis fitoquímico preliminar del extracto etanólico de las hojas de Lafoensia acuminata
| Ensayo | Metabolitos | Extracto crudo de Lafoensia acuminata |
|---|---|---|
| Dragendorff | Alcaloides | + |
| Wagner | - | |
| Hager | + | |
| Liebermann-Burchard | Triterpenoides y/o esteroides |
- |
| Salkowski | - | |
| Espuma | Saponinas | - |
| FeCl3 | Fenólicos/taninos | +++ |
| Shinoda | Flavonoides | + |
| Leucoantocianidinas | - | |
| Gelatina-sal | Taninos | ++ |
| Erlich | Cumarinas | + |
| Baljet | Compuestos lactónicos | +++ |
| Comportamiento ácido-base | Quinonas | ++ |
Convenciones: - negativo, + escaso, ++ abundante, +++ muy abundante
Evaluación antibacteriana del extracto y fracciones (Fr-Hex, Fr-CH3Cl, Fr-AcOEt y Fr-EtOH): Los resultados mostraron que la fracción en hexano (Fr-Hex) no fue activa frente a ninguno de los microrganismos evaluados.
Los datos se analizaron con la prueba de Shapiro-Wilks y se encontró que para S. aureus y P. aeruginosa presentaron una distribución normal; se evidenciaron diferencias estadísticas significativas entre los tratamientos (p<0.05), los datos obtenidos para Candida sp no presentaron una distribución normal y se aplicó la Prueba no paramétrica Kruskal Wallis, encontrando diferencias estadísticas significativas entre los tratamientos.
Las fracciones que presentaron mayores porcentajes de inhibición frente a S. aureus P. aeruginosa fueron Fr-AcOEt y Fr- EtOH y para Candida sp la fracción Fr- EtOH fue la más activa (Figura 1).
Fraccionamiento de las fracciones Fr-AcOEt y Fr-EtOH por cromatografía en columna líquida al vacío: De acuerdo con los resultados obtenidos en los bioensayos de actividad antimicrobiana se estableció que las fracciones con mayores porcentajes de inhibición de crecimiento de los microorganismos evaluados fueron las fracciones en etanol (Fr-EtOH) y en acetato de etilo (FrAcOEt). Por ello, se continuó con el fraccionamiento de ambas fracciones por medio de cromatografía en columna al vacío (CLV) en la que se utilizó como fase estacionaria sílica gel 60 HF 254+366 (para cromatografía de placa).
Fraccionamiento de la fracción en etanol (Fr-EtOH): Inicialmente, se estableció la fase móvil para la separación de Fr-EtOH por medio CCD, utilizando mezclas de hexano y acetato de etilo. Las placas fueron corridas, y posteriormente, reveladas utilizando una lámpara de UV a 254 nm y 365 nm. La proporción de estos disolventes que permitió una mayor distribución de las manchas por la placa fue la proporción hexano: acetato de etilo 6:4. A continuación, se realizó la separación cromatográfica de Fr-EtOH para lo cual se utilizó la técnica de cromatografía líquida al vacío (CLV). Se utilizó una columna de vidrio con frita de fibra de vidrio de 12 cm de alto y 6.6 cm de diámetro que se sujetó a un Kitasato, el cual se conectó a la bomba de vacío. En la columna se colocaron 80 g de sílica gel para columna en seco. 1.0 g de Fr-EtOH se redisolvió en etanol al 96% y absorbió en 5 g de sílica gel. Se permitió que el etanol se evaporara y se dispuso en la columna. Sobre la muestra se colocó papel filtro para evitar la flotación de la muestra. Las fases móviles utilizadas fueron mezclas de hexano y acetato de etilo en diferentes proporciones, a saber, 7:3 (500 mL), 5:5 (400 mL) y 3:7 (200 mL). Luego, se continuó con acetato de etilo puro (200 mL) y se continuó con mezclas de acetato de etilo y etanol en diferentes proporciones: 8:2 (300 ml), 6:4 (400 mL), 4:6 (400 mL), 2:8 (400 mL). Finalmente, se eluyó la columna con etanol 100% (1.0 L). En total se utilizaron 3.4 L de fase móvil.
En el desarrollo de la columna cromatográfica se colectaron 19 fracciones que fueron concentradas y llevadas a sequedad en el horno a 40°C. Posteriormente, se disolvieron en una pequeña cantidad de fase móvil y se chequearon por CCD en el orden de elución con el fin de reunirlas con base en los perfiles cromatográficos. Las placas fueron reveladas con luz UV a 254 nm y 365 nm y con yodo.
Fraccionamiento de la fracción en acetato de etilo (Fr-AcOEt): El proceso de fraccionamiento de FrAcOEt se realizó de manera similar a la descrita para Fr-EtOH. Inicialmente, se realizó el proceso de separación en CCD para definir el sistema de fase móvil. Se probaron dos mezclas de hexano y acetato de etilo, 8:2 y 6:4. De este ensayo se observó que los componentes de la mezcla son más polares que la fase móvil, por ello, la mezcla solo avanzó hasta un 30% de la placa con la mezcla de hexano y acetato de etilo 8:2. La fase móvil hexano y acetato de etilo 6:4 permitió que la mezcla se separara adecuadamente. 1.0 g de Fr-AcOEt se redisolvió en acetato de etilo y luego se colocó sílica gel para que ésta se absorbiera. Se permitió que el disolvente se evaporara y cuando la sílica con muestra estuvo completamente seca se depositó sobre la columna de sílica gel. Sobre la muestra se colocó papel filtro para evitar la flotación de la muestra. Las fases móviles utilizadas fueron mezclas de hexano y acetato de etilo en diferentes proporciones, a saber, 8:2 (900 mL) y 6:4 (900 mL), 2:8 (900 mL), 1:9 (600 mL). Luego, se continuó con acetato de etilo puro (900 mL) y se continuócon etanol al 96% (1.5L). Finalmente, se adicionaron 400 mL de agua desionizada. El total se utilizaron 6.1 L de fase móvil.
Con el desarrollo de la columna cromatográfica se colectaron 27 subfracciones que fueron luego concentradas y llevadas a sequedad en el horno a 40°C. A continuación, se disolvieron en fase móvil para realizar el chequeo de las subfracciones por CCD. En total se obtuvieron 11 fracciones.
Bioensayo con las fracciones Fr-EtOH: Las 9 fracciones se probaron frente a Staphylococcus aureus, Pseudomonas aeruginosa y Candida sp, la fracción 6 no fue activa frente a ninguno de los microorganismos evaluados, por lo tanto, ese dato no hizo parte del análisis estadístico (Figura 1). En el caso de Pseudomonas aeruginosa y Candida sp, se aplicó la prueba no paramétrica Kruskal Wallis y se encontraron diferencias estadísticas significativas entre los tratamientos, para S. aureus los datos no presentaron diferencias estadísticas significativas su significancia es mayor de 0.05. Para S. aureus, algunas de las subfracciones (Fr-EtOH-2, Fr-EtOH-3, Fr-EtOH-4) fueron más activas que la fracción inicial (Fr-EtOH); para P.aureginosa la fracción inicial Fr-EtOH fue la más activa, de las subfraciones la que presentó mayor porcentaje de inhibición fue Fr-EtOH-3; para Candida sp. la subfracción (Fr-EtOH-3) fue más activa que la fracción inicial (Fr-EtOH).
El análisis comparativo frente a los tres microorganismos y la fracción originas en etanol y las subfracciones, se puede observar en la figura 1.
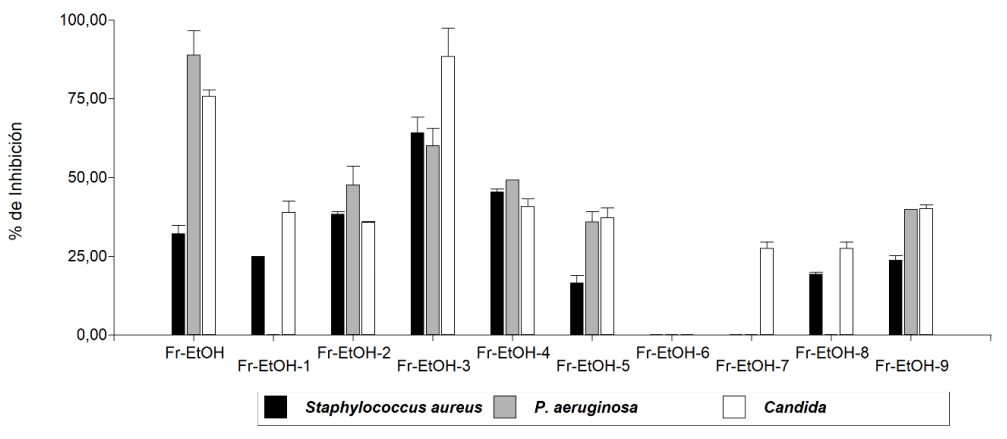
Figura 1: Actividad antimicrobiana de las subfracciones Fr-EtOH.
Bioensayo con las fracciones de Fr-AcOEt: En la (figura 2), se observa el porcentaje de inhibición que se evidenció con las 11 subfracciones; 5 fueron activas frente a los microorganismos evaluados, por lo cual fueron analizadas junto a la fracción original con el fin de compararlas y analizar los valores. Se aplicó la prueba no paramétrica de Kruskal Wallis y se encontraron diferencias estadísticas significativas entre los tratamientos.
Para S. aureus y Candida sp la subfracción (Fr-AcOEt-6) presentó un porcentaje de inhibición cercano al de la fracción original; para P.aureginosa fueron activas las subfracciones (Fr-AcOEt-3, Fr-AcOEt-4, Fr-AcOEt-5) de las cuales Fr-AcOEt-3 y Fr-AcOEt-5 mostraron un porcentaje de inhibición cercano al de la fracción original, en la figura 2 se observa gráficamente el análisis del ensayo.
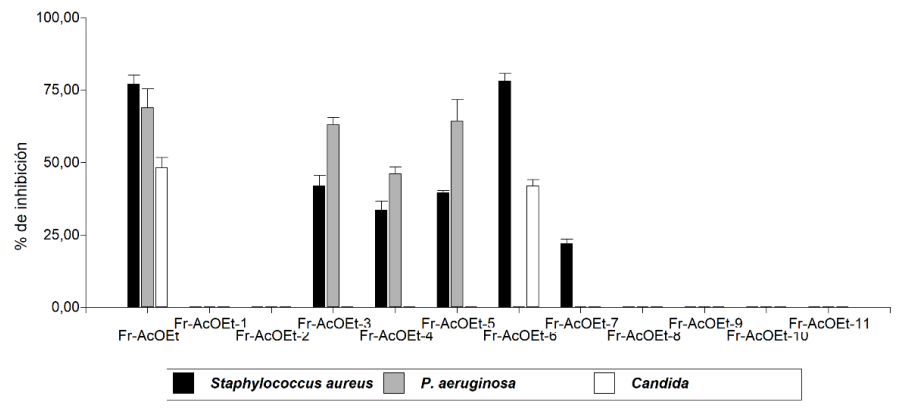
Figura 2: Actividad antimicrobiana de la fracción y subfracciones de acetato de etilo (AcOEt).
Determinación de la CMI: Después de concluido el análisis con todas las subfracciones, de la fracción de etanol se identificó que la subfracción más activa Fr-EtOH-3, y para el caso de las subfracciones de acetato de etilo fue la Fr-AcOEt-6, con estas se procedió a realizar la determinación de la concentración mínima inhibitoria (CMI) frente a los microrganismos evaluados. La mínima concentración de la Fr-EtOH-3 y Fr-AcOEt-6, frente a P. aeruginosa fue de 7.5 mg/mL. Mientras que para S. aureus y Candida sp la CMI fue de 30 mg/mL.
Discusión
El análisis cualitativo del extracto crudo permitió establecer la presencia de compuestos fenólicos, taninos, flavonoides, compuestos lactónicos y quinonas. De acuerdo con lo reportado por [20,21] los flavonoides y taninos han sido identificados en especies del género Lafoensia.
El extracto y fracciones de L. acuminata fueron activas frente a S. aureus, Candida sp y P. aeruginosa, lo que amplía el potencial frente a microorganismo patógenos y complementa el estudio realizado por [18].
Los ensayos de actividad antimicrobiana mostraron que el extracto etanólico y las fracciones en cloroformo, acetato de etilo y etanol inhibieron el crecimiento de los microorganismos evaluados,mientras que la fracción en n-Hexano no fue activa. En otros estudios de evaluación de actividad antimicrobiana del extracto y fracciones, se observó que la fracción de hexano no mostró inhibición frente a las cepas evaluadas [22], por lo tanto, se puede indicar que los compuestos responsables de la actividad antimicrobiana se encuentran en fracciones de mayor polaridad como la de acetato de etilo, que fue la más activa frente a S. aureus y P. aeruginosa y la fracción en etanol fue más activa frente a P. aeruginosa y Candida sp. Lo anterior sugiere que los compuestos bioactivos son los de polaridad intermedia a polares.
Especies como Lafoensia replicata Pohl, mostró inhibición del extracto obtenido de distintas partes de la planta, frente a los mismos organismos que se evaluó en esta investigación [23], adicional se evidenció el potencial antioxidante lo que sugiere que probablemente L. acuminata también pueda presentarlo. Zenaldo y colaboradores [24] encontraron que el extracto de Lafoensia pacari tiene un alto poder de inhibición frente a bacterias multirresistentes (P. aeruginosa, S. aureus).
En el caso de Candida sp el fraccionamiento permitió evidenciar que los compuestos activos de la Fr-AcOEt se concentraron en la subfracción Fr-AcOEt-6, lo que significa que presentan características químicas muy similares, por lo cual se sugiere continuar evaluando y analizando los compuestos presentes en la fracción Fr-AcOEt-6.
Frente P. aureginosa los compuestos activos se agruparon en dos subfracciones (Fr-AcOEt-3, FrAcOEt-5) las cuales conservan el porcentaje de inhibición frente a la fracción inicial (Fr-AcOEt). En el fraccionamiento de etanol los compuestos activos frente a Candida sp y S. aureus se concentraron en la fracción Fr-EtOH-3, superando el porcentaje de inhibición de la fracción original, lo que indica que el fraccionamiento permitió agrupar los compuestos activos.
Para P. aureginosa ninguna subfracción superó la inicial, en este caso los compuestos agrupados presentan sinergia y estando juntos son más activos, es por ello que, la fracción original (Fr-EtOH) presentó mayor actividad.
Teniendo en cuenta lo anterior se planea a futuro la evaluación de citotoxicidad del extracto y sus fracciones, debido a que esta actividad resulta importante para el descubrimiento y desarrollo de nuevos productos de origen natural [25].
Conclusiones
El fraccionamiento bioguiado mediante el ensayo de actividad antimicrobiana permitió identificar las fracciones en las cuales se ubicaron los compuestos con la capacidad de inhibir el crecimiento de las bacterias y la levadura estudiada.El fraccionamiento del extracto crudo utilizando disolventes de diferentes polaridades resultó efectivo para separar los compuestos activos. La fracción en hexano no mostró actividad antimicrobiana, mientras que, los compuestos activos se distribuyeron en las fracciones de cloroformo. acetato de etilo y etanol.
El extracto crudo y fracciones presentaron actividad antimicrobiana frente a S. aureus, Candida sp y Pseudomonas aeruginosa, siendo las más activas la fracción Fr-EtOH y Fr-AcOEt. De las 9 fracciones obtenidas a partir de Fr-EtOH, la fracción Fr-EtOH-3 fue la más activa frente a los microorganismos evaluados.
De acuerdo con estos resultados, las fracciones son aún complejas por lo que los compuestos activos eluyeron en más de una fracción, esta puede ser una explicación al hecho que las fracciones activas se encuentran próximas. Además, estos resultados son muy prometedores, ya que, las fracciones mostraron actividad frente a los microorganismos evaluados, por lo que, se podría afirmar que hay varios compuestos activos. Ante este panorama sería interesante continuar con el proceso de fraccionamiento bioguiado hasta detectar los compuestos responsables de la actividad mostrada en estos ensayos.
Referencias:
1. Dewick PM (2002) Medicinal natural products: a biosynthetic approach. John Wiley & Sons.
2. Newman DJ & Cragg GM (2020) Natural products as sources of new drugs over the nearly four decades from 01/1981 to 09/2019. Journal of natural products, 83(3), 770-803.
3. Rangel-Ch JO (2015) La biodiversidad de Colombia: significado y distribución regional. Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales, 39(151), 176-200.
4. Seca AM, Moujir LM, & Sharopov F (2020) Biological activity and applications of natural compounds. Applied Sciences, 1-206
5. Quiñones Pérez D (2017) Resistencia antimicrobiana: evolución y perspectivas actuales ante el enfoque" Una salud". Revista Cubana de Medicina Tropical, 69(3), 1-17.
6. Johnson JR, Johnston B, Clabots C, Kuskowski MA, & Castanheira M (2010) Escherichia coli sequence type ST131 as the major cause of serious multidrug-resistant E. coli infections in the United States. Clinical infectious diseases, 51(3), 286-294
7. Achkar JM & Fries BC (2010) Candida infections of the genitourinary tract. Clinical microbiology reviews, 23(2), 253-273.8. Valli M., Russo HM., & Bolzani VS. (2018) The potential contribution of the natural products from Brazilian biodiversity to bioeconomy. Anais da Academia Brasileira de Ciências, 90(1), 763-778
9. Newman DJ & Cragg GM (2020) Natural products as sources of new drugs over the nearly four decades from 01/1981 to 09/2019. Journal of natural products, 83(3), 770-803.
10. Durán-Prieto J, Tulande-Marín E & Ocampo-Flóres V (2020) Avispas (Insecta: Hymenoptera) asociadas a árboles urbanos de la ciudad de Bogotá, Colombia. Revista Chilena de Entomología, 46(4).
11. Cepeda BD & Camacho LF (2015) Análisis de captura de carbono en seis especies forestales nativas (3 esciofias-3 heliofias) plantadas con fines de restauración en el Parque Ecológico La Poma (PEP)-sabana de Bogotá–Colombia. Revista Mutis, 5(2), 46-54.
12. Gołęedebiewski WM & Wróbel JT (1981) The Lythraceae alkaloids. In The Alkaloids: Chemistry and Physiology (Vol. 18, pp. 263-322). Academic Press. https://doi.org/10.1016/S1876-0813(08)60239-0
13. Santos D, Salatino M, & Salatino A (2000) Foliar flavonoids of Lafoensia (Lythraceae). Biochemical systematics and ecology, 28(5), 487-488.
14. Reichert C, da Silva D, Carollo C, Weffort-Santos A & de Moraes C (2018) Metabolic profiling and correlation analysis for the determination of killer compounds of proliferating and clonogenic HRT-18 colon cancer cells from Lafoensia pacari. Journal of ethnopharmacology. 224(1), 541-552.
15. Solon S, Lopes L, de Sousa JP & Schmeda-Hirschmann G (2000) Free radical scavenging activity of Lafoensia pacari. Journal of Ethnopharmacology, 72(1-2), 173-178.
16. Tamashiro P, Olaitan BS, de Almeida DAT, da Silva JC, Marson-Ascêncio PG, Ascêncio SD, et al. (2012) Evaluation of antiulcer activity and mechanism of action of methanol stem bark extract of Lafoensia pacari A. St.-Hil. (Lytraceae) in experimental animals. Journal of Ethnopharmacology, 144(3), 497-505.
17. Silva Junior IE, Cechinel V, Zacchino SA, Lima JCDS & Martins DTDO (2009) Antimicrobial screening of some medicinal plants from Mato Grosso Cerrado. Revista Brasileira de Farmacognosia, 19(1B), 242-248.
18. Gutiérrez D (2018) Prestar los servicios profesionales para el desarrollo de investigaciones en fitoquímica, estudios de actividad biológica de las especies priorizadas por la línea de investigación en especies y propagación. Informe técnico CTO-JBB-125-2018. Bogotá.19. Corzo-Barragán, D. C. Y Plazas González E. (2019). Manual de procedimientos básicos de Bromatología y Fitoquímica. Bogotá, D.C.: Jardín Botánico de Bogotá José Celestino Mutis. ISBN:978-958-8576-37-4
20. Santos D, Salatino M & Salatino A (2000). Foliar flavonoids of Lafoensia (Lythraceae). Biochemical systematics and ecology, 28(5), 487-488.
21. Reichert C, da Silva D, Carollo C, Weffort-Santos A & de Moraes C (2018). Metabolic profiling and correlation analysis for the determination of killer compounds of proliferating and clonogenic HRT-18 colon cancer cells from Lafoensia pacari. Journal of ethnopharmacology. 224(1),541-552.
22. Plazas González EA (2017). Tamizaje fitoquímico y actividad antibacteriana in vitro de extractos y fracciones de tres especies colombianas del género Hypericum. Revista Cubana de Plantas Medicinales, 22(1).
23. Lima MD (2023). Análisis de la composición química y actividades antioxidantes y antimicrobianas de extractos de la especie Lafoensia replicata Pohl y evaluación de su eficacia como conservantes en cosmética. Tesis de maestría en química - Universidad Federal de Uberlândia, Uberlândia. DOI http://doi.org/10.14393/ufu.di.2023.105
24. Zenaldo P, Melo-Filho G, Valter Alvino LM, Sant'Ana A (2009) Atividade antimicrobiana de extratos hidroalcoólicos de Lafoensia pacari A. St.-Hil., Lythraceae, frente a bactérias multirresistentes de origem hospitalar. Revista Brasileira de Farmacognosia 19(3)-Set 2009 https://doi.org/10.1590/S0102-695X2009000500023
25. Pino Pérez O & Jorge Lazo F (2010). Ensayo de Artemia: útil herramienta de trabajo para ecotoxicólogos y químicos de productos naturales. Revista de protección vegetal, 25(1), 34-43.
Aporte de cada autor
Las dos autoras declaran que participaron de la conceptualización de la investigación, realización de la fase experimental, análisis, redacción, preparación, presentación del manuscrito.
 ISSN 1666-7948 www.quimicaviva.qb.fcen.uba.ar |
Revista QuímicaViva Volumen 23, Número 1, Abril de 2024 |
Publicado en:
Vol 23, Nro 1
Abril de 2024
Identificador: E0262
DOI:No disponible
Tipo: Trabajos de investigación
Recibido en: 10/04/2024
Aceptado en: 20/04/2024
Contacto: Diana Carolina Corzo Barragán