
ISSN 1666-7948
Revista Electrónica de Ciencia y Educación
Departamento de Química Biológica FCEN-UBA IQUIBICEN

ISSN 1666-7948
Revista Electrónica de Ciencia y Educación
Departamento de Química Biológica FCEN-UBA IQUIBICEN
Perspectivas traslacionales sobre el maltrato infantil: programación del estrés y neurodesarrollo en humanos y roedores
Jazmín Grillo Balboa1,2 y Mariela Chertoff1,2
1 Laboratorio de Neuroepigenética y Adversidades Tempranas, Departamento de Química Biológica, Facultad de Ciencias Exactas y Naturales, Universidad de Buenos Aires, Argentina.
2 Instituto de Química Biológica de la Facultad de Ciencias Exactas y Naturales (IQUIBICEN), CONICET-UBA, Argentina.
Resumen
El maltrato infantil constituye una de las principales problemáticas de salud pública a nivel global, con consecuencias que trascienden el daño físico inmediato y afectan profundamente el desarrollo cerebral y emocional de quienes lo padecen. Este artículo revisa la evidencia neurobiológica que vincula experiencias adversas tempranas con alteraciones en los circuitos del estrés, haciendo especial énfasis en los mecanismos moleculares involucrados. A partir de estudios en humanos y modelos animales, se describe cómo el estrés temprano afecta el desarrollo y funcionamiento del eje hipotalámico-pituitario-adrenal, así como de estructuras cortico-límbicas clave como la amígdala, el hipocampo y la corteza prefrontal. En conjunto, esta evidencia sugiere que el maltrato infantil puede inducir una reprogramación del sistema de respuesta al estrés, alterando la arquitectura cerebral y aumentando la vulnerabilidad a trastornos emocionales y cognitivos en la vida adulta.
Palabras clave: maltrato infantil - estrés temprano - neurodesarrollo - eje HPA
Translational perspectives on infant maltreatment: stress programming and neurodevelopment in humans and rodents
Abstract
Infant maltreatment is one of the most significant public health issues worldwide, with consequences that extend beyond immediate physical harm and profoundly affect brain and emotional development. This article reviews neurobiological evidence linking early adverse experiences to disruptions in stress-related circuits, with a particular focus on the molecular mechanisms involved. Drawing on studies in both humans and animal models, we describe how early-life stress impacts the development and functioning of the hypothalamic-pituitary-adrenal (HPA) axis, as well as key cortico-limbic structures such as the amygdala, hippocampus, and prefrontal cortex. Together, this evidence suggests that infant maltreatment may induce a reprogramming of the stress response system, altering brain architecture and increasing vulnerability to emotional and cognitive disorders in adulthood.
Keywords: infant maltreatment - early-life stress - neurodevelopment - HPA axis
Maltrato infantil: una pandemia oculta a simple vista
El maltrato infantil es uno de los principales problemas de salud pública que afectan a la población mundial. La Sociedad Internacional para la Prevención del Maltrato y la Negligencia Infantil (The International Society for the Prevention of Child Abuse and Neglect) lo define como toda acción u omisión voluntaria que pueda lesionar potencialmente a un niño e interferir con su desarrollo emocional, psicofísico y social [1].
Datos de UNICEF publicados en 2024 indican que aproximadamente 400 millones de niños y niñas en el mundo experimentan de manera habitual algún tipo de disciplina violenta en sus hogares, y más del 80% sufre violencia física. A pesar de los avances en la concientización sobre esta problemática, uno de cada cuatro cuidadores primarios considera que el castigo corporal —definido como “actos en los que se usa la fuerza física con el objeto de causar dolor o malestar, aunque sea leve”— es una herramienta necesaria para la crianza y educación de los niños [2]. En Argentina, según datos de la misma fuente, el 59,4% de los cuidadores encuestados admitió recurrir a la violencia física para disciplinar a sus hijos. Sin embargo, los datos actuales sobre la prevalencia del maltrato infantil en el país siguen siendo escasos, lo que dificulta su visibilización y la implementación de estrategias de prevención y respuesta eficaces [2].
Más allá de las consecuencias inmediatas en la integridad física de los niños, un creciente cuerpo de evidencia indica que una primera infancia adversa impacta profundamente en la vida de los individuos, manifestándose en etapas posteriores, especialmente en la adolescencia y la adultez [3]. Por ejemplo, la violencia y la negligencia infantil se han asociado con un mayor riesgo de desarrollar conductas problemáticas, como el abuso de sustancias [4], así como con alteraciones en el desarrollo cognitivo y emocional. En términos más específicos, la exposición a maltrato infantil puede provocar dificultades en la memoria y la función ejecutiva [5], y aumentar el riesgo de padecer ansiedad, depresión, psicosis y trastorno de estrés postraumático (TEPT) en la adultez [6,7].
Estas consecuencias comparten un denominador común: una alteración en los mecanismos que regulan la respuesta al estrés. Por ese motivo, para comprender cómo estas experiencias moldean el funcionamiento cerebral, es necesario introducir brevemente el sistema de respuesta al estrés y los circuitos neurobiológicos que lo integran.
El Sistema de Respuesta al Estrés
En términos biológicos, se considera “agente estresante” a cualquier estímulo o condición que pueda perturbar este balance fisiológico y/o psicológico [8]. En vertebrados, la respuesta a dicho estímulo está mediada por un Sistema de Respuesta al Estrés (SRE), altamente conservado en la evolución [9]. Este sistema integra la acción de una serie de circuitos cerebrales y órganos periféricos que, activados de forma eficiente, coordinada y oportuna, son capaces de detectar eventos, interpretarlos como amenaza real o potencial, desencadenar una respuesta acorde y así asegurar la supervivencia del individuo [10].
El eje HPA (Hipotálamo-Pituitario-Adrenal)
Un actor central del SRE es el eje HPA. Su actividad facilita una serie de cambios metabólicos, gastrointestinales, cardiorrespiratorios, autonómicos, inmunes y neuroendocrinos que permiten la supervivencia y adaptación del individuo a su contexto. A nivel encefálico, el agente estresante activa a las neuronas del núcleo paraventricular (PVN) hipotalámico, quienes secretan hormona liberadora de corticotropina (o CRH, por su acrónimo en inglés) iniciando la cascada endócrina del eje HPA. En la glándula pituitaria, la CRH hipotalámica induce la secreción de hormona adrenocorticotropa (ACTH por su acrónimo en inglés) que se libera al torrente sanguíneo y estimula la liberación de glucocorticoides (GC) (cortisol en humanos y corticosterona en roedores) desde la corteza de la glándula adrenal [10] (Fig. 1).
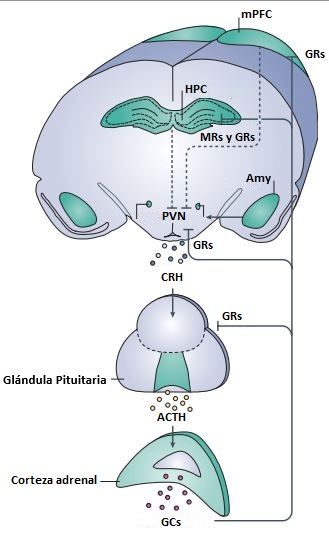
Figura 1: El eje Hipotalámico-Pituitario-Adrenal (HPA) (adaptado de [11]). Cuando el núcleo paraventricular (PVN) hipotalámico detecta una amenaza, libera hormona liberadora de corticotropina (CRH) a la glándula pituitaria que, en respuesta, secreta hormona adrenocorticotropa (ACTH) a la circulación sistémica. Esta última actúa sobre la corteza de la glándula adrenal induciendo la liberación de glucocorticoides (GC) a la sangre. Además de facilitar una serie de efectos catabólicos y supresores en el organismo mediante su acción sobre órganos diana, los GC actuarán sobre receptores de GC (GR) y mineralocorticoides (MR) desencadenando una serie de vías de retroalimentación negativa que inhiben el eje HPA a distintos niveles (el PVN, la glándula pituitaria y otras regiones neuroanatómicas, como el hipocampo (HPC) y la corteza prefrontal (mPFC)) con el fin de regresar a la homeostasis. Por el contrario, en la amígdala (Amy), los GR desencadenan la excitación del eje HPA para poner en movimiento la respuesta al estrés que permite lidiar con el agente estresante
Los GC son un grupo de hormonas de la familia de los esteroides, capaces de atravesar libremente las membranas celulares y unirse a receptores específicos: los receptores de glucocorticoides (GR) y los de mineralocorticoides (MR) [12]. Ambos receptores se encuentran ampliamente distribuidos en distintos órganos y tejidos del sistema inmune, cardiovascular, gastrointestinal, reproductivo y nervioso. Aunque pueden localizarse tanto en las membranas celulares como en forma soluble en el citoplasma, esta última isoforma es la más estudiada hasta el momento. Su traslocación al núcleo tras la unión con el ligando permite suscitar una serie de efectos catabólicos y supresores que facilitan la adaptación fisiológica al contexto estresante [13].
A nivel funcional, los MR tienen una mayor afinidad por los GC y están predominantemente ocupados bajo condiciones basales, lo que los posiciona como moduladores del tono emocional y la excitabilidad neuronal en situaciones de reposo. En cambio, los GR, de menor afinidad, se activan principalmente en condiciones de estrés, regulando la retroalimentación negativa del eje HPA y modulando procesos como la memoria, la conducta emocional y la respuesta inmune. Esta distinción funcional permite que el sistema regule finamente tanto la sensibilidad como la intensidad de la respuesta al estrés. El estrés intenso o prolongado puede mantener al sistema activado más allá del tiempo esperado fisiológicamente (estrés crónico). La exposición sostenida a altos niveles de GC tiene efectos deletéreos en el organismo, y afecta negativamente a todos los sistemas mencionados [14].
Particularmente, a nivel del Sistema Nervioso Central (SNC) se ha demostrado que los GR intervienen tanto en la excitabilidad como en la neuroquímica y la plasticidad neuronal de distintas áreas [15]. Se trata de receptores altamente expresados en centros del SRE y áreas cortico-límbicas que regulan su actividad, a la vez que coordinan distintos aspectos de la respuesta evocada por el individuo ante el agente estresante. La unión de los GC a GR en el PVN y glándula pituitaria permite regular al eje por mecanismos de retroalimentación negativa, inhibiendo la producción de neurohormonas —como CRH y ACTH— que conducirían a mayores niveles de GC [16] (Fig. 1). Asimismo, la actividad de los GR en regiones cortico-límbicas específicas facilita la modulación del eje HPA. Entre ellas, tres actores fundamentales son la amígdala (Amy), la corteza prefrontal medial (mPFC) y el hipocampo (HPC).
Circuitos cortico-límbicos vinculados a la respuesta de estrés
La Amy cumple un rol fundamental en la respuesta comportamental de miedo y la regulación del procesamiento emocional. La activación de GR en esta estructura induce un incremento en la expresión de CRH local, lo cual contribuye directamente al estado emocional de miedo [17]. Las neuronas CRH en Amy proyectan al PVN y estimulan al eje HPA (Fig. 1). La mPFC, por su parte, es la estructura que controla la planificación de conductas, la resolución de problemas y formación de memorias de largo término y de trabajo (de ahí su importancia en la regulación del SRE). Posee proyecciones al PVN que inhiben la liberación de CRH [17] (Fig. 1). Por último, la función del HPC suele asociarse al aprendizaje y almacenamiento de representaciones espacio-temporales del evento estresante, aunque también cumple un rol crítico en la inhibición del eje HPA. Como en la mPFC, la activación de los GR hipocampales disminuye la probabilidad de activación del eje [17] (Fig. 1).
Diversos estudios realizados en ratas demostraron que el estrés crónico modifica la correcta expresión y actividad de GR [18–20]. Como consecuencia de esto, la retroalimentación negativa del eje HPA puede verse alterada, hecho que a su vez podría conducir a una respuesta inadecuada o exagerada frente a una situación de estrés. Una actividad atípica del SRE ha demostrado aumentar la vulnerabilidad de los individuos a sufrir psicopatologías como depresión, ansiedad, abuso en el consumo de sustancias de abuso y TEPT, entre otros [11].
Programación de la respuesta al estrés
Para agregar un eslabón de complejidad al sistema descripto, la respuesta de estrés es intrínseca de cada individuo. La adaptación del SRE a un mismo evento estresante puede ser diferente entre individuos, predisponiendo a desarrollar patologías vinculadas a una desregulación del sistema de estrés en algunos, pero no generando alteraciones en otros. Entonces, la vulnerabilidad o resiliencia a eventos estresantes depende ampliamente de la capacidad del eje HPA y estructuras asociadas de encender y apagar su respuesta de forma oportuna, hecho que a su vez depende de la experiencia previa que tuvo ese individuo al estrés. Una correcta sensibilidad y actividad basal del SRE son fundamentales para el bienestar y la salud del individuo. Por el contrario, una alteración persistente en el sistema podría resultar perjudicial para el desarrollo, crecimiento e inserción social, conduciendo a la emergencia de patologías conductuales y/o somáticas [21]. Estas diferencias individuales en la respuesta al estrés están profundamente influenciadas por experiencias previas, particularmente aquellas ocurridas en etapas tempranas del desarrollo. Este fenómeno, conocido como programación de la respuesta al estrés, implica que ciertas experiencias durante períodos sensibles del desarrollo pueden moldear de forma duradera la forma en que el organismo percibe y responde a los desafíos ambientales.
El eje HPA y las áreas cortico-límbicas que regulan su respuesta completan su maduración postnatalmente, lo que hace al sistema especialmente susceptible a experiencias tempranas adversas [22]. Se ha demostrado que niveles elevados de cortisol en niños, niñas y adolescentes en edad escolar (entre 8 y 16 años de edad), por ejemplo, predicen un mayor riesgo de sufrir episodios depresivos un año y medio después [23]. Sin embargo, la magnitud y dirección de estos efectos es dependiente de múltiples factores, como el sexo, la etapa de vida en la que ocurre la adversidad y la naturaleza del estresor [11,17]. Además, mujeres con antecedentes de trauma infantil mostraron una mayor incidencia de depresión, ansiedad, dependencia de sustancias de abuso y TEPT en comparación con los varones [24].
Estos resultados se han visto replicados, en parte, en modelos animales. En ratas Wistar, se ha mostrado que el estrés neonatal afecta diferencialmente la regulación del eje HPA según el tipo de adversidad y el sexo. Por ejemplo, la separación materna en el día postnatal (P) 3 eleva los niveles de corticosterona (CORT) en sangre de hembras ante un agente estresante, pero no en machos [25]. En contraste, la deprivación social en las primeras dos semanas de vida atenuó la respuesta de CORT ante un estresor, únicamente en machos [26]. Pese a la variabilidad de los resultados, el rol de los cuidados parentales ha sido identificado como un factor crítico en la modulación de estos efectos y en la determinación de trayectorias cognitivas y emocionales en el desarrollo temprano.
Importancia de los cuidados tempranos en el desarrollo
El cuidado parental ha sido un comportamiento fundamental en la historia evolutiva de los animales [27]. Este comportamiento, altamente conservado en varios grupos de vertebrados e invertebrados, facilita la supervivencia de los individuos en un período que reviste extrema importancia y a la vez vulnerabilidad. En mamíferos, estos cuidados alcanzan un grado de complejidad excepcional, trascendiendo la provisión de calor, nutrición y protección para desempeñar un papel clave en la maduración del sistema nervioso y la regulación de la respuesta al estrés. A través de interacciones tempranas con los cuidadores, los individuos desarrollan circuitos neurobiológicos fundamentales para la regulación emocional y la adaptación al entorno.
Tanto en humanos como en primates no humanos y roedores, la calidad del vínculo de apego con el cuidador primario desempeña un papel crucial en la trayectoria del desarrollo neurobiológico. Un apego seguro favorece una adecuada regulación emocional y una mayor resiliencia ante situaciones adversas, mientras que experiencias tempranas de cuidado inconsistente o deficiente pueden alterar la regulación del eje HPA y aumentar la vulnerabilidad a trastornos emocionales y conductuales en etapas posteriores de la vida [28,29]. Estas influencias tempranas no se limitan a la infancia, sino que pueden persistir a lo largo de la vida, moldeando la respuesta al estrés y la susceptibilidad a diversas condiciones ambientales.
En roedores, existe un período crítico conocido como período de hiporesponsividad al estrés (Stress Hyporesponsive Period, SHRP), que ocurre aproximadamente entre los P4-14 [30]. Durante este tiempo, los niveles basales de CORT se mantienen bajos y la respuesta a estímulos estresantes está atenuada, lo que protege al cerebro de los efectos tóxicos de la exposición prolongada a GC en la vida temprana [31]. Lo curioso de este estado es que la respuesta a CORT es funcional en las crías al nacer, pero es la presencia de la madre, su estimulación táctil y contacto con las crías, lo que modula la activación del eje HPA [30,32]. Sin embargo, la interrupción de estos cuidados puede precipitar una activación prematura de la respuesta al estrés y generar cambios neurobiológicos duraderos [29].
Si bien no hay un análogo al SHRP en humanos, el apego inseguro en la infancia se ha asociado con un mayor riesgo de desarrollar dificultades en la regulación emocional, mayor reactividad al estrés y una predisposición a trastornos afectivos en la adultez [33–37]. Las experiencias tempranas de negligencia o cuidado inconsistente pueden alterar la percepción de seguridad del infante y generar patrones maladaptativos de afrontamiento del estrés, afectando su capacidad de lidiar con desafíos ambientales a lo largo de la vida [38–40].
Programación perinatal del neurodesarrollo
El cerebro de animales altriciales, como humanos, primates no-humanos y roedores, continúa desarrollándose postnatalmente [41]. En humanos, la primera infancia es el período que abarca desde el último tercio de gestación hasta los primeros tres años de vida [42], mientras que en los roedores esta etapa culmina hacia la segunda semana postnatal [43]. Se trata de un período crítico para el desarrollo del individuo, caracterizado por una intensa plasticidad sináptica en núcleos fundamentales para la función cognitiva y emocional. Durante esta etapa, factores ambientales pueden modular patrones funcionales y estructurales del cerebro, favoreciendo la adaptación del individuo a su entorno [3]. Sin embargo, esta “ventana” al mundo externo también deja al sistema vulnerable ante experiencias traumáticas que podrían afectar patrones estructurales y funcionales del cerebro, conduciendo a trayectorias de desarrollo que exceden los fines adaptativos y aumentar el riesgo de desórdenes cognitivos y afectivos en la adultez [44].
Entre los factores que pueden impactar negativamente en el neurodesarrollo se incluyen la malnutrición, la exposición a toxinas, infecciones y agentes estresantes [45]. En particular, el estrés perinatal se ha asociado con alteraciones en la regulación del eje HPA y sus circuitos cortico-límbicos, afectando la respuesta fisiológica y conductual al estrés en etapas posteriores de la vida [17,31].
Modelos animales del maltrato infantil
Si bien los roedores son claramente incapaces de reproducir la riqueza del repertorio cognitivo y emocional de los humanos, las similitudes en el rol del cuidador primario durante el desarrollo temprano y en la configuración del sistema de estrés, además de la disponibilidad de pruebas conductuales validadas para evaluar su estado emocional, los transforman en una herramienta fundamental para abordar el estudio de los mecanismos moleculares implicados en el desarrollo de desórdenes derivados del maltrato infantil.
En este contexto, se han desarrollado modelos preclínicos que simulan condiciones de adversidad en el cuidado temprano, entre los cuales se destacan el modelo de “Escasez de recursos de anidamiento” (SAM, o Scarcity-Adversity Model) y el modelo de “Limitación de cama y nido” (LBN, o Limited Bedding and Nesting) [29]. Ambos protocolos consisten en restringir la disponibilidad de recursos de anidamiento para la construcción del nido durante un período crítico de la lactancia (típicamente entre los P8 y P12). El estrés que induce este empobrecimiento ambiental en las madres lactantes se traslada a las crías a través de cuidados tempranos fragmentados y violentos [46,47]. El hecho de que sea la propia madre —y no el experimentador— quien imparte estrés en las crías confiere al modelo una alta validez traslacional, ya que reproduce con mayor fidelidad la naturaleza relacional del maltrato infantil. La adversidad que experimentan las crías en estos modelos emerge así de la disrupción del vínculo madre-cría, replicando aspectos centrales del maltrato infantil en humanos. A través de estos diseños experimentales, es posible evaluar de forma controlada las consecuencias del maltrato infantil en la fisiología, la conducta y la arquitectura cerebral de la descendencia.
Consecuencias del maltrato infantil en el Sistema de Estrés
El abordaje de las consecuencias del maltrato infantil en humanos es menos consistente que los resultados obtenidos en ensayos con modelos animales. Además de las limitaciones obvias que implican los estudios en humanos, como la capacidad de abarcar la multiplicidad de variables que repercuten en el fenotipo observado, es importante considerar que el maltrato infantil no pueda ser registrado sino a través de la propia percepción y el autorreporte. Dicho esto, en términos generales se observa una atenuación en la actividad del eje luego del trauma infantil. En particular, individuos con antecedentes de maltrato infantil muestran una menor producción total de cortisol y una reducción en los cambios dinámicos de su secreción tras la percepción de un estresor [37]. Además, esta desregulación es más pronunciada en personas con antecedentes de maltrato infantil y TEPT en la adultez, que en individuos con TEPT derivado de trauma en la adultez únicamente. Esta modulación del eje HPA podría ser un mecanismo adaptativo para minimizar los efectos neurotóxicos del estrés crónico.
En modelos animales de maltrato infantil, también se han observado alteraciones en la regulación del eje HPA. Algunos estudios han reportado un aumento en los niveles basales de CORT en ratas expuestas al modelo SAM [48] y LBN [49], tanto en la etapa neonatal como en la adultez. Además, se han identificado modificaciones en las glándulas adrenales de estas crías, que van desde una hipertrofia hasta cambios en su morfología e histología [47,49,50]. Estos hallazgos sugieren una activación sostenida del eje HPA en respuesta al estrés temprano. Sin embargo, estos efectos no son consistentes en todos los estudios. Se han reportado casos de disminución en los niveles basales de CORT y en el tamaño de las glándulas adrenales en neonatos [51], así como estudios en los que no se observan cambios en condiciones basales, pero sí una respuesta alterada ante un estrés agudo, ya sea en forma de hipoactivación [46,52] o hiperactivación del eje [47]. Estas discrepancias sugieren que las consecuencias del estrés temprano en la regulación del eje HPA son altamente dependientes de la ventana del desarrollo en la que impactan, y que su efecto en la vida del individuo varía a lo largo de la ontogenia. A pesar de las discrepancias que puedan hallarse en los diferentes estudios, lo que sí es claro es que este modelo induce cambios persistentes en la fisiología del estrés.
Consecuencias del maltrato infantil en el sistema cortico-límbico
Dada su implicación en la regulación del miedo y del eje de estrés (ver sección “El Sistema de Respuesta al Estrés”), la amígdala es una de las regiones más afectadas por el estrés temprano. Estudios en humanos han demostrado que el maltrato infantil induce alteraciones significativas en esta estructura, tanto a nivel morfológico como funcional. Se han reportado cambios en el volumen amigdalar, con estudios que encuentran aumentos o reducciones en función del momento del desarrollo en que ocurre el maltrato, lo que sugiere una alteración en los procesos de maduración y poda neuronal [53,54]. A nivel funcional, estudios de neuroimágenes han mostrado una hiperactivación de la amígdala en individuos con antecedentes de maltrato, y cambios en su conectividad funcional con otras regiones cerebrales relevantes [55,56]. Estos hallazgos en humanos han sido replicados en el modelo SAM. En roedores, la exposición a estas condiciones genera un aumento en la actividad neuronal de la amígdala, evidenciado por una mayor expresión de c-Fos [57], así como una alteración en su conectividad funcional con la mPFC, lo que sugiere un menor control cortical sobre su activación [44]. A nivel estructural, se han observado cambios morfológicos en las neuronas piramidales de la amígdala tras la exposición al maltrato [58] y una disminución de las sinapsis inhibitorias dentro de esta región [59], lo que podría contribuir a su hiperexcitabilidad. A nivel molecular, estudios en modelos animales han reportado una menor metilación global del ADN en la amígdala tras la adversidad temprana [60], lo que sugiere posibles mecanismos epigenéticos involucrados en la desregulación de esta estructura. Asimismo, se ha encontrado un aumento en la expresión de CRH en la amígdala de animales expuestos a maltrato, lo que refuerza su papel en la sensibilización del eje del estrés [61].
El hipocampo, altamente sensible al estrés por su alta densidad de GR, es una de las regiones más afectadas por el estrés temprano y, en consecuencia, una de las más estudiadas en modelos de adversidad temprana. En adultos con antecedentes de adversidad temprana, se ha documentado una reducción en el volumen hipocampal [62,63], lo que se asocia con déficits de memoria y en la regulación del estrés [62,64]. A nivel molecular, se ha observado una hipermetilación del promotor del gen que codifica para GR, disminuyendo la sensibilidad del hipocampo a la retroalimentación negativa del eje HPA [65,66]. Además, en individuos con historial de trauma infantil, se ha reportado una mayor metilación del gen del transportador de serotonina, lo que se ha vinculado con un mayor riesgo de desarrollar trastornos como la depresión en la vida adulta [67]. En animales, el modelo SAM/LBN ha demostrado afectar el desempeño en tareas dependientes del hipocampo, particularmente aquellas relacionadas con la memoria [68], así como en pruebas conductuales que reflejan rasgos similares a la depresión y anhedonia [46,69]. A nivel neurobiológico, se han observado alteraciones en la plasticidad sináptica del hipocampo, evidenciadas tanto por estudios histológicos [70] como por neuroimágenes [71], y por expresión de marcadores de neurogénesis [72]. Además, se ha reportado un aumento en la expresión de CRH y una reducción en la expresión de GR en esta región, consistentes con una desregulación del eje de estrés [73]. También se ha descrito un incremento en el reclutamiento y activación de la microglía hipocampal, lo que correlaciona con déficits en la memoria espacial [74].
La PFC, involucrada en la modulación del eje y en funciones ejecutivas, también se ve afectada por el estrés temprano. En personas con antecedentes de maltrato infantil, se ha documentado una reducción en el volumen de la PFC y en su densidad cortical [75–78]. Además, estudios por neuroimágenes han revelado alteraciones en la activación de esta región y en su conectividad funcional con la amígdala, lo que sugiere un patrón de regulación emocional disfuncional en la adultez [79,80]. También se han identificado patrones de metilación específicos en genes clave vinculados a la regulación del estrés y la plasticidad, como BDNF, NR3C1 y FKBP5, en saliva y sangre de niñas, niños y adolescentes con antecedentes de abuso o negligencia infantil [60]. En modelos animales, se demostró que la exposición al estrés durante la primera semana posnatal impacta el desarrollo estructural de la PFC, alterando la arborización dendrítica de las neuronas piramidales en distintas subregiones, lo que se asocia con un peor desempeño en tareas de memoria temporal, típicamente dependientes de esta región [29]. A nivel molecular, se han observado alteraciones en la metilación del gen BDNF, esencial para la plasticidad sináptica y el desarrollo neuronal [81,82], así como niveles elevados de GR en la PFC de animales expuestos al modelo SAM [52], lo que sugiere una desregulación del eje de estrés. Desde un enfoque funcional, estudios con fMRI en ratas adolescentes y adultas mostraron una conectividad funcional alterada entre la Amy y la PFC en animales expuestos a SAM/LBN, lo cual refleja un desarrollo atípico de los circuitos responsables de la regulación emocional [58,83]. De forma complementaria, Junod y col. [44] reportaron que, ante estímulos de amenaza, los animales SAM exhiben una menor activación neuronal en subregiones de la Amy, junto con una mayor activación en la PFC. En conjunto, estos hallazgos sugieren que la adversidad temprana compromete el desarrollo estructural y funcional de la PFC, afectando sus funciones cognitivas superiores y promoviendo una mayor reactividad emocional ante estímulos amenazantes.
Conclusiones
La evidencia presentada a lo largo de este trabajo resalta que el maltrato infantil no solo constituye una forma extrema de violencia relacional, sino también un factor con alto nivel de impacto en el neurodesarrollo de niños y niñas. Tanto en humanos como en modelos animales, la exposición a cuidados primales alterados en etapas tempranas de la vida induce alteraciones persistentes en la regulación del eje HPA y en la estructura y función de regiones clave del sistema cortico-límbico, como la amígdala, el hipocampo y la corteza prefrontal. Estas modificaciones, que incluyen cambios estructurales, sinápticos, moleculares y epigenéticos, están directamente asociadas con una mayor susceptibilidad a desarrollar trastornos emocionales, cognitivos y conductuales en la adolescencia y adultez (Fig. 2).
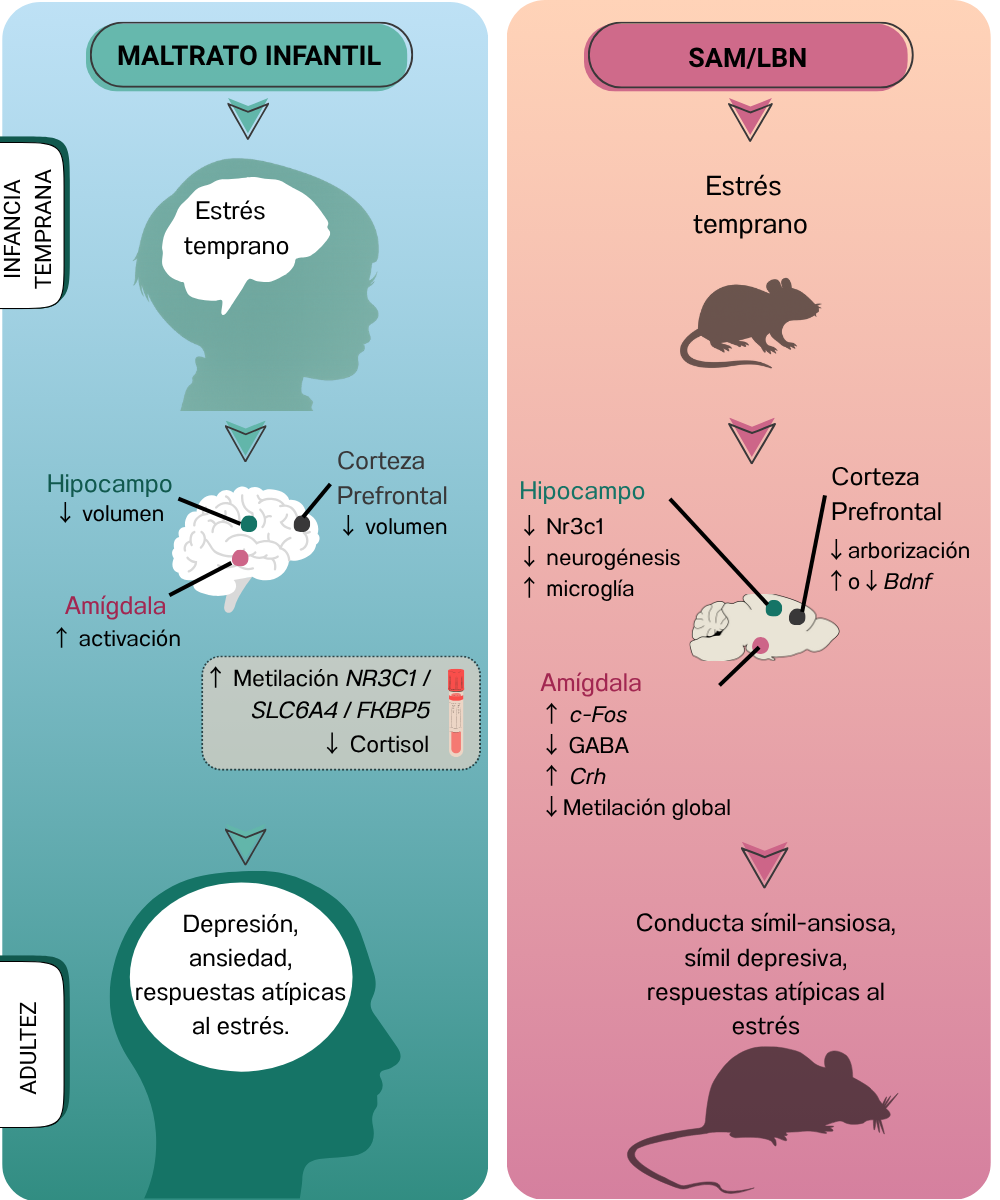
Figura 2: Impacto del estrés temprano por maltrato infantil en humanos y su correlato en modelos animales. Resumen gráfico de los efectos del estrés temprano tanto en humanos (izquierda) como en modelos animales de maltrato (derecha). En humanos, el maltrato infantil durante la infancia temprana se asocia con una mayor activación de la amígdala, reducción del volumen en el hipocampo y la corteza prefrontal, y alteraciones epigenéticas que incluyen el aumento en la metilación de genes reguladores del eje del estrés (NR3C1, SLC6A4 y FKBP5), así como niveles reducidos de cortisol basal. En la adultez, estas alteraciones se vinculan con una mayor prevalencia de trastornos como depresión, ansiedad y respuestas atípicas al estrés. En paralelo, los modelos en ratas mediante escasez de recursos de anidamiento (SAM/LBN) inducen un patrón de cuidado materno fragmentado que genera estrés temprano. En la adultez, las crías expuestas presentan disminución de la expresión de GR (gen Nr3c1), menor neurogénesis y aumento de microglía en el hipocampo; alteraciones en la corteza prefrontal, incluyendo menor arborización dendrítica y cambios en la expresión de Bdnf; y mayor activación de la amígdala, acompañada por aumento en la expresión de c-Fos y Crh, reducción de sinapsis inhibitorias (mediadas por GABA) y menor metilación global. Estas alteraciones se asocian con fenotipos conductuales similares a la ansiedad y la depresión, y respuestas atípicas al estrés. SAM: Scarcity-Adversity Model, LBN: Limited Bedding and Nesting, NR3C1 / Nr3c1: Gen que codifica el receptor de glucocorticoides, SLC6A4: Transportador de serotonina, FKBP5: Proteína de unión a inmunofilina asociada a GR, Crh: Corticotropin-releasing hormone (hormona liberadora de corticotropina), Bdnf: Brain-derived neurotrophic factor (factor neurotrófico derivado del cerebro), GABA: Ácido gamma-aminobutírico.
Comprender los mecanismos neurobiológicos que subyacen a estas trayectorias es esencial para diseñar estrategias de prevención e intervención eficaces. La investigación traslacional basada en modelos animales aporta herramientas clave para identificar biomarcadores tempranos de riesgo, así como posibles ventanas terapéuticas que podrían ser aprovechadas para revertir o mitigar el impacto del estrés temprano sobre el cerebro en desarrollo. Sin embargo, más allá del desarrollo de intervenciones clínicas, destacamos la relevancia de este tipo de investigaciones en la visibilización de la importancia de las buenas prácticas de cuidado, y reforzamos la necesidad de implementar políticas públicas basadas en evidencia científica orientadas a la protección integral de los derechos de los niños, niñas y adolescentes.
Referencias
1. https://ispcan.org/, accesado 17/06/2025.
2. https://data.unicef.org/topic/child-protection/violence/violent-discipline/#data, accesado 17/06/2025
3. Opendak M, y Sullivan RM (2019) Unique infant neurobiology produces distinctive trauma processing. Developmental Cognitive Neuroscience, 36(March), 100637. https://doi.org/10.1016/j.dcn.2019.100637
4. https://www.acf.hhs.gov/cb/data-research/child-maltreatment, accedido en 17/06/2025
5. Nelson CA, Zeanah CH, Fox NA, Marshall PJ, Smyke AT, y Guthrie D (2007) Cognitive Recovery in Socially Deprived Young Children: The Bucharest Early Intervention Project. Science, 318(5858), 1937-1940. https://doi.org/10.1126/science.1143921
6. Andersen SL (2019) Stress, sensitive periods, and substance abuse. Neurobiology of Stress, 10(November 2018), 100140. https://doi.org/10.1016/j.ynstr.2018.100140
7. Glynn LM, Howland MA, Sandman CA, Davis EP, Phelan M, Baram TZ y Stern HS (2018) Prenatal maternal mood patterns predict child temperament and adolescent mental health. Journal of Affective Disorders, 228, 83-90. https://doi.org/10.1016/j.jad.2017.11.065
8. Franklin TB, Saab BJ y Mansuy IM (2012) Neural Mechanisms of Stress Resilience and Vulnerability. Neuron, 75(5), 747-761. https://doi.org/10.1016/j.neuron.2012.08.016
9. Nesse RM, Bhatnagar S y Ellis B (2016) Evolutionary Origins and Functions of the Stress Response System. En Stress: Concepts, Cognition, Emotion, and Behavior: Handbook of Stress. Elsevier Inc. https://doi.org/10.1016/B978-0-12-800951-2.00011-X
10. Godoy LD, Rossignoli MT, Delfino-Pereira P, Garcia-Cairasco N y Umeoka EH de L (2018) A comprehensive overview on stress neurobiology: Basic concepts and clinical implications. Frontiers in Behavioral Neuroscience, 12(July), 1-23. https://doi.org/10.3389/fnbeh.2018.00127
11. Lupien SJ, McEwen BS, Gunnar MR y Heim C (2009) Effects of stress throughout the lifespan on the brain, behaviour and cognition. Nature reviews. Neuroscience, 10(6), 434-445. https://doi.org/10.1038/nrn2639
12. Timmermans S, Souffriau J y Libert C (2019) A General Introduction to Glucocorticoid Biology. Frontiers in Immunology, 10, 1545. https://doi.org/10.3389/fimmu.2019.01545
13. Koning A-SCAM, Buurstede JC, Van Weert LTCM, y Meijer OC (2019) Glucocorticoid and Mineralocorticoid Receptors in the Brain: A Transcriptional Perspective. Journal of the Endocrine Society, 3(10), 1917-1930. https://doi.org/10.1210/js.2019-00158.
14. Yaribeygi H, Panahi Y, Sahraei H, Johnston TP y Sahebkar A (2017) The impact of stress on body function: A review. EXCLI Journal, 16, 1057-1072. https://doi.org/10.17179/excli2017-480
15. De Kloet ER, Vreugdenhil E, Oitzl MS y Joëls M (1998) Brain Corticosteroid Receptor Balance in Health and Disease*. Endocrine Reviews, 19(3), 269-301. https://doi.org/10.1210/edrv.19.3.0331
16. Senft RA, Meddle SL y Baugh AT (2016) Distribution and Abundance of Glucocorticoid and Mineralocorticoid Receptors throughout the Brain of the Great Tit (Parus major). PLOS ONE, 11(2), e0148516. https://doi.org/10.1371/journal.pone.0148516
17. van Bodegom M, Homberg JR y Henckens MJAG (2017) Modulation of the Hypothalamic-Pituitary-Adrenal Axis by Early Life Stress Exposure. Frontiers in Cellular Neuroscience, 11(April), 1-33. https://doi.org/10.3389/fncel.2017.00087
18. Guidotti G, Calabrese F, Anacker C, Racagni G, Pariante CM y Riva MA (2013) Glucocorticoid Receptor and FKBP5 Expression Is Altered Following Exposure to Chronic Stress: Modulation by Antidepressant Treatment. Neuropsychopharmacology, 38(4), 616-627. https://doi.org/10.1038/npp.2012.225
19. Mizoguchi K, Ishige A, Aburada M y Tabira T (2003) Chronic stress attenuates glucocorticoid negative feedback: Involvement of the prefrontal cortex and hippocampus. Neuroscience, 119(3), 887-897. https://doi.org/10.1016/S0306-4522(03)00105-2
20. Raone A, Cassanelli A, Scheggi S, Rauggi R, Danielli B y De Montis MG (2007) Hypothalamus–pituitary–adrenal modifications consequent to chronic stress exposure in an experimental model of depression in rats. Neuroscience, 146(4), 1734-1742. https://doi.org/10.1016/j.neuroscience.2007.03.027
21. Chrousos GP (2009) Stress and disorders of the stress system. Nature Reviews Endocrinology, 5(7), 374-381. https://doi.org/10.1038/nrendo.2009.106
22. Andersen SL (2015) Exposure to early adversity: Points of cross-species translation that can lead to improved understanding of depression. Physiology & behavior, 176(3), 139-148. https://doi.org/10.1016/j.physbeh.2017.03.040
23. Goodyer IM, Park RJ y Herbert J (2001) Psychosocial and endocrine features of chronic first-episode major depression in 8–16 year olds. Biological Psychiatry, 50(5), 351-357. https://doi.org/10.1016/S0006-3223(01)01120-9
24. MacMillan HL, Fleming JE, Streiner DL, Lin E, Boyle MH, Jamieson E, Duku EK, Walsh CA, Wong MYY y Beardslee WR (2001) Childhood Abuse and Lifetime Psychopathology in a Community Sample. American Journal of Psychiatry, 158(11), 1878-1883. https://doi.org/10.1176/appi.ajp.158.11.1878
25. Oomen CA, Girardi CEN, Cahyadi R, Verbeek EC, Krugers H, Joëls M y Lucassen PJ (2009) Opposite Effects of Early Maternal Deprivation on Neurogenesis in Male versus Female Rats. PLoS ONE, 4(1), e3675. https://doi.org/10.1371/journal.pone.0003675
26. Rüedi‐Bettschen D, Zhang W, Russig H, Ferger B, Weston A, Pedersen E, Feldon J y Pryce CR (2006) Early deprivation leads to altered behavioural, autonomic and endocrine responses to environmental challenge in adult Fischer rats. European Journal of Neuroscience, 24(10), 2879-2893. https://doi.org/10.1111/j.1460-9568.2006.05158.x
27. Caron J-B y Vannier J (2016) Waptia and the Diversification of Brood Care in Early Arthropods. Current Biology, 26(1), 69-74. https://doi.org/10.1016/j.cub.2015.11.006
28. Glynn LM y Baram TZ (2019) The influence of unpredictable, fragmented parental signals on the developing brain. Frontiers in Neuroendocrinology, 53(January). https://doi.org/10.1016/j.yfrne.2019.01.002
29. Walker CD, Bath KG, Joels M, Korosi A, Larauche M, Lucassen PJ, Morris MJ, Raineki C, Roth TL, Sullivan RM, Taché Y y Baram TZ (2017) Chronic early life stress induced by limited bedding and nesting (LBN) material in rodents: Critical considerations of methodology, outcomes and translational potential: Roundtable discussion at the 4 th Neurobiology of Stress Workshop (Newport Beach, Apr. Stress, 20(5), 421-448. https://doi.org/10.1080/10253890.2017.1343296
30. Levine S (2001) Primary social relationships influence the development of the hypothalamic–pituitary–adrenal axis in the rat. Physiology & Behavior, 73(3), 255-260. https://doi.org/10.1016/S0031-9384(01)00496-6
31. Avishai-Eliner S (2002) Stressed-out, or in (utero)? Trends in Neurosciences, 25(10), 518-524. https://doi.org/10.1016/S0166-2236(02)02241-5
32. Liu D, Diorio J, Tannenbaum B, Caldji C, Francis D, Freedman A, Sharma S, Pearson D, Plotsky PM y Meaney MJ (1997) Maternal care, hippocampal glucocorticoid receptors, and hypothalamic- pituitary-adrenal responses to stress. Science, 277(5332), 1659-1662. https://doi.org/10.1126/science.277.5332.1659
33. Teicher MH, Andersen SL, Polcari A, Anderson CM, Navalta CP y Kim DM (2003) The neurobiological consequences of early stress and childhood maltreatment. Neuroscience & Biobehavioral Reviews, 27(1-2), 33-44. https://doi.org/10.1016/S0149-7634(03)00007-1
34. Graham YP, Heim C, Goodman SH, Miller AH y Nemeroff CB (1999) The effects of neonatal stress on brain development: Implications for psychopathology. Development and Psychopathology, 11(3), 545-565. https://doi.org/10.1017/S0954579499002205
35. Cowan CSM, Callaghan BL, Kan JM y Richardson R (2016) The lasting impact of early-life adversity on individuals and their descendants: Potential mechanisms and hope for intervention. Genes, Brain and Behavior, 15(1), 155-168. https://doi.org/10.1111/gbb.12263
36. Atrooz F, Liu H y Salim S (2019) Stress, psychiatric disorders, molecular targets, and more. En Progress in Molecular Biology and Translational Science (Vol. 167). Elsevier Inc. https://doi.org/10.1016/bs.pmbts.2019.06.006
37. Schär S, Mürner-Lavanchy I, Schmidt SJ, Koenig J y Kaess M (2022) Child maltreatment and hypothalamic-pituitary-adrenal axis functioning: A systematic review and meta-analysis. Frontiers in Neuroendocrinology, 66, 100987. https://doi.org/10.1016/j.yfrne.2022.100987
38. Schore AN (2001) Effects of a secure attachment relationship on right brain development, affect regulation, and infant mental health. Infant Mental Health Journal, 22(1-2), 7-66. https://doi.org/10.1002/1097-0355(200101/04)22:1<7::AID-IMHJ2>3.0.CO;2-N
39. Alink LRA, Cicchetti D, Kim J y Rogosch FA (2012) Longitudinal associations among child maltreatment, social functioning, and cortisol regulation. Developmental Psychology, 48(1), 224-236. https://doi.org/10.1037/a0024892
40. Bernard K, Frost A, Bennett CB y Lindhiem O (2017) Maltreatment and diurnal cortisol regulation: A meta-analysis. Psychoneuroendocrinology, 78, 57-67. https://doi.org/10.1016/j.psyneuen.2017.01.005
41. Sanchez MM (2006) The impact of early adverse care on HPA axis development: Nonhuman primate models. Hormones and Behavior, 50(4), 623-631. https://doi.org/10.1016/j.yhbeh.2006.06.012
42. https://www.valenciaport.com/autoridad-portuaria/sobre-valencia-port/plan-estrategico/ accedido 20/06/25
43. Andersen SL (2003) Trajectories of brain development: Point of vulnerability or window of opportunity? Neuroscience and Biobehavioral Reviews, 27(1-2), 3-18. https://doi.org/10.1016/S0149-7634(03)00005-8
44. Junod A, Opendak M, LeDoux JE y Sullivan RM (2019) Development of threat expression following infant maltreatment: Infant and adult enhancement but adolescent attenuation. Frontiers in Behavioral Neuroscience, 13(June), 1-13. https://doi.org/10.3389/fnbeh.2019.00130
45. Antonelli MC, Pallarés ME, Ceccatelli S y Spulber S (2017) Long-term consequences of prenatal stress and neurotoxicants exposure on neurodevelopment. Progress in Neurobiology, 155, 21-35. https://doi.org/10.1016/j.pneurobio.2016.05.005
46. Grillo Balboa J, Colapietro AA, Cantarelli VI, Ponzio MF, Ceol Retamal MN, Pallarés ME, Antonelli MC y Chertoff M (2025) Sex-Specific Outcomes in a Rat Model of Early-Life Stress Due to Adverse Caregiving. Neurotoxicity Research, 43(2), 10. https://doi.org/10.1007/s12640-025-00731-9
47. Colapietro AA, Grillo Balboa J, Ceol Retamal MN, Regueira E, Hermida GN, Cantarelli VI, Ponzio MF, Pallarés ME, Antonelli MC y Diaz SL (2025) Infant Maltreatment Induces Early Alterations in Adrenal Glands and Stress Response in Juvenile Rat Offspring. Neurochemical Research, 50(2), 108. https://doi.org/10.1007/s11064-025-04363-5
48. Raineki C, Holman PJ, Debiec J, Bugg M, Beasley A y Sullivan RM (2010) Functional emergence of the hippocampus in context fear learning in infant rats. Hippocampus, 20(9), 1037-1046. https://doi.org/10.1002/hipo.20702
49. Molet J, Maras PM, Avishai-Eliner S y Baram TZ (2014) Naturalistic rodent models of chronic early-life stress. Developmental Psychobiology, 56(8), 1675-1688. https://doi.org/10.1002/dev.21230
50. Ivy AS, Brunson KL, Sandman C y Baram TZ (2008) Dysfunctional nurturing behavior in rat dams with limited access to nesting material: A Clinically Relevant Model for Early-Life Stress. Neuroscience, 154(3), 1132-1142.
51. Moussaoui N, Larauche M, Biraud M, Molet J, Million M, Mayer E y Taché Y (2016) Limited Nesting Stress Alters Maternal Behavior and In Vivo Intestinal Permeability in Male Wistar Pup Rats. PLOS ONE, 11(5), e0155037. https://doi.org/10.1371/journal.pone.0155037
52. Perry RE, Rincón-Cortés M, Braren SH, Brandes-Aitken AN, Opendak M, Pollonini G, Chopra D, Raver CC, Alberini CM, Blair C y Sullivan RM (2019) Corticosterone administration targeting a hypo-reactive HPA axis rescues a socially-avoidant phenotype in scarcity-adversity reared rats. Developmental Cognitive Neuroscience, 40(August). https://doi.org/10.1016/j.dcn.2019.100716
53. Teicher MH y Khan A (2019) Childhood Maltreatment, Cortical and Amygdala Morphometry, Functional Connectivity, Laterality, and Psychopathology. Child Maltreatment, 24(4), 458-465. https://doi.org/10.1177/1077559519870845
54. Siehl S, Sicorello M, Herzog J, Nees F, Kleindienst N, Bohus M, Müller-Engelmann M, Steil R, Priebe K, Schmahl C y Flor H (2022) Neurostructural associations with traumatic experiences during child- and adulthood. Translational Psychiatry, 12(1), 515. https://doi.org/10.1038/s41398-022-02262-9
55. Jenness JL, Peverill M, Miller AB, Heleniak C, Robertson MM, Sambrook KA, Sheridan MA y McLaughlin KA (2021) Alterations in neural circuits underlying emotion regulation following child maltreatment: A mechanism underlying trauma-related psychopathology. Psychological Medicine, 51(11), 1880-1889. https://doi.org/10.1017/S0033291720000641
56. Jedd K, Hunt RH, Cicchetti D, Hunt E, Cowell RA, Rogosch FA, Toth SL y Thomas KM (2015) Long-term consequences of childhood maltreatment: Altered amygdala functional connectivity. Development and Psychopathology, 27(4pt2), 1577-1589. https://doi.org/10.1017/S0954579415000954
57. Raineki C, Opendak M, Sarro E, Showler A, Bui K, McEwen BS, Wilson DA y Sullivan RM (2019) During infant maltreatment, stress targets hippocampus, but stress with mother present targets amygdala and social behavior. Proceedings of the National Academy of Sciences of the United States of America, 116(45), 22821-22832. https://doi.org/10.1073/pnas.1907170116
58. Guadagno A, Wong TP y Walker CD (2018) Morphological and functional changes in the preweaning basolateral amygdala induced by early chronic stress associate with anxiety and fear behavior in adult male, but not female rats. Progress in Neuro-Psychopharmacology and Biological Psychiatry, 81, 25-37. https://doi.org/10.1016/j.pnpbp.2017.09.025
59. Santiago AN, Lim KY, Opendak M, Sullivan RM y Aoki C (2018) Early life trauma increases threat response of peri-weaning rats, reduction of axo-somatic synapses formed by parvalbumin cells and perineuronal net in the basolateral nucleus of amygdala. Journal of Comparative Neurology, 526(16), 2647-2664. https://doi.org/10.1002/cne.24522
60. Doherty TS y Roth TL (2018) Epigenetic Landscapes of the Adversity-Exposed Brain. En Physiology & behavior (Vol. 176, Número 5, pp. 1-19). https://doi.org/10.1016/bs.pmbts.2017.11.025
61. Demaestri C, Gallo M, Mazenod E, Hong AT, Arora H, Short AK, Stern H, Baram TZ y Bath KG (2022) Resource scarcity but not maternal separation provokes unpredictable maternal care sequences in mice and both upregulate Crh-associated gene expression in the amygdala. Neurobiology of Stress, 20(August), 100484. https://doi.org/10.1016/j.ynstr.2022.100484
62. Hart H y Rubia K (2012) Neuroimaging of child abuse: A critical review. Frontiers in Human Neuroscience, 6. https://doi.org/10.3389/fnhum.2012.00052
63. Woon FL y Hedges DW (2008) Hippocampal and amygdala volumes in children and adults with childhood maltreatment‐related posttraumatic stress disorder: A meta‐analysis. Hippocampus, 18(8), 729-736. https://doi.org/10.1002/hipo.20437
64. Howe ML, Cicchetti D y Toth SL (2006) Children’s basic memory processes, stress, and maltreatment. Development and Psychopathology, 18(03). https://doi.org/10.1017/S0954579406060378
65. Tyrka AR, Price LH, Marsit C, Walters OC y Carpenter LL (2012) Childhood Adversity and Epigenetic Modulation of the Leukocyte Glucocorticoid Receptor: Preliminary Findings in Healthy Adults. PLoS ONE, 7(1), e30148. https://doi.org/10.1371/journal.pone.0030148
66. Parade SH, Huffhines L, Daniels TE, Stroud LR, Nugent NR y Tyrka AR (2021) A systematic review of childhood maltreatment and DNA methylation: Candidate gene and epigenome-wide approaches. Translational Psychiatry, 11(1), 134. https://doi.org/10.1038/s41398-021-01207-y
67. Provenzi L, Giorda R, Beri S y Montirosso R (2016) SLC6A4 methylation as an epigenetic marker of life adversity exposures in humans: A systematic review of literature. Neuroscience & Biobehavioral Reviews, 71, 7-20. https://doi.org/10.1016/j.neubiorev.2016.08.021
68. Baram TZ y Birnie MT (2024) Enduring memory consequences of early-life stress / adversity: Structural, synaptic, molecular and epigenetic mechanisms. Neurobiology of Stress, 33, 100669. https://doi.org/10.1016/j.ynstr.2024.100669
69. Bolton JL, Ruiz CM, Rismanchi N, Sanchez GA, Castillo E, Huang J, Cross C, Baram TZ y Mahler SV (2018) Early-life adversity facilitates acquisition of cocaine self-administration and induces persistent anhedonia. Neurobiology of Stress, 8, 57-67. https://doi.org/10.1016/j.ynstr.2018.01.002
70. Ivy AS, Rex CS, Chen Y, Dubé C, Maras PM, Grigoriadis DE, Gall CM, Lynch G y Baram TZ (2010) Hippocampal Dysfunction and Cognitive Impairments Provoked by Chronic Early-Life Stress Involve Excessive Activation of CRH Receptors. The Journal of Neuroscience, 30(39), 13005-13015. https://doi.org/10.1523/JNEUROSCI.1784-10.2010
71. Molet J, Maras PM, Kinney‐Lang E, Harris NG, Rashid F, Ivy AS, Solodkin A, Obenaus A y Baram TZ (2016) MRI uncovers disrupted hippocampal microstructure that underlies memory impairments after early‐life adversity. Hippocampus, 26(12), 1618-1632. https://doi.org/10.1002/hipo.22661
72. Roth TL, Matt S, Chen K y Blaze J (2014) Bdnf DNA methylation modifications in the hippocampus and amygdala of male and female rats exposed to different caregiving environments outside the homecage. Developmental Psychobiology, 56(8), 1755-1763. https://doi.org/10.1002/dev.21218
73. Maniam J, Antoniadis CP, Youngson NA, Sinha JK y Morris MJ (2016) Sugar consumption produces effects similar to early life stress exposure on hippocampal markers of neurogenesis and stress response. Frontiers in Molecular Neuroscience, 8(JAN2016), 1-10. https://doi.org/10.3389/fnmol.2015.00086
74. Hoeijmakers L, Ruigrok SR, Amelianchik A, Ivan D, Van Dam A-M, Lucassen PJ y Korosi A (2017) Early-life stress lastingly alters the neuroinflammatory response to amyloid pathology in an Alzheimer’s disease mouse model. Brain, Behavior, and Immunity, 63, 160-175. https://doi.org/10.1016/j.bbi.2016.12.023
75. Gold AL, Sheridan MA, Peverill M, Busso DS, Lambert HK, Alves S, Pine DS y McLaughlin KA (2016) Childhood abuse and reduced cortical thickness in brain regions involved in emotional processing. Journal of Child Psychology and Psychiatry, 57(10), 1154-1164. https://doi.org/10.1111/jcpp.12630
76. Ansell EB, Rando K, Tuit K, Guarnaccia J y Sinha R (2012) Cumulative Adversity and Smaller Gray Matter Volume in Medial Prefrontal, Anterior Cingulate, and Insula Regions. Biological Psychiatry, 72(1), 57-64. https://doi.org/10.1016/j.biopsych.2011.11.022
77. Teicher MH y Samson JA (2016) Annual Research Review: Enduring neurobiological effects of childhood abuse and neglect. Journal of Child Psychology and Psychiatry, 57(3), 241-266. https://doi.org/10.1111/jcpp.12507
78. McCrory E, De Brito SA y Viding E (2011) The Impact of Childhood Maltreatment: A Review of Neurobiological and Genetic Factors. Frontiers in Psychiatry, 2. https://doi.org/10.3389/fpsyt.2011.00048
79. Teicher MH, Samson JA, Anderson CM y Ohashi K (2016) The effects of childhood maltreatment on brain structure, function and connectivity. Nature Reviews Neuroscience, 17(10), 652-666. https://doi.org/10.1038/nrn.2016.111
80. Gerin MI, Viding E, Herringa RJ, Russell JD y McCrory EJ (2023) A systematic review of childhood maltreatment and resting state functional connectivity. Developmental Cognitive Neuroscience, 64, 101322. https://doi.org/10.1016/j.dcn.2023.101322
81. Roth TL, Lubin FD, Funk AJ y Sweatt JD (2009) Lasting epigenetic influence of early-life adversity on the BDNF gene. Biological psychiatry, 65(9), 760–769. https://doi.org/10.1016/j.biopsych.2008.11.028
82. Doherty TS, Chajes JR, Reich L, Duffy HBD y Roth TL (2019) Preventing epigenetic traces of caregiver maltreatment: A role for HDAC inhibition. International Journal of Developmental Neuroscience, 78(March), 178-184. https://doi.org/10.1016/j.ijdevneu.2019.05.002
83. Yan CG, Rincón-Cortés M, Raineki C, Sarro E, Colcombe S, Guilfoyle DN, Yang Z, Gerum S, Biswal BB, Milham MP, Sullivan RM y Castellanos FX (2017) Aberrant development of intrinsic brain activity in a rat model of caregiver maltreatment of offspring. Translational Psychiatry, 7(1). https://doi.org/10.1038/tp.2016.276
 ISSN 1666-7948 www.quimicaviva.qb.fcen.uba.ar |
Revista QuímicaViva Volumen 24, Número 2, Agosto de 2025 |
Publicado en:
Vol 24, Nro 2
Agosto de 2025
Identificador: E0296
DOI:10.62167/qv.e0296
Tipo: Perspectivas
Recibido en: 17/07/2025
Aceptado en: 22/07/2025
Contacto: J Grillo Balboa