
ISSN 1666-7948
Revista Electrónica de Ciencia y Educación
Departamento de Química Biológica FCEN-UBA IQUIBICEN

ISSN 1666-7948
Revista Electrónica de Ciencia y Educación
Departamento de Química Biológica FCEN-UBA IQUIBICEN
Desovillando el misterio de la Atrofia Muscular Espinal
María Alejandra Petino Zappala
Facultad de Filosofía y Letras, Facultad de Ciencias Exactas y Naturales, Universidad de Buenos Aires – CONICET
Científicos de nuestro país lideran el desarrollo de una terapia combinada para una devastadora enfermedad que por el momento fue efectiva en ratones.

Figura 1: De izquierda a derecha, Alberto Kornblihtt, Vanina Sánchez (presidenta de FAME) y Luciano Marasco, primer autor del paper. Fuente: CONICET
A principios de Junio tuvimos un gran anuncio protagonizado por el laboratorio liderado por el biólogo Alberto Kornblihtt. Este grupo del Instituto de Fisiología, Biología Molecular y Neurociencias (IFIBYNE) dependiente de UBA y CONICET salió en los medios del país por haber dado un paso en la lucha contra una elusiva enfermedad. Pero el caso no es solamente interesante por su costado científico, sino porque ilustra la organización de familiares de pacientes y sus diálogos con investigadores e instituciones: fue un grupo que nuclea a 400 familias de personas afectadas por esta patología quien puso en marcha los engranajes del anunciado avance contra la Atrofia Muscular Espinal (AME).
¿Qué es la AME?
La enfermedad que motivó esta investigación es en muchos casos ciertamente devastadora. De naturaleza neurológica, causa en las personas afectadas una debilidad muscular progresiva que en muchos casos puede llegar a ser terrible: en la forma más común y grave, AME1, los primeros síntomas aparecen dentro de los seis meses de vida y sin intervención suelen causar la muerte antes de los dos años. Su severidad y la rapidez de su avance depende de factores genéticos, y el otro extremo del espectro incluye formas de comienzo adulto que no afectan la expectativa de vida, aunque sí su calidad.
Gracias a las investigaciones previas se sabe que son las deficiencias en el gen SMN1 (por Survival Motor Neuron 1) las que causan el cuadro. Como su nombre lo indica, la proteína SMN que codifica este gen es vital para la supervivencia neuronal, y su ausencia o pérdida de función puede tener los efectos incapacitantes ya mencionados. Pero hasta hace unos años no existían tratamientos para esta patología. Fueron necesarios años de trabajos en ciencia básica y muchos estudios específicos sobre los mecanismos de la enfermedad para que en 2017 finalmente se aprobase el nusinersen, una droga desarrollada de forma específica para la AME.
¿Las ventajas? Incluso en los casos más graves su pronta aplicación puede hacer una diferencia abismal. Vanina Sánchez, presidenta de Familias AME Argentina (FAME), lo ilustra claramente: cuando son diagnosticados y tratados muy tempranamente hasta los pacientes del tipo más severo pueden desarrollarse de forma normal.
Por otro lado, su versión comercial, llamada Spinraza, estuvo desde el principio en el ojo de la tormenta por ser una de las medicinas más caras del mundo. En Argentina, hubo una larga pulseada entre el Estado y el laboratorio Biogen, que fabrica la droga, para negociar el acceso de los pacientes. Luego de un primer acuerdo previo muy desventajoso para nuestro país, que permitía a la empresa especular con el precio y mantenerlo en la confidencialidad, se firmó en 2021 un nuevo convenio. Este acuerdo asegura que las prepagas, obras sociales o el Estado cubran la totalidad del medicamento para los casos de AME1. A su vez el laboratorio ha aceptado bajar el costo, que igualmente, sigue siendo exorbitante: unos 80.000 dólares por dosis, tres de ellas al año por cada paciente.
Con o sin convenios, adquirir drogas para tratar la AME puede ser prohibitivo para un país periférico. Incluso dentro del norte global el acceso para los pacientes puede depender de las vicisitudes de los sistemas de salud y de los nexos, no siempre transparentes, entre el laboratorio, los seguros médicos y los Estados. Además su costo restringe en muchos casos la cobertura sólo a los casos más graves. Esta fue una de las preocupaciones que motivó el estudio que fuese anunciado por el laboratorio del IFIBYNE: ¿puede mejorarse la eficiencia del fármaco para hacerlo más accesible a quienes lo necesiten?
Luces y sombras de un genoma inquieto
Para entender cómo funciona el nusinersen y cómo el equipo de Alberto Kornblihtt está contribuyendo a mejorar el tratamiento hay que adentrarse un poco en nuestra historia evolutiva reciente. La región del cromosoma 5 en que se encuentra el ya mencionado gen SMN1 es testigo del dinamismo de nuestro material genético. Se trata de una zona que en el pasado de nuestra especie sufrió una duplicación e inversión, que contiene secuencias repetitivas o complementarias, y que es por lo tanto susceptible a rearreglos y deleciones frecuentes que pueden afectar al gen SMN1. Semejante inestabilidad explica que la AME sea la más común de las enfermedades genéticas que causan muerte infantil.
Tal vez paradójicamente, esta agitada historia de nuestro genoma fue la llave para el desarrollo del nusinersen. Como producto de la duplicación en el cromosoma 5, en el linaje humano existe un gen parálogo de SMN1 llamado SMN2, es decir una réplica casi exacta. “Casi” es la palabra clave: aún siendo escasas y silenciosas, las diferencias entre SMN1 y SMN2 impiden que el duplicado compense las falencias en el gen original. La principal causa es una variante en un sitio de splicing de SMN2. Al procesarse el ARN mensajero del gen, a diferencia de lo que ocurre en su parálogo SMN1 en personas sanas, el exón 7 se elimina en una alta proporción de los transcriptos. La secuencia del polipéptido de SMN que se genera es normal, pero la exclusión de ese exón hace que la proteína sea inestable. La expresión de SMN2, entonces, no alcanza generalmente para compensar las alteraciones en SMN1 en personas afectadas. Por eso, aún teniendo este “backup” genético, las mutaciones en SMN1 causan la patología.
Si tan solo se pudiese modificar el equilibrio del splicing alternativo de este exón en SMN2 para aumentar su inclusión, los pacientes podrían contar con una mayor producción de proteína SMN funcional. Y de hecho gran parte de los esfuerzos contra la AME se enfocan en este proceso y logran enlentecer el curso de la enfermedad. Así funciona el nusinersen, desarrollado por el uruguayo Adrián Krainer en su laboratorio en Cold Spring Harbor. Es un oligonucleótido antisentido que se inyecta directamente en el líquido cefalorraquídeo de los pacientes; por su secuencia, puede pegarse al ARN mensajero de SMN2 en un sitio inhibidor del splicing cercano al exón 7. De esta forma, la droga altera el balance del splicing hacia la inclusión del exón 7 y así aumenta la cantidad de proteína SMN capaz de “rescatar” a las neuronas motoras. Esta fue la primera droga disponible contra la AME.
Ciencia básica, ciencia aplicada y ciudadanos científicos
La historia no termina aquí, por supuesto. Hay muchos factores que pueden afectar los procesos de splicing, por lo que la eficacia del nusinersen es variable y mejorable. Aquí radica el potencial para bajar el costo del tratamiento: lograr que el fármaco funcione mejor y en menores cantidades a través de otros factores que inclinen la balanza aún más a favor de la inclusión del exón 7. Esta era una de las esperanzas de Kornblihtt y sus colaboradores, con una ya amplísima historia de investigación de los mecanismos del splicing alternativo, cuando empezaron a trabajar en este desarrollo.
Pero aún con su gran experiencia en el tema, este fue el comienzo de un nuevo camino para el laboratorio del biólogo. “Nosotros siempre trabajamos en los mecanismos básicos, en ciencia básica – aclaró Kornblihtt en una conferencia de prensa difundida por CONICET – pero hace unos seis años golpearon la puerta de mi oficina los padres de los niños que sufren AME”. A sabiendas de que el principal tratamiento para la enfermedad involucraba este equilibrio en el splicing alternativo, fueron ellos quienes se pusieron al hombro la tarea de contactar a los expertos. En la Argentina, Kornblihtt era “número puesto”.
La colaboración no empezó de forma inmediata: como manifestó el investigador en su charla, la relación entre los científicos y los pacientes o sus familias puede ser complicada. Siempre existe el riesgo de que las expectativas no se cumplan, y sobre todo ante una patología tan cruel, es posible alimentar involuntariamente esperanzas desmedidas. Las familias insistieron. “Desde 2003 teníamos un sueño, que era que en algún momento se investigue en nuestro país” contó emocionada Vanina Sánchez en el evento. “Alberto nos cerró una puerta pero dejó abierta una ventana. Se quedó pensando, un tiempo después nos llamó y nos dijo que sí”. Como aclaró el biólogo, los familiares no sólo querían que se hiciera investigación básica en el país, sino tener contactos científicos que les permitieran interpretar los avances que se producían afuera. Así fue que estos ciudadanos, originalmente agrupados para contenerse mutuamente ante la devastadora y hasta ese momento intratable enfermedad, se involucraron de forma directa en la investigación. No sólo financiaron parte de los reactivos hasta que el laboratorio acumuló suficiente evidencia para acceder a los subsidios necesarios, sino que establecieron también un ida y vuelta invitando a los investigadores argentinos a comunicar sus descubrimientos en reuniones en el país y el mundo.
Aprovechando la sinergia
Uno de los factores que en el laboratorio del IFIBYNE ya habían detectado como relevante para el splicing alternativo es el grado de condensación del ADN. Se sabe que cuando la estructura de la cromatina se encuentra más laxa, la transcripción se realiza a mayor velocidad. Luciano Marasco, becario doctoral y primer autor del paper, explica en el video difundido por CONICET por qué el grupo puso su atención en este fenómeno: en el caso particular de SMN2, cuanto más veloz sea la transcripción, más aumenta la proporción de transcriptos que incluyen al exón 7, y por ende la cantidad de proteína SMN funcional. Estudiando el splicing en esta zona además verificaron que el nusinersen tendía a condensar la cromatina en la región de pegado, por lo que limitaba su propia efectividad. Contrarrestar este efecto indeseado del fármaco podría mejorar su funcionamiento. Esa fue la punta del hilo del que empezaron a tirar.
Para eso tuvieron que probar con los compuestos ya conocidos por su efecto en la condensación del ADN. Así llegaron al ácido valproico, un medicamento usado en algunos casos de epilepsia y trastorno bipolar que ejerce sus efectos relajando la estructura de la cromatina. La apuesta era por una terapia combinada con el nusinersen, en la que se potenciasen los efectos de ambas drogas en la inclusión del exón 7 de SMN2. Y, al menos en modelos animales, funcionó, como anunciaron en la conferencia de prensa y en un paper publicado en Junio en la revista Cell [1].
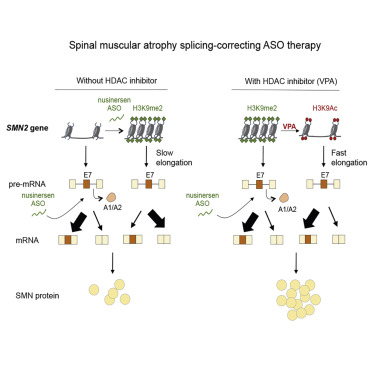
Figura 2: La imagen del paper muestra los efectos combinados de nusinersen y ácido valproico (VPA) en el splicing alternativo del exón 7. Fuente: [1].
Con Marasco como primer autor, el trabajo presenta los resultados en ratones: los efectos de la administración combinada de nusinersen y ácido valproico se ven en los productos de splicing de SMN2, pero también en el nivel de expresión proteica, en el fenotipo a nivel neuronal, en el crecimiento y la supervivencia de los animales. Aunque son buenas noticias, todavía resta conocer los efectos de la combinación en pacientes de AME. Vanina Sánchez se ocupó de aclarar en la conferencia de prensa que la expectativa entre las familias es muy grande, pero que tienen cautela y se encuentran a la espera de los ensayos clínicos que corroboren si la terapia combinada es efectiva en humanos.
Por lo pronto, todos los participantes de la conferencia aprovecharon para destacar que tanto el desarrollo original del nusinersen como de esta terapia combinada hubiesen sido imposibles si no fuese por la inversión en ciencia básica, y mencionaron la importancia de la soberanía científica y del rol del Estado para implementar políticas de largo plazo independientes de las necesidades del mercado. Vale destacar que al menos hasta esta etapa el financiamiento de los ensayos de la terapia combinada ha provenido de las organizaciones de familias, fundaciones o de fondos públicos, sin el involucramiento de multinacionales farmacéuticas que eventualmente pudiesen especular con el costo de la terapia.
Nota: María Alejandra Petino Zappala es Especialista en Comunicación Pública de la Ciencia y la Tecnología e integrante de esparCiencia
Referencias:
1. LE Marasco, G Dujardin, R Sousa-Luís, YH Liu, JN Stigliano, T Nomakuchi, NJ Proudfoot, AR Krainer, AR Kornblihtt. (2022) Counteracting chromatin effects of a splicing-correcting antisense oligonucleotide improves its therapeutic efficacy in spinal muscular atrophy. Cell 185(12):2057-2070.e15. doi: 10.1016/j.cell.2022.04.031.
|
|
Revista QuímicaViva Número 2, año 21, Agosto 2022 quimicaviva@qb.fcen.uba.ar |
 ISSN 1666-7948 www.quimicaviva.qb.fcen.uba.ar |
Revista QuímicaViva Volumen 21, Número 2, Agosto de 2022 |
Publicado en:
Vol 21, Nro 2
Agosto de 2022
Identificador: E0232
DOI:No disponible
Tipo: Enseñanza de la ciencia
Recibido en: 26/06/2022
Aceptado en: 27/06/2022
Contacto: María Alejandra Petino Zappala