Efectos de los surfactantes en la biorremediación de suelos contaminados con hidrocarburos
Héctor H. Riojas González(1,3), Luis G. Torres Bustillos(2), Iram Mondaca Fernández(1).
José de Jesús Balderas Cortes(1), Pablo Gortáres Moroyoqui(1)
1Departamento de Recursos Naturales. Instituto Tecnológico de Sonora, 5 de Febrero 818 Sur, Colonia Centro, Cd. Obregón, Sonora, México. C.P. 85000
2UPIBI-Instituto Politécnico Nacional, Av Acueducto s/n Colonia Barrio La Laguna Ticoman. México, D.F. C.P. 07340
3h.riojas@gmail.com
Recibido 4/11/2010 - Aceptado 2/12/2010
Resumen
El proceso de biorremediación en suelos contaminados con hidrocarburos, llevado a cabo con surfactantes, está condicionado por las capacidades fisiológicas de los microorganismos, la estructura química del hidrocarburo, el tipo de surfactante y los factores ambientales del suelo. Aplicar surfactantes en una biorremediación puede actuar incrementando la biodisponibilidad del hidrocarburo mediante la acción paralela de la desorción y solubilización del contaminante, permitiendo la transferencia de masa y biodegradación. Pero también puede actuar en una inhibición y/o toxicidad de la población microbiana. La presente revisión tiene por objeto describir los efectos de los surfactantes en el proceso de biorremediación dándole un énfasis a los efectos que influyen en la biodisponibilidad y finalmente discutir sobre los factores que ocasionan la inhibición y toxicidad.
Palabras clave: Biodisponibilidad, surfactantes, biodegradación, hidrocarburos, solubilización micelar
Abstract
Bioremediation process in soil contaminated with hydrocarbons, carried out with surfactants, is conditioned by physiological capabilities of microorganisms, chemical structure of hydrocarbon, surfactant type and environmental factors of soil. Applying surfactants in bioremediation may act by increasing the bioavailability of oil by the parallel action of the contaminant desorption and solubilization, allowing mass transfer and biodegradation. However it can produce or cause an inhibition and / or toxicity. The aim of this review is to describe the effects of surfactants in the bioremediation process giving emphasis to the effects that influence the bioavailability and finally to discuss factors causing inhibition or toxicity.
Key words: Bioavailability, surfactants, biodegradation, hydrocarbons, micellar solubilization
1. Introducción
La contaminación ambiental ocasionada por el petróleo y productos petroquímicos (mezclas complejas de hidrocarburos) se reconoce como uno de los más graves problemas de la actualidad, sobre todo cuando se asocia a los derrames accidentales a gran escala (1).
Una vez derramado este contaminante en el suelo, la mayoría de los compuestos alifáticos se pierden por volatilización, mientras que algunos hidrocarburos como los policíclicos persisten en la superficie (2), generando un gran impacto en virtud de sus efectos tóxicos y recalcitrantes para los seres vivos (3). Los hidrocarburos más estudiados son benceno, tolueno, etilbenzeno y xileno agrupados también bajo la apelación BTEX y los poliaromáticos (HAP), el diaromático naftaleno y los triaromáticos fenantreno, antraceno y fluoreno (4) que generan un impacto negativo a los ecosistemas y a la salud de los seres vivos (5).
Entre las técnicas más empleadas hasta ahora para la eliminación de los hidrocarburos presentes en los suelos, podemos citar la extracción de hidrocarburos por vacío, el lavado del suelo contaminado con agua, la incineración y la recuperación electrocinética entre otros (6). Se estima que los costos de restauración de residuos peligrosos pueden acercarse a 1,7 billones de dólares en los próximos 30 años tan solo en E.U.A. (7). Con algunas de estas técnicas se han conseguido efectos positivos, pero su elevado costo económico constituye hoy en día un obstáculo muy a tener en cuenta para su empleo (Tabla 1). Por ello, se ha planteado la posibilidad de buscar alternativas viables para la eliminación de los hidrocarburos contenidos en los suelos que sean ambientalmente correctas, simples y económicas. Aparecen así las técnicas de biorremediación, que consisten en hacer uso de microorganismos o plantas para conseguir eliminar mediante biodegradación una contaminación por orgánicos (8), y constituye una tecnología en clara expansión y muy competitiva, capaz de conseguir la biodegradación de los hidrocarburos contenidos en los suelos.
Tabla 1. Costos de tratamientos. Ref. (9)
Tratamiento
Costo por tonelada (dólares, E.U.A.)
Depósito
$140-200
Incineración
$150-140
Estabilización/fijación
$100-200
Biorremediación
$15-17
Numerosos microorganismos, incluyendo bacterias, hongos y levaduras, son conocidos por su capacidad para degradar hidrocarburos (10). Contaminantes presentes en la fase líquida no acuosa (NAPL, por sus siglas en inglés) o absorbidos en la matriz del suelo no suelen estar disponibles para la degradación microbiana, por lo que la tasa de degradación es a menudo limitada por problemas de transferencia de masa (11).
Dependiendo de las características del suelo y del contenido de materia orgánica, los hidrocarburos de mayor peso molecular y menor solubilidad pueden adsorberse en los microporos de las partículas del suelo, resultando con esto ser inaccesibles como fuentes de carbono y energía para los microorganismos. Ante este escenario los surfactantes actúan logrando incrementar la biodisponibilidad mediante la acción paralela de la desorción y solubilización del contaminante (2,12,13). Sin embargo la toxicidad e inhibición puede reducir el potencial de las aplicaciones en la biorremediación (7). Para elegir un surfactante para la biorremediación se debe tener en cuenta el tipo de contaminante que se desea remediar, las propiedades del suelo así como las propiedades del propio surfactante y por último la existencia de microorganismos degradadores del contaminante que se trate de remediar (14).
Los surfactantes son esenciales para el proceso de biorremediación, esto confirma el hecho de que algunos microorganismos producen su propio surfactante (biosurfactante) para solubilizar compuestos orgánicos hidrofóbicos (15).
En este artículo se analizan y discuten las interacciones que existen entre el hidrocarburo, el surfactante y los microorganismos presentes en el suelo, con relación a su biodisponibilidad y biodegradabilidad, así como el efecto de inhibición o toxicidad del surfactante en la población microbiana.
2. Potencial de la biorremediación en suelos contaminados con hidrocarburos
Los suelos contaminados son, por lo general, colonizados por diferentes especies que se adaptan a las fuentes de energía presentes en el sitio. Se estima que en un gramo de suelo en condiciones naturales (no afectadas por acciones antropogénicas) se pueden encontrar hasta 600 millones de bacterias, entre las cuales pueden existir entre 15 mil y 20 mil especies distintas, en la Tabla 2 se presentan las bacterias más representativas del suelo (16).
Tabla 2. Composición de bacterias en el suelo Ref. (17).
Género
Bacterias en el suelo (%)
Arthrobacter
5-60
Bacillus
5-67
Pseudomonas
3-15
Agrobacterium
1-20
Alcaligenes
1-20
Flavobacterium
1-20
Corynebacterium
2-12
Micrococcus
2-10
Taphylococcus
<5
Xanthomonas
<5
Mycobacterium
<5
En los suelos contaminados con hidrocarburos, las bacterias y hongos capaces de utilizar hidrocarburos (18) representan el 1% de la población total siendo aproximadamente 104 a 106 células por gramo de suelo, también se han encontrado cianobacterias y algas capaces de degradar hidrocarburos. Los suelos contaminados con hidrocarburos contienen más microorganismos que los suelos no contaminados, pero su diversidad es más reducida (19). Todos los ecosistemas contienen algún tipo de microorganismo degradador de hidrocarburos, solo que varía su cantidad y diversidad (16). Se conoce que las bacterias son el grupo microbiano más versátil en la biodegradación de hidrocarburos, el 96% de las aisladas en medios líquidos (lagos, ríos y lagunas) presentan capacidad de crecer y emulsificar hidrocarburos (20). Leahy y Colwell (21) reportan que los microorganismos degradadores más importantes tanto en el agua como en el suelo son: Pseudomonas sp, Achromobacter, Acinetobacter, Alcaligenes, Arthrobacter, Bacillus, Flavobacterium y Norcadia.
Los hidrocarburos con menos de 10 átomos de carbono o bien de tres o menos anillos aromáticos tienden a ser fáciles de degradar (22,23). Igualmente algunos estudios han revelado que prácticamente todos los HAP con menos de 5 anillos son al menos parcialmente biodegradables por una variedad de microorganismos tanto aerobios como anaerobios (7). El benceno, xileno y tolueno, son ejemplos de componentes de la gasolina que se degradan con facilidad; por otro lado, algunas estructuras moleculares complejas como parafinas ramificadas, olefinas o alcanos cíclicos, son mucho más resistentes a la biodegradación (9). Las resinas y asfaltenos se consideran como compuestos resistentes a la biodegradación, esto se debe a que su estructura es muy compleja y deben intervenir diferentes tipos de enzimas que sean capaces de oxidar tanto alcanos lineales como cíclicos, aromáticos, policíclicos y heteropoliaromáticos (24,25). Pseudomona eruginosa es de los pocos organismos capaces de degradar alcanos de cadena ramificada (26). Durante la biodegradación ocurren dos eventos principales: el consumo del sustrato y el crecimiento microbiano, los cuales están estrechamente relacionados (13). La respuesta de los microorganismos degradadores de hidrocarburos a un agente surfactante dependerá de una serie de factores tales como la ultraestructura celular, la capacidad de biodegradación o flujo de salida, concentración del surfactante y la biodisponibilidad (26). Se estima que se necesitan de 103 a 104 UFC/g suelo de microorganismos para una biodegradación y 105 a 106 UFC/g de heterótrofos totales en el suelo capaces de metabolizar y mineralizar el contaminante hasta CO2 y H2O (27).
Numerosos estudios señalan algunos factores ambientales que influyen en la biodegradación del hidrocarburo de los cuales se destacan: la presencia de nutrientes, oxigeno, humedad y una adecuada temperatura. Si se aplican surfactantes junto con los factores ambientales antes mencionados, se puede incrementar considerablemente el proceso de biorremediación.
3. Aplicación de surfactantes en la biorremediación de suelos contaminados con hidrocarburos
La biorremediación se ha visto favorecida con la presencia de surfactantes y/o biosurfactantes, en donde la biodisponibilidad se ha considerado como uno de los factores más benéficos para la biorremediación y la posible inhibición y/o toxicidad como los factores adversos a considerar.
Cualquier nueva tecnología, como lo es la biorremediación con la aplicación de surfactantes, pueden implicar ciertos riesgos. Sin embargo, reconocer los factores de riesgo es un primer paso para reducirlos o evitarlos.
3.1 Los surfactantes
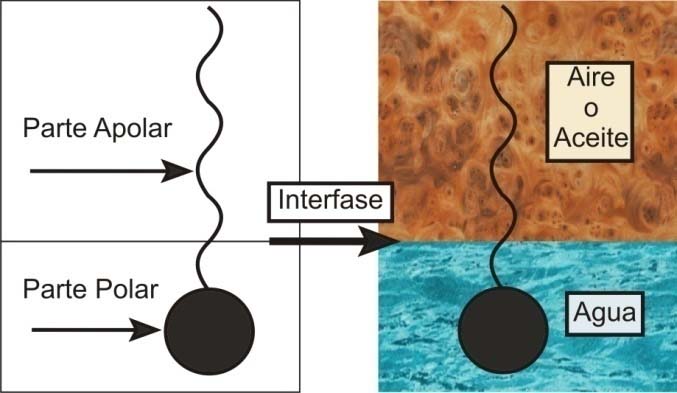
Los surfactantes son moléculas que tienen una fracción de cabeza polar hidrofílica y una cola hidrofóbica de fracción no polar (28) (Figura 1), manteniéndose principalmente en la interfase aceite/agua o aire/agua (29).
Figura 1. Ubicación de la molécula de surfactante en la interfase. Si el surfactante está dentro de la fase acuosa, su grupo polar puede estar rodeado de moléculas de agua (solvatación). Si el surfactante está disuelto en una fase oleica, su grupo apolar posee interacciones con el solvente (29).
El uso potencial de los surfactantes para remediar suelos contaminados con hidrocarburos depende principalmente de las capacidades fisiológicas de los microorganismos, la estructura química del hidrocarburo y los factores ambientales del suelo (12,30,31).
En un sistema la adición de surfactantes puede tener dos consecuencias: en primer lugar puede mejorar la dispersión y la pseudosolubilización como fue demostrado por Breuil y Kushner (32) quienes señalan que los ácidos grasos C16 y C18 y los surfactantes Triton X-100, Fl-70, 75 y Brij, estimulan el crecimiento de Pseudomonas eruginosa en hexadecano. En segundo lugar, la presencia de surfactante líquido-líquido puede inhibir la adhesión bacteriana a esa interfaz, reduciendo la tasa de degradación, esto se demostró por primera vez por Aiba et al (33) para la degradación de n-dodecano y tetradecano en presencia de Tween 20 y para el n-hexadecano por Mimura et al (34). En la tabla 3 se presentan las ventajas y desventajas de los surfactantes.
Tabla 3. Ventajas y desventajas de los surfactantes
Ventajas
Ref.
Desventajas
Ref.
o Se le atribuye el aumento de solubilidad y biodisponibilidad.
o De fácil comercialización, distribución y a bajo costo.
35
o Su toxicidad y los efectos de los intermedios (residuos) suelen ser más tóxicos que los compuestos originales
36
o Mejora la degradación del hidrocarburo
o Algunos son biodegradables
o Se podría utilizar como sustrato primario cuando el contaminante se degrada
co-metabólicamente.
14
o Degradación preferencial del surfactante, puede disminuir la degradación del contaminante, la degradación del surfactante reducirá el efecto de la biodisponibilidad.
37
38
3.2 Los biosurfactantes
Algunos microorganismos pueden sintetizar sus propios surfactantes a los cuales se les conoce como biosurfactantes, incluso pueden sinterizar en condiciones extremas (39), la mayoría son neutros o de carga negativa, se clasifican por su composición química en: glicolipidos, lipopeptidos y lipoproteínas, fosfolipidos, ácidos grasos y poliméricos (40). En la tabla 4 se presentan las ventajas y desventajas de los biosurfactantes.
Tabla 4. Ventajas y desventajas de los biosurfactantes
Ventajas
Ref.
Desventajas
Ref.
o Son biodegradables
o Menos tóxicos que los sintéticos
o Las moléculas de superficie se adaptan a los cambios de sustrato de crecimiento
o Tienen estructuras definidas.
o Mejora la degradación del hidrocarburo
o Se le atribuye el aumento de solubilidad y biodisponibilidad.
o Son amigables al medioambiente.
41
o La producción a gran escala de biosurfactantes es compleja y difícil.
42
43
o Algunos biosurfactantes pueden ser tan tóxicos como los sintéticos.
44
o Pueden competir con el hidrocarburo como sustrato preferencial.
o La producción de biosurfactantes no es económicamente viable.
30
Van Hamme et al (45) señalan que el biosurfactante en realidad puede tener una actividad antimicrobiana y es probable que los microorganismos produzcan moléculas tales como agentes antagonistas para ganar ventaja competitiva por el sustrato en las comunidades microbianas (es decir, amensalismo). Dicho lo anterior, a pesar de que el interés en biosurfactantes va en aumento, estos compuestos no compiten económicamente con los surfactantes sintéticos (46). Para ser efectivo el uso de surfactantes sintéticos en la biorremediación los esfuerzos deben estar dirigidos en el desarrollo de surfactantes sintéticos no tóxicos que imiten la estructura de los surfactantes naturales (43).
3.3 Factores benéficos de los surfactantes en el incremento de la biodisponibilidad
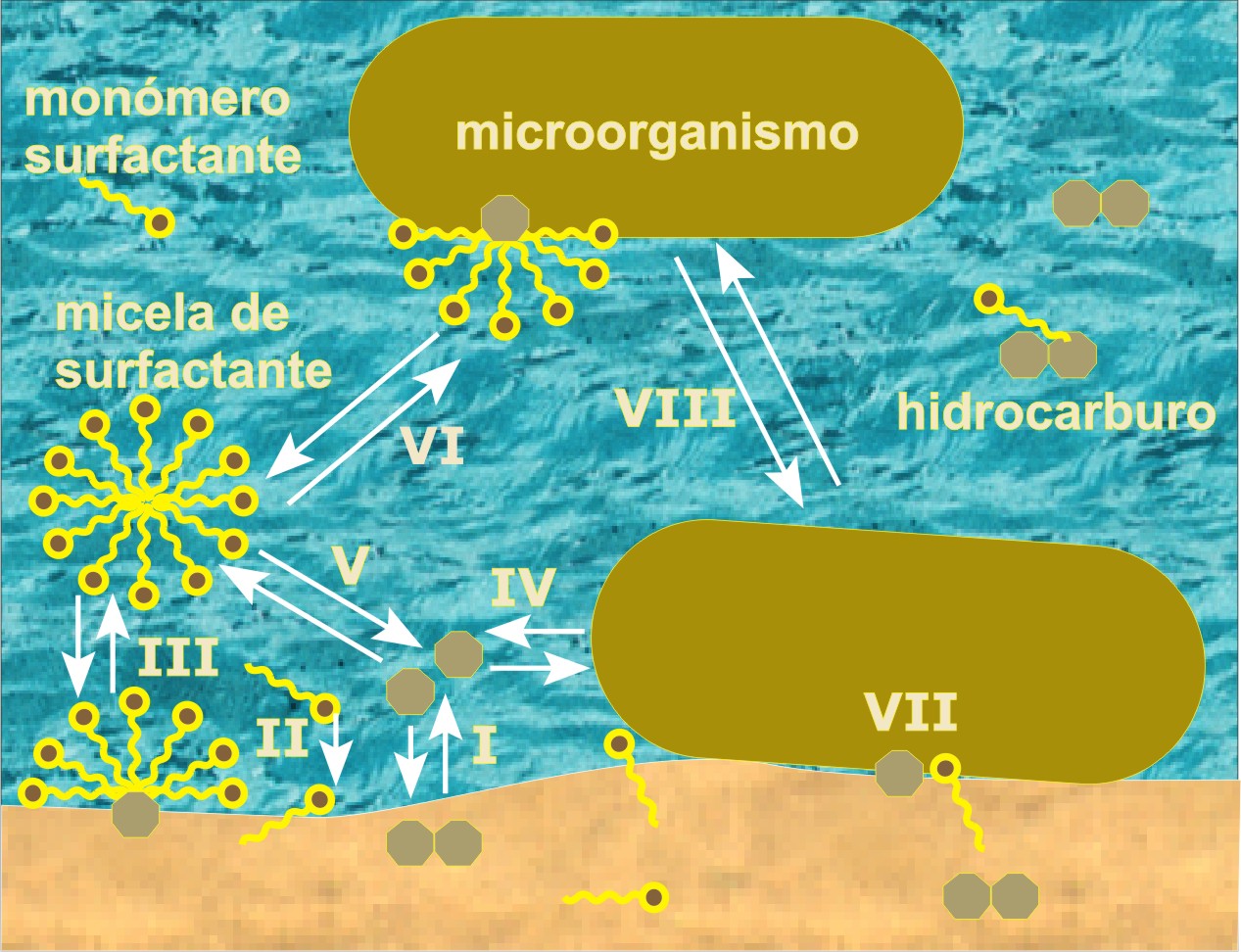
Uno de los parámetros principales que influyen en el alcance de la biodegradación es su biodisponibilidad y este es un objetivo prioritario para el campo de biorremediación (47). Los contaminantes hidrófobos no son fácilmente biodisponibles debido a su baja solubilidad acuosa o su tendencia en adsorberse fuertemente al suelo (48,49). Se acepta que la biodisponibilidad es el factor más importante para que la degradación biológica termine siendo lenta, además parece disminuir con el tiempo del envejecimiento del suelo (7). La biodisponibilidad limitada de un contaminante se presenta cuando su tasa de degradación por microorganismos está afectada por una barrera físico-química entre el contaminante y los microorganismos. Para comprender mejor el proceso de biodisponibilidad es necesario comprender las interacciones entre el suelo, los contaminantes y los microorganismos (50). En la Figura 2 se muestra el esquema de las interacciones entre microorganismo, el suelo, contaminante y surfactante, en donde se describen las interacciones para la biodisponibilidad.
Figura 2. Las fases de interacciones: I.- sorción de contaminantes, II.- sorción de la molécula de surfactante, III.- solubilización del contaminante, IV.- contaminante fase acuosa para los microorganismos, V.- partición de contaminante entre la fase agua y la micela, VI.- sorción de micela al microorganismo, VII.- contaminante fase sólida al microorganismo y VIII.- sorción del microorganismo al suelo. Imagen modificada de Volkering (14).
El efecto más importante del surfactante entre el suelo y el contaminante es la estimulación del transporte de masa del contaminante desde el suelo hasta la fase acuosa, donde se puede dar la biodisponibilidad, la cual está influenciada por; las interacciones de surfactante-células, interacciones célula-contaminante e interacciones de superficie de contaminantes, esto va relacionado con tres mecanismos; la emulsión de contaminantes líquidos, solubilización micelar y la facilidad de transporte. Un contaminante adsorbido puede facilitar el transporte en el suelo, siendo este el efecto más importante de los surfactantes en biorremediación, por lo tanto, la reducción de la tensión interfacial y de superficie son probablemente los mejores parámetros para la selección del surfactante en la remediación biológica del suelo (51). Los factores que influyen en la biodisponibilidad son los siguientes.
3.3.1 La emulsión de contaminantes
Muchos de los contaminantes persistentes tiene baja solubilidad en agua y por tanto la biodisponibilidad es mejorada con la adición de surfactantes, al reducir la tensión superficial e interfacial entre líquidos, sólidos y gases, les permite dispersarse fácilmente en emulsiones (52), lo cual se traduce en un aumento de superficie de contacto que permite la mejora de transporte de masa del contaminante a la fase acuosa y la movilidad adsorbida de la fase liquida del contaminante (53), por lo tanto la movilidad del contaminante a la fase de agua es removido con una emulsión. La emulsificación del surfactante puede aumentar el metabolismo microbiano con el hidrocarburo y puede incrementar la actividad enzimática microbiana o bien facilitar el transporte del sustrato orgánico de las células microbianas (31). En suelos hidrófobos que tienen un contenido crítico de humedad más allá de cómo se comporten como suelos hidrofílicos, una pequeña cantidad de surfactante puede emulsionar un poco de agua y luego promover el comportamiento hidrofílico (54).
3.3.2 Concentración Micelar Crítica
La Concentración Micelar Crítica (CMC) es la concentración mínima para que el surfactante forme agregados llamados "micelas", los cuales son responsables de las propiedades de solubilización y de detergencia. Algunos estudios han demostrado que la biodisponibilidad se puede aumentar mediante la adición de los surfactantes en niveles inferiores de la CMC (11). La CMC de los surfactantes en disolución acuosa varía con la estructura de surfactantes, la temperatura de la solución, la presencia de compuestos orgánicos, electrolitos, entre otros (28). Por lo tanto, un surfactante con un valor menor de CMC será más deseable si puede llegar a solubilizar contaminantes en concentraciones bajas, con un mínimo de exposición de sustancias toxicas para los microorganismos del suelo (55,56). El potencial de los surfactantes en determinadas concentraciones por debajo de su CMC para mejorar la degradación de los compuestos hidrófobos es notable, porque las altas concentraciones además de ser costosas también pueden ser tóxicas para los microorganismos (57). Aronstein y Alexander (11), señalan que el agente surfactante por encima de la CMC puede ser apropiado para el lavado de suelo, pero esta alta concentración puede ser inapropiada para la biorremediación. Del mismo modo Merrettig-Bruns y Jelen (58), señalan que los surfactantes para procesos de biorremediación por lo general están entre 10 mg/L es decir, aproximadamente 10-100 veces inferior a su CMC.
3.3.3 Solubilización micelar
La baja solubilidad de muchos hidrocarburos reduce su disponibilidad para los microorganismos, incrementa la adsorción de compuestos de superficie y limita el proceso de biodegradación (59). La solubilidad es causada por la presencia de micelas, los compuestos orgánicos hidrofóbicos se disuelven principalmente en el núcleo de las micelas, donde tendrán un transporte micelar de los hidrocarburos a la fase acuosa, puede ser rápido debido al pequeño tamaño de la micela (60). Los microorganismos pueden acceder a un sustrato a través de contacto directo con cristales sólidos (ejemplo: azufre elemental, fenantreno) gotas de liquido (ejemplo: el petróleo crudo disuelto en el agua) o por contacto con el sustrato pseudosolubilizado en micelas de surfactante, hemi-micelas (monocapas interfase de superficie) admicelas (bicapas interfacial de superficie) o gotas de emulsión (61). Kim et al (62) estudiaron sobre la eliminación de HAP con surfactante no iónico, llegaron a la conclusión que la solubilidad de los HAP es proporcional con las concentraciones de surfactantes, por encima de la CMC mejora, mientras que por debajo o cerca de la CMC no mejora la solubilidad de los HAP.
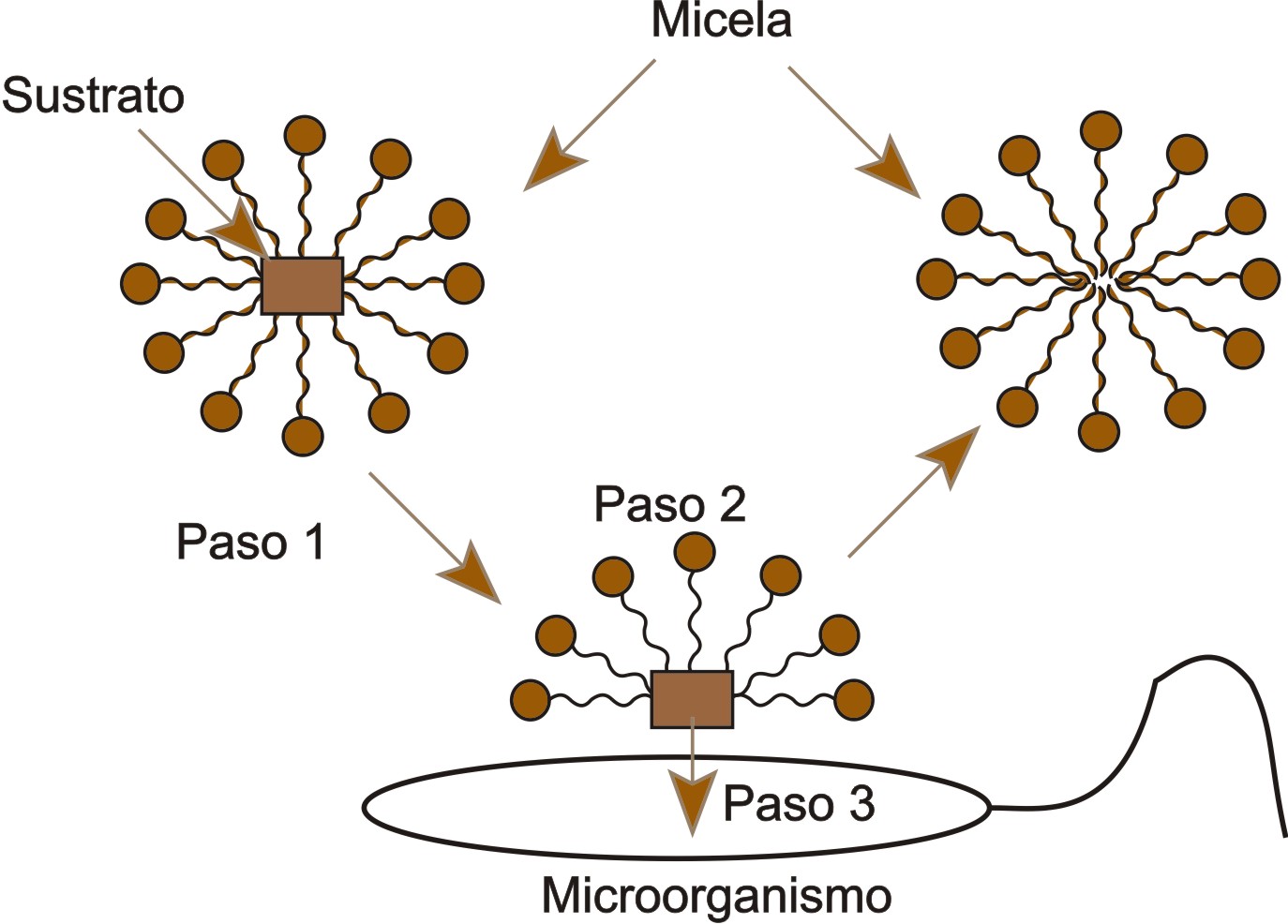
El surfactante puede mejorar la biodisponibilidad de dos formas: a) la velocidad de dilución se puede aumentar mediante la separación de los hidrocarburos por las micelas y b) el surfactante puede influir en el proceso de dilución mediante la interacción con la superficie del sustrato, esto afectara la máxima velocidad de dilución y puede aumentar el crecimiento microbiano (14), cuando están solubilizados están disponibles para ser metabolizados por los microorganismos (13). Tiehm (37) informó que un patrón exponencial se observó con un cultivo mixto de fenantreno solubilizado por surfactante no iónico. Según Kim et al (62), resultados de una mejor solubilidad (Brij30>Tween80>TritonX-100) indican que el naftaleno y fenantreno se ven afectados por la estructura de la micela. Shin et al (63) reportan que el pH óptimo en la solubilización del hidrocarburo puede no ser óptimo para el crecimiento microbiano y por tanto para la degradación. La captación del sustrato en micelas por la célula bacteriana se explica en la Figura 3 y en la Tabla 5.
Figura 3. La transferencia de masa de micelas a la célula bacteriana se compone de tres pasos: Primer paso: es el transporte de la micela solubilizada con el sustrato. Segundo paso: es el intercambio de las moléculas del surfactante (micelas) con la célula, esta etapa se puede interpretar cómo el proceso para la degradación, y finalmente el Tercer paso: es la transferencia del sustrato a la célula bacteriana. Imagen modificada de Guha (61).
Tabla 5 Fases de la solubilización micelar. (Ref. 64)
Dos fases de la solubilización micelar:
I.- Fase de la cinética micelar, el tiempo de su formación es de microsegundos por lo tanto en este paso no suele ser limitante.
II.- Fase de la transferencia de masa de la micela en la célula, suele verse afectada por las interacciones específicas entre las micelas adsorbidas y las superficies celulares, esta etapa consta de tres pasos:
a) El transporte de la micela solubilizada con un sustrato a la célula o enzima mediante la mezcla.
b) El intercambio de las micelas con la capa hemi-micela de los surfactantes que forman las moléculas.
c) La transferencia del sustrato de la hemi-micela a la célula.
Tiehm (37) encontró que diferentes surfactantes no iónicos estimulan el crecimiento de cultivos mixtos en algunos hidrocarburos aromáticos policiclicos, pero no pudo concluir si eso se debió a la estimulación del crecimiento del sustrato micelar, una pseudosolubilidad durante el primer periodo del experimento o por un máximo aumento de la tasa de disolución. El hecho de que el sustrato micelar no es fácilmente biodisponible tiene importantes consecuencias para la aplicación de los surfactantes en la biorremediación: en primer lugar, la presencia de micelas puede disminuir la concentración de contaminantes en la fase agua, reduciendo así la actividad de las bacterias o el crecimiento, este efecto combinado con la toxicidad de los surfactantes, podría explicar la inhibición de la mineralización del contaminante por surfactante micelar, como se describe por Laha y Luthy (65), en segundo lugar, en los procesos in situ, el sustrato no disponible puede ser removido y por lo tanto causa una contaminación no deseada en aguas subterráneas. Por estas razones un estudio cuidadoso antes del uso de surfactantes en la biorremediación puede ser recomendado. Zhang et al (66) señalan que a una alta concentración de surfactante, el sustrato no está disponible porque se encuentra en la fase micelar, las moléculas del sustrato tienen que ser transferidas de la fase micelar a la fase acuosa para que sean biodisponibles para los microorganismos. Lee y Chen (67) señalan que casi el 87% de solución de fenantreno fue degradado en presencia de Tergitol 15-5-7, la conclusión es que el fenantreno no es fácilmente biodisponible en la fase micelar en comparación a que si el fenantreno está en la fase acuosa.
Por el contrario, Cerniglia (68) demostró que el crecimiento de la E.coli en la glucosa no fue afectada negativamente por la presencia de micelas del surfactante Triton X-100, los ensayos de biodegradación fueron realizados con glucosa y acido salicílico, esto es porque la glucosa es un sustrato fácilmente degradable, mientras que el acido salicílico es un metabólico intermedio de la oxidación del naftaleno. Del mismo modo Lui et al (69) observaron la biodisponibilidad de micela solubilizada en microorganismos degradadores de naftaleno en dos surfactantes no iónicos Brij30 y Triton X-100, los resultados mostraron que el naftaleno solubilizado por las micelas es biodisponible y degradable por el cultivo mixto de bacterias.
Guha et al (61) estudiaron la cinética de biodegradación de fenantreno en la fase micelar con surfactantes no iónicos, la biodisponibilidad de fenantreno fue presentada por una concentración efectiva de fenantreno en la solución micelar disponible para la biodegradación. Pritchard et al (71) señalan que la solubilidad junto con el metabolismo microbiano de contaminantes orgánicos es técnicamente factible y tiene potencial como técnica de remediación. Zhang et al (66) señalan que el efecto de un sustrato sobre la biodegradación son consecuencia de una combinación del poder solubilizante del surfactante y la biodisponibilidad del sustrato en las micelas del surfactante.
3.3.4 Mecanismos del transporte de masa del contaminante
Para una facilidad del transporte de los contaminantes de la fase sólida a la fase acuosa, debe ser causada por varios fenómenos: la interacción de moléculas de contaminante con surfactante, la interacción de surfactantes con las diferentes fases (tanto en monómeros como en micelas), la movilidad del contaminante sobre la materia orgánica y las partículas del suelo (71) y la reducción de la tensión superficial del agua sobre los poros de las partículas del suelo (71-73). Cuando la biodegradación está limitada por la biodisponibilidad del sustrato, la concentración de sustrato en el líquido es muy inferior a la concentración de saturación, esto significa que la facilidad de transporte es el mecanismo más importante que rige la tasa de biodegradación (74-77). La influencia del surfactante en la biodegradación se logra con la mejora en la transferencia de masa y la tasa de transferencia directa de la micela al microorganismo (78), tomando en cuenta que los hidrocarburos se pueden mover por medio de la fase acuosa y/o micelar (70). Volkering et al (75) encontraron que para los compuestos de baja solubilidad acuosa o de alta capacidad de adsorción (por ejemplo HAP) la masa de transferencia de la fase solida a la liquida, puede ser esencial para el proceso de degradación microbiana.
3.3.5 Balance Lipofílico-Hidrofílico
El valor del Balance Lipofílico-Hidrofílico (HLB por sus siglas en ingles) es un parámetro empírico que describe la contribución relativa de la fracción hidrofílica con el peso de la molécula de surfactante. El HLB con un valor de 3 a 6 es lipofílico y puede ser utilizado para preparar agua en aceite (w/o) en las emulsiones y los surfactantes con valor de HLB de 10 a 18 son más hidrofílicos (54). Kang et al (79) señalan que los surfactantes con una mayor HLB (Tween 80, Tween 60 y Tween 20) resultaron en una mejor solubilidad. Torres et al (80) señalan que el más alto crecimiento microbiano se observa con Tween 80 (valor mayor a 10 de HLB), los patrones de biodegradación no son necesariamente vinculados a los patrones de crecimiento de la biomasa. Si bien se tienen informes que la mejor biodegradación se suele tener en valores mayores de HLB de 10, Torres et al (81), reportaron que obtuvieron con Span 80 (4.3 de HLB) mejores resultados en la degradación del diesel, lo cual lo atribuye que un HLB bajo puede promover emulsiones aceite/agua, podría ser que el agua se emulsione en la fracción grasa y por lo tanto, los microorganismos contenidos en el agua están más cerca de la fracción a degradarse y con agua disponible para la célula, Torres et al (54) señala que el mejor crecimiento microbiano se obtuvo a bajos valores de HLB, a bajas dosis de surfactante y a altas temperaturas. Del mismo modo, Fu y Alexander (82) realizaron un estudio con una amplia gama de concentraciones de surfactantes y valores de HLB desde 4.7 hasta 18, en concentraciones de 40 mg/kg hasta 400 mg/kg en 47 días, el que dio mejores resultados de remoción fue el Span 80 después de 37 días el efecto de este ultimo puede estar relacionado con su valor de HLB bajo.
3.3.6 Adsorción-Desorción
Varios estudios revelan que los microorganismos solo pueden tomar sustratos disueltos (83). Existen sin embargo publicaciones que muestran que los compuestos adsorbidos son hasta cierto punto disponibles para el microorganismo sin previa desorción (84), incluso cuando esta adsorbido al sustrato y pueda ser degradable será menos biodisponible, por lo tanto la desorción desempeña un papel esencial en la biodegradación (85). De igual manera la mayoría de los estudios publicados demuestran que la desorción y la movilidad del contaminante hidrófobo en el suelo pueden ser mejorados con la adición de surfactantes (13,73).
Kim et al (62) realizaron pruebas que señalan, el grado de magnitud de la desorción del hidrocarburo es menor para la arcilla que para la arena, esto se debe probablemente a que interfiere el contenido de la materia orgánica en la desorción. Según Volkering et al (14) los mejores parámetros para la selección de un surfactante para la remediación biológica, es la tensión interfacial y la desorción del contaminante. De acuerdo con Singh-Cameotra y Bollag (41) los surfactantes son eficaces en reducir la interfase del petróleo y también pueden reducir la viscosidad del aceite. Deschênes et al (86) señalan que una concentración muy alta de Tween 80 (156 g/L, 10.000 veces de la CMC) moviliza alrededor del 70% a los HAP del suelo contaminado. La adsorción y retención de HAP en la matriz del suelo son los procesos críticos que influyen a la movilidad del contaminante, la toxicidad y persistencia.
3.3.7 Temperatura
La temperatura afecta la biodegradación por medio de dos mecanismos, en primer lugar, el incremento de temperatura puede aumentar la constante de velocidad de desorción y la disminución de los coeficientes de distribución (Kd) (87) y en cierta medida aumenta esto a la biodisponibilidad. En segundo lugar el aumento de temperatura (en un rango determinado) puede mejorar el crecimiento microbiano y su actividad, por lo tanto estimula la tasa de biodegradación (54). La temperatura afecta el crecimiento microbiano, así que a bajas temperaturas la degradación será lenta (88). Torres et al (80) señalan que los factores que más influyen en la biodegradación, son en primer lugar la temperatura, en segundo lugar el valor de HLB del surfactante y sorprendentemente en tercer lugar la dosis del surfactante, la conclusión del estudio indica que el tipo de familia de surfactante (es decir, producto químico) y no solo el valor de HLB afecta claramente la tasa de biodegradación.
3.3.8 Facilidad del surfactante de ser biodegradado por los microorganismos
La disminución de las fuerzas de interfase ocasionadas por los surfactantes origina una unión de moléculas orgánicas en la superficie del suelo, con esto se logra que los compuestos sean más fácilmente disponibles para los microorganismos (31). Sin embargo la biodegradación de los surfactantes no iónicos se hace más difícil cuando la parte hidrofóbica de la molécula es ramificada. Un anillo aromático en la parte hidrófoba de la molécula dificulta aún más la biodegradación (37). Amplia información sobre la biodegradabilidad de los surfactantes ha sido recopilada por Swisher (89) con una actualización de la degradación aeróbica de los surfactantes por Van Ginkel (90). En un análisis de sorción del suelo debe tener en cuenta los aspectos ambientales si se dejan grandes cantidades de surfactante en el suelo tratado, sin embargo ese problema es resuelto si este surfactante es fácilmente biodegradable (12). Sin embargo, si el surfactante es altamente biodegradable puede convertirse en competencia como fuente de carbono, lo que influye en la degradación del sustrato primario (37). Los surfactantes que sean fácilmente biodegradables perderán su capacidad de solubilización, por lo que se debe encontrar un equilibrio entre la biodegradación y su eficiencia de solubilización (43).
Scott y Jones (91) publicaron una excelente revisión sobre la biodegradación de los surfactantes en el medioambiente, ese estudio se centró en la presencia de detergentes en aguas residuales donde los surfactantes estaban presentes a menudo en concentraciones entre <0.1 y 3 mg/kg.
Torres et al (92) informan que existen surfactantes como Tween 80 y Surfacpol que son altamente biodegradables, el Surfacpol se biodegrada alrededor del 96% y el Tween 80 alrededor de un 45% en un periodo de 168 hrs. Wong et al (93) señalan que Pseudomonas aeriginosa cuando se combina con Tween 80 mejora de manera efectiva la solubilidad y degradación de fenantreno, y además el Tween 80 es biodegradable (94). Algunas pruebas dadas por Mihelcic et al (50) encontraron que la degradación anaerobia de los surfactantes no iónicos coincidió con las zonas en las que se observó la eliminación de tetracloruro de carbono. Kim et al (62) señala que Brij30 es el surfactante mas biodegradable, no mostrando inhibición de sustrato hasta una concentración de 1.5 g/L y es usado como fuente de C (por la bacteria).
White et al (95) han señalado que existen tres rutas para la biodegradación primaria en los compuestos iónicos: a) ataque y la degradación progresiva del grupo hidrofóbico, b) Ataque y degradación progresiva de grupo hidrofílico y c) Separación de hidrofílico a los grupos hidrófobos. Por lo tanto, el proceso de degradación, principalmente se limita a la degradación de la fracción del surfactante etoxilado.
Deschênes et al (96) lograron con una concentración de 0,5% un aumento sustancial con surfactante aniónico SDS (Sodio Dodecil Sufato) en la movilización de fluoreno, fenantreno, antraceno, fluoranteno y pireno, el efecto de la degradación de SDS, fue de 11 semanas de incubación, del cual fue casi completamente biodegradado. En una concentración mayor de SDS disminuyó la biodegradación de HAP, esto se puede explicar por la alta biodegradabilidad de SDS y su posible uso preferencial por los microorganismos nativos como sustrato. Este estudio demuestra que el SDS es muy eficaz en el aumento de la concentración de HAP a la fase acuosa, lo cual sugiere que este surfactante puede aplicarse en la remediación. La adición de SDS en altas concentraciones reduce la biodegradación de HAP, esto es atribuible no por su toxicidad, sino en su uso como sustrato preferencial por parte de la microflora nativa. La alta biodegradabilidad de SDS sugiere que este surfactante no va a persistir por largos periodos de tiempo ni en el suelo ni en las aguas subterráneas después del tratamiento.
3.4 Factores adversos que pueden ocasionar los surfactantes
De todos los aspectos antes mencionados de este artículo, la inhibición y toxicidad del surfactante siempre es desfavorable, todos los demás aspectos pueden tener efectos positivos o negativos sobre la remediación (14). El surfactante tiene poca utilidad cuando el propio producto da lugar a una contaminación ambiental. En consecuencia, la toxicidad de los surfactantes y sus potenciales de degradación son uno de los criterios más importantes para la selección de un agente surfactante en la remediación del suelo. Una revisión de la toxicidad de los diferentes tipos de surfactantes sobre numerosas especies se da por De Oude (97). Los estudios de surfactantes químicos han demostrado que la carga tiene un impacto sobre la toxicidad. En términos generales catiónicos son los más tóxicos y han sido usados históricamente como antimicrobianos, mientras que los aniónicos son menos tóxicos y más activos contra gram positivos que gram negativos, los no iónicos y biosurfactantes se consideran como los menos tóxicos. Los surfactantes pueden ejercer efectos tóxicos que causan disrupción en la membrana que conduce a la lisis celular, mediante el aumento de la permeabilidad de la membrana causando fugas metabólicas, alterando la estructura de la membrana física o la interrupción de la proteína, interfiriendo con la membrana en importantes funciones tales como la generación de energía y transporte. Los surfactantes pueden interactuar con las proteínas producidas por los microorganismos alterando tanto su conformación como sus funciones fisiológicas, en el caso de las enzimas estas interacciones pueden modificar la especificidad enzimática, de actividad o características de estabilidad (45). Incluso cuando los no iónicos son menos activos contra las bacterias que los iónicos, a mayor dosis de surfactante, mayor será la toxicidad del surfactante (98). Torres et al (81), establecen que la toxicidad del surfactante es determinada por la tendencia a la adsorción del surfactante y la facilidad de su penetración en la membrana celular, independientemente si el surfactante es catiónico, aniónico o no iónico. El efecto inhibidor se puede observar en concentraciones de surfactante por encima de la CMC (99) y la inhibición del contacto directo entre las células y las micelas con el sustrato (100), también se observa que el efecto del surfactante depende también de las bacterias que afectan lo que significa que las interacciones entre bacterias y surfactantes también se deben considerar (101).
Una determinada cepa puede responder de manera diferente a los distintos surfactantes expuestos, esto se debe a las interacciones específicas entre las moléculas de surfactante y la membrana celular (43). Los microorganismos anaerobios parecen ser los más afectados por la presencia del surfactante (45). Los efectos de los surfactantes en la fisiología de los microorganismos van desde la inhibición debido a la toxicidad, a la estimulación del crecimiento debido al uso del surfactante como sustrato (14). Los surfactantes pueden interferir con transportes de la célula, dañando irreversiblemente la membrana estructural (desnaturalización de las enzimas). Se ha demostrado que incluso la compatibilidad de biosurfactantes con células estructurales de membrana a veces es específica del microorganismo que lo produce, y aunque los biosurfactantes son esencialmente biodegradables, pueden producir efectos negativos en las membranas de otros microorganismos (102).
Goncalves et al (103) utilizaron técnicas espectroscópicas para caracterizar la interacción de los surfactantes aniónicos con actividades enzimáticas, llegaron a la conclusión de que el surfactante promueve una interrupción o desestabilización de cruciales interacciones electrostáticas, lo que indica una pérdida en la estructura de la enzima, por lo que a mayor dosis de surfactante mayor es el grado de desnaturalización de la proteína.
3.4.1 Presencia de micelas en la biodegradación
Existe controversia sobre la participación micelar en el proceso de biorremediación. Las moléculas de surfactante pueden llegar a penetrar en la membrana lipidica de las bacterias y por lo tanto cambiar el equilibrio osmótico a través de la membrana celular lo que conduce a la perforación de la célula y eventualmente a su muerte (68). Sin embargo, Li y Chen (43) reportan que, a concentraciones bajas (por debajo de la CMC), no se pueden formar micelas. Pero la incorporación de monómeros de surfactantes en la membrana celular es suficiente para afectar la función de la barrera de la membrana celular, induciendo algunos trastornos enzimáticos o bien penetrando en la célula.
Singh et al (12) señalan que cuando la concentración del surfactante tiene un valor por encima de la CMC se inhibe la biodegradación, lo que sugiere que el sustrato que está dentro de la micela no está biodisponible. Del mismo modo Laha y Luthy (99) mostraron que la concentración por encima de la CMC ocasiona inhibición en la biodegradación ya sea porque el grupo polar crea una barrera entre las micelas y los microorganismos degradadores los cuales no tienen fácil el acceso al sustrato o porque las moléculas de surfactantes pueden ser tóxicas para los microorganismos. Bewley et al (104) encontraron que los surfactantes no iónicos Triton X-100 y Tansoxid 550 mejoran la desorción del suelo, pero inhiben la degradación de varias cepas. Zhang y Miller (105) informaron el hecho de que la presencia de micelas no hace fácil la biodisponibilidad, lo cual influye en la aplicación de la biorremediación, la presencia de micelas puede disminuir la concentración de contaminantes con lo que crea una desaceleración o reduce el crecimiento microbiano, este efecto combinado con la posible toxicidad del surfactante podría dar cuenta a la inhibición de la degradación del hidrocarburo.
En contraste, otros estudios señalan que la presencia de las micelas de surfactantes no inhibe la degradación de hidrocarburos, éstos se solubilizan por micelas de surfactantes en medios líquidos logrando su biodisponibilidad y biodegradabilidad (65).
Volkering et al (75) realizaron experimentos de crecimiento microbiano adicionando surfactantes, informaron que no hubo efectos tóxicos de los surfactantes en concentraciones de hasta 10 g/L demostraron que no está fácilmente disponible (en la fase micelar) para la degradación por los microorganismos. Colores et al (106) reportaron que el surfactante Witconol NS70 (alcohol no iónico etoxilado) a una concentración por debajo de su CMC no afecta las tasas de mineralización de hexadecano y fenantreno, mientras que por encima de la CMC inhibe la degradación de hidrocarburos.
Laha y Luthy (99) señalan una inhibición de la degradación en varios surfactantes en donde se encontraban las concentraciones por encima de la CMC de fenantreno en un cultivo mixto, en concentraciones por debajo de la CMC no tuvo inhibición en estos mismos surfactantes, sin embargo los mismos autores no pudieron dar una explicación sobre el fenómeno inhibitorio. Makkar y Rockne (7) mostraron que los surfactantes por encima de la CMC no tuvieron efectos inhibitorios o tóxicos, la degradación mayor de fenantreno se debió a la solubilización por los surfactantes.
Liu et al (69) informan que el surfactante no iónico Triton X-100 en concentraciones por encima de la CMC no inhibe el crecimiento de la cepa Gram negativa E.coli en glucosa, esto confirma que las concentraciones de surfactante no producen efecto tóxico inherente.
Little et al (107) examinaron la estructura celular de las bacterias y los biofilms con técnicas de microscopia electrónica, el análisis de la muestra de barrido por microscopia se realizó para comparar las estructuras de la célula en el naftaleno, se evalúo con dos surfactantes Brij30 y Triton X-100 a 103 CMC, esta comparación mostró que no existen importantes diferencias estructurales entre las bacterias que crecen en el naftaleno, en ausencia y en presencia de micelas de surfactante. Esto confirma que el surfactante no tiene efectos sobre una ruptura de la membrana celular de la bacteria degradadora. La presencia de surfactante no tuvo efectos adversos sobre la glucosa en la mineralización con 0,20% (vol/vol) Brij30 (2253 CMC) y Triton X-100 (203 CMC).
3.4.2 Alternativas para reducir la toxicidad
Los surfactantes no iónicos son las mejores opciones para mejorar la biodegradación de hidrocarburos debido a su baja toxicidad, sin embargo tienen diferentes grados de toxicidad en función de su estructura molecular. Polioxietileno octil fenol (Series Triton X) ha demostrado ser tóxico para las células, ya que puede solubilizar la biocapa lipidica de la membrana (108). Polioxietileno sorbitan (Series Tween) han demostrado que poseen baja toxicidad (109).
No necesariamente siempre causa el surfactante la inhibición y toxicidad, el solubilizar el contaminante en el suelo con ayuda de surfactantes puede ocasionar toxicidad, pero puede ser causado por el contaminante y no por el surfactante, así lo comenta Bramwell y Laha (110) mostraron que la presencia de fenantreno solubilizado (aplicando surfactante no iónico Tween 20) aumenta la toxicidad, esto indica que la toxicidad fue por el sustrato. También puede ocurrir que el contaminante incremente la toxicidad del surfactante tal como lo menciona Shin et al (111) al reportar pruebas de toxicidad al solubilizar el fenantreno, causando que aumentara la toxicidad del surfactante 100 veces. De cualquier manera se debe reducir los efectos adversos de los surfactantes, algunas alternativas son las siguientes.
Por lo general la toxicidad del surfactante disminuye con el aumento de longitud de la cadena (es decir el aumento del HLB), esto se debe a la alta solubilidad acuosa de un surfactante con la HLB mayor, logrando con esto una menor intervención entre sus moléculas con la membrana celular (112). Se reduce la toxicidad de algunos surfactantes cuando están en concentraciones por debajo o cercanas de la CMC (113), de igual forma se puede reducir su toxicidad agregando dosis bajas.
Cserhati et al (114) señalan que los surfactantes mas tóxicos son los que tienen las partes hidrofóbicas del surfactante con grupos de 6 a 13 moléculas de etileno, disminuyendo su toxicidad con cadenas más cortas o más etoxiladas (115).
Sikkema et al (116) recomiendan agregar membranas biológicas las cuales consisten principalmente de fosfolípidos moleculares, que son muy similares a los surfactantes, por lo tanto estas membranas son muy eficaces en la adsorción de los surfactantes evitando que estos puedan generar efectos tóxicos o la posibilidad de una fusión micelar. Bardi et al (53) recomiendan agregar ciclodextrinas para la remediación de hidrocarburos en suelos, los cuales son compuestos naturales que forman complejos solubles con moléculas hidrófobas, son ampliamente usadas en la medicina e inofensivas para los microorganismos y enzimas. Boldrin et al (117) reportan que la toxicidad de los surfactantes disminuye con el aumento de longitud de la cadena etoxilada, incrementando la degradación de los hidrocarburos. Li y Chen (43), observaron que la toxicidad de Triton X-100 para la cepa Sphingomonas tuvo reducción significativa en la presencia de iones de calcio (Ca2+) es probable que los iones Ca2+ pueden estabilizar la membrana de la célula, haciendo que la célula se haga menos sensible a los agentes surfactantes. Mg2+ se observó que también mejora la tolerancia del surfactante a la célula, pero en un rango menos que Ca2+.
El surfactante no iónico es normalmente menos tóxico para los microorganismos que los iónicos debido a las interacciones débiles con la membrana celular. Se deben hacer esfuerzos en el desarrollo de surfactantes sintéticos que sean compatibles biológicamente con las células (43).
4. Conclusiones
· La biorremediación es una tecnología que tiene un gran potencial en la recuperación de sitios contaminados por hidrocarburos de petróleo y generalmente es más barata que otras alternativas de restauración. Los factores externos de la biorremediación tales como los nutrientes, humedad, temperatura, oxigeno, pH, entre otros son importantes para lograr condiciones favorables. La biorremediación se ve muy favorecida con la aplicación de surfactantes, le ayuda en la biodisponibilidad del contaminante y con esto en su biodegradación, si bien pueden existir efectos negativos, esto hace suponer realizar pruebas previas, para definir el tipo de surfactante a utilizar y su dosis.
· Los surfactantes son compuestos que tienen la particularidad de mantenerse en dos interfases cuyo potencial y caracterización es su capacidad de emulsión, desorción, solubilidad y como agentes de superficie, son necesarios en procesos biológicos, en algunos tratamientos de biorremediación no se podrían llevar a cabo sin ayuda de estos compuestos.
· Si bien, existe interés en sustituir los surfactantes sintéticos por los biosurfactantes, estos últimos no compiten económicamente y resulta muy compleja y difícil su producción a gran escala, por lo tanto las investigaciones deben ser orientadas a mejorar los surfactantes sintéticos como por ejemplo en que su estructura sea similar al surfactante natural, que se pueda reutilizar y reciclar, en que no sean tóxicos o bien en buscar sinergias con mezclas de otras sustancias para aminorar los efectos negativos.
Bibliografía
1. Plohl K, and Leskovsek H. (2002). Biological degradation of motor oil in water. Acta Chim. Slov., 49, 279-289.
2. Jiménez DJ, Medina SA, Gracida JN. (2010). Propiedades, aplicaciones y producción de biotensoactivos. Rev. Int. Contam. Ambient. 26 (1) 65-84.
3. Tissot B, Welte DH. (1984). Petroleum formation and occurrence. New York USA: Sppringer-Verlang.
4. Kästner M and Mahro B. (1996). Microbial degradation of polycyclic aromatic hydrocarbons in soils affected by the organic matrix of compost. Appl Microbiol Biotechnol.44:668–675.
5. Gómez SE, Gutiérrez DC, Hernández AM, Hernández CZ, Losada M, Mantilla PC. (2008). Factores bióticos y abióticos que condicionan la biorremediación por Pseudomonas en suelos contaminados por hidrocarburos NOVA- ISSN:1794-2470 Vol.6 No.9,101-212
6. Paul EA, Clark FE. Soil microbiology and biochemistry. San Diego: Academic Press; 1998.
7. Makkar R, Rockne K. (2003). Comparison of synthetic surfactants and biosurfactants in enhancing degradation of polycyclic aromatic hydrocarbons. Environ Toxicol Chem Vol. 22, No. 10, pp. 2280–2292.
8. Bollag, J.-M. 1992. Decontaminating soil with enzymes: An in situ
method using phenolic and anilinic compounds. Environ. Sci. Technol. 26:1876–1881.
9. Kosaric N. (2001). Biosurfactants and their application for soil bioremediation. Food Technol. Biotechnol. 39, 295-304.
10. Chaillan F, Chaineau CH, Point V, Saliot A, Oudot J. (2006). Factors inhibiting bioremediation of soil contaminated with weathered oils and drill cuttings. Environ. Pollut., 144, 255-265.
11. Aronstein BN and Alexander M. (1992). "Surfactants at Low Concentrations Stimulate Biodegradation of Sorbed Hydrocarbons in Samples of Aquifer Sands and Soil Slurries," Environ. Toxicol. Chem. 11, 1227-1233.
12. Singh A, Van Hamme JD, Ward O. (2007). Surfactants in microbiology and biotechnology: Part 2. Biotechnology Advances 25: 99 – 121.
13. Helmy Q, Kardena E, Wisjnuprapto. (2009). Performance of petrofilic consortia and effect of Surfactant tween 80 addition in the oil sludge removal Process. J. of Applied Sciences in Environ. Sanitation, 4 (3): 207-218.
14. Volkering F, Breure AM, Rulkens WH. (1998). Microbiological aspects of surfactant use for biological soil remediation. Biodegradation 8, 401–417.
15. Lange S and Warger F. (1987). Structure and Properties of Biosurfactants. In Biosurfactants and Biotechnology, Marcel Dekker Inc., N.Y.
16. Duran M and Contreras N. (2006). Alternativa de tratamiento para tierras fuller contaminadas con aceite dieléctrico. Scientia et Technica Año XII, No 32. UTP. ISSN 0122-1701. pp.419-424
17. Ogram A. (1997). Methods of soil microbial community analysis. Manual of Environmental Microbiology. Washington DC, ASM Press, pp 422-430.
18. Sutherland J. (1992). Detoxification of polycyclic aromatic hydrocarbons by fungi. J. Ind Microbiol. 9:53-62.
19. Messarch M and Nies L. (1997). Modification of heterothropic plate counts for assessing the bioremediation potencial of petroleum contaminated soils. Environ. Technol. 18 : 639-646.
20. Dejonghe W, Berteloot E, Goris J, Boon N, Crul K, Maertens S, Höfte M, De Vos P, Verstraete W, and Top EM. (2003). Synergistic Degradation of Linuron by a Bacterial Consortium and Isolation of a Single Linuron-Degrading Variovorax Strain. Applied and Environmental Microbiology, p. 1532-1541, Vol. 69, No. 344.
21. Leahy J and Colwell R. (1990). Microbial degradation of hydrocarbons in the environment. Microbiological Reviews, 3, 305.
22. Gray MR, Banerjee DK, Fedorak PM, Hashimoto A, Masliyah JH and Pickard MA. (1994). Biological remediation of anthracene-contaminated soil in rotating bioreactors. Applied Microbiology and Biotechnology, Vol. 40, pp. 933-940.
23. Tsomides HJ, Hughes JB, Thomas JM and Ward CH. (1995). Effect of surfactant addition on phenanthrene biodegradation in sediments. Environmental Toxicology and Chemistry, Vol. 14, pp.
953-959.
24. Fernández C, Llobregat M, Jiménez B, Altomare V, Labrador H. (2008). Biodegradación de asfalteno y resinas por microorganismos presentes en suelo contaminado con hidrocarburo. Rev. Fac. Ing. UCV v.23 N.4.
25. Pineda-Flores G, Mesta-Howard AM. (2001). Petroleum asphaltenes: generated problematic and possible biodegradation mechanisms. Rev Latinoamericana de Microbiología, 43: 143-150.
26. Pérez RM, Camacho MI, Gómez JM, Ábalos A, Viñas M and Cantero D. (2008). Aislamiento y selección de una cepa bacteriana degradadora de hidrocarburos a partir de suelos contaminados con petróleo. Revista CENIC Ciencias Biológicas, Vol. 39, No. 1.
27. Knaebel DB, Federle TW, McAvoy DC and Vestal JR. (1994). Effect of mineral and organic soil constituents on microbial mineralization of organic compounds in a natural soil. Appl Environ Microbiol.60:4500–4508.
28. Deshpande S, Shiau BJ. (1999). Wade, D.; Sabatini, D.A. and Harwell, J.H. “Surfactants selection for enhancing ex situ soil washing”. Pergamon., 33 (2), 351-60.
29. Celik GY, Aslim B and Beyatli Y. (2008). Enhanced crude oil biodegradation and rhamnolipid production by Pseudomonas stutzeri strain G11 in the presence of Tween-80 and Triton X-100. J. Environ. Biol. 29(6), 867-870.
30. Jayashree R, Vasudevan N and Chandrasekaran S. (2006). Surfactants enhanced recovery of endosulfan from contaminated soils. International Journal of Enviornmental Science and Technology, Vol. 3, No. 3, pp. 251-259.
31. Hadibarata T, Tachibana S. (2009). Enhanced Chrysene Biodegradation in Presence of a Synthetic Surfactant. Interdisciplinary Studies on Environmental Chemistry- Environmental Research in Asia. TERRAPUB. pp. 301–308.
32. Breuil C and Kushner DJ. (1980). Effects of lipids, fatty acids, and other detergents on bacterial utilization of hexadecane. Can. J. Microbiol. 26: 223–231.
33. Aiba S, Moritz V, Someya J and Haung KL. (1969). Cultivation of yeast cells by using n-alkanes as the sole carbon source I. batch culture. J. Ferm. Technol. 47: 203–210
34. Mimura A, Watanabe S and Takeda I.(1971). Biochemical engineering analysis of hydrocarbon fermentation III. analysis of emulsification phenomena. J. Ferm. Technol. 49: 255–262.
35. Robles IV, Fava F, Poggi HM. (2008). A review on slurry bioreactors for bioremediation of soils and Sediments. Microbial Cell Factories, 7:5
36. Holt MS, Mitchel GC and Watkinson RJ. (1992). The environmental chemistry, fate and effects of nonionic surfactants. In: Hutzinger O (Ed) The handbook of environmental chemistry. volume 3, Part F, (pp 91–98 and 119–139).
37. Tiehm A. (1994). Degradation of polycyclic aromatic hydrocarbons in the presence of synthetic surfactants. Appl. Environ. Microbiol. 60: 258–263.
38. Oberbremer A, Müller-Hurtig R and Wagner F. (1990). Effect of the addition of microbial surfactants on hydrocarbon degradation in a soil population in a stirred reactor. Appl. Microbiol. Biotechnol. 32: 485–489.
39. Liu Q, Dong M, ZhouaW, Ayub M, Zhang YP, Huang S. (2004). Improved oil recovery by adsorption–desorption in chemical flooding. J Petrol Sci Eng; 43:75–86.
40. Sulbarán M, Bahsas A, Velásquez W, Otoniel, J. (2005). Caracterización de Biosurfactantes producidos por Pseudomonas Fluorescentes aisladas de emulsiones de petróleo pesado. Ciencia v.13 n.2.
41. Singh-Cameotra S and Bollag J-M. (2003). Biosurfactant-Enhanced Bioremediation of Polycyclic Aromatic Hydrocarbons. Critical Reviews in Environmental Science and Technology, 30(2):111–126.
42. Gong G, Zheng Z, Chen H, Yuan C, Wang P, Yao L and Yu Z. (2009). Enhanced Production of Surfactin by Bacillus subtilis E8 Mutant Obtained by Ion Beam Implantation. Food Technol. Biotechnol. 47 (1) 27–31.
43. Li J-L, Chen B-H. (2009). Surfactant-mediated Biodegradation of Polycyclic Aromatic Hydrocarbons. ISSN 1996-1944. Materials, 2, 76-94
44. Lang S and Wagner F. (1993). Biological activities of biosurfactants. In: Kosaric N (ed.) Biosurfactants. Marcel Dekker, Inc. New York, USA.
45. Van Hamme JD, Singh A and Ward OP. Physiological aspects. (2006). Part 1 in a series of papers devoted to surfactants in microbiology and biotechnology. Biotechnology Advances 24, 604–620.
46. Gautam KK and Tyagi VK. (2006). “Microbial Surfactants: A Review”, J. Oleo Sci., Vol. 55, 155-166.
47. Bouwer EJ, Zhang W, Wilson LP and Durant ND. (1997). Biotreatment of PAHcontaminated soils/sediments. Ann NY Acad Sci. 829:103–17.
48. Billingsley KA, Backus SM, Wilson S, Singh A and Ward OP. (2002). Remediation of PCBs in soil by surfactant washing and biodegradation in the wash by Pseudomonas sp. LB400. Biotechnology Letters 24: 1827–1832.
49. Thibault SL, Anderson M and Frankenberger WT. (1996). Influence of surfactants on pyrene desorption and degradation in soils. Appl. Environ. Microbiol. 62: 283–287.
50. Mihelcic JR, Lueking DR, Mitzell RJ and Stapleton JM. (1993). Bioavailability of sorbed- and seperate-phase chemicals. Biodegradation 4: 141–153.
51. Yu H, Zhu L, and Zhou W. (2007). Enhanced desorption and biodegradation of phenanthrene in soil–water systems with the presence of anionic–nonionic mixed surfactants. J. Hazard. Mater. 142, 354.
52. Banat IM, Makkar RS, Cameotra SS. (2000). Potential commercial applications of microbial surfactants. Appl Microbiol Biotechnol. 53:495–508.
53. Bardi L,Mattei A, Steffan S, Marzona M. (2000). Hydrocarbon degradation by a soil microbial population with beta-cyclodextrin as surfactant to enhance bioavailability. Enzyme Microb Technol. 27:709–13.
54. Torres LG, Rojas N, Bautista G and Iturbe R. (2005). Effect of temperature, and surfactant’s HLB and dose over the TPH diesel biodegradation process in aged soils: Process Biochemistry. V. 40, p. 3296– 3302
55. Lee, D.-H., Kim, E.-S., Chang, H.-W. (2005). Effect of Tween surfactant components for remediation of toluene-contaminated groundwater. Geosciences Journal, Vol. 9, No. 3, p. 261 – 267.
56. Aronstein BN, Calvilo YM and Alexander M. (1991). Effects of surfactants at low concentrations on the desorption and biodegradation of sorbed aromatic compounds in soil. Environ Sci Teclmol 25:1728-1731.
57. West CC, Harwell JH. (1992). Surfactants and subsurface remediation. Environ Sci Technol 26:2324-2330.
58. Merrettig-Bruns U and Jelen E. (2009). Anaerobic Biodegradation of Detergent Surfactants. ISSN 1996-1944. Materials, 2, 181-206.
59. Abalos A, Vinas M, Sabate J, Manresa MA and Solanas AM. (2004). Enhanced biodegradation of Casablanca crude oil by a microbial consortium in presence of rhamnolipid produced by Pseudomonas aeruginosa AT10. Biodegradation, 15:249-260.
60. Almgren M, Grieser F and Thomas JK. (1979). Dynamic and static aspects of solubilization of neutral arenes in ionic micelar solutions. J. Am. Chem. Soc. 101: 279–291
61. Guha S, Jaffe PR and Peters CA. (1998). Bioavailability of mixtures of PAHs partitioned into the micellar phase of a nonionic surfactant. Environ. Sci. Technol. 32, 2317-2324.
62. Kim IS, Park J-S and Kim K-W. (2001). Enhanced biodegradation of polycyclic aromatic hydrocarbons using nonionic surfactants in soil slurry. Applied Geochemistry 16, 1419–1428.
63. Shin K, Kim K and Seagren E. (2004). Combined effects of pH and biosurfactant addition on solubilization and biodegradation of phenanthrene. Appl Microbiol Biotechnol 65:336–343
64. Guha S and Jaffe PR. (1996). Biodegradation kinetics of phenanthrene partitioned into the micelle phase of nonionic surfactants, Environ. Sci. Technol. 30, 605–611.
65. Laha S and Luthy R. (1991). Inhibition of phenanthrene mineralization by nonionic surfactants in soil water systems. Environ Sci Technol 25:1920–1930.
66. Zhang YM, Maier WJ and Miller RM. (1997). Effect of rhamnolipids on the dissolution, bioavailability and biodegradation of phenanthrene. Environ. Sci. Technol. 31, 2211-2217.
67. Lee J-L and Chen B-H. (2009). Effect of Nonionic Surfactants on Biodegradation of Phenanthrene by a Marine Bacteria of Neptunomonas naphthovorans. Research Express NCKU Vol.10 (4), 1-4.
68. Cerniglia CE. (1984). Microbial metabolism of polycyclic aromatic hydrocarbons. Adv. Appl. Microbiol. 30:31–37.
69. Liu ZB, Jacobson AM and Luthy RG. (1995). Biodegradation of naphthalene in aqueous nonionic surfactant systems. Appl. Environ. Microbiol. 61, 145-151.
70. Pritchard PH, Lin J-E, Mueller JG and Lantz S. (1994). Metabolic and Ecological factors affecting the bioremediation of PAH- and creosote-contaminated soil and water, EPA/600/R-94/075, USEPA, Washington, DC.
71. Yeom IT, Ghosh MM and Cox CD. (1996). Kinetic aspects of surfactant solubilization of soil-bound polycyclic aromatic hydrocarbons. Environ. Sci. Technol. 30: 1589–1595
72. Volkering F, Breure A, Andel J and Rulkens W. (1995). Influence of non-ionic surfactants on bioavailability and biodegradation of polycyclic aromatic hydrocarbons. Appl Environ Microbiol 61: 1699–1705.
73. Seo Y, Bishop PL. (2007). Influence of nonionic surfactant on attached biofilm formation and phenanthrene bioavailability during simulated surfactant enhanced bioremediation, Environ. Sci. Technol. 41, 7107–7113.
74. Tsai TT, Kao CM, Yeh TY, Liang SH, Chien HY. (2009). Remediation of Fuel Oil-Contaminated Soils by a Three-Stage Treatment System. Environ. Eng. Sci., 26(3): 651-659.
75. Volkering F, Breure A and Van Andel JG. (1993). Effect of microorganisms on the bioavailability and biodegradation of crystalline naphthalene. Appl. Microbiol. Biotechnol. 40:535–540.
76. Bogan BW and Lamar RT. (1995). One-electron oxidation in the degradation of creaosote polycyclic aromatic hydrocarbons by Phanerochaete chrysosporium. Appl. Environ. Microbiol., 61, 2631–2635.
77. Schippers C, Gessner K, Mueller T and Scheper T. (2000). Microbial degradation of phenanthrene by addition of a sophorolipid mixture. J Biotechnol 83:189–198.
78. Grimberg SJ, Stringfellow WT and Aitken MD. (1996). Quantifying the biodegradation of phenanthrene by Pseudomonas stutzeri P16 in the presence of a nonionic surfactant. Appl. Environ. Microbiol. 62: 2387–2392.
79. Kang S-W, Kim Y-B, Shin J-D, Kim E-K. (2009). Enhanced Biodegradation of Hydrocarbons in Soil by Microbial Biosurfactant, Sophorolipid. Appl Biochem Biotechnol. 160:780–790.
80. Torres LG, Rojas N and Iturbe R. (2004). Use of two-surfactants mixtures to attain specific HLB values for assisted TPH-diesel biodegradation: Journal of Environmental Sciences (China), v. 16, no. 6, p. 950–956.
81. Torres LG, Iturbe R and Orantes JL. (2003). Three surfactants CMC and diesel removal efficiencies from highly contaminated sandy soils. Environ Geosci. 10(1):28–36.
82. Fu MH and Alexander M. (1995). Use of surfactants and slurrying to enhance the biodegradation in soil of compounds initially dissolved in nonaqueous-phase liquids. Appl Microbiol Biotechnol. 43:551-558.
83. Alvarez-Cohen L, McCarthy PL and Roberts PV. (1993). Sorption of trichloroetylene onto a zeolite accompanied by methanotrophic biotransformation. Environ. Sci. Technol. 27: 2141–2148
84. Guerin WF and Boyd SA. (1992). Differential bioavailability of soilsorbed naphthalene for two bacterial species. Appl. Environ. Microbiol. 58: 1142–1152.
85. Gordon AS and Millero FJ. (1985). Adsorption mediated decrease in the biodegradation rate of organic compounds. Microbial Ecol. 11: 289–298
86. Deschênes L, Lafrance P, Villeneuve J and Samson R. (1996). Adding sodium dodecyl sulfate and Pseudomonas aeruginosa UG2 biosurfactants inhibits polycyclic aromatic hydrocarbon biodegradation in a weathered creosote-contaminated soil. Appl Microbiol Biotechnol 46:638–646.
87. Quyum A, Achari G, Goodman RH. (2002). Effect of wetting and drying and dilution on moisture migration through oil contaminated hydrophobic soils. Sci Total Environ. 296:77–87.
88. Holliger C and Zehnder A. (1996). Anaerobic biodegradation of hydrocarbons. Current Opinion in Biotechnol. 7 : 326-330.
89. Swisher RD. (1987). Surfactant biodegradation. Surfactant science series 18. Marcel Dekker, Inc., New York.
90. Van Ginkel CG.(1996). Complete degradation of xenobiotic surfactants by consortia of aerobic microorganisms. Biodegradation 7: 151–164.
91. Scott MJ and Jones MN. (2000). The biodegradation of surfactants in the environment. Biochemica et Biophysica Acta 1508, 235-251.
92. Torres LG, Orantes JL, Iturbe R. (2006). Biodegradation of Two Nonionic Surfactants Used for In Situ Flushing of Oil-Contaminated Soils. Tenside Surfactant Detergents, 43 (5) 251–255.
93. Wong JWC, Fang M, Zhao Z and Xing B. (2004). Effect of surfactants on solubilization and degradation of phenanthrene under thermophilic conditions. – Journal of Environmental Quality 33: 2015-2025.
94. Singer ME, Finnerty WR. (1984). Microbiol metabolism of straight chain and branched alkanes. – In Atlas, R.M. (ed) Petroleum microbiology, Macmillan pub. New York.
95. White GF, Higgins TP and John DM. (1997). Multiple mechanisms for biodegradation of non-ionic surfactants in bacteria. In: proceedings of the International Symposium Environmetal Biotechnology. Oostende, Netherlands. 21-23.
96. Deschênes L, Lafrance P, Villeneuve JP and Samson R. (1995). The effect of an anionic surfactant on the mobilization and biodégradation of PAHs in a creosote-contaminated soil. Hydrological Sciences-Journal- des Sciences Hydrologiques, 40,4, 471-484.
97. De Oude NT. (1992). The handbook of environmental chemistry. volume 3 part F: anthropogenic compounds. Springer Verlag, Heidelberg, FRG.
98. Helenius A & Simons K. (1975). Solubilization of membranes by detergents. BioChem. Biophys. Acta 415: 29–79.
99. Laha S and Luthy RG. (1992). Effects of nonionic surfactants on the solubilization and mineralization of phenanthrene in soil-water systems. Biotechnol. Bioeng. 40, 1367-1380.
100. Foght JM, Gutnick DL and Westlake DWS. (1989). Effect of emulsan on biodegradation of crude-oil by pure and mixed bacterial cultures. App. Environ. Microbiol. 55, 36-42.
101. Boonchan S, Britz ML and Stanley GA. (1998). Surfactant-enhanced biodegradation of high molecular weight polycyclic aromatic hydrocarbons by Stenotrophomonas maltophilia. Biotechnol. Bioeng. 59, 482-494.
102. Mata-Sandoval JC, Karns J and Torrents A. (2000). The influence of surfactants and biosurfactants on the bioavailability of hydrophobic organic pollutants in subsurface environments. Rev.Int. Contam. Ambient. 16 (4) 193-203.
103. Goncalves AMD, Aires-Barros MR and Cabral JMS. (2003). Interaction of an anionic surfactant with a recombinant cutinase from Fusarium solani Pisi: a spectroscopic study. Enzyme Microb Technol. 32: 868–79.
104. Bewley RJF, Ellis B, Theile P, Viney I and Rees J. (1989). Microbial clean-up of contaminated soil. Chemistry & Industry dec: 778–783
105. Zhang Y and Miller R. (1992). Enhanced octadecane dispersion and biodegradation by a Pseudomonas rhamnolipid surfactant (biosurfactant). Appl Environ Microbiol 58:3276–3282.
106. Colores GM, Macur RE, Ward DM and Inskeep WP. (2000). Molecular analysis of surfactant-driven microbial population shifts in hydrocarboncontaminated soil. Appl Environ Microbiol. 66:2959–64.
107. Little B, Wagner P, Ray R, Pope R and Scheetz R. (1991). Biofilms: an ESEM evaluation of artifacts introduced during SEM preparation. J. Ind. Microbiol. 8:213–222.
108. Vanderwerf MJ, Hartmans S and Vandentweel WJJ. (1995). Permeabilization and lysis of pseudomonas pseudoalcaligenes cells by Triton X-100 for efficient production of D-Malate. Appl. Microbiol.Biotechnol. 43, 590-594.
109. Hickey AM, Gordon L, Dobson ADW, Kelly CT and Doyle EM. (2007). Effect of surfactants on fluoranthene degradation by Pseudomonas alcaligenes PA-10. Appl. Microbiol. Biotechnol.74, 851-856.
110. Bramwell DAP and Laha S. (2000). Effects of surfactant addition on the biomineralization and microbial toxicity of phenanthrene. Biodegradation. 11, 263-277.
111. Shin KH, Ahn Y and Kim KW. (2005). Toxic effect of biosurfactant addition on the biodegradation of phenanthrene. Environ Toxicol Chem. 24:2768–74.
112. Jin DY, Jiang X, Jing X and Ou ZQ. (2007). Effects of concentration, head group, and structure of surfactants on the degradation of phenanthrene. J. Hazard. Mater. 144, 215-221.
113. Chen P, Pickard MA and Gray MR. (2000). Surfactant inhibition of bacterial growth on solid anthracene. Biodegradation. 11:341–7.
114. Cserhati T, Illes Z and Nemes I. (1991). Effect of non-ionic tensides on the growth of some soil bacteria. Appl. Microbiol. Biotechnol. 35:115-118.
115. Cserhati T, Szoegyi M, Bordas B and Dobrovolszky A. (1984). Structural requirements for the membrane damaging effect of non homologous series of nonionic tensides. Quant. Struct.-Act. Relat. 3:56-59.
116. Sikkema J, De Bont JAM and Poolman B. (1995). Mechanisms of membrane toxicity of hydrocarbons. Microbiol. Rev. 59: 201–222.
117. Boldrin B, Tiehm A and Fritzsche C. (1993). Degradation of phenanthrene, fluorene, fluoranthene, and pyrene by a Mycobacterium sp. Appl. Environ. Microbiol. 59:1927-1930.
ISSN 1666-7948
www.quimicaviva.qb.fcen.uba.arRevista QuímicaViva
Número 3, año 9, Diciembre 2010
quimicaviva@qb.fcen.uba.ar