Tratamiento biológico de efluentes industriales con contenido en metales: factores a tener en cuenta para un diseño eficiente
Metal loaded wastewater biotreatments: how to achieve a successful design.
Matías Barrionuevo1, María Alejandra Daniel1, Luciana Garavaglia1, Nerina Méndez2 y Griselda Sosa1, Roberto Candal3, Silvia Cerdeira1, Helena Ceretti1, Silvana Ramírez1, Eduardo Reciulschi1, Anita Zalts1 y Diana L. Vullo1,2.
1- Área Química, Instituto de Ciencias, Universidad Nacional de General Sarmiento (UNGS), J.M. Gutiérrez 1150, (B1613GSX) Los Polvorines, Buenos Aires. 2- Área Microbiología, Departamento de Química Biológica, Facultad de Ciencias Exactas y Naturales, UBA. 3- INQUIMAE-CONICET, Facultad de Ciencias Exactas y Naturales, UBA.
Email: dvullo@ungs.edu.ar; dvullo@qb.fcen.uba.ar
RESUMEN
El desarrollo de un biotratamiento eficiente para efluentes con contenido en metales, requiere del conocimiento de las interacciones metal-microorganismos, microorganismo-superficies y metal-componentes del efluente, de manera de efectuar un aprovechamiento máximo de la capacidad retentiva o biotransformadora bacteriana. Para la puesta a punto e implementación de sistemas de tratamiento biológico de efluentes industriales con contenidos de Cd(II), Zn(II) y Cr(VI) es indispensable, en un primer paso, de un diseño y funcionamiento de biorreactores en escala laboratorio. De esta manera estamos desarrollando métodos de remediación de efluentes industriales, con particular interés en los efluentes de procesos de galvanoplastía. Para cumplir el objetivo principal del proyecto de investigación en curso estudiamos: a) la biosorción y/o biotransformación de metales mediada por bacterias aisladas de ecosistemas contaminados sumado a modificaciones de la movilidad bacteriana en presencia de metales; b) la capacidad de adhesión microbiana a diferentes matrices formando películas; c) el comportamiento de la comunidad microbiana y d) la capacidad de complejamiento de los componentes del medio con el metal.
Palabras clave: metales, bioremediación, biosorción, biotransformación, quimiotaxis, capacidad complejante.
ABSTRACT
For the development of a successful biotreatment for wastewaters containing metals, studies on metal-microbes, microbe-surfaces and metal-environment interactions are required. The correct design of bioreactors for electroplating wastes at laboratory scale is the first step of our research project. In order to fulfil our general aim, several aspects should be studied: a) Cd(II) and Zn(II) biosorption and Cr(VI) biotransformation performed by indigenous bacteria; b) metal influence on bacterial motility; c) bacterial capacity of biofilm development and microbial community behaviour and d) complexing capacity of environment components with Cd(II) and Zn(II).
Keywords: bioremediation, metals, biosorption, biotransformation, chemotaxis, complexing capacity.
INTRODUCCIÓN
La contaminación de los suelos y de las aguas subterráneas y superficiales se origina en prácticamente cualquier actividad humana económica o culturalmente importante. La remediación definitiva de estos sitios requiere la extracción de los contaminantes. Desgraciadamente, las técnicas de remediación empleadas actualmente son muy costosas y, en el caso particular de los suelos, suelen afectar la fertilidad y/o el uso posterior de los mismos, mientras que en el caso de los acuíferos y aguas superficiales, puede comprometer seriamente el uso de este recurso como fuente de agua para el consumo humano.
Teniendo en cuenta a todos los metales presentes en nuestro planeta, podemos clasificarlos en tres grandes grupos (Duffus, 2002): 1. Esenciales para procesos biológicos y a su vez no tóxicos a concentraciones altas (Clase A) 2. Esenciales pero tóxicos más allá de una concentración límite (“Borderline”) y 3. Netamente tóxicos (Clase B). Dicha clasificación está basada en el comportamiento como ácido de Lewis que cada catión metálico posee, ya que de ello depende su tendencia hacia la formación de complejos con diferentes familias de ligandos. Por ejemplo el Ca y el K son metales no tóxicos, pertenecientes a la Clase A; Cr y Mn son metales esenciales para ciertos procesos biológicos pero más allá de una concentración límite ejercen cierta toxicidad debido a la capacidad de formar ciertos complejos con ligandos biológicos (Borderline) y por último Cd, Hg y Pb que no poseen utilidad biológica y ejercen una acción tóxica gracias a su alta afinidad por grupos funcionales con O, N y S (Clase B).
Numerosos efluentes industriales presentan concentraciones relativamente altas de muchos metales, entre los cuales se encuentran aquellos pertenecientes tanto al grupo 2 como al 3. Actividades tales como procesamiento o reciclado de metales (no ferrosos) y tratamientos superficiales como las galvanoplastías, producen habitualmente efluentes con contenidos de Cd, Zn, Cu, Pb, Hg, Ni o Co. En el caso de Cr es común encontrarlo como Cr(VI) en efluentes relacionados con actividades como la fabricación de pigmentos y curtiembres además de los procesos galvánicos. Las industrias asociadas a tales actividades efectúan ciertos tratamientos de efluentes basados en la precipitación química (Demir, 2007; Zoubolis, 2004). Sin embargo, dicha precipitación no permite la remoción de concentraciones bajas de los metales, generalmente complejados y en coexistencia con material orgánico (Lim, 2003, van Veen, 2002). Generalmente los tratamientos químicos son útiles cuando las concentraciones son mayores a 100 mg/L, no siendo el caso de muchos de los efluentes estando o no parcialmente tratados. En tales situaciones es necesaria la implementación de un tratamiento biológico mediante el desarrollo de biorreactores acordes al metal a remover del sistema (Diels, 2003; Konovalova, 2003; Chirwa, 1997). La actividad industrial que utiliza metales dentro de sus procesos es netamente global y el cuidado en la eliminación de sus desechos es de alta relevancia en cualquier ámbito. La prevención de la contaminación es el primer paso hacia la conservación adecuada de todos los espacios de nuestro planeta, por lo que el desarrollo de un tratamiento biológico eficiente y accesible debería ser de interés tanto para industrias nacionales como extranjeras.
Las estrategias microbianas de supervivencia frente a metales Clase B y “borderline” se encuentran ampliamente estudiadas (Lovley, 2000; Valls, 2002). Aprovecharlas en beneficio del ambiente es una posibilidad a tener en cuenta en el momento del correcto diseño de un sistema de biorremediación que asegure la eficiencia del proceso (Bender, 2004; Gadd, 2000; Malik, 2004).
Cuando se trabaja con microorganismos es necesario evaluar cuál será el destino de los residuos biológicos del proceso involucrado. Resulta entonces imprescindible conocer la inocuidad desde el punto de vista sanitario y la implicancia de la liberación de dichos microorganismos al ambiente. Los microorganismos aislados de ecosistemas contaminados son supervivientes de aquellos efectos tóxicos provocados por metales mediante el funcionamiento de diferentes mecanismos biológicos, por lo que representan potenciales microremovedores siempre y cuando no posean relevancia clínica.
La aplicación de las estrategias microbianas de detoxificación de metales como el cadmio, cromo, plomo, níquel, zinc y cobre forma la base del tratamiento biológico de efluentes industriales. Dichas estrategias se basan en la adsorción superficial microbiana del metal de interés (caso Cu(II), Cd(II) y Zn(II)), mecanismo denominado biosorción (Ahluwalia, 2007; Guibaud, 2009; Lu, 2006; Pal, 2008; Vijayaraghavan, 2005), o bien en la biotransformación del metal, en el caso de Cr(VI) (Konovalova, 2003; Thacker, 2007; Nkhalambayausi-Chirwa, 2001; Asatiani, 2005; Megharaj, 2003; Abate, 2007), mediante la cual se produce un cambio en el estado de oxidación del metal que favorece su precipitación posterior como material insoluble.
En el caso de la remoción de Cu, Cd y Zn por el mecanismo de biosorción es necesario implementar un proceso que funcione en fase heterogénea mediante la inmovilización de células sobre soportes de bajo costo. Para lograr un sistema eficiente y exitoso, debería asegurarse la adhesión de los microorganismos a las diversas superficies utilizadas como soportes. Dicha adhesión no es siempre posible cuando se trabaja con células adaptadas a desarrollarse en suspensión, como es el caso de cepas cultivadas en un laboratorio. La utilización de microorganismos aislados a partir de diversos ecosistemas resulta en un beneficio adicional, debido a que en sus ambientes naturales éstos ya se encuentran íntimamente relacionados con superficies de diferentes orígenes formando las llamadas biopelículas (biofilms). El empleo de microorganismos organizados en biopelículas para diversos procesos de biorremediación posee una serie de ventajas (Singh, 2006; Perumbakkam, 2006). Entre ellas podemos mencionar, por ejemplo que estos procesos a) permiten trabajar en fase heterogénea facilitando una circulación continua del efluente a tratar; b) posibilitan una mejor adaptación y supervivencia bacteriana, especialmente en situaciones de estrés, ya que la protección de la estructura macromolecular de la matriz mejora la eficiencia del proceso manteniendo intacta la actividad biológica de interés. El estudio de la formación de una biopelícula y sus condiciones ambientales óptimas, así como también la estructura, los fenómenos de quimiotaxis bacteriana (Caiazza, 2007; Kato, 2008; Pandey, 2002), transporte de nutrientes y solutos de interés ambiental asociados a la misma son de fundamental importancia a la hora de implementar procesos de tratamiento de efluentes mediante la utilización de reactores de lecho fijo o fluidizado.
Los fenómenos de adhesión, agregación y biosorción dependen de las propiedades eléctricas de las superficies bacterianas por lo que el estudio de la movilidad electroforética es imprescindible para la comprensión y optimización del funcionamiento del tratamiento biológico a implementar (Tsuneda, 2004; Eboigbodin, 2006; Deng, 2005, Borrok, 2005, Bingol, 2005)
En el caso de la biotransformación de Cr(VI) a Cr(III) es necesario mantener las células en continuo crecimiento, ya que se trata de una reducción enzimática, por lo que los reactores adecuados tendrían el formato de un quimiostato. El efluente liberado a partir de los mismos enriquecido en Cr(III) sería procesado para lograr la separación efectiva de dicho catión en el medio líquido, como Cr(OH)3 utilizando agentes floculantes.
Así como el desarrollo de un biotratamiento eficiente requiere del conocimiento de las interacciones metal-microorganismos, es necesario conocer en detalle las interacciones microorganismo-superficies y metal-componentes del efluente, de manera de efectuar un aprovechamiento máximo de la capacidad retentiva microbiana. Por lo tanto, con un trabajo interdisciplinario se busca integrar los resultados que surjan como consecuencia del mismo, lo que no es común encontrar en la bibliografía disponible. En el Área Química Ambiental de la UNGS hemos desarrollado un proyecto de investigación que actualmente se encuentra en curso, cuyo objetivo general es la puesta a punto e implementación de sistemas de tratamiento biológico de efluentes industriales con contenidos de Cd(II), Zn(II) y Cr(VI) a través del diseño y funcionamiento de biorreactores en escala laboratorio. De esta manera estamos desarrollando métodos de remediación de efluentes industriales, con particular interés en los efluentes de procesos de galvanoplastía. Para cumplir nuestro objetivo estudiamos: a) la biosorción y/o biotransformación de metales mediada por bacterias aisladas de ecosistemas contaminados sumado a modificaciones de la movilidad bacteriana en presencia de metales, es decir interacciones metal-microorganismos; b) la capacidad de adhesión microbiana a diferentes matrices formando películas, por lo tanto las interacciones bacteria-superficies; c) el comportamiento de la comunidad microbiana, es decir interacciones bacteria-bacteria y d) la capacidad de complejamiento de los componentes del medio con el metal, o sea interacciones metal-entorno. Este proyecto es netamente interdisciplinario en donde todos los aspectos de la Química se hallan representados: Microbiología, Química Analítica (Electroquímica), Fisicoquímica, Química Orgánica y Química Biológica. La integración del conocimiento generado es la vía de comprensión de los fenómenos en estudio para el éxito en el cumplimiento de nuestro objetivo general.
Este trabajo resume el grado de avance alcanzado por nuestro grupo y muestra la evolución que hemos tenido a lo largo de estos años desde que el artículo Microorganismos y metales pesados: una interacción en beneficio del medio ambiente, fue publicado en esta revista Química Viva, Año 2 Número 3, en el año 2003.
MICROORGANISMOS
Los microorganismos con los que trabajamos son cinco cepas bacterianas, que fueron aisladas a partir de ecosistemas con conocidos niveles de contaminación con metales. Dichas bacterias poseen capacidad adsortiva para Cd(II) y Zn(II) y además capaces de reducir Cr(VI) a Cr(III). Estas cinco cepas fueron identificadas por secuenciación del gen del rARN 16S como Pseudomonas veronii 2E, Delftia acidovorans AR, Klebsiella oxytoca P2, Klebsiella ornithinolytica 1P y Ralstonia taiwanensis M2.
INTERACCIONES METAL-BACTERIA
Biosorción de Cd(II) y Zn(II): estudios fisicoquímicos sobre Pseudomonas veronii 2E.
Habiendo evaluado la capacidad biosortiva de los microorganismos aislados, se escogió a Pseudomonas veronii 2E como objeto de estudio, debido a los mayores rendimientos obtenidos (Vullo, 2008) en cuanto a biosorción se refiere. Se utilizaron dos estrategias para estudiar la interacción metal-bacteria: a) el desarrollo de isotermas de adsorción para Cd(II), para Zn(II) y para mezclas de ambos y búsqueda de un modelo fisicoquímico que ajuste para la comprensión del fenómeno y b) la exploración de los cambios en la carga superficial bacteriana por efecto de los iones metálicos, mediante mediciones de movilidad electroforética en presencia de Cd(II), Zn(II) y mezclas de ambos (Méndez, 2009).
a) Isotermas de adsorción
La construcción de isotermas de adsorción consistió en exponer suspensiones bacterianas, con masa celular constante, a diferentes concentraciones de Cd(II) (0 a 2 mM), Zn(II) (0 a 0,5 mM) y a mezclas de ambos (diferentes combinaciones con 0,5 y 0,1 mM de concentración total). Luego de una incubación a 32ºC durante 24 hs. se midió el metal remanente en los sobrenadantes por Voltametría de Preconcentración Electrolítica, luego de centrifugar (3.000 x g, 15 min) y filtrar las muestras (0,45 µm de diámetro de poro). El pH de las mezclas metal-bacteria debió mantenerse regulado ya que la adsorción es un fenómeno dependiente de este parámetro. En particular el pH=7,5 fue regulado con solución de HEPES (ácido N-[2-hidroxietil]piperazin-N'-[2-etansulfónico], pKa= 7,5) 10 mM. Al graficar q, es decir la cantidad de metal retenida por g de peso seco bacteriano en función de la concentración de metal en equilibrio se obtiene el gráfico de la Figura 1.A.
El valor de q se calcula como:
q = (Ci- Ceq) x Vt / mt
donde Ci es la concentración inicial del metal Ceq es la concentración de metal en equilibrio, Vt es el volumen total de la mezcla y mt es la masa total bacteriana expresada en peso seco.
La isoterma obtenida para Cd(II) difiere de la de Zn(II) en cuanto a la capacidad máxima de adsorción, es decir el valor de q al cual se llega al plateau de la curva es mucho mayor en el caso del cadmio.
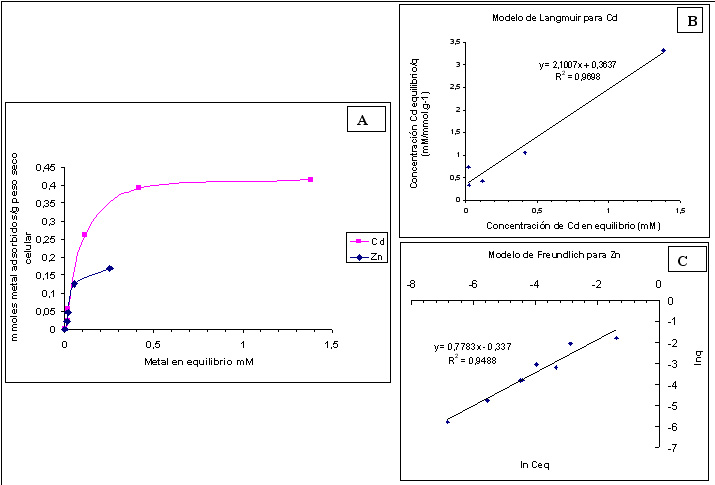
Figura 1. A. Isotermas de adsorción de Pseudomonas veronii 2E para Cd(II) y Zn(II). B. Linealización según el modelo de Langmuir para Cd(II) y C. Linealización según el modelo de Freundlich para Zn(II).
Para comprender el fenómeno de adsorción se estudió el ajuste de nuestro sistema biológico a algunos de los modelos fisicoquímicos establecidos. Se ensayaron dos modelos: Langmuir y Freundlich. El modelo de Langmuir establece la existencia de una monocapa superficial adsorbente saturable. Cada partícula adsorbida no modifica la capacidad adsortiva de la monocapa, por lo que las interacciones adsorbente-adsorbato son independientes. Las expresiones que se obtienen para este modelo son:
q = qmax . Ceq /(Kd + Ceq) o Ceq /q = Kd / qmax + Ceq / qmax
siendo qmax la capacidad adsortiva máxima y Kd es la constante de equilibrio de disociación metal-superficie. Si se grafica Ceq /q vs. Ceq y el gráfico resulta lineal, significa que el sistema se ajusta a este modelo. La biosorción de Cd(II) aparentemente ocurre por un mecanismo acorde con el modelo de Langmuir (Figura 1.B., Vullo, 2008).
El modelo de Freundlich no considera la existencia de una monocapa homogénea sino una superficie heterogénea en donde no todos los sitios de interacción son iguales e independientes. No se puede aproximar a una capacidad adsortiva de saturación máxima, ya que la superficie se va modificando a medida que la adsorción progresa. Matemáticamente hablando, la isoterma de Freundlich se define según la siguiente ecuación:
q = KF . Ceq 1/n
donde KF y n son llamadas constantes de Freundlich, características de cada sistema y son indicadores de la capacidad e intensidad del proceso de adsorción. Si se aplica ln a la ecuación anterior se obtiene la siguiente expresión:
ln q = ln KF + (1/n) ln Ceq
Por lo tanto si se grafica ln q vs. ln Ceq, y se obtiene un gráfico lineal quiere decir que el sistema responde a este modelo. En nuestro caso ocurre con Zn(II), según puede observarse en la Figura 1.C.
¿Qué pasó con las mezclas de Cd(II) y Zn(II)? Los valores de q obtenidos son bien diferentes de acuerdo a la concentración total inicial de ambos metales. Cuando esta concentración es baja (0,1 mM) el valor de q total permanece constante entre 0,05 y 0,06 mmoles de metal/g peso seco celular, mientras que cuando la concentración inicial total es 0,5 mM q aumenta con la concentración de Cd(II) hasta coincidir con los valores de q obtenidos con Cd(II) solo.
Todos estos resultados sugieren una interacción metal-bacteria diferente dependiendo del metal involucrado. Es probable que dicha interacción esté dada por sitios superficiales distintos.
b) Movilidad electroforética bacteriana
La interfase formada entre la cubierta externa bacteriana y el entorno extracelular juega un rol importante dentro de la fisiología microbiana. Los componentes de esta capa externa son fundamentalmente macromoléculas con grupos funcionales carboxilato, fosfato y amino, que confieren una carga expuesta superficial de signo negativo. La carga electrostática influye sobre la polaridad e hidrofilicidad, propiedades determinantes de las funciones celulares. La carga superficial celular se puede estimar mediante la determinación de potencial zeta (ζ), que es el potencial eléctrico de la región interfacial entre la superficie bacteriana y el entorno acuoso. La ecuación de Smoluchowski:
ζ = (η . µ) / (ε0 . ε)
relaciona al potencial zeta con la movilidad electroforética (µ), η es la viscocidad del medio, ε0 es la permitividad del vacío y ε es la constante dieléctrica del medio.
La movilidad electroforética es una propiedad intensiva que indica la habilidad de las partículas de moverse en un campo eléctrico. Una modificación sobre la superficie provocada por la interacción con un catión, modificaría la carga neta negativa de la superficie celular y, por ende, µ. Además µ depende de la fuerza iónica del medio y obviamente del pH, por lo que ambos parámetros deben mantenerse constantes a lo largo de las mediciones. Las mismas suelen realizarse por una técnica denominada light scattering utilizando un instrumental especial como por ejemplo “Brookhaven 90-plus zetameter”. En la Figura 2. se representa la variación de la movilidad electroforética en función de la concentración del catión en condiciones de fuerza iónica constante (KCl 10 mM) y pH constante (pH=7,5, buffer HEPES 10 mM). En ambos casos la presencia del catión hace menos negativa la carga neta superficial, es decir µ se hace más positiva. El comportamiento de Cd(II) es bien diferente al del Zn(II). A concentraciones bajas de Cd(II) µ se modifica y permanece constante más allá de una concentración 0,05 mM, mientras que recién a una concentración de Zn(II) de 0,2 mM, µ llega a un valor constante. Los valores de µ son más positivos en presencia de Zn(II) comparados con los del Cd(II). Esto se debe a un mayor efecto pantalla que ejercen las cargas positivas del catión de menor radio, es decir la carga superficial negativa se encuentra menos expuesta con zinc que con cadmio.
Estos resultados permiten confirmar la suposición de que la interacción Cd(II)-bacteria ocurre en sitios diferentes que la interacción Zn(II)-bacteria. Si bien ambos metales difieren en los sitios de afinidad, esto no quiere decir que sean independientes entre sí, es decir que la presencia de uno puede llegar a modificar la interacción de la célula con el otro.
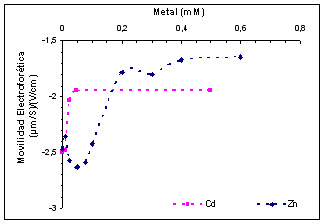
Figura 2. Movilidad electroforética de Pseudomonas veronii 2E en presencia de cadmio o zinc.
Biotransformación de Cr(VI)
La capacidad microbiana de reducir Cr(VI) a Cr(III) puede estar mediada por la actividad de la enzima cromato reductasa, descripta por varios autores (Thacker, 2007). No solamente es necesaria la biotransformación de Cr(VI) para la remoción del cromo de un efluente industrial, sino que también es imprescindible lograr una separación del mismo de los sobrenadantes obtenidos en dicho proceso. Dicha separación del sistema acuoso consiste en la inmovilización del Cr(III) en su forma insoluble Cr(OH)3. Si bien este compuesto es altamente insoluble en agua, la formación y floculación de Cr(OH)3 requiere de ciertas condiciones fisicoquímicas del entorno.
¿Cómo se comporta el Cr(III) en agua? Forma una serie de acuocomplejos como por ejemplo:
![]()
Ahora bien, si esta solución se trata con una solución de NaOH 0,1M ocurre lo siguiente:
a. Primer paso: precipitación a un pH cercano a 7
[Cr(H2O)6]3+ + 3OH- [Cr(H2O)3(OH)3] (s) + 3 H2O
b. Segundo paso: redisolución del precipitado a pH altamente alcalinos
[Cr(H2O)3(OH)3] (s) + 3OH- [Cr(OH)6]3- + 3 H2O
Considerando la constante del producto de solubilidad, el pH al cual comienza la precipitación sería alrededor de 7 para una concentración inicial de Cr(III) de 0,045 mM. Dicho valor corresponde a concentraciones encontradas en efluentes industriales, que a su vez exceden los límites establecidos para su descarga (menor que 2 mg/l o 0,038mM según la Resolución 336/03 de la Provincia de Buenos Aires y Resolución 79.179/90 de Recursos Hídricos de la Nación Argentina).
Por lo tanto además de testear la capacidad bioreductora de las bacterias, es necesario poder separar exitosamente el cromo mediante procesos químicos de floculación acoplados con la biotransformación.
En la Tabla 1 se muestran los máximos valores obtenidos en cuanto a la biotransformación de Cr(VI) de cultivos bacterianos en lote, tanto puros como mixtos (Garavaglia, 2009). La desaparición de Cr(VI) se midió utilizando técnicas espectrofotométricas de acuerdo a recomendaciones internacionales (APHA, 1998).
Tabla 1. Remoción de Cr(VI) por parte de cultivos puros como mixtos en sistemas en lote. Los valores corresponden a los mejores rendimientos obtenidos en fase estacionaria de crecimiento.
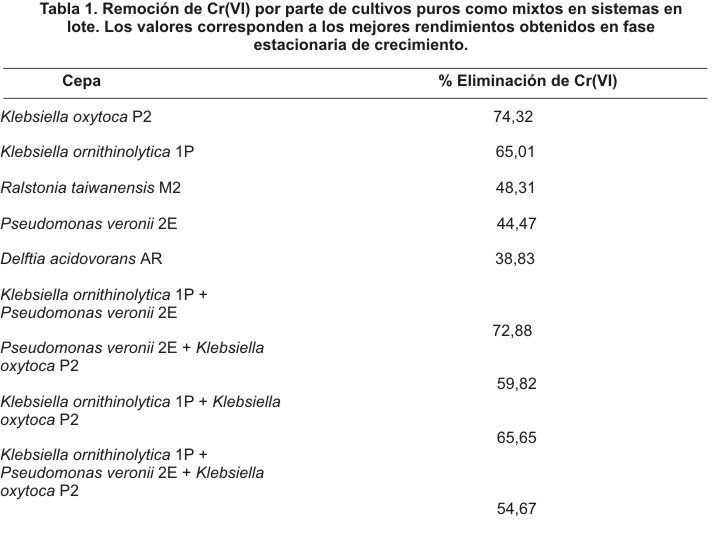
Los mayores porcentajes de remoción de Cr(VI) se obtuvieron con Klebsiella oxytoca P2 y con el cultivo mixto Klebsiella ornithinolytica 1P + Pseudomonas veronii 2E. Estas dos últimas cepas en forma conjunta mejoraron notablemente el rendimiento en la biotransformación. Si bien estos cultivos demostraron una reducción de Cr(VI), en ningún momento se observó la precipitación de compuestos insolubles de Cr(III), a pesar de obtener un pH=8 en todos los casos. Las mediciones de cromo total realizadas por espectroscopia de absorción atómica demostraron que todo el Cr(III) permanecía en solución por lo que se ensayaron métodos de floculación con diferentes agentes. Con la utilización de Na2CO3 0,1 M se logró una precipitación prácticamente cuantitativa del Cr(III) en solución.
Movilidad Bacteriana
De acuerdo al entorno celular, las bacterias pueden experimentar diferentes tipos de movilidades, modificándolas a su beneficio. En los medios líquidos o semi-sólidos de baja densidad, cierto grupo de bacterias son capaces de desplazarse libremente por medio de un apéndice denominado flagelo. El desplazamiento en este tipo de medios es denominado swimming. Cuando un grupo de bacterias coloniza un ambiente terrestre o que presenta restricciones para su movilidad, no puede propagarse a través del mismo por swimming. En dichos casos, el desplazamiento se produce por un proceso denominado swarming. El swarming se suele describir como una forma de movilidad rápida, grupal y coordinada que depende de dos factores fundamentales: el contacto constante célula-célula y la síntesis de una nueva batería de flagelos a lo largo de toda la superficie celular. La quimiotaxis es la movilidad dirigida hacia un posible sustrato o en contra de un compuesto con efecto negativo para los microorganismos.
Los tres tipos de movilidad son importantes durante la formación de biopelículas y pueden ser afectados por cambios en el medio. Como la formación de biopelículas es fundamental en el diseño de biorreactores de lecho fijo o fluidizado, la presencia de metales en los efluentes a tratar puede afectar el desarrollo adecuado de la película microbiana. Se estudió entonces la influencia de los metales Cd(II), Zn(II), Cu(II) y Cr(VI) sobre los distintos tipos de movilidad observada para las bacterias móviles Ralstonia taiwanensis M2, Pseudomonas veronii 2E y Delftia acidovorans AR. El ensayo de swimming se realizó en medio de cultivo PYG (peptona de caseína 2,5 g/L, extracto de levadura 1,25 g/L y glucosa 0,5 g/L) adicionado con 3 g/L de agar y se inoculó por punción en tubos con diferentes concentraciones de cada metal. Un resultado swimming positivo consistió en una distribución homogénea de la población bacteriana en todo el medio. El ensayo de swarming se realizó por punción central en placa con medio de cultivo nutritivo con el agregado de 4g/L de agar. La movilidad tipo swarming se verificó por el agrandamiento en dirección radial del desarrollo bacteriano a lo largo del tiempo de incubación. El ensayo de quimiotaxis fue una adaptación del chemical in plug colocando en placas una gota central con el quimioefector en agarosa 0,5% y alrededor una suspensión bacteriana en agarosa 0,35%. La aglomeración microbiana en torno a la gota central evidenció una quimiotaxis positiva, mientras que una disminución de la concentración bacteriana alrededor de la gota central fue provocada por una quimiotaxis negativa. Los resultados obtenidos fueron variados ya que cada cepa respondió de manera diferente. En la Figura 3 se ejemplifican algunos de ellos.

Figura 3. Acción de los metales sobre la movilidad de Ralstonia taiwanensis M2.
INTERACCIONES BACTERIA-BACTERIA
El desarrollo de cultivos mixtos sólo es posible si las bacterias logran crecer en forma conjunta a lo largo de todo un cultivo en lote. Es por ello que primeramente se evaluó la posibilidad de que las bacterias liberaran alguna actividad antimicrobiana. Como se ve en la Figura 4, tanto Ralstonia taiwanensis M2 como Delftia acidovorans AR la poseen, tal como lo revelan sus respectivos halos de inhibición alrededor de sus colonias.
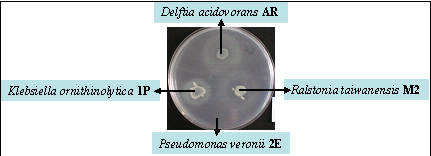
Figura 4. Ensayo de actividad antimicrobiana sobre Pseudomonas veronii 2E.
Para efectuar un seguimiento de la composición de un cultivo mixto se efectuó una Electroforesis en Gradiente de Gel Desnaturalizante (DGGE, Muyzer, 1993) del ADN bacteriano, extraído a partir de muestras pertenecientes a diferentes estadios de los diferentes cultivos mixtos. Los resultados obtenidos fueron claros: sólo pudieron coexistir Klebsiella ornithinolytica 1P y Pseudomonas veronii 2E, el par que demostró un pronunciado incremento en la eliminación de Cr(VI) (Tabla1). En los demás casos se vio una clara predominancia de Klebsiella oxytoca P2 sobre las demás bacterias, no pudiendo mejorar los rendimientos obtenidos en cuanto a la biotransformación de Cr(VI).
INTERACCIONES BACTERIA-SUPERFICIES
La posibilidad de generar biopelículas está determinada por la capacidad que posee una determinada bacteria de interactuar con superficies que pueden actuar como soporte. Superficies poliméricas (siliconas, teflón, poliuretanos, etc.; Vullo, 2008) y vidrio son ejemplos de matrices a ensayar para la utilización de las mismas en biorreactores. La Figura 5 muestra una visión microscópica del desarrollo bacteriano sobre las matrices ensayadas. Las bacterias aisladas se adhieren a una diversidad de superficies, esto posibilita la inmovilización de los microorganismos para usos en biotratamientos.
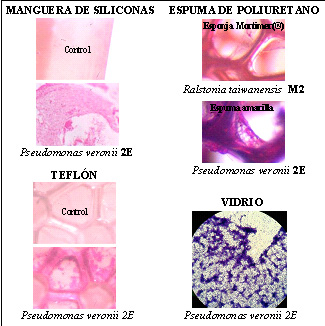
Figura 5. Películas microbianas en diferentes matrices, vistas con un aumento de 100x.
INTERACCIONES METAL-ENTORNO
La biodisponibilidad es un factor a tener en cuenta a la hora de evaluar interacciones metal-microorganismos. Está determinada por la capacidad de asociación del catión metálico con componentes del entorno celular, que pueden ser solubles o asociados a partículas en suspensión. Considerando el material soluble, la capacidad complejante de ciertas sustancias orgánicas puede traer como consecuencia una disminución en la concentración de metal libre en solución. Tanto en efluentes industriales como en medios de cultivo existen variedades de sustancias con grupos funcionales disponibles que pueden actuar como complejantes. La evaluación de la capacidad complejante tanto del medio de cultivo como del efluente a tratar es indispensable y determinante de la eficiencia global del biotratamiento.
¿Cómo se mide la capacidad complejante de un sistema acuoso? La técnica es la Voltametría de Preconcentración Electrolítica de Onda Cuadrada, mediante la cual se realiza una titulación del sistema por agregados crecientes de una solución del metal de interés. En la Figura 6 se muestra un gráfico representando la titulación del medio de cultivo utilizado para el desarrollo de nuestras bacterias (PYG: peptona de caseína 2,5 g/L, extracto de levadura 1,25 g/L y glucosa 0,5 g/L). Se graficó la corriente de pico Ip en función de la concentración de Cd(II) total agregado. Se ven dos curvas: 1) la correspondiente a los puntos con círculo abierto es la titulación control en un entorno sin capacidad complejante, que corresponde a una recta ya que la concentración de metal es directamente proporcional a la corriente detectada en el instrumental y 2) la correspondiente a puntos con círculos cerrados: no es un gráfico lineal en este caso ya que los primeros puntos poseen una tendencia diferente a los cuatro últimos. Marcando la recta para el caso 1) vemos que su origen es el (0,0), lo cual es lógico ya que la corriente registrada es nula cuando la concentración de Cd(II) = 0. Tomando los últimos cuatro puntos del caso 2), y trazando la recta a la que aproximan, se puede extrapolar la misma al eje x, cortándolo en un valor de concentración de Cd(II) cercano a 1 µM. ¿Qué quiere decir esto? Que en el medio de cultivo ensayado existen ligandos que complejan el Cd(II) agregado en una concentración de 1 µM, suponiendo una estequiometría metal-ligando 1:1. El Cd(II) disponible genera una señal de corriente de pico Ip correspondiente a una menor concentración que la agregada, con lo cual parte del Cd(II) agregado se encuentra en una situación de equilibrio de complejamiento con componentes del medio de cultivo que no permiten su detección. La linealizaciones de Ruzic y Scatchard (gráficos insertos en la Figura 6) contribuyen al cálculo de constantes de estabilidad de los complejos.
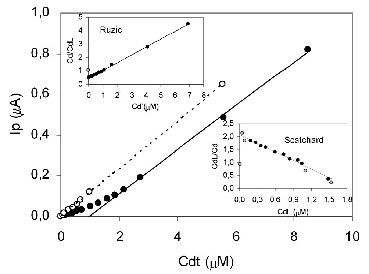
Figura 6. Titulación del medio de cultivo PYG con solución de Cd(II) para la determinación de la capacidad complejante.
CONCLUSIONES: PRESENTE Y FUTURO
Gracias a los estudios realizados y como conclusión global en cuanto a las interacciones metal-microorganismos, microorganismo-superficies, microorganismo-microorganismo y metal-entorno, hemos podido avanzar en el diseño de biorreactores sobre lecho fijo para Cd(II) y Zn(II). En la Figura 7 vemos dos reactores en funcionamiento cuyos volúmenes de trabajo son 50 mL (C50) y 200 mL (C200). Hemos tenido resultados preliminares de un 50% de retención de Cd(II) y Zn(II) en efluentes artificiales, situación que aún podemos mejorar, antes de trabajar con efluentes industriales reales, para luego efectuar una ampliación de escala de trabajo.

Figura 7. Biorreactores de laboratorio en funcionamiento para la retención de Cd(II) y/o Zn(II).
¿Cuáles son las actividades programadas en un futuro cercano? Haciendo un listado, podemos resumirlas así:
• Mejoramiento del funcionamiento de biorreactores de lecho fijo.
• Estudios de formación de biopelículas en diversos materiales para utilizar como lechos.
• Ensayar la retención de cationes en biorreactores utilizando efluentes artificiales de mezclas que contienen Cd(II) y Zn(II).
• Determinar la capacidad complejante de efluentes de galvanoplastías.
• Probar el funcionamiento de los biorreactores con efluentes industriales.
• Determinar la presencia de actividad cromato-reductasa en las bacterias que demostraron la capacidad de eliminar Cr(VI).
• Desarrollar un biorreactor con células en suspensión para Cr(VI) acoplado con precipitación química.
• Profundizar los estudios en comunicación célula-célula: quorum sensing y la influencia de los metales sobre este fenómeno.
Es claro que queda mucho por delante, pero nos encaminamos hacia el desarrollo de tecnologías innovadoras aplicables en la prevención de la contaminación. El tratamiento adecuado de los efluentes industriales, previo a su descarga en cursos de agua, es imprescindible para el resguardo la calidad del recurso.
AGRADECIMIENTOS
El proyecto es financiado por la Universidad Nacional de General Sarmiento y la Agencia Nacional de Promoción Científica y Tecnológica (ANPCyT, PICTO-UNGS 36782-341). Agradecemos al Lic. Aldo Collauti (Centro de Desarrollo Analítico, Buenos Aires) por las determinaciones de cromo total.
Agradecemos especialmente a las instituciones nacionales que hicieron posible el trabajo de los becarios: María Alejandra Daniel (ANPCyT), Luciana Garavaglia y Griselda Sosa (UNGS) y Matías Barrionuevo (Comisión de Investigaciones Científicas de la Provincia de Buenos Aires, CIC).
REFERENCIAS
Ahluwalia, S.S. y Goyal, D., 2007. Microbial and plant derived biomass for removal of heavy metals from wastewater. Bioresource Technology, 98(12): 2243-2257
American Public Health Association, American Water Works Association, and Water Environment Federation. Standard Methods for the Examination of Water and Wastewater, 20th Edition, Washington, D. C., 1998.
Asatiani, N. y Holman, H., 2004. Effect of chromium (VI) action on Arthrobacter oxydans. Current Microbiology 49:321-326.
Bender, J. y Phillips, P., 2004. Microbial mats for multiple applications in aquaculture and bioremediation. Bioresource Technology, 94: 229-238.
Bingol, A., Handan, U., Bayhan, Y.K., Karagunduz, A., Cakici, A. y Keskinler, B., 2004. Removal of chromate anions from aqueous stream by a cationic surfactant-modified yeast, Bioresource Technology 94: 245-249.
Borrok, D.M. y Fein, J.B. 2005. The impact of ionic strength on the adsorption of protons, Pb, Cd and Sr onto surfaces of Gram negative bacteria: testing non-electrostatic diffuse and triple monolayer models. Journal of Colloid Interface Science 286: 110-126.
Caiazza, N., Merrit, J., Brothers, K. y O´Toole, G.A., 2007. Inverse regulation of biofilm formation and swarming motility by Pseudomonas aeruginosa PA14, Journal of Bacteriology, 189(9): 3603-3612.
Ceretti, H.M., Vullo, D.L., Zalts, A. y Ramírez S.A., 2006. Cadmium complexation in culture media. Electroanalysis 18(5): 493-498.
Chirwa, E.M.N. y Wang, Y., 1997. Hexavalent Chromium Reduction by Bacillus sp. In a Packed-Bed Bioreactor. Environmental Science and Technology 31: 1446-1451.
Demir, A., y Arisoy, M., 2007. Biological and chemical removal of Cr(VI) from waste water: cost and benefit analysis, Journal of Hazardous Materials 147:275-280.
Deng, S y Ting, Y.P., 2005. Polyethylenimine-modified fungal biomass as a high capacity biosorbent for Cr(VI) anions: sorption capacity and uptake mechanisms, Environmental Science and Technology 39: 8490-8496.
Diels, L., Spaans, P.H., Van Roy, S., Hooyberghs, L., Ryngaert, A., Wouters, H., Walter, E., Winters, J., Macaskie, L., Finlay, J., Pernfuss, B., Woebking, H., Pümpel, T. y Tsezos, M., 2003. Heavy metals removal by sand filters inoculated with metal sorbing and precipitating bacteria. Hydrometallurgy 71: 235-241.
Duffus, J.H., 2002. “Heavy metals” – a meaningless term?, IUPAC technical report, Pure and Applied Chemistry, 74(5): 793-807.
Eboigbodin, K.E., Newton, J.R.A., Routh, A.F. y Biggs, C.A., 2006. Bacterial quorum sensing and cell surface electrokinetic properties, Applied Microbial and Cell Physiology, 73: 669-675.
Gadd, G.M., 2000. Bioremedial potential of microbial mechanisms of metal mobilization and immobilization. Current Opinion in Biotechnology 11: 271-279.
Garavaglia, L., Cerdeira, S. y Vullo, D.L., 2009. Chromium (VI) biotransformation by b- and g-Proteobacteria from natural polluted environments: a combined biological and chemical treatment for industrial wastes. Enviado para su publicación.
Guibaud, G., van Hullebusch, Bordas, F., d´Abzac, P. y Joussein, E., 2009. Sorption of Cd(II) and Pb(II) by exopolymeric substances (EPS) extracted from activated sludges and pure bacterial strains: Modeling of the metal/ligand ratio effect an role of the mineral fraction. Bioresource Technology, 100: 2959-2968.
Kato, J., Kim, HE, Takiguchi, N., Kuroda, A. y Ohtake, H., 2008. Pseudomonas aeruginosa as a model microorganism for investigation of chemotactic behaviors in ecosystem, Journal of Bioscience and Bioengineering, 106(1): 1-7.
Konovalova, V., Dmytrenko, G.M., Nigmatullin, R.R., Bryk, M.T. y Gvozdyak, P., 2003. Chromium(VI) reduction in a membrane bioreactor with immobilized Pseudomonas cells. Enzyme and Microbial Technology 33: 899-907.
Lim, P.E., Mak, K.Y., Mohamed, N. y Noor, A.M., 2003. Removal and speciation of heavy metals along the treatment path of wastewater in subsurface-flow constructed wetlands. Water Science and Technology, 48(5): 307-313
Lovley, D.R., (ed.) 2000. Environmental Microbe-Metal Interactions, American Society for Microbiology, Washington D.C.
Lu W.B., Shi J.J., Wang C.H. y Chang J.S., 2006. Biosorption of lead, copper and cadmium by an indigenous isolate Enterobacter sp. J1 possessing high heavy-metal resistance. Journal of Hazardous Materials, 134(1-3): 80-86.
Malik, A., 2004. Metal bioremediation through growing cells. Environment International, 30: 261-278.
Megharaj, M., Avundainayagam, S. y Naidu, R., 2003. Toxicity of hexavalent chromium and its reduction by bacteria isolated from soil contaminated with tannery waste. Current Microbiology 47: 51-54.
Méndez, N., Ramírez, S., Ceretti, H., Zalts, A., Candal, R. y Vullo, D.L., 2009. Pseudomonas veronii 2E surface interactions with Zn(II) and Cd(II), en redacción.
Muyzer, G., De Waal, E. y Uitterlinden, A., 1993. Profiling of Complex Microbial Populations by Denaturing Gradient Gel Electrophoresis Analysis of Polymerase Chain Reaction-Amplified Genes Coding for 16S rRNA, Applied and Environmental Microbiology, 59: 695 – 700
Nkhalambayausi-Chirwa, E.M. y Wang, Y., 2001. Simultaneous chromium (VI) reduction and phenol degradation in a fixed-film coculture bioreactor: reactor performance. Water Research 35(8): 1921-1932.
Pal, A. y Paul, A.K., 2008. Microbial extracellular polymeric substances: central elements in heavy metal bioremediation. Indian Journal of Microbiology, 48: 49-64.
Pandey, G. y Jain, R.K., 2002. Bacterial chemotaxis toward environmental pollutants: role in bioremediation, Applied and Environmental Microbiology, 68(12): 5789-5795.
Perumbakkam, S., Hess, T.F. y Crawford, R.L., 2006. A bioremediation approach using natural transformation in pure-culture and mixed-population biofilms. Biodegradation 17: 545-557.
Polti, M. , Amoroso, M. y Abate, C, 2007. Chromium (VI) resistance and removal by actinomycete strains isolated from sediments, Chemosphere 67: 660-667.
Singh, R., Paul, D. y Jain, R.K., 2006. Biofilms: Implications in bioremediation, Trends in Microbiology, 14(9):389-397.
Thacker, U., Parikh, R., Shouche, Y. y Madamwar, D., 2007. Reduction of chromate by cell-free extract by Brucella sp. Isolated from Cr(VI) contaminated sites. Bioresource Technology 98:1541-1547.
Tsuneda, S. Aikawa, H., Hayashi, H. y Hirata, A., 2004. Significance of cell electrokinetic properties determined by soft-particle analysis in bacterial adhesion onto a solid phase, Journal of Colloid and Interface Science, 279: 410-417.
Valls, M. y de Lorenzo, V., 2002. Exploiting the genetic and the biochemical capacities of bacteria for the remediation of heavy metal pollution. FEMS Microbiology Reviews 26:327-338.
van Veen, E., Burton, N., Comber, S. y Gardner, M., 2002. Speciation of copper in sewage effluents and its toxicity to Daphnia magna. Environmental Toxicology and Chemistry, 21: 275-280.
Vijayaraghavan K, Jegan J, Palanivelu K. y Velan M., 2005. Biosorption of copper, cobalt and nickel by marine green alga Ulva reticulata in a packed column. Chemosphere. 60(3):419-26.
Vullo, D., Ceretti, H., Daniel, M.A., Ramírez, S. y Zalts, A., 2008. Copper, cadmium and zinc biosorption by Pseudomonas veronii 2E, Bioresource Technology 99: 5574-5581.
Zoubolis, A.I., Loukidou, M.X. y Matis, K.A., 2004. Biosorption of toxic metals from aqueous solutions by bacteria strains isolated from metal-polluted soils. Process Biochemistry, 39: 909-916.
|
|
Revista QuímicaViva Número 2, año 8, Agosto 2009 quimicaviva@qb.fcen.uba.ar |