Rol biológico del selenio en el humano
Héctor Hernández-Mendoza1*, María Judith Rios-Lugo2
1Centro de Investigaciones Energéticas, Medioambientales y Tecnológicas, Avda. Complutense 22, 28040 Madrid, España, E-mail: hector.hernandez@ciemat.es
2Departamento de Bioquímica y Biología Molecular III, Facultad de Medicina, Universidad Complutense de Madrid, Av. Complutense s/n, 28040 Madrid, E-mail: jud_rl@yahoo.com
*Autor para correspondencia:
Teléfonos: + 34 + 91 346 6206
Fax: + 34 + 91 346 6121
Resumen
Desde década de los 70, los esfuerzos en ensayos clínicos con selenio en diferentes centros aplicados a la salud y nutrición humana, han llegado a la conclusión de que el selenio es un elemento esencial en la dieta humana, principalmente en la prevención de muchas enfermedades que no tienen cura definitiva, entre las que se destacan; cáncer, virus de la inmunodeficiencia humana (HIV) y complicaciones cardiovasculares. Este trabajo es una pequeña revisión sobre las propiedades antioxidantes y anticancerígenas en humanos, además de conocer aspectos principales funciones del selenio y rol biológico en el humano.
Palabras claves: Selenio en humanos; seleno-enzimas; selenoproteínas; suplementos nutricionales.
Biological role of the selenium in the human
Abstract
Since the 70’s decade the efforts in different clinical tests with selenium in center applied to the health and human nutrition, have reached conclusion that the selenium is an essential element in the human diet. Participating mainly in prevention of many diseases that they do not have definitive cures. Among them: cancer, AIDS and cardiovascular complications. This work is a brief revision of the anti-carcinogenic and antioxidants properties of selenium in humans and its biological roll in human beings.
Key words: Selenium; human; seleno-enzymes; selenoprotein; nutritional supplements.
1. Introducción
En la naturaleza, el selenio se encuentra ampliamente distribuido en forma de seleniuro combinado con elementos pesados y en menor proporción como elemento libre asociado con azufre elemental e hidrógeno. A su vez, el selenio presenta varios estados de oxidación, formando gran variedad de compuestos inorgánicos y orgánicos, siendo su química compleja en el medioambiente y en los sistemas vivos (Tabla. 1). En el humano [1,2], el selenio ha sido reconocido como elemento esencial en el mantenimiento de las funciones fisiológicas en el organismo, que a su vez, debe ser ingerido en la dieta humana en concentraciones del orden de 70 µg/día en el caso de déficit de selenio [3]. Su disminución o aumento de concentración puede provocar deficiencias [4] o efectos tóxicos [5]. Es por ello que, los efectos beneficiosos del selenio siempre están relacionados con el contenido de selenoproteínas o enzimas dependientes de selenio en el organismo [6-15]. Las fuentes principales del selenio es la ingesta de alimentos que proceden de la dieta diaria y los suplementos nutricionales enriquecidos con selenio [4,16-19], la forma en que se aportan el selenio en este tipo de alimento es unido a proteínas (selenoproteínas de bajo peso molécular, <10 KDa). En la estructura de la selenoproteína, tiene uno o varios átomos de selenio que reemplaza el azufre de los aminoácidos cistina, cisteína y metionina, dando lugar a especies orgánicas de selenio como selenocistina (SeCys2) [20], selenocisteína (SeCys) [21-22], selenometionina (SeMet) [23-24], metil-selenocisteína (CH3SeCys) y seleno-metil-selenocisteína (SCM) [25-26]. En la actualidad estas especies son el objetivo de numerosas investigaciones en el campo del la salud humana, ya que presentan propiedades antioxidantes y anticancerígenas [10,13,14,27-29].
La determinación de selenio en fluidos corporales como; orina, heces, sangre, secreciones biológicas, se basan en técnicas de espectroscopía atómica, en concreto en técnicas como espectrometría de absorción atómica (AAS) [30-34], espectrometría de emisión atómica (AES) [35-36] y espectrometría de fluorescencia atómica (AFS) [37-39] que han resultado asequibles por su bajo costo y por su alta precisión. Sin embargo, la técnica de espectrometría de masa con plasma acoplado por inducción (ICP-MS) ha tenido un papal evidente en la identificación de especies orgánicas de selenio por su alta sensibilidad y amplio rango dinámico. Los limites de detección del ICP-MS, puede llegar a niveles inferiores de ng/L en diferentes muestras biológicas [35,40-42], por lo que se puede afirmar que su sensibilidad en la determinación multielemental es incomparable con otras técnicas analíticas en el análisis clínico.
Tabla.1. Principales especies de selenio en medioambiente y seres vivos (inorgánicos y orgánicos) [1,4,11,15,20,52,61].
2. Rol biológico del selenio y selenoproteínas en el humano
Los primeros estudios con selenio en seres vivos fue en la década de los 50 por Schawarz y Foltz [43], los estudios consistieron en la administración de selenio en ratas con necrosis hepática por déficit de vitamina E. Sus resultados demostraron que el selenio tiene una función antioxidante, debido a la reducción de la necrosis hepática en las ratas. Sin embargo, no fue hasta el año 1973, cuando se comprobó la función reductora de la especie SeCys2 presente en la enzima glutationa peroxidasa (GSHPx) [44]. A partir de ese momento, se han hecho varios ensayos clínicos en humanos con el fin de identificar las funciones fisiológicas y bioquímicas presentes en el organismo (Tabla. 2) [45-51], dichas funciones guardan una estrecha relación con los niveles adecuados de selenoproteínas y enzimas dependiente de selenio en varios órganos vitales (cerebro, sistema endocrino y reproductor) [52-58]. En estos órganos los niveles de enzimas dependiente de selenio como la GSHPx [8,53], Yodotrina iodinasa (ID) [58] y tiorredoxina reductasa (TR) [56-57] pueden ser normales en estados carenciales moderados de selenio, por lo que su función biológica permanece estable, mientras tanto, los niveles de selenoproteína P (Sel P) disminuyen notablemente su actividad biológica [12], afectando principalmente a órganos como el hígado, los músculos esqueléticos y el corazón que presentan lesiones ante niveles carenciales de selenio [59]. La ingestión de complementos nutricionales con selenio, pueden revertir esta situación, provocando que las selenoproteínas y enzimas dependientes de selenio se normalicen [3,4]. Hoy en día, se han identificado entre 30 y 50 especies orgánicas que contienen selenio fuertemente fijado a ellas [60-62]. En el humano, solamente algunas seleno-enzimas y selenoproteínas se han caracterizado como dependientes de selenio por el rol biológico presente en el mantenimiento y funcionamiento del hombre, ya que estas especies de selenio pueden ayudar a combatir varías enfermedades, entre la que destacan, varios tipos cáncer [15,25-28], HIV [8] y complicaciones cardiovasculares [11].
Tabla. 2. Principales funciones filológicas y bioquímicas presentes en el humano cuando hay un aumento en la ingestión de complementos nutricionales con selenio.
3. La incorporación del selenio a proteínas
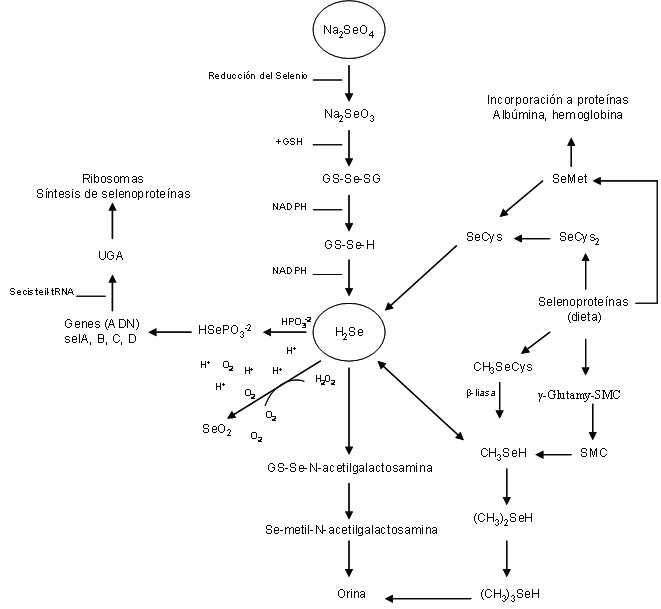
El selenio inorgánico (Na2SeO4, NaSeO3) se incorpora en el hombre mediante la GSHPx que reduce el selenio hasta llegar a seleniuro de hidrógeno (H2Se), éste suprime radicales libres hasta su bioeliminación (Figura. 1) o se combina con grupos fosfatos formando fosfato de selenio hidrogenado (HSePO3-2) para la síntesis de nuevas selenoproteína [21-22]. En resumen, la síntesis de especies SeCys a partir HSePO3-2 dentro de la célula implica cuatro genes del RNASec (selA, selB, selC, y selD). El gen selC codifica la serina; el gen SelA convierte serina a cisteína; el gen selD es el donador de selenio, y el gen selB es el factor de la traducción que reconoce el selenocisteil-tRNA. Este último lo entrega al codón de iniciación UGA del RNAm para la síntesis de la SeCys [21]. La especie SeCys2 se incorpora de forma específica reduciéndose a SeCys que tiene una estructura igual a la cisteína, diferenciándose únicamente en que un átomo de selenio que remplaza al azufre del aminoácido y la especie SeCys se incorpora reduciéndose a seleniuro de hidrógeno (H2Se). La especie SeMet se incorpora por vías no específica homeostáticamente, dado que el tRNAMet no discrimina entre metionina y SeMet, está se incorpora de manera no específica a proteínas, tales como, la albúmina y hemoglobina para sustituir a la metionina. La SCM se hidroliza obteniendo la SeCys y el metil-selenio, éste último es el más eficiente en la protección contra el cáncer [26].
4. Enzimas dependientes de selenio
Glutatión peroxidasa (GSHPx)
El papel fisiológico principal de las enzimas GSHPx es antioxidante (acción similar a la vitamina E), disminuye los niveles de concentración de las especies de oxígeno reactivas (ROS) y de las especies de oxigeno y nitrógeno reactivas (RNOS) evitando el daño oxidativo a membranas plasmática. Actualmente, se han descrito cuatro isoformas de la GSHPx en el humano idénticas (tiene peso molecular entre 88 y 107 kDa) y cada una tiene un residuo de SeCys, la glutatión peroxidasa citosólica (cGSHPx), glutatión peroxidasa plasmática (plpGSHPx), fosfolípido hidroperóxido glutatión peroxidasa (phGSHPx) y glutatión peroxidasa gastrointestinal (giGSHPx). La cGSHPx fue la primera enzima dependiente de selenio que se identificó en ratas, conejo, ratón y humano mediante la secuenciación de cDNA, estas comparaciones en estos organismos vivos con el humano reveló que al menos hay un 85-95% de homogeneidad en la secuencia primaria de la enzima [63], donde se ha encontrado una acumulación de aminoácidos aromáticos e hidrofóbicos cerca del sitio activo (SeCys), localizado en la posición 45 sobre la superficie de la subunidad [64]. La función biológica de esta enzima es la protección de la oxidación y peroxidación de los ácidos grasos insaturados y de la que proviene del metabolismo celular (radicales libres). Su localización está asociada a la membrana celular [52]. La enzima plpGSHPx fue aislada en plasma de humano en 1987 [65], su lugar de acción se encuentra en riñón [66] y pulmón [67]. Su estructura es distinta a cGSHPx, ya que es una proteína de secreción que se libera al plasma [67], dentro de su función se encuentra en los tejidos evitando los peróxidos circulantes. La phGSHPx es una enzima que depende directamente de los niveles de selenio en la célula, lo que indica que su principal función es antioxidante. Su localización de esta enzima está estrechamente asociada con las membranas intracelulares debido a que tiene una alta afinidad sobre los hidroperóxidos en este lugar [68]. La enzima giGSHPx fue caracterizada en 1993 [69] y aislado de células de hepatoma , en células y tejido de carcinoma mamario humano. Su función podría estar relacionada con los hidroperóxidos lipídicos ingeridos con la dieta.
Tioredoxina reductasa (TR)
En su estructura contiene dos residuos de SeCys (peso molecular 11 kDa) y se han identificado tres isoformas idénticas, la tioredoxina, la ditio-proteína y la TR [56-57]. Esta última es la enzima que se encuentra distribuida ampliamente en varios tejidos. Dentro de sus principales funciones destacan; en la regulación de procesos redox–dependientes intracelulares, en los factores de la transcripción para el control redox de grupos tioles, en los mecanismos de reparación de la síntesis del DNA, actúa como coenzima para cataliza nicotiamida-adenina dinucleotido fosfato hidrogenado (NADPH) dependiente de la reducción de la tiroxina y estimula la proliferación de las células normales [70].
Yodotrina iodinasa (ID)
En su estructura contiene un residuo de SeCys y se ha identificado tres isoformas (peso molecular 30 kDa), la deiodinasa tipo 1 (D1), la deiodinasa tipo 2 (D2) y la deiodinasa tipo 3 (D3) [58,71]. Todas ellas son enzimas microsomales, transmembránica con la porción catalítica (carboxilo termina) en el citosol [72] y se encuentra asociada a la membrana celular. Dentro de sus principales funciones, es la vinculación con la síntesis y metabolismo de las hormonas tiroideas (remueve un átomo de yodo (5´) de la tiroxina transformándola en 3,4,3´-triodotironina), ya que se sabe que la hormona triyodotironina (T3) biológicamente activa es sintetizada por hormona tiroxina (T4), que a su vez depende de enzimas deiodinasa.
Glutaredoxina
Hasta el momento no se ha caracterizado su secuenciación de aminoácidos. Sin embargo, esta enzima cataliza la reducción de disulfuro dependientes del enzima glutationa (GSH) y unido a la TR. Además es un donador de electrones para plGSHPx reduciendo los hidroperóxidos en membrana celular [70].
Selenofosfato-sintetasa SPS2
Esta enzima esta fue caracterizada por primera vez en bacterias [22], su peso molecular es de 50 kDa y en su estructura tiene un residuo de SeCys, dentro de sus funciones conocidas es necesaria para la síntesis de HSePO3-2 y selenocisteína, lo que indica que es esencia en la síntesis de nuevas selenoproteína.
5. Selenoproteínas
Selenoproteína P (Sel-P)
Es la selenoproteína contiene de nueve a doce residuos de SeCys (peso molecular 57 kDa) y es la más abundante en sangre y plasma [54,55,74], lo que indica que 60-80% del selenio se encuentra en estos dos especimenes biológicos. La función de esta selenoproteína es antioxidante y actúa como una proteína de transporte. Además esta selenoproteína sirve como marcador biológico al igual que la enzima GSHPx en el déficit de selenio. Se puede expresa en células endoteliales arteriales y hepáticas.
Selenoproteína de la cápsula espermática (Sel CME)
Es también es llamada como selenoproteína-34KDa, se ha identificado en espermatozoides de rata [74], en su estructura contiene más de una SeCys, debido a que la secuencia las proteínas que participan en el movimiento del espermatozoide que tiene dieciocho a veinte residuos de cisteína, lo que indica la afinidad del selenio y sus efectos adversos sobre los espermatozoides cuando hay un déficit de selenio [75].
Selenoproteína W (Sel-W)
Es una proteína que se identificado en humano, pero si en músculo esquelético y miocardio en rata [76]. En su estructura contiene con un residuo de SeCys y se identificado cuatro isoformas confirmando su actividad antioxidante en rata (peso molecular 8 kDa), hasta el momento no tiene una función conocida en el humano, pero se cree que tiene una posible función redox.
Selenoproteínas de peso molecular variado [4,20,29].
La selenoproteína-15kDa está localizada en células epiteliales de la próstata ventral, se opina que tiene una función redox similar a la GPx4 y que posee una acción protectora de las células secretoras frente al carcinoma Selenoproteína-18 es localizado en riñón y otros órganos, sea identificado como una proteína de reserva de selenio.
6. Déficit de selenio y suplementos nutricionales enriquecidos con selenio como alternativa
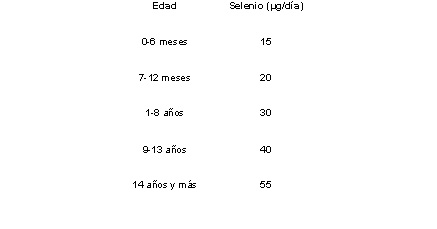
La incorporación del selenio en los seres humanos proviene fundamentalmente de la dieta (carne, pescado, leche, queso, mariscos, frutas, vegetales y cereales). En el caso de los vegetales (principales bioacumuladores de selenio), el contenido de selenio está relacionado con su concentración en el suelo. Existen regiones cuyo contenido de selenio es notablemente bajo, entre las que destacan países con regiones áridas como Australia [77], Corea del Norte, China central, Nepal, Tíbet, África central y particularmente la República Democrática de Congo [78], donde la ingestión de complementos nutricionales con selenio, pueden ser una alternativa en el déficit de selenio en el organismo. Los niveles bajos de selenio en el hombre pueden originar entre otras enfermedades como la Keshan (cardíaca) que afecta principalmente a niños , mujeres embarazadas y en lactancia con una mortalidad del 50% si no se trata a tiempo. Esta enfermedad fue detectada por primera vez en la provincia de Keshan, China (11) y en la actualidad puede prevenirse administrando selenio en la dieta. Otra enfermedad es es la de y la Kashin-Beckse (ósea) que se caracteriza por la rigidez simétrica, tumefacción y dolor de las articulaciones interfalángicas de los dedos, las rodillas y los tobillos.(79). La normalización de la ingesta diaria de selenio que recomienda el Comité de Nutrición y Alimentos del Instituto de Medicina (Food and Nutrition Board of the Institute of Medicine) basarse en la edad (Tabla. 3) [79].
Tabla. 3. Concentración de selenio en la ingesta diaria que recomienda el Comité de Nutrición y Alimentos del Instituto de Medicina (Food and Nutrition Board of the Institute of Medicine)
Por otra parte, M.P Rayman [3,4,51] reconocida especialista en el tema, ha recomendado una ingesta diaria de selenio, teniendo en cuenta factores como el país de origen, la edad y el sexo. Además varios estudios clínicos en humanos por otros especialistas en el tema, han recomendado en el caso que hay una deficiencia de selenio en la ingesta diaria una dosis entre 70-100 µg/día de selenio [49,50,77]. En la actualidad el desarrollo de suplementos alimenticios enriquecidos con selenio se están investigando, ya que presenta una alternativa en la prevención de varias enfermedades citas anteriormente. Las levaduras como Saccharomyces cerevisiae enriquecidas han sido las más estudiada en diferentes centros de investigación por su capacidad de biotransformación del selenio inorgánico a SeMet [16,81,82], ya que puede asimilar durante su crecimiento hasta 3 mg/g de selenio inorgánico. Otros biotransformadores de selenio excelente son, las plantas Allium (cebollas, ajos, brécol) [18] y la nuez Brazil nuts [17]. Esta última puede biotransforma hasta 35 µg/g de selenio inorgánico [17]. Por otra parte, los estudios realizados por Andreani et al [83] en bacterias, ha demostrado que el selenio es esencial para las lactobacilos, en especifico las especies Lactobacillus rhamnosus y Lactobacillus fermentum, donde el selenio tiene un papel funcional en la estimulación enzimática de estos microorganismos. Actualmente, se ha abierto la posibilidad de realizar nuevos alimentos enriquecidos con selenio principalmente en lactaos y su derivados por su rápida biotransformación del selenio a selenoproteínas [19, 84].
7. Toxicidad del selenio
El selenio es tóxico en humanos cuando la exposición se prolonga a dosis altas [5]. Sus efectos tóxicos se conocen desde hace mucho tiempo y depende de factores como la forma química, la concentración y las posibles transformaciones que puedan sufrir en su interacción con el medio ambiente. Las formas orgánicas de los elementos por ejemplo, arsénico, mercurio y estaño, suelen considerarse más tóxicas que las especies inorgánicas, por su naturaleza lipofílica, al poseer mayor facilidad para difundir rápidamente a través de las membranas celulares. Sin embargo, muchas especies orgánicas de selenio son esenciales y forman parte de las proteínas (SeMet, SMC y SeCys2), por lo que su toxicidad potencial es nula. Dentro de las formas inorgánicas, el selenio elemental parece ser el menos tóxico por ser el más insoluble y por tanto difícilmente asimilable por los organismos. Las especies selenito y seleniato presentan toxicidad semejante, otorgándoseles propiedades mutagénicas. En el humano se desconocen los niveles exactos para producir intoxicación crónica, pero cantidades del orden de 2-8 mg/kg son capaces de producir graves lesiones. Se han registrado varios casos de envenenamiento por selenio con un consumo dietético de 5 a 27 mg/kg [5], o por exposición industrial a seleniuros, dióxidos de selenio y oxicloruro de selenio. Los síntomas de selenosis por inhalación son mareos e irritación de las membranas mucosas. Cuando la exposición es elevada produce acumulación de líquido en los pulmones, bronquitis, neumonía, fiebre, dolor de garganta, conjuntivitis, vómitos, dolores abdominales, diarrea y expansión del hígado. Cuando es ingerido puede producir pelo quebradizo y uñas deformadas, sarpullidos, calor, hinchamiento de la piel, dolores agudos. Por último, la bioeliminación del selenio ingeridos por la dieta humana es por vía urinaria en forma metilada ((CH3)Se+) o acetilada (acetilgalactosaminado) (Figura. 1). Sin embargo, cuando hay una exposición tóxica, las vías secundarias a la bioeliminación del selenio pueden ser por heces, secreciones biológicas, uñas y pelo.
Figura. 1. Proceso de incorporación del selenio inorgánico (Na2SeO4, NaSeO3, Se-2), metabolismo de selenoproteínas y síntesis de selenoproteínas a partir de HSePO3-2.
8. Conclusiones
Los beneficios del selenio en humanos son más que evidentes. Las seleno-enzimas y selenoproteínas reducción de especies de oxígeno reactivas (ROS), especies de oxigeno y nitrógeno reactivas (RNOS), el cual disminuye el daño a membranas y otras estructuras de la célula por radicales libres. Además actúan en la reducción de la peroxidación de los lípidos y grupos sulfhídrico de la membrana celular. Por tanto, el selenio ayuda ha prevenir y mantener las funciones fisiológicas en enfermedades que tengan un elevado nivel de estrés oxidativo como cáncer, HIV y complicaciones cardiovasculares.
9. Referencias
[1] Brown KM, Arthur JR. Selenium, selenoproteins and human health: A review. Public Health Nutr. 2001;4(2B):593-599.
[2] Arthur JR, McKenzie RC, Beckett GJ. Selenium in the immune system. J Nutr. 2003;133(5 SUPPL. 2):1457S-1459S.
[3] Rayman MP. The argument for increasing selenium intake. Proc Nutr Soc. 2002;61(2):203-15.
[4] Rayman MP. The importance of selenium to human health. Lancet, 2000; 356:233-241.
[5] Yang GQ, Wang SZ, Zhou RH, Sun SZ. Endemic selenium intoxication of humans in China. Am. J Clin Nutr. 1983;37:872-881.
[6] Broome CS, McArdle F, Kyle JAM, Andrews F, Lowe NM, Hart CA, Arthur JR , Jackson M.J. An increase in selenium intake improves immune function and poliovirus handling in adults with marginal selenium status. Am. J Clin Nutr. 2004;80(1):154-162.
[7] Manzanares CW. Selenium in critically ill patients with systemic inflammatory response. Nutr Hosp. 2007; 22(3):295-306.
[8] Look MP, Rockstroh JK, Rao GS, et al. Serum selenium, plasma glutathione (GSH) and erythrocyte glutathione peroxidase (GSH-Px) levels inasymptomatic versus symptomatic human immunodeficiency virus-1 (HIV-1) infection. Eur J Clin Nutr. 1997;51:266 –72.
[9].Arnér ESJ, Holmgren A. Physiological functions of thioredoxin and thioredoxin reductase. Eur J Biochemistry. 2000;267(20):6102-6109.
[10] Flohé L. The glutathione peroxidase reaction: molecular basis of the antioxidant function of selenium in mammals. Curr Top Cell Regul. 1985;27:473–478.
[11] Levander OA. A global view of human selenium nutrition. Ann. Rev. Nutr, 1987;7:227-250.
[12] Saito Y, Takahashi K. Selenoprotein P: Its Structure and Functions. J Health Sci. 2000;46(6):409-413.
[13] Clark LC, Combs GF, Jr, Turnbull BW, Slate EH, Chalker DK, Chow J, et al. Effects of selenium supplementation for cancer prevention in patients with carcinoma of the skin. A randomized controlled trial. Nutritional Prevention of Cancer Study Group. JAMA, 1996;276:1957-1963.
[14] Wilke BC, Vidailhet M, Favier A, Guillemin C, Ducros V, Arnaud J, et al. Selenium, glutathione peroxidase (GSH-Px) and lipid peroxidation products before and after selenium supplementation. Clin Chim Acta. 1992;207:137-142.
[15] Brigelius-Flohé R. Selenium Compounds and Selenoproteins in Cancer- Review. Chemi Biodiv. 2008; 5(3):389-395.
[16] Pehrson B, Ortman K, Madjid N, Trafikowska U. The influence of dietary selenium as selenium yeast or sodium selenite on the concentration of selenium in the milk of Suckler cows and on the selenium status of their calves. J Anim Sci. 1999; 77: 3371-3376.
[17] Chang JC, Gutenmann WH, Reid CM and Lisk DJ. Selenium content of Brazil nuts from two geographic locations in Brazil. Chemosphere. 1995;30(4):801-802.
[18] Ip C, Lisk DJ. Enrichment of selenium in allium vegetables for cancer prevention. Carcinogenesis. 1994;15(9):1881-1885.
[19] Alzate A, Cañas B, Pérez-Munguía S, Hernández-Mendoza H, Pérez-Conde C, Gutiérrez AM, Cámara C. Evaluation of the inorganic selenium biotransformation in selenium-enriched yogurt by HPLC-ICP-MS. J Agric Food Chem. 2007; 28;55(24):9776-9783.
[20] Lockitch G. Selenium: clinical significance and analytical concepts. Crit Rev Clin Lab Sci. 1989;27:483-541.
[21] Bock A, Forchhammer K, Heider J, Leinfelder W, Sawers G, Veprek B, et al. Selenocysteine: the 21st amino acid. Mol. Microbiol, 1991; 5(3):515-520.
[22] Stadtman TC. Selenocysteine. Ann Rev Biochem. 1996;65:83-100.
[23] Rayman MP. The use of high-selenium yeast to raise selenium status: How does it measure up?. Br J Nutr 2004;94(4):557-573.
[24] Waschulewski IH, Sunde RA. Effect of dietary methionine on tissue selenium and glutathione peroxidase (EC 1.11.1.9) activity in rats given selenomethionine. Br J Nutr. 1998;60:57-68.
[25] Ip C, Dong Y. Methylselenocysteine modulates proliferation and apoptosis biomarkers in premalignant lesions of the rat mammary gland. Anticancer. Res. 2001;21(2A):863–867.
[26] Ip C, Thompson HJ, Zhu Z, Ganther HE. In vitro and in vivo studies of methylseleninic acid: evidence that a monomethylated selenium metabolite is critical for cancer chemoprevention. Cancer Res. 2000;60: 2882-2886.
[27] Lippman SM, Goodman PJ, Klein EA, Parnes HL, Thompson IM, Alan R, Jr, et al. Designing the Selenium and Vitamin E Cancer Prevention Trial (SELECT). J Natl Cancer Inst. 2005;97:94–102.
[28] Duffield-Lillico AJ, Dalkin BL, Reid ME, Turnbull BW, Slate EH, Jacobs ET, et al. Nutritional Prevention of Cancer Study Group. Selenium supplementation, baseline plasma selenium status and incidence of prostate cancer: an analysis of the complete treatment period of the Nutritional Prevention of Cancer Trial .BJUI. 2003;91(7):608-612.
[29] Holben DH, Smith AM. The Diverse Role of Selenium within Selenoproteins-A Review. J Am Diet Assoc. 1999;99:836-843.
[30] Oster O, Prellwitz W. A methodological comparison of hydride and carbon furnace atomic absorption spectroscopy for the determination of selenium in serum. Clin Chim Acta. 1982;124(3): 277-291.
[31] Tiran B, Tiran A, Rossipal E, Lorenz O. Simple decomposition procedure for determination of selenium in whole blood, serum and urine by hydride generation atomic absorption spectroscopy. J Trace Elem Electrolytes Health Dis. 1993;7(4):211-216.
[32] Moreno MA, Marin C, Vinagre F, Ostapczuk P. Trace element levels in whole blood samples from residents of the city Badajoz, Spain. Scie Total Environ. 1999;229;209-215.
[33] Tsalev DL, Lampugnani L, D'Ulivo A, Petrov Jr, I.I, Georgieva, R, Marcucci, K, et al. Electrothermal atomic absorption spectrometric determination of selenium in biological fluids with rhodium modifier compared with hydride generation atomic spectrometric techniques. Microchem J. 2001;70(2):103-113.
[34] Adányi N, Váradi M, Sziklai-László I, Snyder P, Snyder RD, Cser, MÁ. Determination of selenium balance in healthy children by AAS-hydride generation and by INAA technique. Acta Alimentaria. 2002;31(3):227-234.
[35] Shibata Y, Morita M, Fuwa K. Selenium and arsenic in biology: Their chemical forms and biological functions. Adv Biophy. 1992;28:31-80.
[36] Machát J, Kanický V, Otruba V. Determination of selenium in blood serum by inductively coupled plasma atomic emission spectrometry with pneumatic nebulisation. Anal Bioanal Chem. 2002;372(4):576-581.
[37] Wietecha-Posłuszny R, Dobrowolska J, Kościelniak P. Method for determination of selenium and arsenic in human urine by atomic fluorescence spectrometry. Anal Lett. 2006;39(15):2787-2796.
[38] Mazej D, Falnoga I, Stibilj V. Selenium determination in whole blood, plasma and selenoprotein P by hydride generation atomic fluorescence spectrometry. Acta Chim Slov. 2003;50(2):185-198.
[39] Rahman L, Corns WT, Bryce DW, Stockwell PB. Determination of mercury, selenium, bismuth, arsenic and antimony in human hair by microwave digestion atomic fluorescence spectrometry. Talanta. 2000;52(5):833-843.
[40] González LJM, Fernández Sánchez ML, Sanz-Medel A. Speciation of inorganic selenium and selenoaminoacids by on-line reversed-phase high-performance liquid chromatography-focused microwave digestion-hydride generation-atomic detection. J Anal At Spectro.1996;11(12):1163-1169.
[41] Krachler M, Alimonti A, Petrucci F, Forastiere F, Caroli S. Influence of sample pre-treatment on the determination of trace elements in urine by quadrupole and magnetic sector field inductively coupled plasma mass spectrometry. J Anal At Spectro. 1998;13(8): 701-705.
[42] Goullé J.-P, Mahieu L, Castermant J, Neveu N, Bonneau L, Lainé G. Metal and metalloid multi-elementary ICP-MS validation in whole blood, plasma, urine and hair: Reference values. Forensic Sci Int. 2005;153(1): 39-44.
[43] Schwartz K, Foltz CM. Selenium is an integral part of factor 3 against dietary necrotic liver degeneration. J Amer Chem Soc. 1957;79:3292-3293.
[44] Rotruck JT, Pope AL, Ganther HE, Swanson AB, Hafeman DG, Hoekstra WG. Selenium: Biochemical Role as a Component of Glutathione Peroxidase. Science. 1973;179:588-590
[45] Lombeck I , Kasperek K, Harbisch HD, Becker K, Schumann E , Schröter W, et al. The selenium state of children. Eur J Pediatr. 1978;128(4):213-223.
[46] Steiner G, Menzel H, Lombeck I, Ohnesorge FK, Bremer HJ. Plasma glutathione peroxidase after selenium supplementation in patients with reduced selenium state. Eur J Pediatr. 1982;138(2):138-140.
[47] Lombeck I, Menzel H, Frosch D. Acute selenium poisoning of a 2-year-old child. Eur J Pediatr. 1987;146:308-312.
[48] Persson-Moschos M, Huang W, Srikumar TS, Åkesson B, Lindeberg S. Selenoprotein P in serum as a biochemical marker of selenium status. Analyst. 1995;120:833-836.
[49] Alfthan G, Neve J. Reference values for serum selenium in various areas-evaluated according to the TRACY protocol. J Trace Elem Med Biol. 1996;10:77-87.
[50] Muntau AC, Streiter M, Kappler M, Röschinger W, Schmid I, Rehnert A, et al. Age-related Reference Values for Serum Selenium Concentrations in Infants and Children. Clin Chem. 2002;48:3 555–560.
[51] Nawrot TS, Staessen JA, Roels HA, Den Hond E, Thijs L, Fagard RH, et al. Blood pressure and blood selenium: a cross-sectional and longitudinal population study. Eur Heart J. 2007;28: 628-633.
[51] Rayman MP, Thompson AJ, Bekaert B, Catterick J, Galassini R, Hall E, et al. Randomized controlled trial of the effect of selenium supplementation on thyroid function in the elderly in the United Kingdom. Am J Clin Nutr. 2008;87: 370-378.
[52] Stadtman TC. Biological function of selenium. Nutr. Rev.1977;35:161-170.
[53] Arthur JR. The glutathione peroxidises. Cell Mol Life Sci. 2000;57:1825-1835.
[54] Burk RF, Hill KE. Selenoprotein P. A selenium-rich extracellular glycoprotein. J. Nutr. 1994;124:1891-1897.
[55] Steinbrenner H, Bilgic E, Alili L, Sies H, Brenneisen P. Selenoprotein P protects endothelial cells from oxidative damage by stimulation of glutathione peroxidase expression and activity. Free Radical Res. 2006;40(9);936-943.
[56] Park YS, Misonou Y, Fujiwara N, Takahashi M, Miyamoto Y , Koh YH, et al. Induction of thioredoxin reductase as an adaptive response to acrolein in human umbilical vein endothelial cells. Biochem Biophys Res Commun. 2005; 327:1058-1065.
[57] Hintze KJ, Wald KA, Zeng H, Jeffery EH, Finley JW. Thioredoxin reductase in human hepatoma cells is transcriptionally regulated by sulforaphane and other electrophiles via an antioxidant response element. J Nutr. 2003;133(9): 2721-2727.
[58] Beech SG, Walker SW, Beckett GJ, Arthur JR, Nicol F, Lee D. Effect of selenium depletion on thyroidal type-I iodothyronine deiodinase activity in isolated human thyrocytes and rat thyroid and liver. Analyst. 1995;120: 827-831.
[59] Patching SG, Gardiner PHE. Recent developments in selenium metabolism and chemical speciation: a review. J Trace Elem Med Biol. 1999;13:193-214.
[60] Köhrle J, Brigelius-Flohé R, Böck A, Gärtner R, Meyer O, Flohé L. Selenium in Biology: Facts and Medical Perspectives. Biol Chem. 2000;381:849–864.
[61] Sunde RA. Molecular biology of selenoproteins. Ann. Rev. Nutr, 1990;10: 451-474.
[62] Sunde RA. Intracellular glutathione peroxidases-structure, regulation and function. In Selenium in Biology and Human Health, ed. RF Burk. New York, Springer-Verlag, 1994; 45-77.
[63] Reddy AP, Hsu BL, Reddy PS, Li NQ, Thyagaraju K, Reddy CC, et al. Expression of Glutathione peroxidase I gene in selenium-deficient rats. Nucleic Acids Res. 1988;16:5557-5568.
[64] Ladenstein R, Wendel A. Crystallographic data of the selenoenzyme glutathione peroxidase. J Mol Biol. 1976;104:877-889.
[65] Ursini F, Maiorino M, Roveri A. Phospholipid hydroperoxide glutathione peroxidase (PHGPx): more than an antioxidant enzyme? Biomed Environ Sci. 1997;10:327-332.
[66] Avissar N, Ornt, DB, Yagil Y, Horowitz S, Watkins RH, Kerl EA, Takahashi K, Palmer IS, Cohen HJ. Human kidney proximal tubules are the main source of plasma glutathione peroxidase. Am J Phys. 1994b;266:C367-C375.
[67] Takahashi K, Akasaka M, Yamamoto Y, Kobayashi C, Mizoguchi J, Koyama J. Primary structure of human plasma glutathione peroxidase deduced from cDNA sequences. J Biochem. 1990;108:145-148.
[68] Weitzel F, Wendel A. Selenoenzymes regulate the activity of leukocyte 5-lipoxigenase via the peroxide tone. J Biol Chem. 1993;268:6288-6292.
[69] Chu FF, Doroshow JH, Esworthy RS. Expression, characterisation and tissue distribution of a new cellular selenium-dependent glutathione peroxidase, GSHPx-GI. J Biol Chem. 1993;268:2571-2576.
[70] Bjornstedt M, Kumar S, Bjorkhem L, Spyrou G, Holmgren A. Selenium and the thioredoxin and glutaredoxin systems. Biomed Environ Sci. 1999;10:271-279.
[71] Reed Larsen P. Mammalian type 2 deiodinase sequences: finally, the end of the beginning. J Clin Invest. 1996;98:242-243.
[72] Toyoda N, Berry MJ, Harney JW, Reed Larsen, P. Topological analysis of the integral membrane protein type 1 iodothyronine deiodinase (D1). J Bioch Chem. 1995;270:12310-12318.
[73] Hill KE, Burk RF. Selenoprotein P - an extracellular protein containing multiple selenocysteines. En: Selenium in Biology and Human Health, [R.F. Burk, ed.]. New York: Springer-Verlag. (1994),117-131.
[74] Calvin HI, Grosshans K, Musicant-Shikora SR, Turner SI. A developmental study of rat sperm and testis selenoproteins. J Repr Fert. 1987;81:1-11.
[75] Arthur JR, Beckett GJ. Symposium 2 Newer aspects of micronutrients in at risk groups. New metabolic roles for selenium. Proc Nutr Soc. 1994;53:615-624.
[76] Vendeland SC, Beilstein MA, Chen CL, Jensen ON, Barofsky E, Whanger PD. Purification and properties of selenoprotein W from rat muscle. J. Biol. Chem, 1993;268(23);17103-17107.
[77] Tinggi U. Essentiality and toxicity of selenium and its status in Australia: A review. Toxicol Lett. 2003;137:103-110.
[78] Tapiero H, Townsend DM, Tew KD. The antioxidant role of selenium and seleno-compounds. Biomed Pharmacother. 2003;57:134-144.
[79] Moreno-Reyes R, Suetens C, Mathieu F, Begaux F, Zhu D,. Rivera MT, et al. Kashin–Beck Osteoarthropathy in Rural Tibet in Relation to Selenium and Iodine Status. Engl J Med. 1998;339 (16):1112–1120.
[80] Institute of Medicine, Food and Nutrition Board. Dietary Reference Intakes: Vitamin C, Vitamin E, Selenium, and Carotenoids. National Academy Press, Washington, DC, 2000.
[81] Infante HG, Connor GO´, Rayman MP, Wahlen R, Entwisle J, Norris P, et al. Selenium speciation analysis of selenium-enriched supplements by HPLC with ultrasonic nebulisation ICP-MS and electrospray MS/MS detection. J Anal At Spectrom. 2004; 19:1529-1538.
[82] Casiot C, Szpunar J, Lobinski R, Potin-Gautier M. Sample preparation and HPLC separation approaches to speciation analysis of selenium in yeast by ICP-MS. J Anal At Spectrom.1999; 14: 645-650.
[83] Andreoni V, Luischi M.M, Cavalca L, Erba D, Ciappellano S. Selenite tolerance and accumulation in the Lactobacillus species. Ann Microbiol. 2000;5:77-87.
[84] Alzate A, Fernández-Fernández A, Pérez-Conde MC, Gutiérrez AM, Cámara C. Comparison of biotransformation of inorganic selenium by Lactobacillus and Saccharomyces in lactic fermentation process of yogurt and kefir. J Agric Food Chem. 2008; 56(18):8728-8736.
ISSN 1666-7948
www.quimicaviva.qb.fcen.uba.arRevista QuímicaViva
Número 2, año 8, Agosto 2009
quimicaviva@qb.fcen.uba.ar