El lenguaje químico de la interacción inmune-neuroendócrina
Luciana Larocca, Mario Calafat, Valeria Roca, Rosanna Ramhorst y Claudia Pérez Leirós
Departamento de Química Biológica. Facultad de Ciencias Exactas y Naturales.
Universidad de Buenos Aires-CONICET.
Ciudad Universitaria, Pab. II, 4o piso, 1428 Buenos Aires. Argentina. Tel/fax: 5411-4576-3342
Email: cpleiros@qb.fcen.uba.ar
Recibido el 30/10/08. Aceptado el 07/11/08.
Resumen
En un esquema simplificado del organismo de un mamífero que responde en forma adaptativa frente a estímulos externos, la fisiología y otras ciencias biomédicas basadas en la evidencia sostuvieron hasta mediados del siglo pasado que el sistema nervioso respondía a los estímulos neurosensoriales mientras que el sistema inmune lo hacía frente a la posible entrada de un organismo extraño. Cada uno con su identidad de células, compartimientos y mediadores, aislado del otro. Las evidencias que se describen brevemente a continuación prueban la hipótesis de una interacción química y molecular bidireccional mediada por citoquinas y neurotransmisores que pueden actuar sobre las células de ambos sistemas. Es posible ahora comprobar observaciones hechas desde los primeros registros de las ciencias de la salud sobre la relación de los estados emocionales-afectivos, con la susceptibilidad a contraer enfermedades y, en sentido inverso, acerca de la influencia de las enfermedades infecciosas sobre los estados de ánimo y conductas en una aparente interacción bidireccional. La descripción de las estrategias experimentales para acceder a ese conocimiento se privilegió por sobre los detalles de los resultados con el fin de estimular la curiosidad sobre este nuevo enfoque.
Palabras clave: neurotransmisores – citoquinas – neuroinmunomodulación - inflamación
Title: Biochemical clues to the neuroimmune cross-talk
Abstract
In a simplified scenario where a mammalian organism responds to external stimuli in an adaptive way, physiology, among other evidence-based biomedical sciences, supported the notion that nervous system was the one to reply upon neurosensitive stimuli whilst the immune system had to manage with foreign organisms. Each provided with their own signals within isolated compartments. Evidence briefly presented herein support the hypothesis of a bidirectional chemical and molecular interaction between both systems with cytokines and neurotransmitters acting on cells from either system. It seems plausible now to comprehend the rationale of early observations made on the first records of life sciences about the influence of affective states on disease susceptibility and, conversely, about the effect of infectious diseases on mood and behavior. We chose to describe more deeply the experimental strategies that led to scientific knowledge than the results obtained, in an attempt to stimulate the curiosity on this novel approach.
Key words: neurotransmitters – cytokines – neuroimmunomodulation - inflammation
Introducción
Imaginemos, por un rato nada más, que nuestro organismo es algo tan simple como un conjunto de sistemas altamente organizado que recibe estímulos externos y responde frente a ellos en forma adaptativa.
En un esquema súper-simplificado como éste, entonces, podríamos reducir las características de los estímulos externos a dos variedades principales: aquellos ligados a percepciones, sensaciones y estímulos ambientales como por ejemplo, luz, calor, dolor, que en general llamaremos neurosensoriales; y otros relacionados a potenciales “agentes con capacidad de invadir el medio interno”, como por ejemplo los microorganismos, a los que nos referiremos como inmunológicos.
Para responder a estos dos tipos de estímulos el organismo cuenta, en el esquema simple que nos propusimos, con dos sistemas: el sistema nervioso y el sistema inmunitario. El primero, con una sorprendente y apenas conocida capacidad de articular respuestas, se estructura a partir de células neuronales (neuronas) conectadas en redes que reciben y transmiten estímulos nerviosos, y células no neuronales (astrocitos, células microgliales, oligodendrogliales y ependimarias) con funciones de sostén mecánico y metabólico, revestimiento, nutrición y defensa, entre otras. Estas células se distribuyen en el sistema nervioso central y periférico manteniendo un ámbito aislado del resto de los sistemas del organismo. Tal aislamiento se debe a la disposición -formando uniones estrechas- de las células endoteliales de revestimiento de los vasos sanguíneos que irrigan el cerebro, estructura anatómico-histológica conocida como barrera hematoencefálica. Se estima que el sistema nervioso en la especie humana cuenta con un número de neuronas en el orden de 109 que se conectan por circuitos redundantes con una insospechada capacidad de almacenamiento y comunicación de la información, atributos necesarios para cumplir funciones primarias como la adaptación al medio y supervivencia así como para funciones superiores como la memoria y el aprendizaje. La transmisión de información entre estas células se da por distintos mecanismos de comunicación intercelular. Por su alto grado de especificidad, plasticidad y distribución, la comunicación más destacable entre células nerviosas es química y sus mediadores son unas moléculas llamadas neurotransmisores. Existen neurotransmisores de diversa estructura química, desde aminoácidos y aminas pequeñas a péptidos, lípidos, proteínas; incluso hace pocos años se describió la neurotransmisión mediada por moléculas inorgánicas tan simples como el óxido nítrico.
Por su parte, el sistema inmune se organiza a partir de las células inmunes que podemos agrupar en leucocitos polimorfonucleares, eosinófilos y basófilos, linfocitos T y B, monocitos-macrófagos, y algunas células más específicas de tejidos como los mastocitos. Provienen mayoritariamente de un origen embriológico distinto a las células nerviosas, sin embargo comparten con ellas características de número, especificidad en la comunicación y función cuyos detalles serán el objeto de esta revisión. Las células inmunes se comunican entre sí por medio de interacciones celulares de alta especificidad mediadas por moléculas de membrana, así como por mediadores solubles como las citoquinas y quimioquinas.
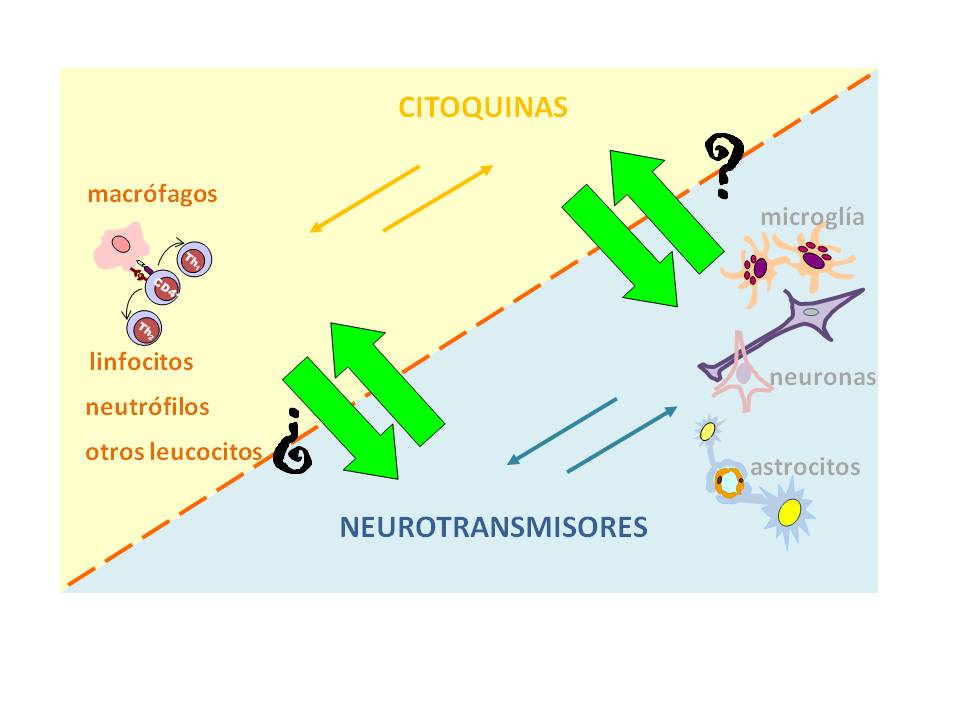
Figura 1: Citoquinas y neurotransmisores en el diálogo neuroinmune
Las células del sistema inmune como macrófagos, linfocitos y otras producen citoquinas como mediadores que actúan sobre receptores expresados en las mismas regulando la respuesta. Las células del sistema nervioso, principalmente las neuronas, liberan neurotransmisores que actúan sobre receptores en ellas y también en diversos tejidos. Flechas verdes gruesas refieren a la pregunta del título y refuerzan las evidencias acerca de las células de ambos sistemas que sintetizan y liberan los mediadores solubles del otro, y que responden a esos estímulos a través de la activación de receptores.
Volviendo al esquema simple de respuestas adaptativas frente a estímulos externos, la fisiología y otras ciencias biomédicas basadas en la evidencia sostuvieron hasta hace pocos años que el sistema nervioso respondía a los estímulos neurosensoriales mientras que el sistema inmune lo hacía frente a la posible entrada de un organismo extraño. Cada uno con su identidad de mensajeros y receptores y aislado del otro. En cuanto al estímulo provocado por microorganismos, los “potenciales invasores”, es interesante comentar que nuestro organismo –dejando ver algunos rastros de la evolución- reacciona frente a cualquier daño en la continuidad de sus “fronteras o barreras defensivas” como si este daño implicara la pérdida de la asepsia. Así, no importa si el daño de un tejido traerá aparejada o no una infección, el sistema de defensa reacciona como si la hubiere, montando una respuesta estereotipada conocida como respuesta inflamatoria. Es importante destacar que dicha respuesta es un mecanismo fisiológico, necesario para frenar procesos de daño tisular por estrés mecánico, químico o infecciones, pero que también subyace a numerosas condiciones de salud como la implantación embrionaria. Por este motivo, su tratamiento con fármacos se indica sólo cuando suscita dolor o cuando se sobrepasan los niveles de respuesta hacia una respuesta inflamatoria descontrolada o excesiva. La respuesta inflamatoria aguda o innata, además, está en la base de la respuesta adaptativa inmunitaria que concita la presentación antigénica con acción de anticuerpos y células T y B de alta especificidad.
¿Cómo ‘dialogan’ el sistema nervioso y el sistema inmune?
Desde tiempos remotos se registraron observaciones sobre la relación de los estados emocionales, afectivos –nerviosos- con la sensibilidad a las infecciones –inmunológicos- y, en sentido inverso, acerca de la influencia de las enfermedades infecciosas sobre los estados de ánimo en una aparente interacción bidireccional. Sin embargo, las evidencias científicas sobre esa interacción sólo podían intuirse con escasa evidencia probatoria. Por ejemplo, experimentos pioneros de Ader & Cohen en el paradigma del reflejo condicionado de Pavlov mostraron la modificación de algunos parámetros inmunológicos (Ader 1975). Como suele ocurrir en los descubrimientos científicos y en la adquisición y validación de conocimiento en un área determinada de las ciencias experimentales, el avance está muy relacionado con el contexto cultural y con las herramientas de conocimiento y experimentación disponibles en cada momento. Así, mientras la cultura occidental de mediados del siglo XX continuaba interesada en la comprensión del papel del lenguaje, las comunicaciones y sus códigos; en el ámbito de la ciencia se aportaba a la comprensión de los mecanismos de comunicación intercelular, los receptores, los mediadores -sus componentes bioquímicos y moleculares- con el fin de desarrollar estrategias terapéuticas para las enfermedades. Al mismo tiempo, se intentaba comprender el funcionamiento del cerebro y la decodificación de mensajes a todos los niveles: molecular, celular, orgánico e individual. Para ese momento, la inmunología había empezado a hacer avances notables en la experimentación y era posible cultivar células, aislar y medir mediadores solubles, conducir ensayos en animales de experimentación endocriados que facilitaban el análisis de especificidad, etc. Las neurociencias, para esa época, disponían de mucha y variada información sobre enfermedades que afectan al sistema nervioso, mucha menos sobre los mecanismos de enfermedad y realmente escasa acerca de la comunicación dentro del sistema nervioso central. No contaban con la posibilidad de cultivar neuronas ni analizar la neurotransmisión a un nivel celular ni molecular, menos aún en sistemas in vivo como lo permiten en la actualidad los diversos dispositivos y equipos de detección y procesamiento de imágenes del cerebro. Esto explica, en parte, que los primeros experimentos in vitro para tratar de contestar la pregunta del título fueran diseños que proveían más información inmunológica que nerviosa.
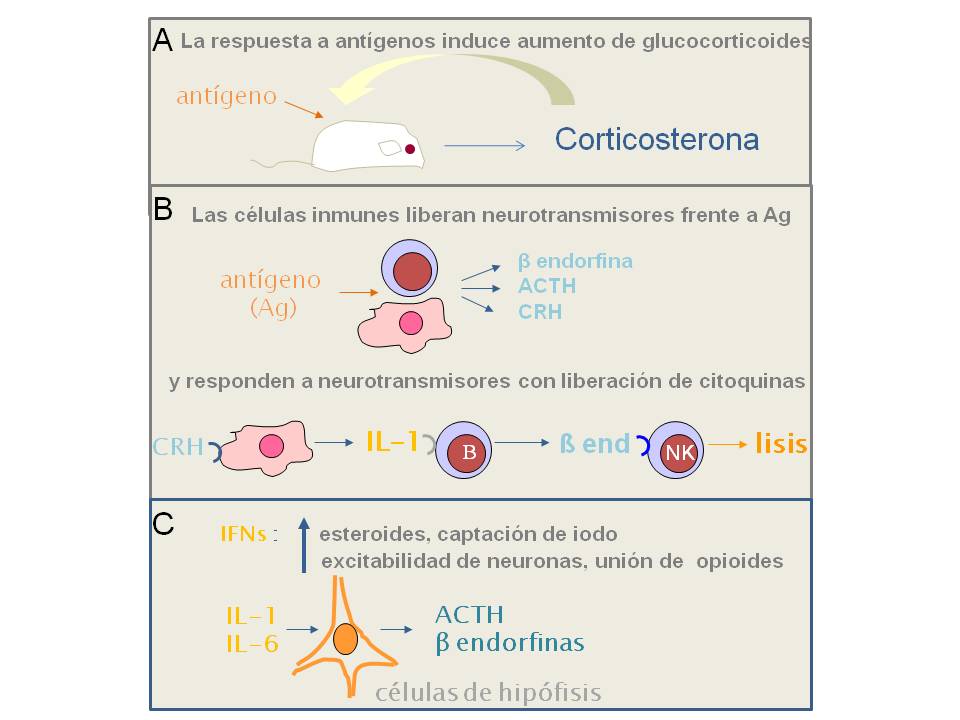
Fue justamente en la década del setenta cuando la interacción de los sistemas nervioso e inmune tuvo las primeras evidencias científicas que la respaldaran y una de las más tempranas provino de un investigador argentino trabajando en Alemania, Hugo Besedovsky (Besedovsky 1975). Besedovsky demostró que la inyección en ratones de un antígeno (eritrocitos de carnero) que conduce a una respuesta inmune sin interferencia de efectos causados directamente por microorganismos, inducía un aumento de hormonas asociadas al estrés (glucocorticoides) en la sangre (Figura 2 A). Los glucocorticoides, a su vez, tenían efecto inmunosupresor. Los autores, en el trabajo original, refieren su carácter preliminar -“These findings while admittedly preliminary, suffice to provide an indication of a temporal pattern of hormonal change during the immune response which could be important in immunoregulation”[1]-, sin embargo, estos resultados preliminares fueron fundantes de una nueva disciplina conocida como Neuroinmunoendocrinología. Tal como se dijo más arriba, a estos experimentos los sucedieron a fines de los años70 otros realizados con variados enfoques inmunológicos y bioquímicos, entre los cuales se destacan los de J. Edwin Blalock, otro de los fundadores de la disciplina (revisados en Blalock 1994). Se demostró que las células inmunes liberan neurotransmisores, que pueden responder a los mismos y que a través de esas interacciones ligando-receptor se establecen comunicaciones autocrinas y paracrinas que modulan la respuesta a un antígeno (figura 2 B).
Figura 2: Primeras evidencias de la interacción bioquímica y funcional de los sistemas inmune y neuroendocrino
Los resultados que avalaron la interacción bioquímica y funcional se relatan en el texto y se describen en detalle en las citas 6, 7 y 12. ACTH: corticotrofina u hormona adrenocorticotrófica; CRH: hormona liberadora de corticotrofina; βend: β-endorfina; Ag: antígeno; B: linfocitos B, NK: células inmunes Natural Killers; IFNs: interferones.
El grueso de la información sobre la interacción inmune-neuroendocrina estuvo dedicado al sentido de la flecha “neuroendocrino hacia inmune” durante los primeros 20 años hasta que los métodos disponibles permitieron verificar científicamente numerosas observaciones sobre los dos sentidos de esta interacción (del Rey 1996, Blalock 2002, Sternberg 2006, Cutolo 2007). Se demostró la inervación de los tejidos linfáticos, se describieron numerosos receptores para neurotransmisores en células inmunes y, en sentido inverso, se probó que las neuronas tienen receptores para citoquinas y quimioquinas y que las producen ante determinados estímulos (figura 2 C).
Uno de los puntos de vista más novedosos e interesantes que ofrece la neuroinmunoendocrinología es la comprensión de los mecanismos de enfermedad en ciertos desórdenes multifactoriales como las enfermedades autoinmunes, algunas infecciones como la enfermedad de Chagas o la tuberculosis y su proyección contribuye al estudio de muchos otros de causas desconocidas (Pérez Leirós 1997, Correa de Santana 2006, Botasso 2007). También vale comentar que una especialidad derivada de ésta es la psiconeuroinmunoendocrinología en la cual se están dando los primeros pasos hacia una concepción química y molecular de los desórdenes afectivos. Sin embargo, en nuestra opinión, este “enfoque químico-molecular” de los estados de ánimo, las conductas y las emociones -y sus trastornos- requiere mucha más evidencia científica que la que se encuentra disponible y que podrían aportar en el futuro la inmunología, la química, la biología molecular, entre otras ciencias experimentales.
Citoquinas y neurotransmisores como mediadores químicos de la interacción neuroinmunendocrina
Una vez aceptado que las citoquinas son algunas de “las palabras” del sistema inmune, los neurotransmisores las del sistema nervioso, y estos sistemas “conversan” entre sí; una de las preguntas que más convocó a los científicos fue qué citoquinas producen cambios de comportamiento y qué neurotransmisores modulan respuestas inmunes. Este objetivo entrañaba el noble propósito de buscar entre ellos posibles candidatos (u otras drogas que las mimeticen) capaces de modular funciones o enfermedades nerviosas e inmunológicas. Dado lo extenso y variado del tema, en las secciones siguientes y a modo de ejemplo elegimos comentar parte de la información disponible sobre una citoquina con acción en el sistema nervioso y la de un neurotransmisor que actúa en el sistema inmune. Entre las numerosas citoquinas que han demostrado tener algún papel en la interfase inmune-neuroendocrina haremos referencia particularmente a la interleuquina 1 (IL-1) dado su carácter de mediadora de estos sistemas tanto en procesos fisiológicos como patológicos. Para describir los resultados obtenidos vamos a empezar con el efecto IL-1 asociado a cambios de comportamiento durante estados de enfermedad y luego referiremos su papel fisiológico en la adquisición de memorias y en el aprendizaje. En otra sección comentaremos efectos inmunes de un neuropéptido, el péptido intestinal vasoactivo (VIP). Y en la última parte describiremos algunos datos acerca de la integración que hace el sistema nervioso de la información periférica asociada al inicio y desarrollo de una respuesta inmune.
Funciones neuroendocrinas de una citoquina: el caso de la interleuquina 1
La IL-1 fue descubierta en 1979 y se la describió inicialmente como uno de los primeros mediadores proteicos liberado por los macrófagos ante un estímulo inflamatorio. Tiene la capacidad de sostener la respuesta inflamatoria así como de iniciar la respuesta inmune adaptativa por su acción sobre linfocitos T con la posterior secreción de IL-2 e IFNγ. A partir de experimentos realizados en la década del 80 se la ha propuesto como una citoquina con efectos en el sistema nervioso, tanto en infecciones en el SNC como en procesos neurodegenerativos, y más recientemente como mediador fisiológico de funciones cognitivas. Las aproximaciones experimentales que se emplearon para realizar los hallazgos que comentaremos son: la administración de IL-1 recombinante a animales de experimentación; la identificación de esa citoquina en determinados circuitos, en ciertas conductas, en estados patológicos o en el tratamiento de pacientes con drogas como el interferón que genera la producción de una cascada de citoquinas; y, de desarrollo más reciente, el uso de animales en los que ha sido silenciado el gen de determinada citoquina (knock out).
Cuando responden a una infección, una de las características de los mamíferos que ha sido ampliamente descripta -y conservada en la evolución- es el estado conocido como sickness behaviour, lo que podríamos traducir como estado febril. Es el que acompaña, justamente, a muchas infecciones virales y bacterianas, en las que se manifiestan cambios de conducta como sueño, fatiga, decaimiento, anorexia, fiebre, disminución de la locomoción, de la libido y, por ejemplo en roedores, de la conducta exploratoria. En respuesta a la inyección de lipopolisacáridos (LPS), la IL-1 es de los primeros mediadores liberados en grandes cantidades por células centinelas como los macrófagos en tejidos periféricos y en el tejido nervioso por los astrocitos y células microgliales (Inui 2001). La administración de IL-1β provoca sueño, fiebre y anorexia en ratones (Licinio 1998). Con respecto a la anorexia, la IL-1β excita neuronas sensibles a glucosa del núcleo ventromedial del hipotálamo que controlan una reducción en el tamaño de las porciones ingeridas y en la duración de la ingesta (Plata-Salaman 1998). Asimismo, esta citoquina inhibe la actividad de neuronas del área hipotalámica lateral asociadas al intervalo entre ingestas. La IL-1β inyectada en ratones directamente en el SNC (inyección intracerebroventricular) causa saciedad temprana con aumento del intervalo entre comidas (Plata-Salaman 1998). La saciedad ocurre a concentraciones de la citoquina en líquido cefalorraquídeo similares a las fisiopatológicas, mientras que el cambio en la frecuencia de las ingestas requiere dosis mayores, comúnmente referidas como dosis farmacológicas. Los ratones knock out para el receptor de IL-1β no desarrollan estos signos ante la inducción de una respuesta inflamatoria (Zheng 1995). A su vez, los ratones deficientes en IL-1β resultaron resistentes a la anorexia y pérdida de peso inducidos por los terpenos de la trementina (turpentine), un compuesto que causa inflamación localizada en el sistema nervioso central (SNC), pero no así cuando se inyectaron en forma sistémica con LPS (Zheng 1995). Finalmente, los ratones deficientes en la enzima que convierte IL-1 en su forma madura y activa no mostraron anorexia cuando se les administró LPS pero sí cuando se administró la citoquina por vía sistémica, indicando que la IL-1β es una citoquina crucial para la regulación de la ingesta, particularmente cuando el estímulo está localizado en el SNC (Inui 2001). Los resultados obtenidos con experimentos similares para detectar efectos de IL-1 sobre la fiebre indican que también regula el aumento de temperatura mediado por prostaglandina E2, responsable de la fiebre inducida por la respuesta inflamatoria a la trementina (Inui 2001).
Con respecto a la relación de IL-1 con las respuestas neuroendocrinas, pueden encontrarse numerosas revisiones sobre los efectos de IL-1 en el eje hipotálamo-hipofisario-adrenal y sus mecanismos de regulación negativa (Sternberg 2006). Ciertamente, el establecimiento de una respuesta inmune pone en marcha, junto con la liberación central y periférica de IL-1, diversos procesos mediados por la síntesis y liberación de glucocorticoides por parte de la hipófisis. Estas hormonas esteroides tienen una alta potencia anti-inflamatoria y, en los niveles circulantes endógenos que se detectan a posteriori de una respuesta inmune, se ha demostrado un efecto inmunoregulador a nivel molecular con un balance de la respuesta inmune hacia un fenotipo Th2 (Liberman 2007). Además, dado que los glucocorticoides aumentan en forma sostenida durante el estrés crónico, se han aportado numerosas evidencias para explicar la asociación entre el estado de estrés crónico y la mayor susceptibilidad de contraer infecciones u otras enfermedades con un fuerte componente inmunológico como son los desórdenes autoinmunes (Marques-Deak 2005, Cutolo 2007). Este tema es revisado continuamente y también da lugar a muchas especulaciones y controversias acerca de la influencia del estrés y la respuesta inmune en situaciones clínicas para las que se están aportando un número cada vez mayor de pruebas científicas y se intentan modelos más sofisticados de conducta que las justifiquen.
En relación a los efectos de IL-1 sobre el SNC en condiciones fisiológicas, las evidencias avalan la hipótesis de un efecto modulador sobre la formación de memorias en distintos experimentos de memoria asociativa. La potenciación de larga duración (LTP) es un aumento sostenido de la transmisión y la actividad sináptica establecido por la neurofisiología como modelo para el estudio de los mecanismos que subyacen al aprendizaje y la memoria. Estudios de LTP in vivo e in vitro permitieron deducir el papel de la IL-1 endógena en aspectos relacionados con el almacenamiento de memorias. La LTP induce expresión y liberación de concentraciones fisiológicas de IL-1 en el hipocampo, mucho menores que las de una respuesta inflamatoria; la IL-1β participa en la inducción de LTP y el antagonista endógeno de IL-1, IL-1ra, bloquea dicha inducción (Schneider 1998). El efecto de IL-1 para sostener la potenciación in vivo e in vitro es a través de dar soporte metabólico a las neuronas activadas (aumenta su captación de glucosa) generando una facilitación de la plasticidad nerviosa y del procesamiento de memorias en el hipocampo (Schneider 1998, Jankowsky 2000, Avital 2003). En un modelo de consolidación de memoria asociado al aprendizaje en ratones se demostró un efecto modulador de la IL-1α endógena del hipocampo (Depino 2004). Es interesante comentar que los efectos de la IL-1 sobre la LTP son contrapuestos a los de otra citoquina, la IL-6, la cual devendría entonces en una ‘citoquina para olvidar’ según lo publicado en un trabajo que los autores han titulado “IL-6: A cytokine to forget” y donde postulan un balance fisiológico de IL-1 e IL-6 endógenas en ciertas funciones cognitivas (Balschun 2004).
Finalmente, estudios recientes confirman y extienden observaciones de 1987 acerca del efecto hipoglucemiante de la IL-1 (del Rey 1987) demostrando que la citoquina endógena en el SNC y en condiciones normales regula la homeostasis de glucosa a través de “re-setear” sus niveles en forma independiente de insulina y en respuesta a altos niveles de glucocorticoides, catecolaminas y glucagon (del Rey, 2006).
Funciones inmunes de un neuropéptido: VIP a modo de ejemplo
El VIP es un neuropéptido descripto por primera vez en 1970 con funciones prosecretorias en intestino y glándulas exócrinas (Said & Mutt 1970). VIP es el cotransmisor más importante de acetilcolina en la secreción salival y lagrimal, además tiene efectos vasodilatadores y de mantenimiento de la quiescencia uterina durante la gestación por su acción sobre el músculo liso vascular (Ekstrom 1983). Además de los efectos periféricos nerviosos del VIP se propuso un papel en el sistema nervioso central asociado al dolor. Varios años después de su descripción como neurotransmisor, se observó que VIP era el neuropéptido más abundante en el sistema inmune y que mediaba efectos anti-inflamatorios e inmunosupresores en distintos sistemas in vitro e in vivo. Así, se demostró que macrófagos estimulados in vitro con LPS simulando una respuesta inflamatoria, tenían una menor producción de citoquinas y mediadores pro-inflamatorios (IL-1, TNF, prostaglandinas) y una mayor producción de mediadores anti-inflamatorios (IL-10) cuando se pre-incubaban las células con VIP (Gomariz 2006). A su vez, se observó que las células inmunes producen VIP, se encontraron sus receptores en macrófagos y linfocitos T y se verificó su efecto sobre la respuesta inmune adaptativa in vitro. La posibilidad de utilizar este neuropéptido en el tratamiento de trastornos inflamatorios crónicos dio lugar a su ensayo en modelos experimentales de enfermedades inflamatorias estandarizados en ratones como la artritis reumatoidea inducida por colágeno o la enfermedad de Crohn por inyección de un derivado de benceno. En ambos casos el VIP demostró un potente efecto anti-inflamatorio con mejoramiento del daño de los tejidos y recuperación de funciones (Gomariz 2006). También fue ensayado en modelos espontáneos como la diabetes insulino-dependiente o tipo 1 que desarrollan los ratones de la cepa NOD (non obese diabetic) donde se probó que VIP disminuye la tasa de mortalidad y las lesiones en páncreas, en parte a través de un aumento de la respuesta Th2 y de células T regulatorias (Rosignoli 2006). En estos mismos ratones en etapas previas a la diabetes, cuando desarrollan una falla exocrina salival similar en algunos aspectos al Síndrome de Sjögren en humanos, se demostró que VIP modula negativamente la respuesta inflamatoria aunque con mecanismos de señalización intracelular distintos a los que presentan los ratones normales (Larocca 2007) (figura 3).
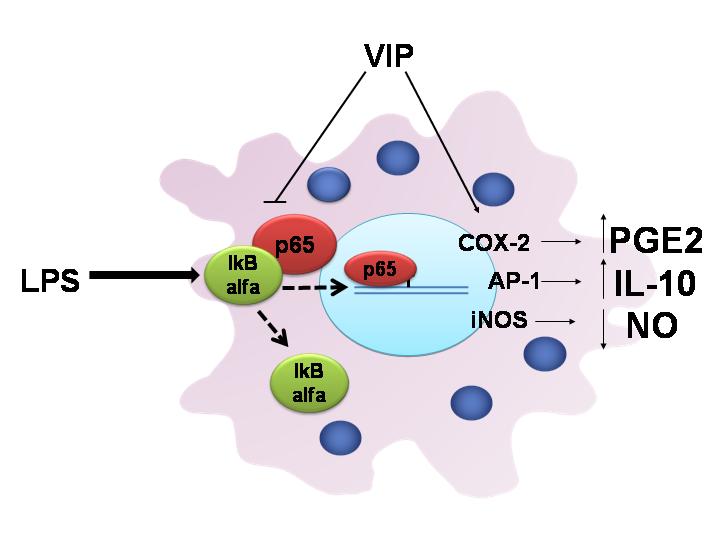
Figura 3: VIP inhibe la respuesta inflamatoria en los macrófagos de ratones NOD
El neuropéptido VIP inhibe la respuesta inflamatoria mediada por lipopolisacárido (LPS) en macrófagos aislados del peritoneo de ratones NOD (non obese diabetic). En el efecto inhibitorio de VIP sobre la producción de un mediador de la inflamación, el óxido nítrico (NO), se induce la liberación de interleuquina 10 (IL-10) y se requiere la activación de la enzima ciclo-oxigenasa 2 (COX 2) que sintetiza prostaglandina E2 (PGE2). IkB alpha, P65: (subunidades del factor nuclear NFkB): IkB es regulatoria y P65 subunidad que se transloca al núcleo y activa la transcripción de genes pro-inflamatorios, entre otros.
Consistente con estas observaciones, su administración local en las glándulas mediante una terapia génica en la etapa pre-diabética reduce los efectos de sequedad salival (Lodde 2006). Los estudios del efecto de VIP en tejidos de pacientes se encuentran aún en fases iniciales, donde se demostró un efecto antirreumático en cultivos de células sinoviales aisladas de pacientes con artritis, por ejemplo (Arranz 2008). Por el momento, basados en estos resultados, se intenta desarrollar moléculas pequeñas de diseño que mimeticen los efectos del VIP para usarlo como anti-inflamatorio, ya que el péptido como tal no reúne las condiciones de biodisponibilidad y seguridad necesarias para su uso en pacientes en forma crónica.
Algunos resultados acerca de cómo el sistema nervioso integra respuestas nerviosas e inmunes de la periferia
Gran parte de la información referida a la regulación e integración nerviosa de respuestas inmunes describe redes relativamente cortas entre el sistema inmune y el sistema nervioso periférico. Las mismas se sustentan anatómica y fisiológicamente en las evidencias comentadas antes sobre inervación nerviosa de órganos linfáticos, redes autocrinas y paracrinas con expresión de receptores y liberación de neurotransmisores o citoquinas. En cambio son más recientes las pruebas sobre redes más largas que vinculan a las respuestas inmunes con el sistema nervioso central.
En efecto, si bien la capacidad de “sentir” respuestas inmunes periféricas por parte del sistema nervioso central y responder en consecuencia era concebida en forma intuitiva, recientemente se han provisto distintas evidencias que sostienen esa hipótesis. Por un lado, se demostró mediante la expresión diferencial de c-fos, un marcador de activación neuronal, la activación de determinadas áreas y no de otras dentro del cerebro frente a respuestas inmunes periféricas del tipo injerto-contra-huésped o por inyección de ovoalbúmina (Furukawa 2004). Esto no sólo indica que el cerebro de algún modo registra el inicio y desarrollo de una respuesta inmune sino, además, que lo hace en ciertas estructuras de la corteza con mayor especificidad frente a ciertos estímulos inmunes como el aloinmune y en otras áreas cuando el estímulo es T-independiente. Más aún, el efecto en el cerebro también difiere -en cuanto a las áreas y neuronas activadas- del que causan la respuesta al LPS o al estrés apoyando su característica de especificidad y la necesidad de una síntesis endógena de citoquinas (Furukawa 2004).
Otra evidencia de la integración central de respuestas periféricas vinculadas al sistema inmune está dada por experimentos de respuestas conductuales condicionadas inducidas por estímulos gustativos apareados con la inyección de superantígenos. Se ha podido demostrar que los superantígenos bacterianos, tales como la enterotoxina B de estafilococo, inducen la proliferación de linfocitos T y la producción de IL-2 con eventos asociados como fiebre, activación del eje hipotálamo-hipofisario-adrenal como prueba de su efecto en el sistema nervioso central. Recientemente se demostró también que si estos experimentos se realizaban con un protocolo asociado a condicionamiento de la conducta, podía observarse una integración nerviosa central de la respuesta inmune (Pacheco-Lopez 2004). Así, se aparearon dos estímulos, el condicionado fue la ingestión de una sustancia activa para el gusto como es la sacarina, mientras que el estímulo no condicionado fue el superantígeno administrado por vía sistémica a ratas. Como controles se usaron ratas expuestas a la solución de sacarina pero inyectadas con solución salina en lugar del antígeno. Los animales que recibieron ambos estímulos juntos mostraron aversión al agua en los días subsiguientes con una reducción de alrededor de un 80% en el consumo, a diferencia de los controles que no habían sido inyectados con antígeno, sugiriendo que la respuesta condicionada observada se debe a la asociación entre información gustativa y el procesamiento de información inmunológica por el sistema nervioso. El mecanismo es desconocido aún pero a partir de experimentos lesionando selectivamente zonas del cerebro se propone que la amígdala podría estar involucrada. Del mismo modo, los experimentos antes descriptos sobre “encendido” de ciertas áreas de la corteza frente a estímulos inmunes dan sustento a esta proposición (Furukawa 2004, Haas 1997).
Por último, recientemente se ha propuesto un circuito de neuroinmuno-regulación que postula que las aferencias sensitivas del nervio vago inervando directamente el sitio de inflamación reciben estímulos mediados por IL-1 y otros mediadores de síntesis rápida en los macrófagos y de liberación inmediata en los mastocitos como el factor de necrosis tumoral (TNF-α) (Figura 4).
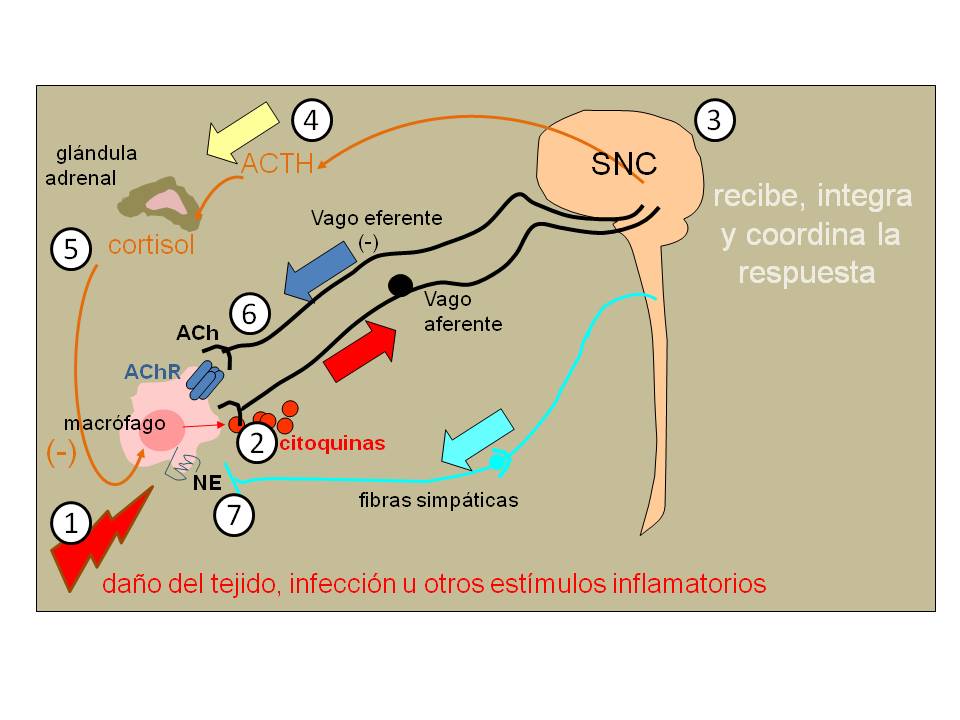
Figura 4: Regulación neuroinmunoendocrina de la respuesta inflamatoria
Ante el daño de un tejido o una infección -estímulo inflamatorio (1)-, los macrófagos residentes en los tejidos se cuentan entre las primeras células que responden y lo hacen sintetizando y liberando numerosos mediadores como por ejemplo las citoquinas inflamatorias (2). Por mecanismos poco conocidos al presente, el sistema nervioso central es capaz de registrar esta respuesta e integrar la información periférica (3) para responder por medio de varios circuitos: Por un lado, hay un aumento de la liberación de adrenocorticotrofina (ACTH) (4) a la circulación sanguínea, ésta actúa en la corteza adrenal para liberar cortisol (5) que tiene efectos anti-inflamatorios. Por otro lado, la “información de inflamación” que llega por fibras aferentes del nervio vago al SNC activa una respuesta anti-inflamatoria (-) que se conduce por fibras eferentes vagales (6) que liberan el neurotransmisor acetilcolina (ACh). La ACh liberada en la cercanía de sus receptores (AChR) presentes en la membrana de los macrófagos inhibe la síntesis de citoquinas inflamatorias. Finalmente, hay evidencias de un efecto inhibitorio de la noradrenalina (NE) liberada por terminales simpáticas sobre receptores β-adrenérgicos de los macrógafos (7).
Según el trabajo del grupo recientemente revisado por su director (Tracey 2007), estas citoquinas asociadas al inicio de la respuesta inflamatoria serían el gatillo para la transmisión de información al SNC que, tras recibir e integrar el mensaje, respondería a través de fibras eferentes del nervio vago que liberan acetilcolina. A su vez, la acetilcolina actuando sobre receptores nicotínicos en los macrófagos acotaría la respuesta inflamatoria (Bernik 2002). Este circuito no sólo se sostiene en evidencias experimentales con sistemas in vitro e in vivo, sino que además podría explicar efectos beneficiosos de algunos tratamientos anti-inflamatorios e inmunosupresores como drogas colinérgicas, la nicotina, la estimulación eléctrica vagal o la acupuntura. Ésta última se valdría de la estimulación mecánica de fibras colinérgicas que al liberar acetilcolina en sus terminales cercanas a los macrófagos reducirían la inflamación.
Consideraciones finales
La modulación inmune-neuroendocrina aporta un punto de vista integrador que permite comprender numerosas observaciones a nivel molecular, celular y conductual de fenómenos inmunes y nerviosos en individuos normales, y de las causas y consecuencias de enfermedades. El alto grado de inter-disciplina que requiere le imprime un aspecto novedoso para abordar el estudio de enfermedades inflamatorias de causa desconocida y multifactorial como así también neurodegenerativas. A la vez, la estricta interpretación de los resultados que se obtienen en cuanto a esta interacción en condiciones fisiológicas aparece como un punto de partida válido y adicional para la comprensión del funcionamiento del cerebro. Los ejemplos expuestos son una expresión mínima de la bibliografía disponible y, en cada caso, se ha privilegiado la descripción de las estrategias experimentales para acceder a ese conocimiento por sobre los detalles de los resultados, con el fin de facilitar la comprensión y estimular la curiosidad sobre este nuevo enfoque.
Agradecimientos
PIP 5638 del CONICET, UBACyT X172 de la Universidad de Buenos Aires
Referencias
1. Ader & Cohen. Behaviorally conditioned immunosuppression. Psicosom Med 37:333-340, 1975
2. Arranz A, Gutierrez Cañas J, carrion M, Juarranz Y, Pablos JL, Martinez C, Gomariz RP. VIP reverses the expression profiling of TLR4-stimulated signaling pathway in rheumatoid arthritis synovial fibroblasts. Mol Immunol 45:3065-3073, 2008.
3. Avital A, Goshen I, Kamsler A, Segal M, Iverfeldt K, Richter-Levin G, Yirmiya R. Impaired interleukin-1 signaling is associated with deficits in hippocampal memory processes and neural plasticity. Hippocampus 13: 826–834, 2003.
4. Balschun D, Wetzel W, del Rey A. Pitossi F Schneider H Zuschratter W Besedovsky H. O. Interleukin-6: a cytokine to forget. FASEB J 18: 1788-1790, 2004.
5. Bernik T, Friedman S, Ochani M, DiRaimo R, Ulloa L, Yang H, Sudan S, Czura CJ. Pharmacological Stimulation of the Cholinergic Antiinflammatory Pathway. J Exp Med 195:781-788, 2002.
6. Besedovsky HO, Sorkin E, Keller M, Muller J. Changes in blood hormone levels during the immune response. Proc Soc Exp Biol Med 150:466-470, 1975.
7. Blalock JE. The syntax of immune-neuroendocrine communication. Immunol Today 15: 504-511, 1994.
8. Blalock JE. Harnessing a neural-immune circuit to control inflammation and shock. J Exp Med 195: F25-F28, 2002.
9. Bottasso O, Bay ML, Besedovsky H, del Rey A. The immuno-endocrine component in the pathogenesis of tuberculosis. Scand J Immunol. 66:166-75, 2007.
10. Corrêa-de-Santana E, Paez-Pereda M, Theodoropoulou M, Kenji Nihei O, Gruebler Y, Bozza M, Arzt E, Villa-Verde DM, Renner U, Stalla J, Stalla GK, Savino W. Hypothalamus-pituitary-adrenal axis during Trypanosoma cruzi acute infection in mice.J Neuroimmunol. 173:12-22, 2006.
11. Cutolo M, Straub RH, Bijlsma JW. Neuroendocrine immune interactions in synovitis. Nat Clin Pract Rheumatol 3:627-634, 2007
12. del Rey A, Besedovsky HO. Immune-neuroendocrine interactions: facts and hypothesis. Endocrine Rev 17: 64-102, 1996.
13. Ekström J, Mansson B, Tobin G. Vasoactive intestinal peptide evokes secretion of fluid and protein from rat salivary glands and the development of supersensitivity. Acta Physiol Scand 119:169–75, 1983.
14. Furukawa H, yamashita A, del Rey A, Besedovsky HO. C-Fos expression in the rat cerebral cortex during systemic GvH reaction. NeuroImmunoModulation 11:425-433, 2004.
15. Gomariz RP, Juarranz Y, Abad C, Arranz A, Leceta J, Martinez C. VIP-PACAP system in immunity: new insights for multitarget therapy. Ann N Y Acad Sci 1070:51-74, 2006.
16. Haas H, Schauenstein K. Neuroimmunomodulation via limbic structures-the neuroanatomy of psiconeuroimmunology. Progr Neurobiol 51:195-222, 1997.
17. Inui A. Cytokines and sickness behavior: implications from knockout animal models. Trend Immunol 22:469-473, 2001.
18. Jankowsky JL, Derric, B E, Patterson PH. Cytokine responses to LTP induction in the rat hippocampus: a comparison of in vitro and in vivo techniques. Learn. Mem. 7: 400–412, 2000.
19. Larocca L, Calafat M, Roca V, Franchi A, Perez Leiros C. VIP limits LPS-induced nitric oxide production through IL-10 in NOD mice macrophages. Int Immunopharmacol 7: 1343–1349, 2007.
20. Liberman AC, Refojo D, Druker J, Toscano M, Rein T, Holsboer F, Arzt E. The activated glucocorticoid receptor inhibits the transcription factor T-bet by direct protein-protein interaction. FASEB J 21:1177-1188, 2007.
21. Licinio J, Kling MA, Hauser P. Cytokines and brain function: relevance to interferon a induced mood and cognitive changes. Sem Oncol 25: 30-38, 1998.
22. Lodde B. M, Mineshiba F,Wang J, Cotrim A. P, Afione S, Tak P. P, Baum B. J. Effect of human vasoactive intestinal peptide gene transfer in a murine model of Sjoqren's syndrome Ann Rheum Dis 65: 195-200, 2006.
23. Marques-Deak A, Cizza G, Sternberg E. Brain-immune interactions and disease susceptibility. Mol Psychiatry. 2005;10(3):239-50.
24. Pacheco-López G, Niemi M, Kou W, Härting M, del Rey A, Besedovsky HO, Schedlowski M. Behavioural endocrine immune-conditioned response is induced by taste and superantigen pairing. Neuroscience 129: 555–562, 2004.
25. Pérez Leirós C, Sterin Borda L, Borda ES, Goin JC, Hosey MM. Desensitization and sequestration of human M2 muscarinic acetylcholine receptors by autoantibodies from patients with Chagas’ disease. J Biol Chem 272:12989-12993, 1997.
26. Plata-Salaman CR. Cytokines and anorexia: a brief overview. Sem Oncol 25:64-72, 1998.
27. Rosignoli F, Torroba M, Juarranz Y, Garcia-Gomez M, Martinez C, Gomariz RP, Leceta J: VIP and tolerance induction in autoimmunity. Ann NY Acad Sci 1070: 525–530, 2006.
28. Said S, Mutt V. Polypeptide with broad biological activity: Isolation from small intestine. Science 169:1217-1218, 1970.
29. Schneider H, Pitossi F, Balschun D, Wagner A, del Rey A, Besedovsky HO. A neuromodulatory role of interleukin-1beta in the hippocampus. Proc. Natl. Acad.Sci. USA 95: 7778–7783, 1998.
30. Sternberg EM. Neural regulation of innate immunity: a coordinated nonspecific host response to pathogens. Nat Rev Immunol 6: 318–328, 2006.
31. Tracey K. Physiology and immunology of the cholinergic antiinflammatory pathway. J Clin Invest 117: 289-296, 2007.
32. Zheng H, Fletcher D, Kozac W. Resistance to fever induction by and impaired acute-phase response in IL-1b deficient mice. Immunity 3:9-19, 1995.
[1] Traducción del autor: Estos hallazgos, aunque admisiblemente preliminares, alcanzan para indicar un esquema temporal de regulación hormonal durante una respuesta inmune que podría se r importante en la inmunoregulación.
ISSN 1666-7948
www.quimicaviva.qb.fcen.uba.arRevista QuímicaViva
Número 3, año 7, Diciembre 2008
quimicaviva@qb.fcen.uba.ar