La entrada del virus dengue a la célula como un potencial blanco antiviral: estudio de polisacáridos sulfatados como antivirales
Laura Beatriz Talarico*
Laboratorio de Virología, Departamento de Química Biológica,
Facultad de Ciencias Exactas y Naturales, Universidad de Buenos Aires.
Ciudad Universitaria, Pabellón 2, Piso 4, 1428 Buenos Aires, Argentina.
Recibido el 30/06/08. Aceptado el 07/07/08.
Resumen
El virus dengue es un flavivirus transmitido por mosquitos del género Aedes, que ha re-emergido en los últimos años produciendo la enfermedad transmitida por artrópodos con mayor prevalencia en humanos. Actualmente, no existe una terapia antiviral específica ni vacunas para el tratamiento y la prevención de la infección por el virus dengue. En el presente trabajo se describen estudios recientes sobre diversos aspectos de la entrada viral, tales como los probables receptores celulares involucrados en la unión al virus y el mecanismo de internalización, además de potenciales agentes inhibidores de esta etapa temprana del ciclo de multiplicación. En particular, se presentan los estudios antivirales realizados in vitro con un polisacárido sulfatado, el carragenano-l, como agente anti-dengue.
Palabras clave: virus dengue, flavivirus, entrada viral, actividad antiviral, polisacáridos sulfatados
The cell entry of dengue virus as a potential antiviral target: study of sulfated polysaccharides as antivirals
Abstract
Dengue virus is a flavivirus transmitted by mosquitoes of the genus Aedes that re-emerged in recent years producing the most prevalent arthropod-borne disease in humans. Currently, there is no specific antiviral therapy or vaccines for treatment and prevention of dengue virus infection. In the present report, recent studies about diverse aspects of virus entry are described, such as probable cell receptors involved in virus attachment and the mechanism of virus internalization, as well as potential antiviral agents of this early stage of the viral multiplication cycle. In particular, in vitro antiviral studies performed with a sulfated polysaccharide, l-carrageenan, as an anti-dengue agent are presented.
Key words: dengue virus, flavivirus, virus entry, antiviral activity, sulfated polysaccharides
Introducción
El virus dengue (DENV), miembro perteneciente al género Flavivirus, familia Flaviviridae, es el patógeno que causa la enfermedad transmitida por mosquitos con mayor prevalencia en humanos. Se estima que cada año ocurren entre 50 y 100 millones de infecciones con DENV, registrándose entre 20.000 a 25.000 muertes, generalmente en niños, produciendo un fuerte impacto sanitario, social y económico en más de 100 países (1).
El virión de DENV es una partícula envuelta, de 40 a 60 nm de diámetro, que contiene tres proteínas estructurales: la glicoproteína de la envoltura (E), la proteína de la membrana (M) y la proteína de la cápside (C), esta última rodeando al genoma de ARN simple cadena de polaridad positiva. El genoma de DENV es traducido como una poliproteína que es cortada por una combinación de proteasas celulares y virales en tres proteínas estructurales y siete proteínas no estructurales (NS1, NS2A, NS2B, NS3, NS4A, NS4B y NS5) (2). Existen cuatro serotipos de DENV (DENV-1 a DENV-4) que co-circulan en regiones tropicales y subtropicales en todo el mundo y son transmitidos a humanos por dos especies de mosquitos, Aedes aegypti (vector principal) y Aedes albopictus.
La infección con DENV en humanos produce un espectro de enfermedad que puede clasificarse en distintas categorías, desde una infección asintomática o una enfermedad febril suave y autolimitada, llamada fiebre del dengue (DF, del inglés dengue fever), hasta una enfermedad severa como la fiebre hemorrágica del dengue (DHF, del inglés dengue hemorrhagic fever), caracterizada por anormalidades en la hemostasia y un incremento de la permeabilidad vascular, que en algunos casos produce el síndrome de shock por dengue (DSS, del inglés dengue shock syndrome), que puede llevar a la muerte (3). La infección primaria produce inmunidad protectora contra el serotipo infectante, pero se ha observado que la infección secuencial heterotípica aumentaría el riesgo de desarrollar DHF/DSS a través de un proceso inmunológico conocido como respuesta aumentada mediada por anticuerpos (ADE, del inglés antibody- dependent enhancement), con formación de complejos inmunes entre el virus y anticuerpos heterólogos no neutralizantes que permitirían un aumento de la infección de células monocíticas a través de la unión a receptores para el fragmento Fc del anticuerpo (4).
Tratamiento y prevención de la enfermedad
Las fallas en el mantenimiento de programas para controlar el mosquito vector han producido la reemergencia global de la infección por dengue, considerado actualmente como un serio problema para la salud pública internacional (1). A pesar de la importancia y del aumento de la incidencia de DENV como patógeno humano, no se dispone hasta el momento de vacunas preventivas ni drogas antivirales específicas para el tratamiento de las infecciones por DENV. El tratamiento sólo consiste en terapias de apoyo para reducir las consecuencias de la fiebre, deshidratación, hipotensión y hemorragias en el paciente (5, 6).
Con respecto al desarrollo de compuestos antivirales, se han estudiado diferentes clases de inhibidores por sus propiedades antivirales, principalmente en cultivos celulares debido a la dificultad en encontrar un modelo animal para DENV. El desarrollo de una quimioterapia para las infecciones por DENV requiere del conocimiento del ciclo de multiplicación viral, así como de las características estructurales y funcionales de las proteínas del virus, con el fin de dilucidar blancos potenciales para bloquear la infección y, de esta forma, obtener información para el diseño racional de compuestos antivirales. Diversos puntos, a lo largo del ciclo de multiplicación viral, están siendo objeto de estudio como potenciales blancos antivirales. Estos incluyen, inhibidores de la entrada viral, inhibidores de la síntesis de ARN, inhibidores de la proteasa viral NS3, inhibidores de la maduración e inhibidores a nivel de la expresión génica.
La entrada de DENV como blanco antiviral
El bloqueo de la entrada del virus a la célula es una estrategia antiviral interesante ya que representa una barrera para impedir la iniciación de la infección (7).
Se han descripto dos mecanismos generales de entrada de DENV a las células huésped. Uno de ellos involucraría la unión de complejos virus - anticuerpo, formados en presencia de concentraciones subneutralizantes de anticuerpo, a células conteniendo receptores Fc mediante la porción Fc de la inmunoglobulina G (8). El otro mecanismo de entrada de DENV a las células es independiente de la presencia de anticuerpos e involucra la unión de la glicoproteína E de DENV a la membrana celular.
Probables receptores celulares para DENV
Se han realizado diversos trabajos para caracterizar los probables receptores celulares para DENV en la infección primaria, que incluyen tanto proteínas como glicosaminoglicanos (GAGs), sugiriendo una dependencia en el tipo de célula huésped y el serotipo viral para la interacción inicial entre DENV y la célula blanco. Entre las proteínas descriptas como posibles receptores de DENV en células de mamífero, se encuentran proteínas susceptibles a tripsina (9), proteínas no identificadas de pesos moleculares diversos que oscilan entre 27 y 182 kDa (10-17), el receptor de 37 kDa/67 kDa de alta afinidad por laminina (18), el receptor de manosa (19), proteínas de shock térmico HSP90 y HSP70 (del inglés heat shock protein) (20), la proteína asociada al antígeno de diferenciación mieloide CD14 (21) y la proteína regulada por glucosa GRP 78 (BiP) (22). Asimismo, se ha informado que la unión de DENV a células dendríticas se produce a través de DC-SIGN (del inglés dendritic cell-specific ICAM-3-grabbing non-integrin), moléculas de adhesión intercelular específicas de este tipo de células. Estas proteínas de membrana contienen un dominio extracelular de lectina tipo C que une carbohidratos con alto contenido de manosas, presentes en la superficie del virión de DENV (23, 24). Para las células de mosquito C6/36, se identificaron proteínas de pesos moleculares entre 40 y 80 kDa (25, 26) como así también una proteína que une laminina (27) como posibles receptores de DENV.
Además de los informes de proteínas como probables receptores para DENV, se ha demostrado la participación de heparan sulfato (HS) en la unión de DENV-2 a diversas células de mamífero (28-32). HS es un GAG presente abundantemente en los proteoglicanos de la superficie celular y en la matriz extracelular de varias células. Está constituido por cadenas de carbohidratos polianiónicos formados por unidades repetitivas de disacáridos, conteniendo ácido urónico o ácido L-idurónico y un derivado de glucosamina variablemente O-sulfatado (33). Diversas sustituciones con grupos sulfato son las responsables de la alta carga negativa de HS. Se ha encontrado que varios virus interactúan con HS para la unión a las células blanco (34). Sin embargo, la interacción de DENV con GAGs se caracteriza por el requerimiento de una forma altamente sulfatada de HS (28).
En base a los trabajos descriptos sobre distintos receptores probables para DENV se ha propuesto que la interacción de DENV y el/los receptores celulares consistiría en un proceso de varios pasos, empleándose secuencialmente múltiples receptores para producirse la entrada viral (13). Debido a que diversos virus se unen a GAG y DC-SIGN, estas moléculas actuarían como la primera línea de receptores (receptores primarios) para DENV que unen grandes cantidades de virus a la superficie de las células huésped. La segunda línea de receptores (co-receptores) estaría constituida por receptores de naturaleza proteica de alta afinidad para DENV que serían los responsables del tropismo de DENV (35).
Mecanismo de entrada de DENV
Está generalmente aceptado que para una infección productiva, la entrada viral de los flavivirus se produciría a través de endocitosis mediada por receptor. Sin embargo, en algunos casos también se ha observado fusión directa en la membrana plasmática. En estudios de microscopía electrónica se mostró que DENV-2 penetró directamente en el citoplasma de células C6/36 y BHK mediante fusión de la envoltura viral con la membrana plasmática a pH fisiológico (36, 37). Trabajos recientes demostraron que la entrada viral se produciría a través de endocitosis mediada por clatrina para DENV en células HeLa y C6/36 (38-40). Otros estudios han indicado una dependencia en el colesterol de membrana para la infección por DENV-2 en ciertas células (20, 41). Asimismo, estudios funcionales y estructurales han demostrado la dependencia del pH ácido para la fusión de membranas de DENV (38-40, 42-45). Actualmente, el modo de entrada de DENV en diversos tipos celulares está siendo objeto de estudio en nuestro laboratorio.
Inhibidores de la entrada de DENV
Los diversos tipos de inhibidores de la entrada de DENV se resumen en la Figura 1. Éstos incluyen lectinas, inhibidores de la fusión viral y sustancias polianiónicas.
Figura 1. Tipos de inhibidores de la entrada de DENV.
Dentro de las lectinas, proteínas que bloquean residuos de azúcares específicos en la glicoproteína E de DENV involucrados en la interacción con los receptores celulares, se encuentran la concanavalina A y el dominio soluble de la lectina DC-SIGN que ejercieron efecto inhibitorio sobre la infección viral (23, 31).
Entre los probables inhibidores de la fusión de DENV se encuentran el clorhidrato de amantadina y el clorhidrato de rimantadina, que ejercieron actividad antiviral in vitro muy débil contra los cuatro serotipos de DENV (46, 47), la clorpromazina, que inhibió la entrada de DENV-2 por endocitosis dependiente de clatrina en células C6/36 (38), péptidos sintéticos inhibidores de la fusión (48) y derivados de tetraciclina dirigidos a la región de la proteína E involucrada en cambios conformacionales inducidos por pH necesarios para la fusión viral (49, 50).
Dentro de las sustancias polianiónicas, se ha demostrado la eficacia anti-DENV-2 en ciertas células de mamífero de los siguientes compuestos: heparina, suramin, pentosan sulfato (PPS), oligosacárido sulfatado PI-88, derivados sulfatados de a-D-glucanos naturales, galactanos extraídos de algas marinas, galactomananos y carragenanos naturales y comerciales (28, 29, 31, 32, 51-60). Estas sustancias polianiónicas actuarían como homólogos estructurales de HS, bloqueando la interacción de la glicoproteína E viral con el receptor celular HS. Se observó que este bloqueo afectó la unión y la penetración de DENV a la célula huésped (31, 58-60). También se ha demostrado el requerimiento de un mínimo tamaño de cadena equivalente al decasacárido de heparina y una alta densidad de carga negativa en los polianiones para permitir la interacción óptima entre el polianión y la proteína E (61). Otras sustancias polianiónicas inorgánicas, los polioxometalatos, resultaron ser inhibidores de la multiplicación de DENV-2 en células de mamífero, mediante una aparente interferencia en la unión del virus a la célula huésped (62).
Polisacáridos sulfatados como antivirales
Los polisacáridos sulfatados constituyen una clase de macromoléculas biológicas con estructuras diversas que presentan variadas propiedades fisicoquímicas, las cuales son la base de sus aplicaciones en el campo de la medicina y la farmacología (63). Dentro de las fuentes naturales donde se pueden aislar los polisacáridos sulfatados se encuentran las algas marinas, plantas superiores, invertebrados marinos y cianobacterias.
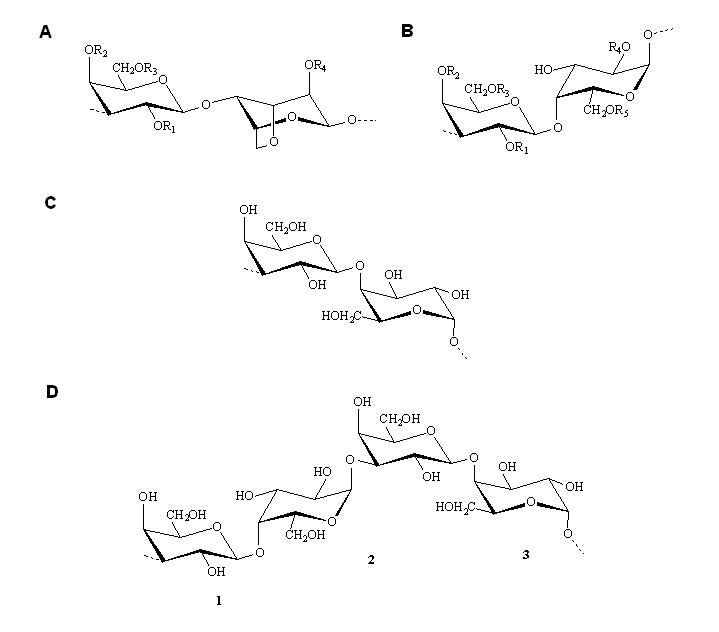
En particular, las algas rojas contienen grandes cantidades de polisacáridos en su pared celular, la mayoría de los cuales son galactanos sulfatados. Estos galactanos están generalmente constituidos por cadenas lineales de unidades alternadas de 1-3 b-D-galactopiranosa y 1-4 a-galactopiranosa (o 3,6-anhidrogalactopiranosa). Los últimos residuos pertenecen a la serie D en el caso de los carragenanos y a la serie L en los agaranos, y con D- y L-galactosa en la misma molécula en el caso de los DL-galactanos híbridos (Figura 2). Estos polisacáridos están sustituídos generalmente con ésteres sulfato, acetales de ácido pirúvico y metil éteres, y además presentan diferentes grados y tipos de ramificación (64).
Diversos factores estructurales influyen sobre la actividad antiviral de los polisulfatos, entre ellos el peso molecular, el grado de sulfatación, la distribución de los grupos sulfato en la molécula y la forma de la cadena hidrocarbonada (63, 65).
Figura 2. Estructura química de polisacáridos extraídos de algas. (A, B) Unidades repetitivas de carragenanos. Según la sustitución de los grupos R (H o SO3-) se obtienen distintos tipos de carragenanos. (C) Unidad repetitiva de agaranos. (D) DL-Galactano híbrido: 1, Dominio de carragenano; 2, Zona de unión; 3, Dominio de agarano.
En estudios previos de nuestro laboratorio hemos evaluado la actividad anti-DENV de polisacáridos sulfatados con diversas estructuras y orígenes, entre ellos se encuentran carragenanos extraídos de algas o comerciales (51, 57-59) y DL-galactanos híbridos aislados de algas rojas sudamericanas (55, 59, 60). Estos compuestos resultaron ser inhibidores efectivos de DENV-2 en células de mamífero pero fueron inactivos en células de mosquito. Esta diferente susceptibilidad estaría de acuerdo con los trabajos que involucran proteínas como probables receptores de DENV en las células C6/36 y describen una ausencia de participación de los residuos de HS en la adsorción viral a estas células (25-27). Asimismo, los estudios de modo de acción antiviral mostraron que la acción anti-DENV-2 de los polisacáridos sulfatados en las células de mamífero se ejerció en las etapas tempranas de infección, adsorción e internalización viral (58-60). En este trabajo se presentan los resultados de la evaluación de la actividad antiviral en diversas células de mamífero de un carragenano-l comercial contra distintos serotipos y aislamientos de DENV y la descripción de su modo de acción.
Materiales y Métodos
Compuesto. El carragenano-l se obtuvo de Sigma-Aldrich. La solución madre del compuesto se preparó en agua destilada en una concentración de 2 mg/ml. En la Figura 2 B se observa la unidad repetitiva del carragenano-l donde R1= R4 = R5 = SO3- y R2 = R3 = H.
Células y virus. La línea celular continua Vero (ATCC), proveniente de riñón de mono verde africano, se cultivó en medio mínimo esencial de Eagle (MEM) (GIBCO) suplementado con 5 % de suero fetal bovino (GIBCO) inactivado. Para el medio de mantenimiento (MM), la concentración de suero se redujo a 1,5 %. La línea celular continua proveniente de un hepatoma humano HepG2 (ATCC) se cultivó en MEM suplementado con 0,03 % de glutamina, 0,01 % de piruvato de sodio y 10 % de suero fetal bovino inactivado. Para el MM la concentración de suero se redujo a 5 %. La línea celular diploide PH, proveniente de prepucio humano, se cultivó en MEM suplementado con 10 % de suero fetal bovino inactivado. Para el MM la concentración de suero se redujo a 5 %. La línea celular de mosquito C6/36 HT, proveniente de Aedes albopictus (adaptada a 33°C), se cultivó en Medio L-15 (Leibovitz) (GIBCO) suplementado con 0,3 % de caldo triptosa fosfato, 0,02 % de glutamina, 1 % de solución de aminoácidos no esenciales MEM y 5 % de suero fetal bovino inactivado. Para el MM la concentración de suero se redujo a 2 %.
Se utilizaron las siguientes cepas de DENV: la cepa de referencia Hawaii (HW) de DENV-1 (provista por la Dra. D. Enría, INEVH, Pergamino, Argentina), la cepa de referencia New Guinea C (NGC) de DENV-2 (provista por la Dra. A. Mistchenko, Hospital de Niños Dr. Ricardo Gutiérrez, Buenos Aires, Argentina), la cepa de referencia 16681 de DENV-2 (provista por la Dra. A. Gamarnik, Fundación Instituto Leloir, Buenos Aires, Argentina), los aislamientos clínicos 67655 y 67702 de DENV-2 (obtenidos del INEVH) y las cepas de referencia H-87 de DENV-3 y 8124 de DENV-4 (Hospital de Niños Dr. Ricardo Gutiérrez, Buenos Aires, Argentina). Las suspensiones virales se prepararon en células C6/36 HT y se titularon por formación de placas en células Vero.
Ensayos de actividad antiviral. La actividad antiviral del carragenano-l se evaluó empleando dos metodologías.
(a) Ensayo de reducción del número de placas. Se infectaron monocapas de células Vero, cultivadas en microplacas de 24 pocillos, con 50 UFP/pocillo de los serotipos de DENV en ausencia o presencia de distintas concentraciones del compuesto. Se ensayó cada dilución por duplicado. Luego de 1 h de adsorción a 37 °C, se descartó el inóculo y las células se cubrieron con MM conteniendo metilcelulosa en presencia de distintas concentraciones del compuesto. Luego de 6 - 12 días de incubación a 37 °C, dependiendo del serotipo viral, las células de fijaron con formol 10 % y se tiñeron con cristal violeta 1 %. La concentración efectiva 50 % (CE50) se calculó como la concentración del compuesto que redujo el número de placas virales en un 50 % con respecto al control sin compuesto.
(b) Ensayo de inhibición del rendimiento viral. Se infectaron monocapas de células HepG2, PH y Vero, cultivadas en microplacas de 24 pocillos, con DENV-2 o DENV-3 a una multiplicidad de infección (m.i.) de 0,1 en ausencia o presencia de distintas concentraciones del carragenano-l. Se ensayó cada dilución por duplicado. Luego de 1 h de adsorción a 37 °C, se retiró el inóculo y las células se cubrieron con MM conteniendo o no distintas concentraciones del compuesto. Luego de 48 h de incubación a 37 °C, se cosecharon los sobrenadantes celulares y se titularon mediante ensayo de formación de placas en células Vero. Se calculó la CE50 como la concentración del compuesto que redujo el rendimiento viral en un 50 % con respecto al control sin tratamiento.
Resultados
Espectro de la actividad antiviral del carragenano-l contra los serotipos de DENV en células Vero
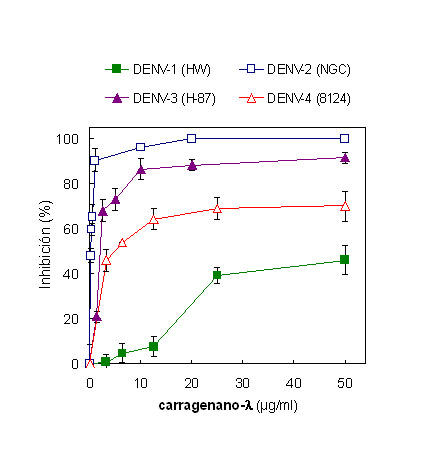
La evaluación de la actividad antiviral del carragenano-l contra los cuatro serotipos de DENV se realizó empleando el método de reducción del número de placas y utilizando cepas de referencia. En la Figura 3, se observa que el efecto antiviral del compuesto en las células Vero fue dependiente del serotipo viral. Los serotipos DENV-2 y DENV-3 fueron los más susceptibles al polisacárido, mostrando valores de CE50 de 0,15 ± 0,04 µg/ml y 2,0 ± 0,3 µg/ml, respectivamente. Como el carragenano-l no ejerció citotoxicidad en las células Vero hasta concentraciones de 1000 µg/ml (58), la actividad antiviral frente a estos dos serotipos fue muy selectiva. Se observó un efecto antiviral menor frente a DENV-4, con un valor de CE50 28 veces mayor que el correspondiente a DENV-2 (CE50 de 4,2 ± 1,1 µg/ml), obteniéndose un máximo porcentaje de inhibición de 70 % en una concentración de 50 µg/ml. Finalmente, el carragenano-l resultó ser muy levemente activo frente a DENV-1, obteniéndose un 46 % de inhibición en la formación de placas en la máxima concentración ensayada (CE50 > 50 µg/ml). De este modo, la susceptibilidad de los serotipos al carragenano-l se encontró en el orden: DENV-2 > DENV-3 > DENV-4 > DENV-1, siendo DENV-2 el serotipo más susceptible al compuesto y DENV-1 el menos susceptible. Estos resultados se corresponden con datos previamente publicados sobre la susceptibilidad de los serotipos de DENV a diversos polisacáridos sulfatados, incluyendo la heparina, galactanos extraídos de algas y distintos tipos de carragenanos (53, 58, 59).
Figura 3. Curvas de respuesta en función de la dosis para la actividad antiviral del carragenano-l contra los distintos serotipos de DENV en células Vero. La actividad antiviral se determinó por el ensayo de reducción del número de placas. Los resultados se expresan como porcentaje de inhibición en la formación de placas de lisis en los cultivos tratados con compuesto en comparación con los cultivos sin tratamiento. Cada valor representa el promedio de dos experimentos ± desvío estándar.
Espectro de la actividad antiviral contra cepas de referencia y aislamientos clínicos de DENV-2 en células Vero
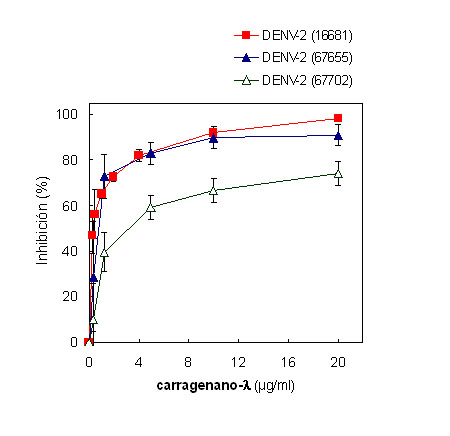
Para evaluar si la susceptibilidad al carragenano-l mostrada por DENV-2 es independiente de la cepa viral utilizada, se ensayó la actividad antiviral del compuesto frente a diferentes cepas de este serotipo viral (Figura 4). La cepa de referencia 16681 presentó una elevada susceptibilidad al polisacárido (CE50 de 0,32 ± 0,01 µg/ml), tal como se observó con la cepa NGC anteriormente ensayada (Figura 3). Con respecto a los aislamientos clínicos, el carragenano mostró un alto efecto inhibitorio frente a la cepa 67655 (CE50 de 0,6 ± 0,3 µg/ml) y un moderado efecto antiviral frente a la cepa 67702 (CE50 de 2,5 ± 0,9 µg/ml) con una máxima inhibición de 74 % para una concentración de carragenano de 20 µg/ml. Cabe destacar la mayor efectividad antiviral contra los aislamientos clínicos de DENV-2 exhibida por el carragenano-l, en comparación con la heparina, que fue inactiva frente a los aislamientos clínicos 67655 y 67702 hasta concentraciones de 100 µg/ml (60, 66).
Figura 4. Curvas de respuesta en función de la dosis para la actividad antiviral del carragenano-l contra distintas cepas de DENV-2 en células Vero. La actividad antiviral se determinó por el ensayo de reducción del número de placas. Los resultados se expresan como porcentaje de inhibición en la formación de placas de lisis en los cultivos tratados con compuesto en comparación con los cultivos sin tratamiento. Cada valor representa el promedio de dos experimentos ± desvío estándar.
Influencia de la célula huésped sobre la actividad antiviral contra DENV
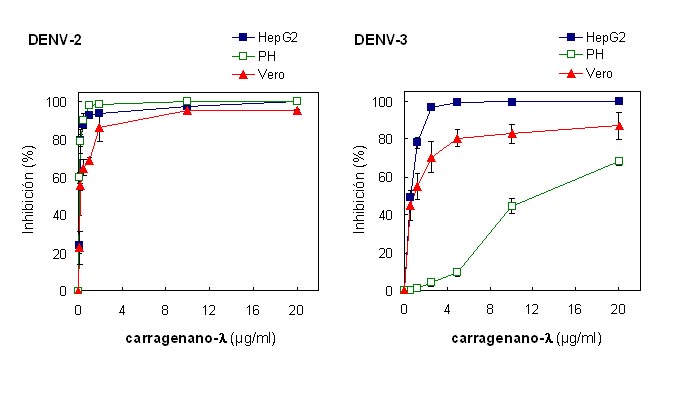
Las células Vero se utilizan ampliamente para propagar y detectar DENV, sin embargo no son representativas de los verdaderos tejidos blanco en la infección natural por DENV. Por esta razón, se estudió el efecto del carragenano-l sobre la multiplicación de DENV en dos tipos celulares humanos, las células HepG2 y PH, para analizar la actividad antiviral del polisacárido en forma comparativa con el sistema de células Vero. Debido a las dificultades en desarrollar un ensayo de plaqueo directo de DENV en los cultivos de células HepG2 y PH, se evaluó la actividad antiviral empleando el ensayo de inhibición del rendimiento viral. Para ello, se emplearon los serotipos que resultaron ser más susceptibles al carragenano-l en las células Vero, DENV-2 y DENV-3. Se observa que el polisacárido fue inhibidor efectivo de DENV-2 en las células humanas HepG2 y PH, mostrando un efecto antiviral (dependiente de la concentración de compuesto) similar al obtenido en las células Vero (Figura 5). Con respecto a DENV-3, también se obtuvo una acción inhibitoria dependiente de la concentración de polisacárido pero se detectó una disminución en la actividad antiviral del carragenano en las células PH, obteniéndose una máxima inhibición de 68 % para una concentración de compuesto de 20 µg/ml. Por el contrario, en las células HepG2 el efecto antiviral frente a DENV-3 fue levemente mayor al obtenido en las células Vero. Asimismo, no se detectó citotoxicidad del carragenano-l en las células HepG2 y PH hasta concentraciones de 1000 µg/ml (58, 66), demostrando que la acción antiviral del compuesto en ambos tipos celulares fue muy selectiva.
Figura 5. Inhibición de la producción de DENV-2 y DENV-3 por el carragenano-l en diferentes tipos celulares. Se infectaron células HepG2, PH y Vero con DENV-2 cepa NGC o DENV-3 cepa H-87 a una m.i. de 0,1 en ausencia o presencia de concentraciones crecientes de carragenano-l. A las 48 h p.i. se determinaron los rendimientos virales por ensayo de placas en células Vero. Los resultados se expresan como porcentaje de inhibición en el rendimiento viral en los cultivos tratados con compuesto en comparación con los cultivos sin tratamiento. Cada valor representa el promedio de dos experimentos ± desvío estándar.
Modo de acción antiviral del carragenano-l contra DENV-2 en células Vero
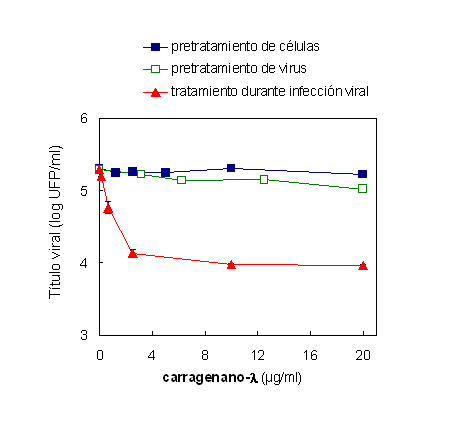
Para estudiar la posibilidad de que el carragenano-l actúe directamente sobre las células a ser infectadas o sobre la partícula viral se realizaron los dos tratamientos por separado. Cuando se preincubaron monocapas de células Vero con distintas concentraciones del compuesto durante 2 h a 37 °C y luego se eliminó el compuesto antes de la infección con DENV-2, no se observó reducción en los títulos virales a las 48 h p.i. respecto al control sin tratamiento (Figura 6). Estos resultados indicarían que el polisacárido no estaría interactuando con el receptor u otras moléculas en la célula huésped. Similarmente, no se detectó disminución en los títulos virales luego de una preincubación de una suspensión de DENV-2 con distintas concentraciones del carragenano-l durante 45 min a 37 °C antes de la infección a las células. Por el contrario, cuando el compuesto se agregó a las células simultáneamente con el inóculo viral se obtuvo una reducción significativa de los títulos virales en una forma dependiente de la concentración del polisacárido (Figura 6). De esta forma, el carragenano-l no produjo un efecto inactivante directo sobre los viriones de DENV-2 hasta una concentración de 20 µg/ml, ni tampoco indujo un estado refractario a la infección por pretratamiento celular, indicando que el bloqueo observado en la multiplicación de DENV-2 en la células Vero se debe totalmente a una interferencia en la multiplicación viral durante el proceso infectivo.
Figura 6. Efecto del carragenano-l por pretratamiento de las células o los viriones antes de la infección. Pretratamiento de células: se preincubaron células Vero con MM conteniendo distintas concentraciones del polisacárido durante 2 h a 37 °C. Luego, se retiró el compuesto y las células se infectaron con DENV-2 a una m.i. de 0,1. Se determinaron los títulos virales en los sobrenadantes celulares a las 48 h p.i. por ensayo de placas. Pretratamiento de virus: se incubaron suspensiones de DENV-2 conteniendo 6 x 105 UFP/ml con distintas concentraciones del compuesto durante 45 min a 37 °C. Luego, se diluyeron las mezclas y se determinó la infectividad remanente en las muestras por ensayo de placas. Tratamiento durante infección viral: se infectaron células Vero con DENV-2 a una m.i. de 0,1 en presencia de distintas concentraciones del carragenano-l. Se determinaron los títulos virales en los sobrenadantes celulares a las 48 h p.i. por ensayo de placas. Cada valor representa el promedio de dos experimentos ± desvío estándar.
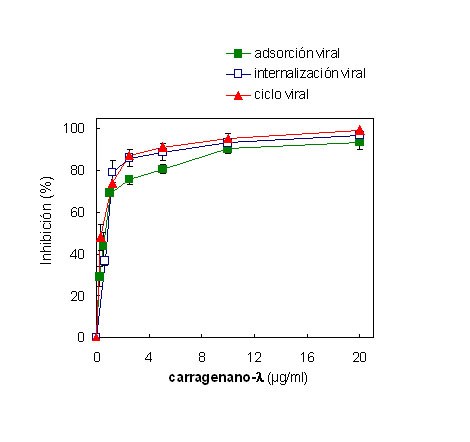
Para verificar un efecto del polisacárido sobre las etapas tempranas del ciclo de multiplicación de DENV-2 en las células Vero se realizó un ensayo de reducción del número de placas empleando diferentes condiciones de tratamiento. La presencia del compuesto durante la adsorción viral a 4 °C o durante la internalización viral a 37 °C mostró una inhibición significativa en la formación de placas y fue dependiente de la concentración del carragenano empleada. A partir de las curvas presentadas en la Figura 7 se obtuvieron valores de CE50 de 0,64 ± 0,08 µg/ml y 0,78 ± 0,01 µg/ml cuando los tratamientos se efectuaron durante la adsorción e internalización viral, respectivamente. Asimismo, se observó un nivel de inhibición similar cuando el compuesto estuvo presente en la adsorción y mantenido durante todo el período de 6 días necesario para la formación de placas (CE50 de 0,52 ± 0,15 µg/ml), sugiriendo que la actividad antiviral del carragenano-l se produce exclusivamente en la entrada viral. Estos resultados se corresponden con datos anteriormente publicados acerca del modo de acción de este tipo de carragenano en células Vero, que demuestran un efecto del mismo sobre la adsorción y el desnudamiento de DENV-2, empleando diferentes metodologías (58, 66).
Figura 7. Efecto del carragenano-l sobre las etapas tempranas del ciclo de multiplicación de DENV-2 en células Vero. Adsorción viral: se infectaron las células con 50 UFP/pocillo de DENV-2 en presencia de distintas concentraciones del carragenano-l y, luego de 1 h de adsorción a 4 °C, se lavaron las células con PBS y se cubrieron con medio de plaqueo en ausencia de compuesto. Internalización viral: se adsorbió el virus a las células durante 1 h a 4 °C, luego se agregó MM conteniendo distintas concentraciones del carragenano-l y se incubó durante 1 h a 37 °C. Posteriormente, se lavaron las células con PBS y se trataron con buffer citrato (ácido cítrico 40 mM, KCl 10 mM, NaCl 135 mM, pH 3) durante 1 min para inactivar el virus adsorbido que aún no ha penetrado. Luego, se cubrieron las células con medio de plaqueo en ausencia de compuesto. Ciclo viral: se infectaron las células con DENV-2 en presencia de distintas concentraciones del carragenano-l y, luego de 1 h de adsorción a 4 °C, se cubrieron con medio de plaqueo en presencia de compuesto. Los resultados se expresan como porcentaje de inhibición en la formación de placas en los cultivos tratados con carragenano-l en comparación con los cultivos sin tratamiento. Cada valor representa el promedio de dos experimentos ± desvío estándar.
Discusión y conclusiones
El conocimiento de los diversos aspectos de la entrada viral, tales como la presencia de diferentes receptores según el tipo de célula y el serotipo viral, el mecanismo de internalización y la fusión viral, puede guiar el desarrollo de nuevas estrategias destinadas a establecer una efectiva terapia anti-dengue. Se han estudiado diversos tipos de inhibidores de la entrada de DENV (Figura 1), principalmente en cultivos celulares debido a la dificultad en encontrar un modelo animal para DENV.
En este trabajo, el carragenano-l, una molécula que mimetiza al HS, fue en general un inhibidor potente de DENV-2 y DENV-3 en células de mono y humanas, no así frente a DENV-4 y DENV-1. Este comportamiento se corresponde con las diversas publicaciones, descriptas en la sección Introducción, sobre distintos receptores y/o co-receptores involucrados para la unión y entrada de DENV de acuerdo al serotipo viral y la célula huésped.
Al estudiar la actividad antiviral del carragenano frente a diferentes cepas de DENV-2, se encontró un marcado efecto inhibitorio contra cepas de referencia y aislamientos clínicos. Se ha demostrado que la adaptación de diversos virus, incluyendo flavivirus, al crecimiento en ciertas líneas celulares conduce a la selección de variantes virales que unen HS con alta afinidad (67-69). Esta afinidad incrementada por HS resulta aparentemente favorable para el crecimiento en cultivos celulares. En este estudio se observó que el efecto inhibitorio del carragenano-l frente a aislamientos clínicos de DENV-2, que tenían pocos pasajes en cultivos de células, fue levemente menor al exhibido frente a cepas de referencia adaptadas al crecimiento en cultivos celulares, obteniéndose una susceptibilidad elevada al polisacárido para todas las cepas estudiadas.
Con respecto al modo de acción antiviral, los ensayos de adsorción e internalización descriptos en este trabajo y en estudios previos (58, 66) demostraron que el carragenano-l actuaría en dos procesos ligados a la entrada de DENV-2, adsorción y desnudamiento viral. La interferencia en la adsorción viral está de acuerdo con el modo de acción descripto para los polisulfatos contra otros virus envueltos (63, 70) y consistiría en el bloqueo de la unión del virus a los residuos de HS presentes en los proteoglicanos celulares. El efecto post-adsorción de DENV-2, ubicado sobre el desnudamiento viral, probablemente sea debido a una asociación del carragenano-l con la glicoproteína E del virus adsorbido que impediría el cambio conformacional de E necesario para la fusión de membranas (58, 66).
Se ha observado que la efectividad de los polisulfatos en modelos in vivo contra diversos virus ha sido variable (63, 65). Los polisulfatos presentan una serie de desventajas que afectan su potencial utilidad en humanos, entre ellas la baja biodisponibilidad oral, la actividad anticoagulante de varios polisacáridos, la alta degradación plasmática y la incapacidad de penetrar las células y llegar a los tejidos blanco, debido esta última al alto peso molecular y la naturaleza aniónica de la molécula. Sin embargo, estudios sobre galactomananos extraídos de algas y compuestos con estructura similar al HS, entre ellos el oligosacárido PI-88, demostraron efecto inhibitorio in vivo en modelos murinos para el virus de la fiebre amarilla y DENV-2 (52, 54), sugiriendo que los polisulfatos representarían una alternativa para la quimioterapia anti-flavivirus.
En este trabajo, al evaluar polisacáridos sulfatados como inhibidores de la entrada viral, se encontró diferente reactividad in vitro contra los cuatro serotipos de DENV. Esto representa una desventaja para las posibilidades futuras de estos compuestos como agentes terapéuticos anti-DENV, debido a la co-circulación que se registra en la actualidad de los cuatro serotipos de DENV en regiones endémicas (1). Por lo tanto, sólo se podría llegar a considerar su utilización teniendo en cuenta estas limitaciones además de las referidas a la biodisponibilidad para una eficaz administración in vivo de este tipo de compuestos. De este modo, el estudio de polisacáridos sulfatados ha remarcado la necesidad de ensayar los cuatro serotipos de DENV cuando se evalúan inhibidores de la entrada viral ya que respuestas similares a las presentadas en este trabajo podrían obtenerse con otras sustancias antivirales.
Asimismo, en forma complementaria, la utilización de esta clase de compuestos ha demostrado ser una herramienta útil para aportar evidencias sobre las distintas formas en las que pareciera transcurrir la interacción temprana virus - célula en la infección con DENV y ha brindado pautas para desentrañar el mecanismo de entrada de DENV a la célula huésped, cuyo conocimiento resulta imprescindible para su utilización como un blanco antiviral exitoso.
Agradecimientos
A la Dra. Elsa B. Damonte por su crítica revisión del manuscrito. A la Dra. Delia Enría y María Alejandra Morales (INEVH, Pergamino, Argentina) por suministrarnos los aislamientos clínicos de DENV-2. Este trabajo se realizó con la financiación proveniente de Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET), Universidad de Buenos Aires (UBA) y Agencia Nacional para la Promoción Científica y Tecnológica (ANPCyT).
Referencias
- Gubler DJ, 2002. Epidemic dengue/dengue hemorrhagic fever as a public health, social and economic problem in the 21st century. Trends Microbiol 10: 100-103.
- Lindenbach BD, Rice CM, 2003. Molecular biology of flaviviruses. Adv Virus Res 59: 23-61.
- Gubler DJ, 1998. Dengue and dengue hemorrhagic fever. Clin Microbiol Rev 11: 480-496.
- Rothman AL, 2004. Dengue: defining protective versus pathologic immunity. J Clin Invest 113, 946-951.
- Damonte EB. Dengue: Un viejo y nuevo desafío para la quimioterapia antiviral. QuímicaViva (QV) 2006; 5: 52-62. Recuperable de http:// www.quimicaviva.qb.fcen.uba.ar
- Leyssen P, Charlier N, Paeshuyse J, De Clercq E, Neyts J, 2003. Prospects for antiviral therapy. Adv Virus Res 61: 511-553.
- Altmeyer R, 2004. Virus attachment and entry offer numerous targets for antiviral therapy. Curr Pharm Des 10: 3701-3712.
- Littaua R, Kurane I, Ennis FA, 1990. Human IgG Fc receptor II mediates antibody-dependent enhancement of dengue virus infection. J Immunol 144: 3183-3186.
- Marianneau P, Mégret F, Olivier R, Morens DM, Deubel V, 1996. Dengue 1 virus binding to human hepatoma HepG2 and simian Vero cell surfaces differs. J Gen Virol 77: 2547-2554.
- Bielefeldt-Ohmann H, 1998. Analysis of antibody-independent binding of dengue viruses and dengue virus envelope protein to human myelomonocytic cells and B lymphocytes. Virus Res 57: 63-79.
- Bielefeldt-Ohmann H, Meyer M, Fitzpatrick DR, Mackenzie JS, 2001. Dengue virus binding to human leukocyte cell lines: receptor usage differs between cell types and virus strains. Virus Res 73: 81-89.
- Jindadamrongwech S, Smith DR, 2004. Virus Overlay Protein Binding Assay (VOPBA) reveals serotype specific heterogeneity of dengue virus binding proteins on HepG2 human liver cells. Intervirology 47: 370-373.
- Martínez-Barragán JJ, del Angel RM, 2001. Identification of a putative coreceptor on Vero cells that participates in dengue 4 virus infection. J Virol 75: 7818-7827.
- Moreno-Altamirano MM, Sánchez-García FJ, Muñoz ML, 2002. Non Fc receptor-mediated infection of human macrophages by dengue virus serotype 2. J Gen Virol 83: 1123-1130.
- Ramos-Castañeda J, Imbert JL, Barrón BL, Ramos C, 1997. A 65-kDa trypsin-sensible membrane cell protein as a possible receptor for dengue virus in cultured neuroblastoma cells. J Neurovirol 3: 435-440.
- Rothwell SW, Putnak R, La Russa VF, 1996. Dengue-2 virus infection of human bone marrow: characterization of dengue-2 antigen-positive stromal cells. Am J Trop Med Hyg 54: 503-510.
- Wei HY, Jiang LF, Fang DY, Guo HY, 2003. Dengue virus type 2 infects human endothelial cells through binding of the viral envelope glycoprotein to cell surface polypeptides. J Gen Virol 84: 3095-3098.
- Thepparit C, Smith DR, 2004. Serotype-specific entry of dengue virus into liver cells: identification of the 37-kilodalton/67-kilodalton high-affinity laminin receptor as a dengue virus serotype 1 receptor. J Virol 78: 12647-12656.
- Miller JL, Dewet BJ, Martinez-Pomares L, Radcliffe CM, Dwek RA, Rudd PM, Gordon S, 2008. The mannose receptor mediates dengue virus infection of macrophages. PLoS Pathog 4: e17.
- Reyes-Del Valle J, Chávez-Salinas S, Medina F, Del Angel RM, 2005. Heat shock protein 90 and heat shock protein 70 are components of dengue virus receptor complex in human cells. J Virol 79: 4557-4567.
- Chen YC, Wang SY, King CC, 1999. Bacterial lipopolysaccharide inhibits dengue virus infection of primary human monocytes/macrophages by blockade of virus entry via a CD14-dependent mechanism. J Virol 73: 2650-2657.
- Jindadamrongwech S, Thepparit C, Smith DR, 2004. Identification of GRP 78 (BiP) as a liver cell expressed receptor element for dengue virus serotype 2. Arch Virol 149: 915-927.
- Navarro-Sanchez E, Altmeyer R, Amara A, Schwartz O, Fieschi F, Virelizier JL, Arenzana-Seisdedos F, Desprès P, 2003. Dendritic-cell-specific ICAM3-grabbing non-integrin is essential for the productive infection of human dendritic cells by mosquito-cell-derived dengue viruses. EMBO Rep 4: 723-728.
- Tassaneetrithep B, Burgess TH, Granelli-Piperno A, Trumpfheller C, Finke J, Sun W, Eller MA, Pattanapanyasat K, Sarasombath S, Birx DL, Steinman RM, Schlesinger S, Marovich MA, 2003. DC-SIGN (CD209) mediates dengue virus infection of human dendritic cells. J Exp Med 197: 823-829.
- Muñoz ML, Cisneros A, Cruz J, Das P, Tovar R, Ortega A, 1998. Putative dengue virus receptors from mosquito cells. FEMS Microbiol Lett 168: 251-258.
- Salas-Benito J, Reyes-Del Valle J, Salas-Benito M, Ceballos-Olvera I, Mosso C, del Angel RM, 2007. Evidence that the 45-kD glycoprotein, part of a putative dengue virus receptor complex in the mosquito cell line C6/36, is a heat-shock related protein. Am J Trop Med Hyg 77: 283-290.
- Sakoonwatanyoo P, Boonsanay V, Smith DR, 2006. Growth and production of the dengue virus in C6/36 cells and identification of a laminin-binding protein as a candidate serotype 3 and 4 receptor protein. Intervirology 49, 161-172.
- Chen Y, Maguire T, Hileman RE, Fromm JR, Esko JD, Linhardt RJ, Marks RM, 1997. Dengue virus infectivity depends on envelope protein binding to target cell heparan sulfate. Nat Med 3: 866-871.
- Germi R, Crance JM, Garin D, Guimet J, Lortat-Jacob H, Ruigrok RW, Zarski JP, Drouet E, 2002. Heparan sulfate-mediated binding of infectious dengue virus type 2 and yellow fever virus. Virology 292: 162-168.
- Hilgard P, Stockert R, 2000. Heparan sulfate proteoglycans initiate dengue virus infection of hepatocytes. Hepatology 32: 1069-1077.
- Hung SL, Lee PL, Chen HW, Chen LK, Kao CL, King CC, 1999. Analysis of the steps involved in dengue virus entry into host cells. Virology 257: 156-167.
- Thaisomboonsuk BK, Clayson ET, Pantuwatana S, Vaughn DW, Endy TP, 2005. Characterization of dengue-2 virus binding to surfaces of mammalian and insect cells. Am J Trop Med Hyg 72: 375-383.
- Esko JD, Selleck SB, 2002. Order out of chaos: assembly of ligand binding sites in heparan sulfate. Annu Rev Biochem 71: 435-471.
- Spillmann D, 2001. Heparan sulfate: anchor for viral intruders?. Biochimie 83: 811-817.
- Halstead SB, Heinz FX, Barrett AD, Roehrig JT, 2005. Dengue virus: molecular basis of cell entry and pathogenesis, 25-27 June 2003, Vienna, Austria. Vaccine 23: 849-856.
- Hase T, Summers PL, Eckels KH, 1989. Flavivirus entry into cultured mosquito cells and human peripheral blood monocytes. Arch Virol 104: 129-143.
- Lim HY, Ng ML, 1999. A different mode of entry by dengue-2 neutralisation escape mutant virus. Arch Virol 144: 989-995.
- Acosta EG, Castilla V, Damonte EB, 2008. Functional entry of dengue virus into Aedes albopictus mosquito cells is dependent on clathrin-mediated endocytosis. J Gen Virol 89: 474-484.
- Krishnan MN, Sukumaran B, Pal U, Agaisse H, Murray JL, Hodge TW, Fikrig E, 2007. Rab 5 is required for the cellular entry of dengue and West Nile viruses. J Virol 81: 4881-4885.
- Mosso C, Galván-Mendoza IJ, Ludert JE, Del Angel RM, 2008. Endocytic pathway followed by dengue virus to infect the mosquito cell line C6/36 HT. Virology doi: 10.1016/j.virol.2008.05.012.
- Lee CJ, Lin HR, Liao CL, Lin YL, 2008. Cholesterol effectively blocks entry of flavivirus. J Virol 82: 6470-6480.
- Hu HP, Hsieh SC, King CC, Wang WK, 2007. Characterization of retrovirus-based reporter viruses pseudotyped with the precursor membrane and envelope glycoproteins of four serotypes of dengue viruses. Virology 368: 376-387.
- Modis Y, Ogata S, Clements D, Harrison SC, 2004. Structure of the dengue virus envelope protein after membrane fusion. Nature 427: 313-319.
- van der Schaar HM, Rust MJ, Waarts BL, van der Ende-Metselaar H, Kuhn RJ, Wilschut J, Zhuang X, Smit JM, 2007. Characterization of the early events in dengue virus cell entry by biochemical assays and single-virus tracking. J Virol 81: 12019-12028.
- Zhang Y, Zhang W, Ogata S, Clements D, Strauss JH, Baker TS, Kuhn RJ, Rossmann MG, 2004. Conformational changes of the flavivirus E glycoprotein. Structure 12: 1607-1618.
- Koff WC, Elm JL Jr, Halstead SB, 1980. Inhibition of dengue virus replication by amantadine hydrochloride. Antimicrob Agents Chemother 18: 125-129.
- Koff WC, Elm JL Jr, Halstead SB, 1981. Suppression of dengue virus replication in vitro by rimantadine hydrochloride. Am J Trop Med Hyg 30: 184-189.
- Hrobowski YM, Garry RF, Michael SF, 2005. Peptide inhibitors of dengue virus and West Nile virus infectivity. Virol J 2: 49.
- Modis Y, Ogata S, Clements D, Harrison SC, 2003. A ligand-binding pocket in the dengue virus envelope glycoprotein. Proc Natl Acad Sci USA 100: 6986-6991.
- Yang JM, Chen YF, Tu YY, Yen KR, Yang YL, 2007. Combinatorial computational approaches to identity tetracycline derivatives as flavivirus inhibitors. PLoS One 2: e428.
- de SF-Tischer PC, Talarico LB, Noseda MD, Guimaraes SMPB, Damonte EB, Duarte MER, 2006. Chemical structure and antiviral activity of carrageenans from Meristiella gelidium against herpes simplex and dengue virus. Carbohydr Polym 63: 459-465.
- Lee E, Pavy M, Young N, Freeman C, Lobigs M, 2006. Antiviral effect of the heparan sulfate mimetic, PI-88, against dengue and encephalitic flaviviruses. Antiviral Res 69: 31-38.
- Lin YL, Lei HY, Lin YS, Yeh TM, Chen SH, Liu HS, 2002. Heparin inhibits dengue-2 virus infection of five human liver cell lines. Antiviral Res 56: 93-96.
- Ono L, Wollinger W, Rocco IM, Coimbra TL, Gorin PA, Sierakowski MR, 2003. In vitro and in vivo antiviral properties of sulfated galactomannans against yellow fever virus (BeH111 strain) and dengue 1 virus (Hawaii strain). Antiviral Res 60: 201-208.
- Pujol CA, Estévez JM, Carlucci MJ, Ciancia M, Cerezo AS, Damonte EB, 2002. Novel DL-galactan hybrids from the red seaweed Gymnogongrus torulosus are potent inhibitors of herpes simplex virus and dengue virus. Antivir Chem Chemother 13: 83-89.
- Qiu H, Tang W, Tong X, Ding K, Zuo J, 2007. Structure elucidation and sulfated derivatives preparation of two a-D-glucans from Gastrodia elata B1. and their anti-dengue virus bioactivities. Carbohydr Res 342: 2230-2236.
- Rodríguez MC, Merino ER, Pujol CA, Damonte EB, Cerezo AS, Matulewicz MC, 2005. Galactans from cystocarpic plants of the red seaweed Callophyllis variegata (Kallymeniaceae, Gigartinales). Carbohydr Res 340: 2742-2751.
- Talarico LB, Damonte EB, 2007. Interference in dengue virus adsorption and uncoating by carrageenans. Virology 363: 473-485.
- Talarico LB, Pujol CA, Zibetti RGM, Faría PCS, Noseda MD, Duarte MER, Damonte EB, 2005. The antiviral activity of sulfated polysaccharides against dengue virus is dependent on virus serotype and host cell. Antiviral Res 66: 103-110.
- Talarico LB, Duarte MER, Zibetti RGM, Noseda MD, Damonte EB, 2007. An algal derived DL-galactan hybrid is an efficient preventing agent for in vitro dengue virus infection. Planta Med 73: 1464-1468.
- Marks RM, Lu H, Sundaresan R, Toida T, Suzuki A, Imanari T, Hernáiz MJ, Linhardt RJ, 2001. Probing the interaction of dengue virus envelope protein with heparin: assessment of glycosaminoglycan-derived inhibitors. J Med Chem 44: 2178-2187.
- Shigeta S, Mori S, Kodama E, Kodama J, Takahashi K, Yamase T, 2003. Broad-spectrum anti-RNA virus activities of titanium and vanadium substituted polyoxotungstates. Antiviral Res 58: 265-271.
- Damonte EB, Matulewicz MC, Cerezo AS, 2004. Sulfated seaweed polysaccharides as antiviral agents. Curr Med Chem 11: 2399-2419.
- Stortz CA, Cerezo AS, 2000. Novel findings in carrageenans, agaroids and “hybrid” red seaweed galactans. Current Topics Phytochem 4: 121-134.
- Pujol CA, Carlucci MJ, Matulewicz MC, Damonte EB, 2007. Natural sulfated polysaccharides for the prevention and control of viral infections. Top Heterocycl Chem 11: 259-281.
- Talarico LB, 2008. Caracterización de la actividad antiviral de polisacáridos sulfatados contra el virus dengue. Tesis para optar por el título de Doctor de la Universidad de Buenos Aires en el área Química Biológica. Biblioteca Luis Federico Leloir, Facultad de Ciencias Exactas y Naturales, Universidad de Buenos Aires.
- Lee E, Hall RA, Lobigs M, 2004. Common E protein determinants for attenuation of glycosaminoglycan-binding variants of Japanese encephalitis and West Nile viruses. J Virol 78: 8271-8280.
- Lee E, Lobigs M, 2002. Mechanism of virulence attenuation of glycosaminoglycan-binding variants of Japanese encephalitis virus and Murray Valley encephalitis virus. J Virol 76: 4901-4911.
- Mandl CW, Kroschewski H, Allison SL, Kofler R, Holzmann H, Meixner T, Heinz FX, 2001. Adaptation of Tick-borne encephalitis virus to BHK-21 cells results in the formation of multiple heparan sulfate binding sites in the envelope protein and attenuation in vivo. J Virol 75: 5627-5637.
- Witvrouw M, De Clercq E, 1997. Sulfated polysaccharides extracted from sea algae as potential antiviral drugs. Gen Pharmacol 29: 497-511.
* Dra. Laura Beatriz Talarico
Ayudante de Primera Dedicación Exclusiva, Área Microbiología, Depto. de Química Biológica,
Facultad de Ciencias Exactas y Naturales, UBA.
ISSN 1666-7948
www.quimicaviva.qb.fcen.uba.arRevista QuímicaViva
Número 2, año 7, Agosto 2008
quimicaviva@qb.fcen.uba.ar