“Citoquinas: el lenguaje del diálogo materno-embrionario”
Vanina A. Fontana
Laboratorio de matriz extracelular y proteoglicanos. Departamento de Química Biológica, Facultad de Ciencias Exactas y Naturales, Universidad de Buenos Aires. Pabellón II. Piso 4. Ciudad Universitaria. 1428 Ciudad de Buenos Aires. Argentina.
e-mail: vfontana@qb.fcen.uba.ar
Recibido el 27/06/08. Aceptado el 11/0708.
RESUMEN
La implantación embrionaria es una secuencia de interacciones bioquímicas y físicas entre el embrión y el útero, que lleva a la formación de un contacto celular íntimo y especializado entre el trofoblasto embrionario y el endometrio materno. La implantación solamente se podrá llevar a cabo durante la ventana de implantación, fuera de la misma el endometrio debe ser indiferente o aún hostil al embrión. Por este motivo es fundamental la existencia de un “diálogo” (interacción) sincronizado entre el endometrio receptivo y el blastocisto funcional que involucre la aparición de factores endócrinos, parácrinos y autócrinos. Entre estos mediadores se encuentran moléculas de adhesión, citoquinas, factores de crecimiento, lípidos y otros. En este trabajo se hará mención especialmente a las citoquinas del tipo Th1 y Th2.
Palabras claves: implantación embrionaria - blastocisto - invasión - citoquinas Th1/Th2
ABSTRACT
Embryo implantation is a sequence of biochemical and physical interactions between the embryo and the uterus, that carries to the formation of a close and specialized cellular contact between the trophoblast and the endometrium. The implantation only will be able to carry out during the window of implantation, out of this the endometrium has to be indifferent or still hostile to the embryo.
By this reason is fundamental the existence of a synchronized “dialogue or cross talk” (interaction) between the receptive endometrium and the activated blastocyst that involve the existence of endocrin, paracrin and autocrin factors, such as adhesion molecules, cytokines, growth factors, lipids. Th1 and Th2 cytokines will be mentioned specially in this work.
Key words: embryo implantation – blastocyst - invasion –cytokines Th1/Th2
INTRODUCCIÓN
La implantación embrionaria es una secuencia de interacciones bioquímicas y físicas entre el embrión y el útero, que lleva a la formación de un contacto celular íntimo y especializado entre el trofoblasto embrionario y el endometrio materno (1). Dicho evento representa el paso más crítico del proceso reproductivo en muchas especies. Es considerado el único fenómeno biológico por el cual el embrión en estadio de blastocisto se conecta íntimamente a la superficie del endometrio materno para formar la placenta que proveerá una interfase entre el feto en desarrollo y la circulación materna (2, 3).
La implantación solamente se podrá llevar a cabo durante un periodo autolimitado de receptividad endometrial que ocurre entre los días 20 y 24 del ciclo menstrual denominado ventana de implantación (dependiente de hormonas ováricas); fuera de la misma el endometrio debe ser indiferente o aún hostil al embrión (4, 5). La receptividad endometrial consiste en la adquisición de ligandos de adhesión junto con la pérdida de componentes inhibitorios que pueden actuar como una barrera ante la presencia de un embrión por implantarse (3). Por este motivo es fundamental la existencia de un “diálogo” (interacción) sincronizado entre el endometrio receptivo y el blastocisto funcional que involucre la aparición de factores endócrinos, parácrinos y autócrinos. Entre estos mediadores se encuentran moléculas de adhesión, citoquinas, factores de crecimiento, lípidos y otros (6, 7). En humanos la eficiencia de dicho diálogo es marcadamente baja considerando que una vez que la implantación comienza se estima que menos del 30% de los embarazos llegan a término (8, 9).
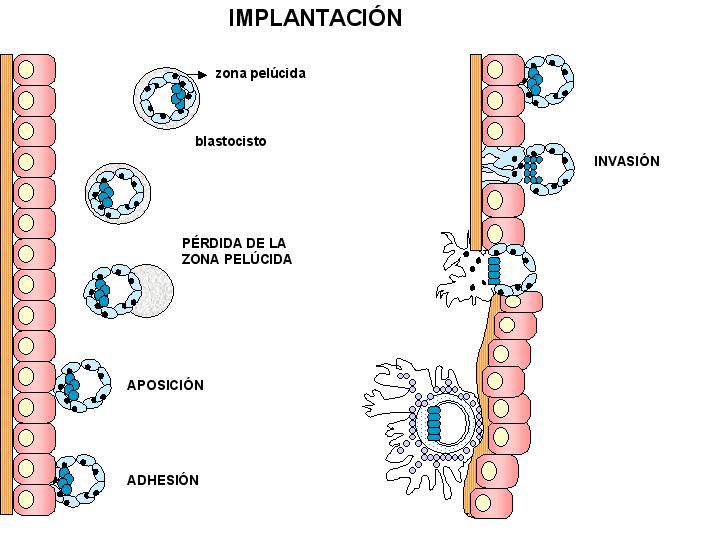
Se pueden distinguir dos periodos según el momento en que ocurre la implantación: el periodo pre-implantatorio (antes de la implantación) y el peri-implantatorio (al momento de la implantación). Para un mejor estudio, el proceso de implantación embrionaria ha sido dividido básicamente de tres etapas: aposición, adhesión e invasión (10).
PERIODO PRE-IMPLANTATORIO
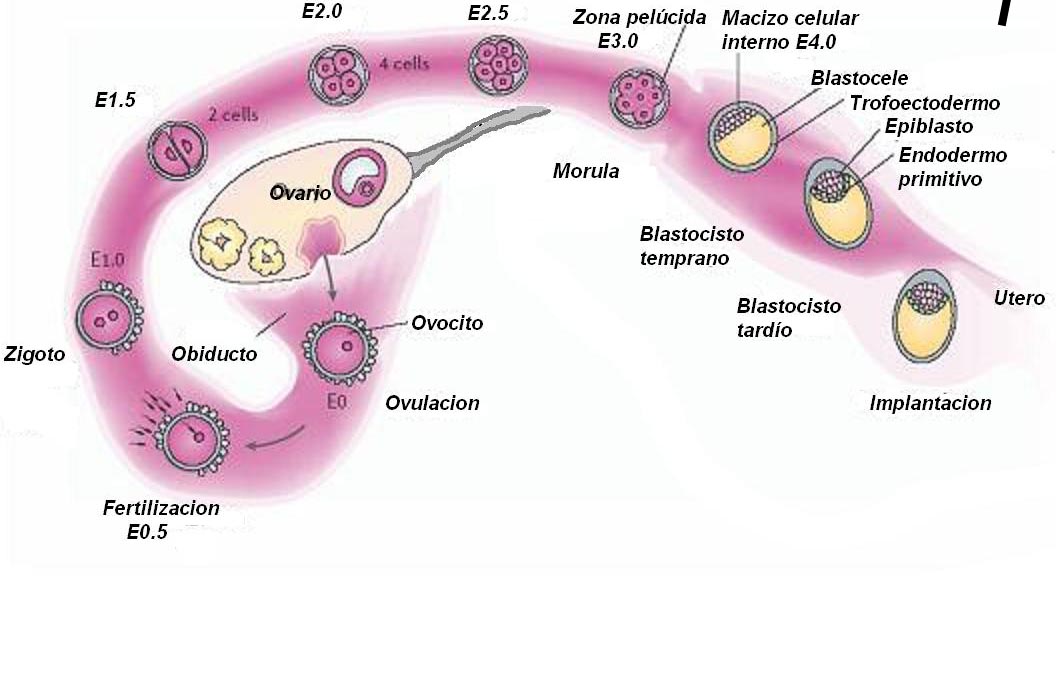
Finalizando el proceso de fertilización en el oviducto, el zigoto formado sufre una serie de divisiones celulares dentro de la zona pelúcida que lo rodea. Esta serie de divisiones mitóticas, denominada clivaje, divide el gran volumen citoplasmático del zigoto en varias células más pequeñas, los blastómeros, para formar una masa de células totipotenciales, la mórula. En algún momento, entre la fase de 8 células y la fase de 16 células, la superficie de la mórula se vuelve más lisa y más esférica. Esto es debido a que las células incrementan los contactos intercelulares y quedan más compactas, estableciéndose uniones herméticas entre las células externas que sellan el interior de la mórula con respecto al medio exterior. Poco después, los espacios intercelulares internos aumentan de tamaño generando una cavidad central llena de líquido, el blastocele. En este momento se dice que la mórula se ha transformado en blastocisto (11) (Figura 1).
Figura 1: Desarrollo de un embrión pre-implantatorio e implantación. Seguido a la fertilización en el oviducto, el embrión sufre una serie de divisiones mitóticas hasta formar una mórula. En el estadio de mórula tardía, el embrión entra al lumen uterino y se transforma en blastocisto. Antes de la implantación el blastocisto escapa de la cubierta que lo rodea (zona pelúcida). El blastocisto se alinea y adhiere a la pared uterina para comenzar el proceso de implantación (12). E: días de vida del embrión.
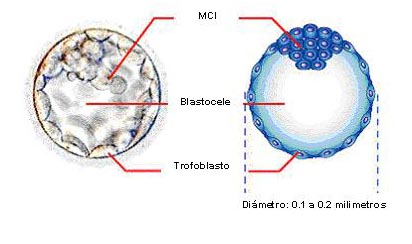
El blastocisto es el estadio del desarrollo donde, por primera vez, se diferencian dos tipos celulares. Dicho estadio se caracteriza por la presencia de: (a) un blastocele, (b) un pequeño grupo de células en uno de los polos del blastocisto que forma el macizo celular inetrno (MCI) y (c) de una monocapa de células epiteliales, continua e impermeable, que rodea y recubre al blastocele y a la MCI llamada trofoectodermo (Figura 2).
El embrión propiamente dicho deriva de la MCI que crece y comienza a diferenciarse dando origen a todas las capas celulares embrionarias (ectodermo, mesodermo y endodermo). La interacción, asociación y desarrollo de estas capas resulta en la diferenciación de tejidos y órganos del feto. Parte de la MCI da también origen a algunas estructuras extraembrionarias (11).
El trofoectodermo es el epitelio precursor de la placenta y el primer componente del sistema de estructuras extraembrionarias. Una vez liberada la zona pelúcida, las células del trofoectodermo establecen un estrecho contacto con la pared del útero, en la que se implanta el embrión (11).
Figura 2: Imagen e ilustración de un blastocisto. El blastocisto se caracteriza por poseer una cavidad (blastocele) con dos poblaciones celulares, el macizo celular interno (MCI) y el trofoectodermo, el cual es el progenitor de las células del trofoblasto (TB). Modificado de http://sps.k12.ar.us/massengale/stemcell_article.htm
PERIODO PERI-IMPLANTATORIO
A medida que el embrión se divide, se desplaza a través del oviducto para llegar al útero materno e implantarse en el endometrio. Este proceso es mediado por una población de células especializadas del blastocisto, denominada trofoblasto, que se forman por diferenciación del trofoectodermo (13).
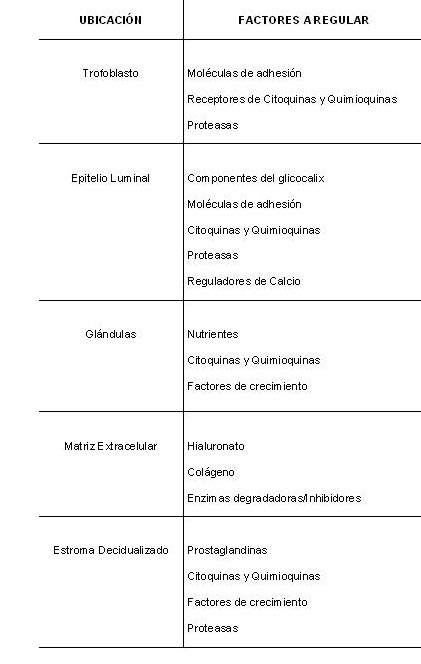
Para que una implantación exitosa ocurra es necesario que se produzca la preparación del endometrio y el desarrollo del embrión de un modo sincronizado para permitir así una comunicación adecuada entre ambos. Los factores endometriales son mediadores críticos de todas las fases del proceso implantatorio (Tabla 1) (14).
Tabla 1: Factores regulados durante las primeras etapas de la implantación.
Preparación del endometrio
Las hormonas esteroideas desempeñan un papel fundamental en la preparación del endometrio para la implantación. Algunas citoquinas se encuentran reguladas por estas hormonas y actúan a nivel autocrino-paracrino. Durante la fase folicular, el endometrio sometido a la acción de los estrógenos prolifera y crece. Luego, tras la ovulación, la secreción de progesterona va a producir importantes cambios en la morfología y función endometrial. Los cambios morfológicos clásicos descritos en el endometrio secretor son:
- Disminución progresiva de la mitosis
- Aparición de vacuolas, en el epitelio endometrial, ricas en glucógeno
- Edema en el estroma
- Decidualización e infiltración leucocitaria.
El endometrio está formado por cuatro componentes básicos: epitelio luminal, epitelio glandular, estroma y vasos. Durante el período peri-implantatorio se van a producir unas modificaciones específicas que van a hacer que el endometrio sea receptivo para la anidación del blastocisto:
- Epitelio luminal: Es el lugar donde se produce el primer contacto entre blastocisto y endometrio. Estas células van a producir receptor para la interleuquina-1 (IL-1) (15).
- Epitelio glandular: La secreción de las glándulas uterinas cambia cualitativamente y cuantitativamente durante este período (16).
- Células del estroma: a partir del décimo día post-ovulación las células del estroma sufren cambios morfológicos y funcionales. A este proceso se le denomina decidualización. Estas células crecen e inician la síntesis y secreción de prolactina, este proceso ocurre fisiológicamente independientemente de la presencia o no del embrión. Además producen durante este período "Insulin growth factor binding protein-I" (IGFBP-I) (17) que aparece al día 4 post-ovulación y está regulada por la progesterona.
- Vasos: En los roedores la primera respuesta del endometrio al blastocisto es el aumento de la permeabilidad capilar en el lugar en que se producirá la invasión. Esta reacción está desencadenada por la producción local de prostaglandinas (18) por células del epitelio y del estroma.
Receptividad Endometrial
En el lugar de implantación la membrana plasmática epitelial luminal es el compartimiento materno que primero contacta con el embrión y define el límite que debe atravesar para poder acomodarse en el tejido uterino. La expresión de diferentes componentes moleculares, mayoritariamente proteicos, en distintos dominios funcionales y estructurales de las células epiteliales endometriales determina la identidad y función de la membrana plasmática. De este modo, la presencia de distintos conjuntos de proteínas de membrana, proteínas del citoesqueleto cortical y lípidos en el momento de implantación, principalmente en el dominio luminal, facilitará la adhesión del embrión en estadio de blastocisto.
La receptividad endometrial delimita un período del ciclo menstrual conocido como “ventana de implantación” en el que es posible la adhesión del blastocisto exclusivamente. Durante este período, en la membrana plasmática de las células epiteliales endometriales se producen cambios morfológicos y bioquímicos (19).
Etapas de la implantación
La implantación en mamíferos presenta considerables variaciones según a qué especie se haga referencia. A continuación se describen las características más importantes y distintivas de este proceso.
1. Pérdida de la zona pelúcida
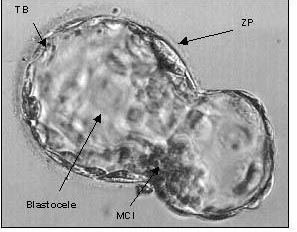
La rotura de la zona pelúcida o “hatching” (Figura 3) es requisito indispensable para la implantación. En el ratón, el blastocisto entra en el cuerno uterino y pierde la zona pelúcida después de 4.5-5 días de gestación, implantándose horas más tarde en la pared uterina (20), en el humano el blastocisto llega a la cavidad uterina 5-6 días después de la ovulación (21). La pérdida de la zona pelúcida es efectuada por una enzima tipo tripsina que digiere la matriz glicoproteica de la misma y es sintetizada por el trofoectodermo mural (22). El blastocisto es capaz de romper la zona pelúcida (ZP) en el interior del útero, in vitro o en lugares ectópicos, lo que indica que no necesita la participación obligada del endometrio. Sin embargo, en las condiciones descritas, el “hatching” se retrasa al menos un día comparado con la rotura de la ZP que ocurre intraútero. Esto indicaría que la presencia de enzimas uterinas in vivo cumpliría una función importante en este proceso. La rotura de la ZP no significa la capacidad de adhesión instantánea; esta capacidad debe ser adquirida en un período que oscila entre minutos y horas. En este estadio de pre-contacto no se observa relación entre el trofoectodermo y el epitelio uterino (23).
Figura 3: Blastocisto en proceso de eclosión (“hatching”). En la imagen se puede observar la estrangulación presente en el blastocisto ocasionada por la rotura de la zona pelúcida (ZP). MCI: macizo celular interno, TB: trofoblasto / trofoectodermo. Modificado de www.advancedfertility.com/blastocystmultiples.htm
2. Estadio de aposición
En el comienzo de la implantación, durante el estadio de aposición (Figura 4), la membrana plasmática de las células trofoblásticas y de las células epiteliales uterinas se encuentran yuxtapuestas y separadas por una mínima distancia. Una red especializada de filamentos submembranosos permite la unión estable entre estas células (2). Durante este período, el blastocisto está íntimamente conectado con estas células uterinas que dejan su forma sobre las membranas celulares del trofoblasto. En este momento se establece un verdadero contacto celular entre los tejidos uterinos y embrionarios aunque la conexión morfológica entre blastocisto y endometrio aún no se ha producido (23).
El blastocisto humano mide aproximadamente 300 µm y la luz uterina se ha estrechado, siendo prácticamente virtual. El blastocisto se coloca habitualmente en una zona determinada del útero dependiendo de la especie; en humanos es el fundus uterino y un tercio superior de la cara posterior uterina. Esto es importante porque va a determinar la localización de la placenta. En animales con múltiples crías (polytocous), los blastocistos mantienen un espacio constante entre ellos. La MCI que dará origen al embrión ocupa un lugar específico dependiente de la especie. En la especie humana se encuentra en la zona en la que se va a desarrollar el trofoblasto invasor (el trofoectodermo polar, el más cercano a la MCI), mientras que en el ratón se encuentra en el lado opuesto al trofoblasto invasor (el trofoectodermo mural, el más lejano a la MCI) (23).
Es importante nombrar la L-selectina, la cual está críticamente involucrada en la fase de aposición embrionaria (24). Las moléculas que participan en la unión con la L-selectina son carbohidratos y están localizados sobre el epitelio luminal en el momento de la implantación, mientras que el trofoectodermo expresa fuertemente L-selectina luego de la eclosión del blastocisto. El linaje de las células trofoblásticas utiliza la L-selectina para unirse al epitelio uterino a través de ligandos de oligosacáridos; cuando la L-selectina es bloqueada con anticuerpos específicos la adhesión del embrión al epitelio se ve perjudicada (24). Un posible candidato como substrato para la unión de las mucinas que expresa el epitelio uterino (MUC1) al embrión incluye a la L-selectina (25). Sin embargo la función de la L-selectina y su participación en el proceso implantatorio es aún muy controvertida (26).
3. Estadio de adhesión
La adhesión es el resultado de los cambios moleculares en la superficie del trofoblasto y del endometrio (Figura 4). Este proceso es particularmente importante ya que está implicada la adhesión de superficies apicales de células de dos orígenes distintos (27). Esta adhesión podría estar mediada por la inducción esteroidea (28) y/o embrionaria (29) de una o más moléculas de adhesión en la superficie celular del epitelio luminal en el momento de la llamada ventana de implantación.
El embrión, a medida que se acerca a la superficie epitelial, es probable que se encuentre inicialmente con el glicocalix epitelial, el cual es más abundante en el epitelio humano durante el período implantatorio. Uno de los componentes singulares de esta capa es la mucina (30).
La mucina MUC1 se expresa en el epitelio luminal a lo largo del ciclo menstrual. El estudio in vivo de la regulación hormonal muestra que la progesterona, a diferencia del estradiol, tiene un efecto sobre la presencia de esta molécula en el epitelio luminal. Se ha propuesto que MUC1 funcionaría como molécula de anti adhesión ya que sobresale 200-500 nm de la membrana, mientras que la mayoría de las proteínas existentes en la superficie celular permanecen dentro de los límites del glicocalix, el cual es aproximadamente de 10 nm de grosor. Por consiguiente, MUC1 podría inhibir la interacción entre el embrión y las moléculas de adhesión apicales del epitelio endometrial materno, creando una barrera que impediría la implantación del embrión (31).
Entre las moléculas de adhesión más relevantes en el proceso de implantación se encuentran las integrinas, presentando una expresión elevada en la mayoría de tejidos placentarios, son receptores de la matriz extracelular compuesta mayoritariamente de fibronectina, vitronectina y colágeno tipo IV, las cuales poseen la secuencia RGD (Arg-Gly-Asp) reconocida por las integrinas; además existen otras secuencias diana que interaccionan con las integrinas. Parecen cumplir un papel importante en la adhesión ya que la expresión de integrina b3 se ve reducida en mujeres infértiles (32). Además el blastocisto es capaz de aumentar selectivamente la expresión de esta molécula a través del sistema de la interleuquina-1 (29). Una vez que el blastocisto ha atravesado la membrana basal, la migración del trofoblasto invasivo de primer trimestre necesita, al menos in vitro, una expresión de integrinas a5 y b1. Esta migración se encuentra estimulada por el Factor de Crecimiento similar a Insulina II (IGF-II) y por la Proteína de unión al Factor de Crecimiento similar a Insulina I (IGFBP-I) y puede ser inhibida por el Factor de Crecimiento Transformante b (TGF-b) (33).
Uno de los factores de crecimiento que son reconocidos por poseer una función importante en el proceso reproductivo es el factor de crecimiento epidermal de unión a Heparina (HB-EGF) (34) y pueden unir dos receptores EGFR (ErbB1) y ErbB4 (HER4) (35). Estudios recientes (36) han identificado factores que modulan la expresión de HB-EGF, EGFR, y ErbB4 en células endometriales estromales in vitro incrementándolos por cAMP, que actúa como inductor de la decidualización del estroma endometrial. Asimismo, dicho estudio demostró que la producción de HB-EGF soluble y transmembrana está modulada diferencialmente por TNFα y TGFβ, sugiriendo que dicho factor posee una función en la maduración endometrial, la mediación de la decidualización y la reducción de la apoptosis en el estroma inducida por TNFα y TGFβ.
4. Estadio de invasión
La implantación de un embrión en el endometrio materno es el primer paso que conduce a la placentación y se asegura que el embrión sea provisto de un adecuado suministro de sangre. En la etapa de invasión (Figura 4), la extensión que el embrión invade varía considerablemente entre los mamíferos, pero en todas las especies, ocurre una remodelación del endometrio materno en el sitio de implantación. Las barreras que deben traspasarse para establecer conexiones con el suministro sanguíneo incluyen la membrana basal del epitelio uterino y del endotelio y, en un rango variable, la matriz intersticial endometrial que da soporte al estroma. La agresividad del trofoblasto es por el contrario solamente vista en células malignas, y la invasión trofoblástica comparte muchas de las características de la invasión y metástasis tumoral. La diferencia fundamental es que la invasión trofoblástica está rigurosamente controlada mientras que la invasión tumoral progresa sin moderación (37).
El mecanismo por el cual el trofoblasto penetra en el epitelio uterino, haciendo contacto con la sangre materna y la medida en que invade al endometrio materno, varía considerablemente de una especie a otra. El objetivo principal en la implantación es asegurar que las células trofoblásticas se anclen firmemente en el estroma endometrial. Estudios ultraestructurales han revelado que hay diferentes modelos de invasión en mamíferos. Según el tipo de penetración del epitelio endometrial en distintas especies se han descrito diferentes estrategias de invasión (12, 38): en ratón y rata, la adhesión del blastocisto al epitelio luminal desencadena localmente la apoptosis epitelial en el sitio de adhesión facilitando la penetración de las células trofoblásticas al estroma a través de la capa de epitelio luminal; en cobayos, el trofoblasto sincicial hace protrusions focales a través de la zona pelúcida y penetra entre las células epiteliales atravesando la membrana basal e introduciéndose en el estroma, originando una placentación epiteliocorial con lo que el intercambio materno-fetal tiene que cruzar el trofoblasto-epitelio-endotelio; en conejos, agrupaciones de células trofoblásticas (protuberancias trofblásticas) se fusionan con el epitelio luminal para formar el simplasma. Tras la fusión los núcleos maternos son fagocitados y este sincicio pasa a estar regido por el embrión; en primates, el trofoblasto sincicial, que se forma en cercania del macizo celular interno, se introduce entre las células epiteliales uterinas y penetra la lámina basal. Las células trofoblásticas desplazan, disocian y sustituyen a las células epiteliales estableciendo una placentación hemocorial, en la cual la sangre materna en el espacio intervelloso está en contacto directo con el trofoblasto.
La invasión que se produce en la placentación hemocorial es similar a la invasión de los tumores malignos. Sin embargo, a diferencia de éstos, en un embarazo normal este proceso es autolimitado y controlado por ambos, útero y trofoblasto. La invasión es debida a la producción de proteasas unidas a la membrana del trofoblasto o secretadas al espacio extracelular. En el momento adecuado, estas proteasas serán anuladas por inhibidores específicos producidos tanto por la decidua como por el mismo embrión, limitando así la capacidad invasiva del trofoblasto.
El control de este proceso invasivo debe ser controlado exhaustivamente para prevenir posibles invasiones patológicas como ocurre en los casos de placenta acreta o en la preeclampsia (39). Este control es mediado por diversas proteasas que degradan la matriz extracelular, entre ellas las serinproteasas, metaloproteasas y colagenasas (40).
Figura 4: Distintos estadios del proceso implantatorio de un blastocisto humano: pérdida de la zona pelúcida, aposición, adhesión e invasión.
EL SISTEMA INMUNOLÓGICO EN LA IMPLANTACIÓN EMBRIONARIA
El endometrio y otros órganos del sistema reproductor contienen células del sistema inmune que pueden desempeñar papeles específicos en la función reproductora. La población leucocitaria de un endometrio normal suele ocupar un 10-15% del estroma, incrementando hasta un 20-25% en la fase secretora tardía premenstrual (41). La mayor parte de esta población está compuesta por linfocitos T y macrófagos que se distribuyen por el estroma de forma difusa o formando agregados periglandulares estromales (42). Las células NK (natural killer) se encuentran principalmente en el estroma y en el interior de los folículos linfoides. La presencia y número de determinados tipos celulares se ha correlacionado con su papel en la respuesta inmune local y su implicación en el proceso de la implantación (41). En cuanto a las moléculas y mediadores que participan en la implantación embrionaria existe una serie de moléculas de acción local (autocrino-paracrino) como las citoquinas (43, 44).
Células NK
Las células NK constituyen un 10-15% de los linfocitos circulantes y se identifican principalmente por la expresión en su membrana de las moléculas CD56 y CD16. Según la densidad con la que expresan CD56 en la superficie celular se distinguen dos subpoblaciones NK: CD56dim CD16bright y CD56bright CD16dim. Aproximadamente el 90% de las NK en la sangre periférica humana poseen una expresión intermedia o baja de CD56 (CD56dim) y una alta expresión de CD16 (CD16bright). El 10% restante tiene un fenotipo caracterizado por una alta expresión de CD56 y una baja expresión de CD16 (CD56bright CD16dim). En contraposición la población CD56bright predomina en los ganglios linfáticos, expresan altos niveles de los receptores NKG2/CD94 y KIR y muestran baja actividad citotóxica, pero a diferencia de CD56dim producen y secretan grandes cantidades de diversas citoquinas inmunorregulatorias (INF-g, TNF-a, TNF-b, IL-10, IL-13 y GM-CSF). Durante el primer trimestre del embarazo, hasta el 40% de las células de la decidua son leucocitos; las células NK, ahora llamados NK uterinas, son los leucocitos predominantes. Debido a esta asociación temporal y al contacto directo que establecen con el trofoblasto, se ha sugerido que las células NK desempeñan un papel crucial en la gestación.
El feto en desarrollo presenta todos los genes MHC paternos, aunque el sistema inmunológico materno no suele generar una respuesta de rechazo contra él. Las células inmunes de la decidua materna entran en contacto con el feto a través del trofoblasto. Este trofoblasto carece de MHC de clase I y II. El trofoblasto extravelloso sólo expresa las MHC de clase Ib, HLA-G, HLA-E y HLA-C.
El contacto entre las células inmunes maternas y el feto ocurre entre: la sangre materna en contacto con el sincitiotrofoblasto, el cual carece de antígenos HLA y por lo tanto no pueden proveer un estímulo antigénico y la decidua materna en contacto con el trofoblasto extravelloso que sólo expresa moléculas HLA-C. La ausencia de moléculas HLA de clase II no le permite presentar antígenos a linfocitos T CD4+. Establecido el embarazo, se activan receptores inhibitorios en las células NK (cuyos ligandos específicos son HLA C, G y E) que protegen al trofoblasto de su potencial actividad citotóxica.
En la decidua materna las células NK uterinas (CD56bright) constituyen el 70% de la población NK. La función de las células NK durante el embarazo estaría relacionada con el reconocimiento de las células del trofoblasto y la regulación de su capacidad invasiva ya que dicha población declina una vez completada la invasión del trofoblasto. La presencia de receptores activadores en células NK que interactúan con HLA-C sugiere que también puedan ser transmitidas señales estimulantes. Estas señales pueden inducir a las células NK presentes en la decidua materna a alterar su repertorio de citoquinas y responder de manera variable a la placenta que se implanta (45). Es importante destacar que a través de interacciones con las células trofoblásticas las NK uterinas controlan la vascularización y la invasión de la placenta. Además son capaces de inhibir su citotoxicidad a través de la expresión del hetrodimero inhibitorio NkG2A-CD94 que interactúa con HLA-E. (46) y de promover la liberación de TNFa y bajas cantidades de IFNg (factores angiogénicos) a través de la interacción de HLA-G soluble con KIRDL4 promoviendo la vascularización de la decidua durante el embarazo.
La información referente al papel de las células NK en la aceptación de la implantación del embrión es aún conflictiva. Se sugirió que la capacidad de los receptores NK en reconocer a las moléculas HLA de clase I paternas a través de receptores de activación sería muy importante dado que la falta de reconocimiento conduciría a las células NK a lisar el trofoblasto y por ende a la falla del embarazo (45).
Células T regulatorias
Se ha descripto la existencia de una expansión sistémica de células T regulatorias en todos los órganos linfoides y dichas células se acumulan especialmente en el útero de ratones hembra y en mujeres preñadas (tanto en embarazos singenéicos como alogéneicos). Dichas células expresan CCR5 (ratones) el cual interactúa con CCL4 permitiendo la acumulación en el útero (47).
Las células T regulatorias tienen un efecto supresor potente hacia antígenos de origen fetal y su número en decidua es significativamente menor en muestras de abortos espontáneos que en muestras de abortos programados. Estudios recientes demostraron que las células T regulatorias CD4(+)CD25(+) aumentan la actividad IDO (indolamina 2,3-dioxygenasa) en células dendríticas y macrófagos. Las células T regulatorias por activación de antígenos fetales expresan CTLA-4 en la superficie celular que a través de la interacción con B7 en las células dendríticas induce la producción de IFNg. Éste estimula la síntesis de IDO en las células dendríticas y en los macrófagos residentes y así inhibirían la proliferación de linfocitos T. Existen otros mecanismos que involucran interacciones célula-célula (por ejemplo a través de TGFb1 y Gal-1) y por la producción de factores solubles (IL-10 y TGFb) (Betz AJRI 2007 58:238). Las células T regulatorias CD4(+)CD25(+) y la enzima IDO podrían cooperar en la inducción de la tolerancia durante un embarazo. La deficiencia de estas células estaría asociada a la pérdida de embarazos tempranos post-implantatorios y a abortos espontáneos en modelos animales y bajos niveles asociados a abortos recurrentes en humanos. Es asi que estas células poseerían un papel fundamental en la inducción y mantenimiento de la tolerancia (48).
Citoquinas
Las citoquinas son pequeñas glicoproteínas con numerosas funciones fisiológicas. Sus acciones están asociadas con la mayor parte de los procesos que ocurren en el cuerpo en la respuesta inmunológica. La familia de citoquinas se caracteriza por ser pleiotrópicas y por su redundancia, a menudo muchas de las moléculas se solapan en sus funciones o poseen roles opuestos (49). Muchas citoquinas están implicadas en un amplio espectro de funciones biológicas en el sistema reproductor y participan en el proceso implantatorio (50).
Citoquinas Th1 y Th2
Los linfocitos T CD4 cumplen un papel importante en regular y dirigir la respuesta inmune a través de las citoquinas que producen. Dentro de esta población de células existe una población llamada Th0 que es funcionalmente indiscriminada inicialmente y puede diferenciarse en dos subpoblaciones de linfocitos llamados células Th1 y Th2. Los linfocitos T CD4 con actividad Th1 producen principalmente interleuquinas (IL) IL-1, IL-2, IL-12, IL-15, IL-18, interferon gamma (IFN-g) y factor de necrosis tumoral- alfa (TNF-a), mientras las células Th2 son la fuente de IL-4, IL-5, IL-10, IL-13 y factor estimulador de colonias de granulocitos y macrófagos (GM-CSF) (51). La inmunidad celular es mayormente dependiente de la actividad de las células Th1, contrariamente las células Th2 están involucradas principalmente en la regulación de la respuesta humoral. Los macrófagos y las “Natural killer” (NK) siendo los componentes celulares principales de la inmunidad innata pueden influenciar la desviación funcional de los linfocitos T CD4 por la producción adecuada de citoquinas. Para que la población de células Th0 se diferencie en sus subpoblaciones y desarrollen su actividad, requieren IFN-g e IL-12 para la subpoblación Th1 e IL-4 para la adquisición de la actividad correspondiente a la subpoblación Th2 (52).
Durante un embarazo existe una fuente adicional de citoquinas Th1 y Th2: el epitelio decidual y estroma, el cito y el sinciotrofoblasto, el corion, el amnios y las células de Hofbauer en la vellosidades coriónicas. Las citoquinas originadas de estos tejidos participan en la inducción de la tolerancia materna por la presencia del feto, la regulación local de la respuesta inmune contra factores infectivos, la modulación de la producción hormonal de la placenta y la remodelación de tejidos durante la invasión trofoblástica (44, 53, 54).
Actividad Th2 durante el embarazo
En 1993, Wegmann y colaboradores (55) desarrollaron una hipótesis inmunotrófica la cual postulaba que durante un embarazo exitoso el balance Th1/Th2 está fuertemente inclinado hacia la actividad Th2 y de acuerdo con esta hipótesis la actividad Th1 es incompatible con un embarazo a término.
Aún durante la fase lutea del ciclo menstrual las células endometriales indican la expresión de ARNm incrementado para citoquinas tipo Th2 (IL-4, IL-6) comparadas con las Th1 (IL-2, IL-12, IFN-g) (56). La interleuquina-4 es secretada por los linfocitos infiltrados en el endometrio y estimula la producción del factor inhibidor de leucemia (LIF) en el tejido endometrial la cual es una citoquina de gran importancia en el periodo peri-implantatorio así como también junto con el factor de crecimiento transformante-b (TGF-b) facilita el proceso de invasión trofoblástica (57), decidualización endometrial (58, 59), regula la interacción entre linfocitos deciduales y el trofoblasto y controla la angiogénesis dentro de las vellosidades trofoblásticas (junto con IL-6) (60). Algunos de los procesos descriptos son dependientes de progesterona (61). La progesterona influencia la red de citoquinas por la disminución de la actividad Th1, de TNF-a en la fase lutea del tejido endometrial (62) y por la inducción de la síntesis de TGF-b en células endometriales y linfocitos deciduales T TCRgd+ (63). La secreción de LIF in vitro es inhibida por la actividad de citoquinas Th1 (IL-12, INF-g). De modo similar, durante experimentos in vitro las citoquinas Th1 (IL-1, TNF-a) influenciaron negativamente el proceso de decidualización endometrial. Además fueron descriptas bajas concentraciones de LIF, IL-4, IL-6 e IL-10 en tejido endometrial y en decidua en mujeres con múltiples fallas de implantación (64) y abortos recurrentes. Durante la implantación, el embrión puede activamente (vía TGF-b y prostaglandina PGE2) modular las interacciones con la decidua, mayormente disminuyendo la secreción de Th1 (IL-2, TNF-a) e incrementando la producción de citoquinas Th2 por los linfocitos deciduales locales (65). Además, el embrión puede secretar citoquinas Th2 (IL-10) y TGF-b los cuales regulan negativamente y autocrinamente las propiedades invasivas del trofoblasto (66) y paracrinamente detienen las citoquinas pro-inflamatorias Th1 (TNF-a, IFN-g) producidos por el tejido materno (67).
Experimentos realizados en el primer trimestre de embarazos normales han mostrado que los linfocitos de sangre periférica de mujeres embarazadas secretan in vitro más citoquinas Th2 (IL-4, IL-10) y menos Th1 (IL-2, IFN-g) comparados con mujeres no embarazadas (68). El balance hacia la producción de citoquinas Th2 también fue confirmado in vivo con la sobreexpresión de genes para IL-4 e IL-6 y una expresión menor de IL-1b e IFN-g en linfocitos de sangre periférica. Además, el número de linfocitos que secretan IL-4 se incrementa progresivamente en el transcurso del embarazo.
La progesterona parece ser el próximo posible inductor de la actividad incrementada de las células Th2 durante el embarazo. Esta hormona estimula a los linfocitos a producir el factor bloqueante inducido por progesterona (PIBF) el cual tiene la capacidad de intensificar la producción de citoquinas Th2 in vitro (IL-3, IL-4, IL-10) y bloquear la secreción de IL-12 por los linfocitos periféricos de mujeres embarazadas. La progesterona también es un factor beneficioso para la producción de GM-CSF y TGF-b. La gonadotrofina coriónica humana (hCG) parece cumplir algún papel en el balance Th1/Th2 (69)
Por otra parte la actividad incrementada de Th2 es acompañada por una predominancia en el número de células Th2 y las células Th1 son más vulnerables al mecanismo de apoptosis dependiente de Fas-Fas-L en la sangre periférica durante el embarazo (70).
El trofoblasto, la decidua, las membranas coriónicas y amnióticas todas son fuente de citoquinas Th2 (IL-4, IL-6, IL-10, IL-13 y TGF-b) (71). Estas citoquinas crean el ambiente propicio para el desarrollo del balance hacia la vía Th2 y permiten restringir los efectos pro-inflamatorios de IL-1b y TNF-a así como también de prostaglandinas e IL-18. EL blanco de la actividad inhibitoria de Th2 son probablemente NK citotóxicas deciduales y macrófagos (72). Estos mecanismos son posiblemente por los cuales se previene la iniciación temprana del parto (73). Esto es cierto a pesar del hecho que el trofoblasto es capaz de producir citoquinas Th1 (IL-1b, IL-2, TNF-a) que es, sin embargo, acompañado de la secreción paralela de receptores específicos los cuales limitan los efectos Th1 excesivos (74).
Actividad Th1 durante el embarazo
Difícilmente podría aceptarse que la evolución “permitiera” la existencia de la actividad Th1 y que no “se encontrase” alguna aplicación razonable para ésta, durante el embarazo. Por supuesto que esta actividad Th1 tiene una función y la lleva a cabo en lugar, espacio y tiempo muy bien definidos y, además, es una respuesta no exagerada. Existen situaciones durante el embarazo en las que la actividad Th1 no sólo acompaña sino que predomina sobre la actividad Th2, ejemplos de estas situaciones son: el periodo peri-implantatorio temprano y el trabajo de parto temprano y a término. Por otra parte está bien documentado que la reacción excesiva de Th1 está asociada a abortos espontáneos recurrentes (75) y podría estar implicado en un embarazo complicado con pre-eclampsia. Pero aún la secreción Th2 aumentada en la interfase feto-materna podría estar involucrada en la patología de aborto y pre-eclampsia (76, 77, 78).
Los estudios realizados sobre implantación en ratones han definido este último tiempo la importancia de las citoquinas Th1 en este proceso. Los componentes del plasma seminal influencian la expresión de quimioquinas por las células endometriales que, secundariamente, activa elementos de la inmunidad innata incluyendo neutrófilos y macrófagos en el estroma endometrial y la cavidad uterina. Los neutrófilos activados secretan especies reactivas de oxígeno (ROS) y debris celular fagocitado mientras que los macrófagos activados se transforman en la fuente más importante de citoquinas Th1, IL-1b y TNF-a. Esta reacción de inflamación local tiene un significado multifactorial para los próximos pasos de la implantación. La cavidad uterina está libre de elementos espermáticos y de microorganismos. La actividad Th1 produce un ambiente propicio para la presentación de aloantígenos paternos a las células inmunocompetentes maternas. Esto también induce cambios en el número y composición de leucocitos endometriales, activa factores de crecimiento y angiogénicos, reconstruye la matriz extracelular, activa las células estromales y endoteliales y de ese modo se prepara el tejido materno para la implantación embrionaria. Las citoquinas Th1 (IFN-g, TNF-a, IL-2) estimulan la actividad citolítica de las células NK deciduales y linfocitos T “killer” activados por linfoquinas (LAK) los cuales son capaces de restringir la proliferación e invasión trofoblástica excesiva. La actividad inicial de las células Th1 induce a los leucocitos endometriales y al mismo embrión a producir citoquinas Th2, LIF y TGF-b (79, 80).
También se han estudiado mecanismos similares durante el periodo peri-implantatorio en el humano. Las citoquinas Th1 presentes (IL-1b) en el ambiente uterino, que son resultado de la respuesta inflamatoria a los componentes seminales paternos, pueden estimular metaloproteasas trofoblásticas (MMP-9) y de ese modo incrementar sus propiedades invasivas (53) y pueden mediar la neoangiogénesis induciendo la transcripción del gen del factor de crecimiento epitelial-vascular (VEGF) (81). La IL-1b junto con el TNF-a estimula la secreción de LIF que tiene un impacto positivo sobre la diferenciación y el crecimiento trofoblástico. Las células embrionarias son además capaces de secretar IL-2 la cual parecería cumplir un rol inmunoestimulador para las células NK deciduales las cuales junto con los macrófagos que secretan IFN-g, IL-12 y TNF-a pueden restringir la profundidad de la infiltración trofoblástica, de ese modo las citoquinas Th1 son potentes inductores de la apoptosis trofoblástica (53, 82, 83, 84). Los interferones pueden ser secretados por el cito y sinciciotrofoblasto especialmente bajo la estimulación de GM-CSF. Tienen una fuerte actividad antiviral y cumplen un papel inmunomodulador ya que pueden disminuir la actividad proliferativa de los linfocitos T y B maternos así como también causar el desprendimiento del antígeno soluble leucocitario humano (sHLA) de la superficie de las células trofoblásticas. El antígeno sHLA funciona como factor inmunosupresor de linfocitos citotóxicos y macrófagos maternos. Los interferones pueden también incrementar la expresión de moléculas HLA-G sobre el citotrofoblasto (85), aumentar la producción de citoquinas Th2 (IL-6, GM-CSF) en el estroma endometrial y junto con IL-12, IL-15, IL-18 y VEGF influenciar localmente la angiogénesis en el útero (86). Teniendo en cuenta estos datos no se puede afirmar que la actividad Th1 controlada sea perjudicial para el desarrollo de un embarazo exitoso.
CONCLUSIÓN
La implantación es un proceso progresivo y versátil en el que el blastocisto se aposiciona, adhiere y, finalmente, invade la superficie subyacente del endometrio. Resulta evidente que tal proceso requiera de una preparación previa, tanto del endometrio que va a recibir al embrión durante la “ventana de implantación” como del embrión que será recibido por el endometrio. El desarrollo sincronizado del embrión al estadio de blastocisto y la diferenciación del útero hasta hacerse receptivo, son críticos para este proceso. Para ello, se debe establecer una “comunicación cruzada” entre los tejidos maternos y fetales dicha comunicación entre el endometrio materno y el embrión durante este proceso es muy compleja y sus detalles no se conocen aún. La implantación involucra respuestas inflamatorias y por lo tanto se requiere una asociación e interacción entre mediadores de estas respuestas, tales como prostaglandinas, quemoquinas y citoquinas. El balance adecuado en tiempo y espacio de las moléculas que participan en el diálogo materno – embrionario durante la implantación, entre ellas citoquinas Th1/Th2, es crucial para el desarrollo de un nuevo individuo.
A pesar de los progresos significativos en investigación en reproducción, todavía quedan sin contestar preguntas fundamentales sobre el proceso de implantación, el cual es el factor limitante más importante en el establecimiento de un embarazo. Es importante destacar que, en humanos, la eficiencia de este proceso es marcadamente baja y que el éxito del mismo no supera al 30% de los casos. Una falla en la implantación es un factor fundamental en la determinación del éxito de ambos, el embarazo espontáneo y la reproducción asistida. La identificación de moléculas (o los niveles de expresión de las mismas) que afecten los mecanismos de señalización complejos entre el embrión y el útero durante el diálogo materno-embrionario podría ser de utilidad para ayudar a aquellas parejas con problemas de infertilidad.
BIBLIOGRAFÍA
1. Acosta, A., 1994. Implantación humana del pre-embrión: aspectos básicos, clínicos e investigación futura. Rev Lat Amer Est Fert, 8: 4-20.
2. Denker HW, 1993. Implantation: a cell biological paradox. J exp Zool. 266(6):541-558
Aplin JD, 2000. The cell biological basis of human implantation. Baillieres Best Pract Res Clin Obstet Gynaecol. 14(5): 757-764
4. Psychoyos A., 1973. Hormonal control of ovoimplantation. Vitamins and Hormones. 31:201-256.
5. Paria BC, Reese J, Das SK, Dey SK., 2002. Deciphering the cross-talk of implantation: advances and challenges. Science, 296(5576):2185-2188.
Lessey BA, Damjanovich L, Coutifaris C, Castelbaum A, Albelda SM, Buck SA, 1992. Integrin adhesión molecules in the human endometrium. Correlation with the normal and abnormal menstrual cicle. J clin Invest. 90: 188-195.
Simón C, Martin JC, Pellicer A., 2000. Paracrine regulators of implantation.Baillieres Best Practice and Research. Clinical Obstetrics and Gynaecology, 14(5):815-826.
Miller JF, Williamson E, Glue J, Gordon YB, Grudzinskas JG, Sykes A., 1980. Fetal loss after implantation. A prospective study. Lancet, 2(8194):554-556.
Achache H y Revel A., 2006. Endometrial receptivity markers, the journey to successful embryo implantation. Human Reproduction Update. 2(6): 731–746.
Enders AC, Chavez DJ y Schlafke S Comparison of implantation in utero and in vitro. In Cellular and Molecular Aspects of Implantation, Eds SR Glasser & D Bullock. New York: Plenum Press. 1981, 365–382.
11. Alberts B, Bray D, Lewis J, Raff M y col. Biología molecular de la célula, Ed. Omega, Barcelona (España) 1990, 884-892.
12. Wang H y Dey S., 2006. Roadmap to embryo implantation: clues from mouse models. Nature Reviews. Genetics. 7:185-199.
Sueoka N, Sato A, Eguchi H, Komiya K, Sakuragi T, Mitsuoka M, Satoh T, Hayashi S, Nakachi K, Sueoka E. 2007. Mutation profile of EGFR gene detected by denaturing high-performance liquid chromatography in Japanese lung cancer patients. J Cancer Res Clin Oncol. 133(2):93-102.
Diedrich K, Fauser B, Devroey P, Griesinger G., 2007. The role of the endometrium and embryo in human implantation. Human Reproduction Update. 13 (4): 365–377.
15. Simón C, Piquette G, Francés A, Polan y ML., 1993. Localization of interleukin-1 type1 receptor and interleukin-1b in human endometrium throughout the menstrual cycle. J. Clin. Endocrinol. Metab. 77:549-555.
Waites GT, Wood PL, Walker RA, Bell SC., 1988. Immunohistological localization of human secretory "pregnancy associated endometrial alpha-2 globulin" (alpha-2 PEG) during the menstrual cycle. J. Reprod. Fertil. 82: 665-672.
Wahlstrom T, Seppala M., 1984. Placental protein 12 (PP12) is induced in endometrium by progesterone. Fertil. Steril. 41: 781-784.
Kennedy TG., 1985. Prostaglandins and blastocyst implantation. Prostaglandins Perspectives. 1: 1-3.
Murphy CR., 1995. The cytoskeleton of uterine epithelial cells: a new player in uterine receptivity and the plasma membrane transformation. Hum. Reprod. Update. 1: 567-580.
Perry JS. 1981. The mammalian fetal membranes. J Reprod Fertil. 1981 Jul;62(2):321-35.
21. Bischof P, Campana A, 1996. A model for implantation of the human blastocyst and early placentation. Hum Reprod Update. 2(3):262-70.
22. Florman HM, Bechtol KB, Wassarman PM., 1984. Enzymatic dissection of the functions of the mouse egg's receptor for sperm. Dev Biol. 106(1):243-55.
23. Simon C, Dominguez F. 2004. Embryonic-endometrial interactions at implantation in humans. Gynecol Obstet Invest. 57(1):28-30.
24. Genbacev OD, Prakobphol A, Foulk RA, Krtolica AR, Ilic D, Singer MS, Yang ZQ, Kiessling LL, Rosen SD, y Fisher SJ. 2003. Trophoblast L-selectin-mediated adhesion at the maternal-fetal interface. Science. 299, 405–408.
Hey NA, Graham RA, Seif MW y Aplin JD. 1994. The polymorphic epithelial mucin MUC1 in human endometrium is regulated with maximal expression in the implantation phase. J. Clin. Endocrinol. Metab. 78, 337–342.
Domínguez F, Yañez-Mo M, Sanchez-Madrid F y Simón C., 2005. Embryonic implantation and leukocyte transendothelial migration: different processes with similar players? FASEB J. 19, 1056–1060.
27. Enders AC 1994. Contributions of comparative studies to understanding mechanism of implantation. En: Endrocrinology of embryo-endometrium interactions. 11-16.
28. Aplin JD. 1997. Adhesion molecules in implantation. J. Reprod. Fertility. 2: 84-93.
Simón C, Gimeno MJ, Mercader A, O'Connor JE, Remohí J, Polan ML, Pellicer A., 1998. Embryonic regulation of integrins b3, a4 and a1 in human endometrial epithelial cells in vitro. J. Clin. Endocrinol. Metabol. 82: 2607-2616.
Meseguer M, Pellicer A, Simon C., 1998. MUC1 and endometrial receptivity. Mol. Hum. Reprod. 4(12):1089-1098.
Aplin JD. 1996. The cell biology of human implantation. Placenta, 17: 269-275.
Lessey BA, Castelbaum AJ, Buck CA, y col., 1994. Further characterization of endometrial integrins during the menstrual cycle and in pregnancy. Fertil. Steril, 62: 497-506.
Irving JA, Lala PV, 1995. Functional role of the cell surface integrins on human trophoblast cell migration: regulation by TGF-b, IGF-II and IGFBP-1. Exp. Cell Res. 217: 419-427.
34. Raab G, Klagsbrun M, 1997. Heparin-binding EGF-like growth factor. Biochim Biophys Acta; 1333:F179–F199.
35. Elenius K, Corfas G, Paul S, Choi CJ, Rio C, Plowman GD, Klagsbrun M, 1997. A novel juxtamembrane domain isoform of HER4/ErbB4: isoform-specific tissue distribution and differential processing in response to phorbol ester. J Biol Chem; 272:26761–26768.
Chobotova K, Karpovich N, Carver J, Manek S, Gullick W, Barlow D y Mardon H. 2005. Heparin-Binding Epidermal Growth Factor and Its Receptors Mediate Decidualization and Potentiate Survival of Human Endometrial Stromal Cells. J Clin Endocrinol Metab. 90(2): 913–919.
37. Salamonsen LA, 1999. Role of proteases in implantation. Reviews of Reproduction. 4:11-22.
Schlafke S, Enders AC. 1975. Cellular basis of interaction between trophoblast and uterus at implantation. Biology of Reproduction. 12(1):41-65.
Zhou Y, Damsky CH, Chiu K, Roberts JM, Fisher SJ. 1993. Preeclampsia is associated with abnormal expression of adhesion molecules by invasive cytotrophoblasts. J Clin Invest. 91(3):950-960.
40. Alexander CM, Werb Z. 1991. Extracellular matrix degradation. Cell Biology of Extracellular Matrix. 255-302.
Bulmer J, Jonhson PM, 1985. Immunohistochemical characterization of the decidual leukocytic infiltrate related to endometrial gland epithelium in early human pregnancy. Immunology., 55: 33-44.
Kamat BR, Isaacson DM, Path FRC, 1986. The inmunocytochemical distribution of leukocytic subpopulation in human endometrium. A. J. P. 127: 66-73.
Simón C, Gimeno MJ, Mercader A, Francés A, García-Velasco JA, Remohí J, Polan ML, Pellicer A, 1996. Cytokines-adhesion molecules-invasive proteinase. The missing paracrine/autocrine link in embryonic implantation? Mol. Hum. Reprod. 2:405-424.
Makrigiannakis A, Minas V. 2007. Mechanisms of implantation. Reprod Biomed Online. Review. 14(1):102-109.
Fainboim L, Geffner J, Trevani A. Introducción a la inmunología humana. Buenos Aires, 2005. 5a edición. Editorial Panamericana. pp 53-93
Navarro F, Llano M, Bellón T, Colonna M, Geraghty DE, López-Botet M. 1999 The ILT2(LIR1) and CD94/NKG2A NK cell receptors respectively recognize HLA-G1 and HLA-E molecules co-expressed on target cells. Eur J Immunol. 29: 277-83
Kallikourdis M, Andersen KG, Welch KA, Betz AG. 2007 Alloantigen-enhanced accumulation of CCR5+ 'effector' regulatory T cells in the gravid uterus. Proc Natl Acad Sci U S A. 9;104:594-599.
Saito S, Shima T, Nakashima A, Shiozaki A, Ito M, Sasaki Y. 2007 What is the role of regulatory T cells in the success of implantation and early pregnancy? J Assist Reprod Genet 24: 379-86
Dimitriadis E, White CA, Jones RL, Salamonsen LA. 2005. Cytokines, chemokines and growth factors in endometrium related to implantation. Hum Reprod Update. Review. 11(6):613-630.
Tabibzadeh S, 1994. Role of cytokines in endometrium and the fetomaternal interface. Reprod. Med. Rew. 3: 11-28.
Raghupathy R. 1997. Th1-type immunity is incompatible with successful pregnancy. Immunol Today. Review. 18(10):478-482.
Del Prete G, Maggi E, Romagnani S. 1994. Human Th1 and Th2 cells: functional properties, mechanisms of regulation, and role in disease. Lab Invest. 70(3):299-306.
Bennett WA, Lagoo-Deenadayalan S, Stopple JA, Barber WH, Hale E, Brackin MN, Cowan BD. 1998. Cytokine expression by first-trimester human chorionic villi. Am J Reprod Immunol. 40(5):309-18.
Chaouat G, Dubanchet S, Ledée N. 2007. Cytokines: Important for implantation? J Assist Reprod Genet. 24:491–505.
Wegmann TG, Lin H, Guilbert L, Mosmann TR. 1993. Bidirectional cytokine interactions in the maternal-fetal relationship: is successful pregnancy a TH2 phenomenon? Immunol Today. 14(7):353-356.
Lim KJ, Odukoya OA, Ajjan RA, Li TC, Weetman AP, Cooke ID. 1998. Profile of cytokine ARNm expression in peri-implantation human endometrium. Mol Hum Reprod. 4(1):77-81.
Senturk LM, Arici A. 1998. Leukemia inhibitory factor in human reproduction. Am J Reprod Immunol. Review. 39(2):144-151.
Arici A, MacDonald PC, Casey ML. 1996. Modulation of the levels of interleukin-8 messenger ribonucleic acid and interleukin-8 protein synthesis in human endometrial stromal cells by transforming growth factor-beta 1. J Clin Endocrinol Metab. 81(8):3004-3009.
Tabibzadeh S. 1991. Human endometrium: an active site of cytokine production and action. Endocr Rev. 12(3):272-290.
Jauniaux E, Gulbis B, Schandene L, Collette J, Hustin J. 1996. Distribution of interleukin-6 in maternal and embryonic tissues during the first trimester. Mol Hum Reprod. 2(4):239-243.
Saito S. 2000. Cytokine network at the feto-maternal interface. J Reprod Immunol. Review. 47(2):87-103.
Hambartsoumian E. 1998. Leukemia inhibitory factor (LIF) production by human decidua and its relationship with pregnancy hormones. Gynecol Endocrinol. 12(1):17-22.
Suzuki T, Hiromatsu K, Ando Y, Okamoto T, Tomoda Y, Yoshikai Y. 1995. Regulatory role of gamma delta T cells in uterine intraepithelial lymphocytes in maternal antifetal immune response. J Immunol. 154(9):4476-4484.
Lass A, Weiser W, Munafo A, Loumaye E. 2001. Leukemia inhibitory factor in human reproduction. Review. Fertil Steril. 76(6):1091-1096.
Fortin M, Ouellette MJ, Lambert RD. 1997. TGF-beta 2 and PGE2 in rabbit blastocoelic fluid can modulate GM-CSF production by human lymphocytes. Am J Reprod Immunol. 38(2):129-139.
Roth I, Corry DB, Locksley RM, Abrams JS, Litton MJ, Fisher SJ. 1996. Human placental cytotrophoblasts produce the immunosuppressive cytokine interleukin 10. J Exp Med. 184(2):539-548.
Lavnikova N, Laskin DL. 1995. Unique patterns of regulation of nitric oxide production in fibroblasts. J Leukoc Biol. 58(4):451-458.
Marzi M, Vigano A, Trabattoni D, Villa ML, Salvaggio A, Clerici E, Clerici M. 1996. Characterization of type 1 and type 2 cytokine production profile in physiologic and pathologic human pregnancy. Clin Exp Immunol. 106(1):127-133.
Carp H, Torchinsky A, Fein A, Toder V. 2001. Hormones, cytokines and fetal anomalies in habitual abortion. Review. Gynecol Endocrinol. 15(6):472-483.
Ramsdell F, Seaman MS, Miller RE, Picha KS, Kennedy MK, Lynch DH. 1994. Differential ability of Th1 and Th2 T cells to express Fas ligand and to undergo activation-induced cell death. Int Immunol. 6(10):1545-1553.
Jones CA, Finlay-Jones JJ, Hart PH. 1997. Type-1 and type-2 cytokines in human late-gestation decidual tissue. Biol Reprod. 57(2):303-311.
Clark DA, Arck PC, Jalali R, Merali FS, Manuel J, Chaouat G, Underwood JL, Mowbray JF. 1996. Psycho-neuro-cytokine/endocrine pathways in immunoregulation during pregnancy. Am J Reprod Immunol. 35(4):330-337.
Fortunato SJ, Menon R, Lombardi SJ. 1997. Interleukin-10 and transforming growth factor-beta inhibit amniochorion tumor necrosis factor-alpha production by contrasting mechanisms of action: therapeutic implications in prematurity. Am J Obstet Gynecol. 177(4):803-809.
Lien E, Liabakk NB, Austgulen R. 1996. Detection of soluble receptors for tumor necrosis factor, interleukin-2 and interleukin-6 in retroplacental serum from normal pregnant women. Gynecol Obstet Invest. 41(1):1-4.
Kalu E, Bhaskaran S, Thum MY, Vishwanatha R, Croucher C, Sherriff E, Ford B, Bansal AS. 2008. Serial estimation of Th1:th2 cytokines profile in women undergoing in-vitro fertilization-embryo transfer. Am J Reprod Immunol. 59(3):206-211.
76. Kwak-Kim JY, Chung-Bang HS, Ng SC, Ntrivalas EI, Mangubat CP, Beaman KD, Beer AE, Gilman-Sachs A. 2003. Increased T helper 1 cytokine responses by circulating T cells are present in women with recurrent pregnancy losses and in infertile women with multiple implantation failures after IVF. Hum Reprod. 18(4):767-73.
Wilczyński JR. 2005. Th1/Th2 cytokines balance--yin and yang of reproductive immunology. Eur J Obstet Gynecol Reprod Biol. Review. 122(2):136-143.
Hayakawa S, Fujikawa T, Fukuoka H, Chisima F, Karasaki-Suzuki M, Ohkoshi E, Ohi H, Kiyoshi Fujii T, Tochigi M, Satoh K, Shimizu T, Nishinarita S, Nemoto N, Sakurai I. 2001. Murine fetal resorption and experimental pre-eclampsia are induced by both excessive Th1 and Th2 activation. J Reprod Immunol. 47(2):121-138. Erratum in: J Reprod Immunol 49(1):95.
Robertson SA, Seamark RF, Guilbert LJ, Wegmann TG. 1994. The role of cytokines in gestation. Crit Rev Immunol. 14(3-4):239-292.
Kayisli UA, Mahutte NG, Arici A. 2002. Uterine chemokines in reproductive physiology and pathology. Am J Reprod Immunol. 47(4):213-21.
Taylor RN, Lebovic DI, Hornung D, Mueller MD. 2001. Endocrine and paracrine regulation of endometrial angiogenesis. Ann N Y Acad Sci. 943:109-121.
Aschkenazi S, Straszewski S, Verwer KM, Foellmer H, Rutherford T, Mor G. 2002. Differential regulation and function of the Fas/Fas ligand system in human trophoblast cells. Biol Reprod. 66(6):1853-1861.
Bauer S, Pollheimer J, Hartmann J, Husslein P, Aplin JD, Knöfler M. 2004. Tumor necrosis factor-alpha inhibits trophoblast migration through elevation of plasminogen activator inhibitor-1 in first-trimester villous explant cultures. J Clin Endocrinol Metab. 89(2):812-22.
Marzusch K, Buchholz F, Ruck P, Handgretinger R, Geiselhart A, Engelmann L, Dietl J. 1997. Interleukin-12- and interleukin-2-stimulated release of interferon-gamma by uterine CD56++ large granular lymphocytes is amplified by decidual macrophages. Hum Reprod. 12(5):921-924.
von Rango U, Classen-Linke I, Raven G, Bocken F, Beier HM. 2003. Cytokine microenvironments in human first trimester decidua are dependent on trophoblast cells. Fertil Steril. 79(5):1176-1186.
Wei P, Chen XL, Song XX, Han CS, Liu YX. 2004. VEGF, bFGF, and their receptors in the endometrium of rhesus monkey during menstrual cycle and early pregnancy. Mol Reprod Dev. 68(4):456-462.
ISSN 1666-7948
www.quimicaviva.qb.fcen.uba.arRevista QuímicaViva
Número 2, año 7, Agosto 2008
quimicaviva@qb.fcen.uba.ar