Señalización en la interacción entre bacterias fitopatógenas y su hospedador
Gustavo E. Gudesblat*
Laboratorio de Fitopatología Molecular. Fundación Pablo Cassará Centro de Ciencia y Tecnología Dr. Cesar Milstein Saladillo 2468 C1440FFX Buenos Aires. Argentina
ggudesblat@fundacioncassara.org.ar
Recibido el 08/08/07. Aceptado el 18/08/07.
Resumen
En la interacción de las plantas con bacterias patógenas ocurren complejos procesos de señalización, tanto en el vegetal como en el microorganismo, que determinan que una infección sea exitosa o por el contrario contrarrestada por las defensas del hospedador. El éxito de una infección depende, en gran parte, de que el patógeno sea capaz de inhibir o retardar la activación de las respuestas defensivas de la planta. Diversos estudios recientes comenzaron a esclarecer, a nivel molecular, cómo las plantas detectan la presencia de los patógenos y cómo éstos logran evadir la respuesta defensiva del hospedador.
"Signalling in the interaction between phytopathogenic bacteria and their host"
AbstractIn the interaction of plants with pathogenic bacteria several complex signalling events take place, both in the host and in the microorganism, which determine wether the outcome will be a successful infection or an adequate defense by the host. The success of an infection depends to a large extent on the ability of the pathogen to inhibit or delay the activation of defensive responses from the plant. Several recent studies have begun to shed light on how, at a molecular level, plants detect the presence of pathogens and on how these bacteria manage to evade defensive responses from the host.
Palabras clave: Interacción planta-patógeno; Respuesta hipersensible; glucano cíclico β-1,2; Receptores LRR; Supresión de la respuesta inmune
Key words: plant-pathogen interaction - Hypersensitive; response ;-1,2 cyclic glucan - LRR receptors - Immnune response suppression
Introducción
Las bacterias heterótrofas dependen de otros seres vivos para obtener su alimento. Algunas, como las que descomponen los organismos muertos, o las comensales, obtienen compuestos nutritivos sin causar mayores daños a los organismos proveedores de dichos compuestos. Otras, en cambio, los consiguen a través de la invasión e interferencia con la fisiología normal de otros seres vivos, es decir que causan una enfermedad. Los organismos atacados por este tipo de bacterias, llamadas patógenas, poseen distintas estructuras y mecanismos para defenderse. Por este motivo, las bacterias atacantes adquirieron a lo largo de la evolución mecanismos sofisticados para interferir con sus mecanismos defensivos, así como también para detectar la presencia de bacterias congéneres, esenciales colaboradores para llevar a cabo infecciones exitosas. En este artículo se describirán hallazgos recientes sobre los mecanismos moleculares y de señalización que ocurren durante la interacción entre bacterias fitopatógenas y sus hospedadores.
Defensas de las plantas contra los ataques de patógenos Una bacteria, u otro fitopatógeno, que intente penetrar en el interior de una planta para obtener compuestos nutritivos deberá sortear, en primer lugar, diversas estructuras y mecanismos defensivos. Las plantas, en su parte aérea, se encuentran cubiertas por una cutícula cerosa hidrofóbica que las protegen tanto de la pérdida de agua como de la invasión de patógenos, los cuales normalmente son incapaces de degradar esa cutícula. En consecuencia, las bacterias invasoras deben penetrar en la planta a través de aperturas naturales como los estomas, o a través de heridas producidas por daño mecánico, como el que provocan los animales herbívoros o los insectos masticadores. Una vez dentro de la planta, las bacterias permanecen en el espacio intercelular o dentro de los vasos de conducción, donde deben hacer frente a diversas amenazas. Las plantas, si bien no poseen células especializadas en la defensa contra patógenos como los animales, son capaces de detectar rápidamente la presencia de bacterias invasoras y de poner en marcha una serie de mecanismos defensivos que pueden incluir:
• Respuesta hipersensible (conocida también como HR, por sus siglas en inglés): consiste en una rápida muerte de células alrededor del sitio de infección, que guarda cierta similitud con la muerte celular programada de los animales (figura 1). La muerte celular es precedida por la producción de especies reactivas de oxígeno, como el peróxido de hidrógeno, que participarían tanto en la muerte del patógeno como en el refuerzo de la pared celular a través de cambios químicos. Dicha molécula, al igual que el óxido nítrico que también es sintetizado durante en la respuesta hipersensible, participaría también en la señalización hacia otras células.
• Rápida síntesis de fitoalexinas, término que engloba a diversos compuestos químicos con actividad antimicrobiana provenientes del metabolismo fenilpropanoide. Las diversas enzimas necesarias para su síntesis son producidas de novo en el momento de la infección.
• Formación de diminutos engrosamientos de la pared celular en el sitio de entrada del patógeno. Estos engrosamientos están constituidos principalmente por callosa, un polímero formado por un glucano b1-3, y lignina, un polímero fenólico altamente complejo, y sirven como una barrera física que bloquea el avance de la bacteria.
• Síntesis de diversas proteínas involucradas en la defensa antimicrobiana, conocidas colectivamente por sus siglas en inglés PR (por pathogenesis-related). Estas proteínas incluyen enzimas capaces de degradar la pared celular de los microorganismos, polipéptidos con actividad antimicrobiana y componentes de las cascadas de transducción de señales que coordinan la respuesta defensiva.
Figura 1. Respuesta hipersensible en una hoja de tabaco infectada con la bacteria Agrobacterium vitis. Fuente: http://www.nysaes.cornell.edu/pubs/press/current/031017Code.html
Además de estas respuestas inducidas por bacterias, las plantas suelen almacenar en las vacuolas de las células, de manera independiente de la presencia del patógeno, compuestos con actividad antimicrobiana como saponinas y glucosinolatos. En añadidura a las respuestas defensivas localizadas en el sitio de la infección, numerosos patógenos son capaces de activar, en el término de horas, la inducción de respuestas defensivas similares en otros órganos de la planta que pueden estar a considerable distancia. Al tener las defensas activadas, estos órganos todavía no infectados se vuelven mucho más resistentes a los patógenos. Este fenómeno se conoce como resistencia sistémica adquirida o SAR, por sus siglas en inglés (systemic acquired resistance). Aunque el mecanismo de transmisión de la señal a través de la planta no está completamente elucidado, se sabe que la hormona ácido salicílico participa de él.
Defensa basal o inespecífica Ahora bien, ante semejante batería de respuestas defensivas, ¿cómo logran ciertas bacterias patógenas llevar a cabo una infección exitosa? La realidad es que la mayoría de las bacterias no logran hacerlo. Una prueba de ello es que las bacterias patógenas suelen tener un rango de hospedador (es decir, de especies susceptibles de ser infectadas) bastante reducido, y usualmente constituyen grupos taxonómicos definidos, como ciertas familias de plantas. Cuando una bacteria fitopatógena intenta atacar plantas pertenecientes a cualquier otro grupo taxonómico distinto del de sus hospedadores habituales, invariablemente no se desarrolla (salvo cuando las plantas están afectadas por algunos tipos de estrés, como la sequía o la desnutrición, que le impiden activar sus defensas). En este caso actúa un mecanismo de defensa denominado basal o inespecífica, que es activado por casi cualquier bacteria, incluyendo las no patógenas y hasta bacterias inactivadas por calor. La defensa basal también se activa por compuestos presentes en muchos grupos de bacterias, como la flagelina (proteína que forma parte del flagelo bacteriano) o los lipopolisacáridos que forman parte de la matriz extracelular bacteriana. Estos compuestos, conocidos colectivamente como PAMPs (por el inglés pathogen-associated molecular patterns, o motivos moleculares asociados a patógenos) desencadenan una respuesta similar a la inmunidad innata de los animales que activan las respuestas defensivas descriptas previamente, con la importante excepción de la respuesta hipersensible. Tanto en plantas como en animales los PAMPs son percibidos a través de receptores tipo Toll, los cuales activan cascadas de MAP quinasas, lo que indica que la inmunidad innata estaría conservada entre ambos grupos taxonómicos.
Defensa específica o mediada por genes de resistencia (R) El rango de hospedador usualmente reducido de los fitopatógenos bacterianos provee una pista interesante para comprender cómo ocurren las interacciones planta-patógeno compatibles (es decir, en las que se desarrolla infección). Así como en la guerra el atacar por sorpresa, desorientar al enemigo, o interferir con sus sistemas de alarma (como los radares o las telecomunicaciones) suelen ser factores claves en el éxito, también las bacterias capaces de llevar a cabo infecciones exitosas son capaces de sintetizar varios factores que, actuando en conjunto, logran retardar o suprimir las respuestas defensivas del hospedador. Muchos de estos factores están codificados por los genes denominados Avr (por avirulencia), y actúan sobre blancos intracelulares muy específicos del hospedador. Este posee a su vez genes que permiten contrarrestar la acción de los genes Avr. Estos genes se denominan R (por resistencia).
El modelo denominado gen por gen, propuesto originalmente por Harold Flor (Flor, 1942), postula que la resistencia de una planta a un patógeno ocurre cuando la planta posee un gen dominante de resistencia llamado R y el patógeno expresa un gen complementario dominante de avirulencia llamado Avr. En otras palabras, la infección sólo ocurre cuando la planta o el patógeno (o ambos al mismo tiempo) carecen del alelo dominante del gen R o Avr respectivamente. En este caso se habla de interacción compatible, mientras que, cuando la infección no progresa, la interacción se denomina incompatible. Con el paso del tiempo se comprobó que este modelo explica la mayor parte de las interacciones planta-patógeno, por lo que hoy en día sigue constituyendo el marco conceptual de referencia para el estudio de la interacción entre los vegetales y organismos patógenos. A diferencia de lo que sucede en la resistencia basal, en la defensa específica mediada por genes de resistencia siempre ocurre la respuesta hipersensible que, como se describió más arriba, consiste en una muerte celular localizada. En la defensa específica también se activan otros mecanismos defensivos descriptos más arriba, pero por lo general la activación es más rápida e intensa que en la defensa basal.
¿Qué proteínas codifican los genes de resistencia? A partir de la década de 1990 se comenzaron a identificar numerosos genes de resistencia y en la actualidad se conocen decenas de ellos. La mayor parte de ellos codifican proteínas de localización citoplasmática contienen un dominio de unión a nucleótidos llamado NBS (por sus siglas en inglés nucleotide binding site) y otro dominio rico en leucinas llamado LRR (por sus siglas en inglés leucine-rich repeats). Otros genes de resistencia capaces de participar en la detección de genes Avr codifican receptores del tipo RLK (por sus siglas en inglés receptor-like kinase) y RLP (por sus siglas en inglés receptor-like protein) (Lee et al., 2006)
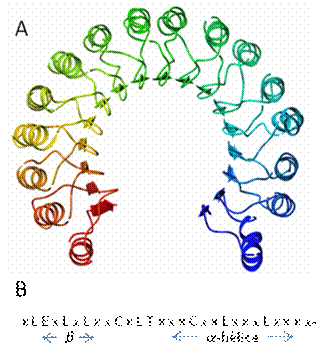
Los dominios LRR se encuentran presentes en proteínas involucradas en el reconocimiento de patógenos y en el desarrollo ontogenético tanto en plantas como en animales. Estos dominios constan de tramos ricos en leucina u otros aminoácidos hidrofóbicos a intervalos regulares dentro de una secuencia de alrededor de 24 aminoácidos. Los dominios LRR participan en la interacción proteína-proteína en muchos organismos. Sobre la base de datos cristalográficos de algunas de estas proteínas se postuló un modelo según el cual los aminoácidos hidrofóbicos presentes en el dominio LRR forman una estructura conservada que está en el interior de la estructura, mientras que el resto de los aminoácidos, muy variables entre proteínas, se encuentran expuestos al solvente y dan la especificidad de la interacción (figura 2).
Figura 2. A) Estructura del una proteína con varios dominios ricos en leucina (LRR), el inhibidor de ribonucleasa porcino. Tanto las láminas en el interior de la herradura como las -hélices en el exterior se encuentran expuestas al solvente y participan en la interacción con otras moléculas. B) Secuencia consenso del motivo LRR de la misma proteína. x indica cualquier aminoácido alifático. Fuente: Kobe B and Deisenhofer J. (1993) Crystal structure of porcine ribonuclease inhibitor, a protein with leucine-rich repeats. Nature, 366: 751-756.
El análisis del genoma de la planta Arabidopsis thaliana muestra que, dentro de unos 150 posibles genes de resistencia, los aminoácidos no hidrofóbicos presentes dentro del dominio LRR son hipervariables y tienen un alto cociente de sustituciones sinónimas versus las no sinónimas. Ello da una fuerte evidencia de que los dominios LRR son responsables de la especificidad de interacción observada entre hospedadores y patógenos que poseen distintos genes R y Avr. Es muy común observar dentro de una población de plantas que algunas son resistentes a ciertas cepas de una especie de bacterias patógenas, pero no a otras, dependiendo de los alelos de genes R que posean.
A pesar de lo atractivo de este modelo, todavía en casi ningún caso se describió una interacción directa de proteínas Avr con proteínas de resistencia, por lo que se postula que los productos de genes de resistencia podrían detectar el pegado de las proteínas Avr a otros blancos intracelulares. Una notable excepción es el sistema estudiado originalmente por Harold Flor, en el cual se demostró recientemente que sí hay una interacción directa entre los genes R y Avr (Dodd et al., 2006). Muchos genes de resistencia poseen en su secuencia dominios involucrados en señalización, como cierres de leucina (leucine zippers), Toll/Interleukine1/resistance o dominios de proteínas quinasas. En consecuencia, se cree que las proteínas codificadas por los genes R tienen dos tipos de funciones: reconocimiento de la señal derivada del Avr y activación de vías de señalización que desencadenan la respuesta defensiva contra el patógeno.
Genes de avirulencia
Los productos de muchos genes Avr tienen dos efectos contrapuestos. Uno, presente en todos ellos, es el de ser blanco directo o indirecto de los genes de resistencia, despertando de esa manera la respuesta defensiva del hospedador. El segundo, descripto en un número cada vez mayor de proteínas Avr, es el de interferir con las señalización defensiva del hospedador, como se describe a continuación. Por ejemplo, el gen AvrPtoB de P. syringae es capaz de suprimir la muerte celular programada en plantas de tomate que no poseen el gen de resistencia Pto (Abramovitch et al., 2006). La proteína AvrPtoB posee por un lado un dominio N-terminal que lleva a un rápido desencadenamiento de la respuesta HR, y por otro, un dominio C-terminal que es necesario para la supresión de la respuesta HR estimulada por el dominio N-terminal. Por lo tanto, una bacteria mutante que carece del dominio C-terminal de AvrPtoB es incapaz de infectar, ya que desencadena rápidamente una respuesta HR.
Las bacterias fitopatógenas residen en el espacio intercelular del hospedador, sin embargo muchos productos de los genes Avr conocidos ejercen su efecto, tanto de estimular como de interferir con las respuestas defensivas del hospedador, dentro de las células vegetales. Muchas proteínas Avr son introducidas a través de sistemas de secreción especializados que las transportan a través de las paredes celulares bacterianas primero, y del hospedador después. La mayoría de los Avr son transportados por sistemas de secreción tipo III (Alfano y Collmer, 2004).
Mientras que las proteínas de este sistema de secreción involucradas en el transporte a través de la pared bacteriana están altamente conservadas entre patógenos, las que participan en la interacción con las células vegetales son más variables, ya que están especializadas según el rango de hospedador de la bacteria. A pesar de esta variabilidad, pueden ser agrupadas en tres clases: subunidades del pilus Hrp, horquillas (hairpins en inglés) y factores de translocación. Los pili son proyecciones proteicas de 8 nm de diámetro que sirven de conducto para el transporte de los efectores bacterianos al citosol vegetal. Las horquillas estarían involucradas en la interacción con la pared celular y la membrana plasmática, mientras que los factores de translocación forman un poro en la membrana plasmática. Pseudomonas syringae, la bacteria fitopatógena mejor estudiada, posee más de 150 genes Avr y más de 40 sistemas de transporte tipo III.
Los productos de los genes Avr son de naturaleza muy heterogénea y no son fáciles de identificar por mutagénesis por inserción de transposones, ya que su ausencia en general produce un fenotipo débil en relación a la patogenia. La secuenciación de genomas bacterianos facilitó mucho su identificación a través de secuencias promotoras (ya que muchos genes Avr están corregulados) y por medio de dominios involucrados en la translocación de sus productos génicos a través de los sistemas de secreción de tipo III. La transcripción de los genes Avr y de los sistemas de secreción se induce fuertemente cuando el patógeno se encuentra dentro del hospedador. Sin embargo, en términos generales se puede decir que no habría factores específicos del la plantas que induzcan estos genes, sino que una combinación de factores, variable según el patógeno (como el contenido de azúcares específicos, o el pH), parecen gatillar la síntesis de los genes necesarios para la virulencia (Brencic y Winans, 2005).
En relación con el modo de acción de los genes Avr en la supresión de la respuesta defensiva, se encontró que muchos de los genes Avr identificados codifican productos con actividad enzimática. Varios productos de genes Avr codifican proteasas de cisteína que presentan similitud de secuencia con proteínas de patógenos animales que suprimen la respuesta inmune innata y la adaptativa en mamíferos. Entre estas proteínas se encuentran AvrPpiG1 de P. syringae y AvrXv4 de Xanthomonas campestris (Roden et al., 2004). Estas proteínas alteran las vías de señalización a través de interferencia con la degradación de proteínas en el proteasoma ya que clivan modificaciones SUMO (por el inglés small ubiquitin-like modifier) de componentes de señalización. Estas modificaciones marcan a las proteínas para su degradación en el proteasoma. El gen AvrPphB de P. syringae codifica por una proteasa de cisteína que cliva una quinasa del hospedador A. thaliana, denominada PBS1, que es necesaria para el reconocimiento del mismo AvrPphB (Shao et al., 2003). Otros genes Avr codifican por proteínas capaces de interferir con la señalización del hospedador, como fosfatasas de tirosina, ADP ribosil transferasas o factores de transcripción. El gen AvrBs2 de X. campestris codifica por una proteína con similitud a otras involucradas en la modificación de enlaces fosfodiéster, pero no se conoce cómo interfiere con la señalización defensiva del hospedador.
Co-evolución de genes de resistencia y avirulencia
Durante mucho tiempo se postuló un modelo de co-evolución de los genes R y Avr según el cual sus productos génicos interactuarían de manera directa. Así, si apareciera una variante génica de un gen Avr que permitiera evitar el reconocimiento por el gen de resistencia, pero que a la vez conservara la función de supresión de la respuesta inmune, la bacteria que posea la nueva variante se volvería infectiva. En el hospedador se seleccionarían entonces nuevas variantes del gen de resistencia correspondiente que reconocieran la nueva variante del Avr. En los últimos años cobró fuerza una variante de esta hipótesis que tiene en cuenta el gran número de casos en los que se verificó que no existe una interacción directa entre los genes R y Avr. Esta nueva hipótesis, denominada “de guardia”, postula que los genes R “guardan” o “protegen” a los blancos moleculares de las proteínas Avr (Dangl y Jones, 2001). Los genes R detectarían, según este modelo, las modificaciones provocadas por los genes Avr, como por ejemplo la fosforilación, sobre sus blancos intracelulares. Los receptores con dominios LRR son fuertes candidatos a participar en la “guardia”, y ya existe alguna evidencia experimental que apoya esta suposición.
Otros mecanismos de supresión de las respuestas defensivas vegetales Si bien en la mayor parte de las publicaciones recientes referidas a la supresión de la respuesta inmune de los vegetales se estudia el rol de distintos genes Avr, ellos no son los únicos efectores bacterianos capaces de causar dicho efecto. Nuestro laboratorio viene estudiando desde hace varios años el rol de dos polisacáridos extracelulares presentes en bacterias fitopatógenas del género Xanthomonas, el exopolisacárido xantano y un glucano cíclico β-1,2 de localización periplasmática. La observación de que mutantes de X. campestris deficientes en la síntesis de xantano tienen afectada su infectividad llevó al descubrimiento de que este polisacárido es capaz de interferir con una de las respuestas defensivas descriptas previamente. El xantano impide por refuerzo de la pared celular por deposición de callosa (Yun et al., 2005). Además de interferir con la patogenia, nuestro laboratorio encontró que estas mutantes tienen afectada la capacidad de formar biofilms, estructuras ordenadas formadas por un conjunto de bacterias que son importantes para la patogenia (Torres et al., 2007). Otro trabajo de nuestro laboratorio muestra que mutantes similares en Xantomonas axonopodis pv. citri tienen afectadas, además de la patogenia, la capacidad de formar biofilms y de adherirse a la superficie foliar. Este último patógeno afecta la producción de cítricos y causa importante pérdidas a los productores de nuestro país ya que no pueden exportar los frutos infectados. El estudio del rol del glucano cíclico β-1,2 de X. campestris en la patogenia reveló que no sólo impide la deposición de callosa al igual que el xantano, además retrasa la expresión de al menos un gen defensa, PR1 y también es capaz de hacerlo de manera sistémica. Al infiltrar plantas de Nicotiana benthamiana con glucano cíclico β-1,2 marcado radiactivamente, se encontró que dicho compuesto es transportado sistémicamente a través de la planta, donde es capaz de ejercer su efecto supresor de la respuesta inmune (Rigano et al., 2007). Este es el primer supresor de la respuesta inmune vegetal descripto que es capaz de ejercer su efecto de manera sistémica. Otros resultados todavía no publicados del laboratorio muestran que X. campestris sintetiza un compuesto difusible, presente en el sobrenadante del medio de cultivo bacteriano, que es capaz de interferir con el cierre estomático, lo cual facilita el ingreso de la bacteria a la planta por medio de los estomas. Dado que una de las respuesta de las plantas frente a cualquier tipo de bacteria es la inducción del cierre estomático, puede decirse que este compuesto interfiere también con la defensa del hospedador. El xantano, el glucano cíclico β-1,2 y el factor que interfiere con el cierre estomático tienen en común que la síntesis, en los tres, está regulada por un mismo mecanismo, denominado rpf (por el inglés regulation of pathogenicity factors, o regulación de factores de patogenicidad), que es activado por un factor lipídico secretado por la bacteria, denominado DSF. Este sistema, que permite a las bacterias detectar la densidad celular, controla también la síntesis de enzimas hidrolíticas que permiten a las bacterias degradar la pared celular del hospedador. La percepción de la densidad celular es muy importante para las bacterias, ya que un gran número de bacterias tienen una chance muy superior de llevar a cabo una infección exitosa que unas pocas. La percepción de la concentración de DSF también le permitiría a las bacterias percibir si están en un espacio confinado, como puede ser el interior de los tejidos del hospedador. Este sistema es distinto de los que controlan la síntesis de genes Avr, y sería interesante investigar si existe coordinación entre ambos al momento de la infección. Un trabajo reciente sugiere que esto podría ser posible, dado que se encontró que la síntesis del factor de virulecia AvrXa21 del patógeno de arroz Xanthomonas oryzae está regulada por la densidad de bacterias (Dodd et al., 2006).
Bibliografía
Abramovitch RB, Janjusevic R, Stebbins CE y Martin GB. Type III effector AvrPtoB requires intrinsic E3 ubiquitin ligase activity to suppress plant cell death and immunity. PNAS 2006; 103: 2851 - 2856.
Alfano JR y Collmer A. Type III secretion system effector proteins: double agents in bacterial disease and plant defense. Ann. Rev Phytopathol 2004, 42: 385-414.
Brencic A y Winans SC. Detection of and Response to Signals Involved in Host-Microbe Interactions by Plant-Associated Bacteria. Microbiol. Mol. Biol. Rev. 2005, 69: 155 - 194.
Dangl JL y Jones JD. Plant pathogens and integrated defense responses to infection. Nature 2001, 411: 826-833.
Dodds PN, Lawrence GJ, Catanzariti AM, The T, Wang CA, Ayliffe, Kobe B, y Ellis JG. Direct protein interaction underlies gene-for-gene specificity and coevolution of the flax resistance genes and flax rust avirulence genes. PNAS 2006, 103: 8888 - 8893.
Flor HH. Inheritance of pathogenicity in Melampsora lini. Phytopath 1942, 32:653-669
Lee S-W, Han S-W, Bartley LE y Ronald PC. From the Academy: Colloquium Review: Unique characteristics of Xanthomonas oryzae pv. oryzae AvrXa21 and implications for plant innate immunity. PNAS 2006, 103: 18395 - 18400.
Rigano L, Siciliano F, Enrique R, Sendín L, Filippone P, Torres P, Qüesta J, Dow JM, Castagnaro A, Vojnov A y Marano MR. Biofilm formation, epiphytic fitness and canker development in Xanthomonas axonopodis pv citri. Molecular Plant Microbe Interaction 2007. En prensa.
Rigano L, Payette C, Brouillard G, Marano MR, Abramowicz L, Torres P, Yun M, Castagnaro AP, El Oirdi M, Langlois M, Dow JM, Bouarab K y Vojnov A. Bacterial Cyclic β-(1, 2) Glucan acts in systemic suppression of Plant Defense Responses. The Plant cell 2007, 19(6):2077-89.
Roden J, Eardley L, Hotson A, Cao Y y Mudgett MB. Characterization of the Xanthomonas AvrXv4 effector, a SUMO protease translocated into plant cells. Mol Plant Microbe Interact 2004, 17(6): 633-43.
Shao F, Golstein C, Ade J, Stoutemyer M, Dixon JE y Innes RW. Cleavage of Arabidopsis PBS1 by a Bacterial Type III Effector Science 2003, 301: 1230.
Torres PS, Malamud F, Rigano LA, RussoD, Marano MR, Castagnaro AP, Zorreguieta A, Bouarab K, Dow JM y Vojnov A. Controlled synthesis of the DSF cell-cell signal is required for biofilm formation and virulence in Xanthomonas campestris. Environmental Microbiology. 2007, 9:2101-9.
Yun MH, Torres PS, El Oirdi M, Rigano LA, Gonzalez-Lamothe R, Marano MR, Castagnaro AP, Dankert MA, Bouarab K y Vojnov AA. Xanthan Induces Plant Susceptibility by Suppressing Callose Deposition. Plant Physiology 2006, 141:178-87.
* Becario postdoctoral de la ANPCyT
ISSN 1666-7948
www.quimicaviva.qb.fcen.uba.arRevista QuímicaViva
Número 2, año 6, Agosto 2007
quimicaviva@qb.fcen.uba.ar