Plantas sanadoras: Presente, pasado y futuro.
Andrea A. Barquero*
Laboratorio de Virología: agentes antivirales y citoprotectores. Departamento de Química Biológica. Facultad de Ciencias Exactas y Naturales. Universidad de Buenos Aires. Pabellón II. Piso 4. Ciudad Universitaria. 1428 Ciudad de Buenos Aires. Argentina.
alecab@qb.fcen.uba.ar
Recibido el 18/08/07. Aceptado el 30/08/07.
Resumen.
Las plantas con propiedades beneficiosas para la salud humana vienen acompañando al hombre desde sus orígenes. En esta actualización sobre el tema se presenta un resumen de la historia del conocimiento de las plantas medicinales desde la Prehistoria hasta nuestros días. Se mencionan además algunas drogas de uso clínico que han sido desarrolladas a partir de plantas y el uso de éstas como fuente para el descubrimiento de compuestos puros con acción terapéutica, particularmente con actividad antiviral. Se discuten las perspectivas de crecimiento del mercado de las plantas medicinales en el contexto del interés creciente por las Terapias Alternativas y Complementarias a nivel mundial. Finalmente, se muestra una aplicación novedosa de los vegetales como sistemas de elaboración que permitirían obtener vacunas y drogas a muy bajo costo.
Palabras claves: plantas medicinales, etnomedicina, medicina tradicional, antiviral, drogas de plantas.
MEDICINAL PLANTS: PAST, PRESENT AND FUTURE Abstract.
Plants with beneficial effects on human health are companions of man from their origins. This update on the subject describes an historical background about the knowledge of the medicinal plants from Prehistory to the present time. In addition, some examples of plant-derived compounds with therapeutic action and the use of plants as a source of new bioactive drugs, particularly with antiviral activity, are mentioned. Also, this article discusses the growing perspective of the medicinal herbal market in the context of the increasing global interest in Alternative and Complementary Medicines. Finally, this review presents a promising plant application as biopharmaceutical production systems that would allow vaccines and drugs obtention at low-coast.
Key words: medicinal plants, ethnomedicine, antiviral, traditional medicine, herbal drugs.
Introducción
En los tiempos más remotos, los pueblos primitivos atribuían los efectos curativos de las plantas a la intervención de alguno de sus dioses. En nuestros días, los científicos han descubierto y desarrollado drogas efectivas para el tratamiento de diversas afecciones a partir de compuestos aislados de diferentes plantas. El objetivo de este artículo es hacer una revisión del pasado, el estado actual y las perspectivas del uso de las plantas con fines medicinales.
Contexto histórico.
No sabemos cómo se comenzaron a utilizar las plantas medicinales pero sí desde cuándo: en la Prehistoria, hace unos 60.000 años atrás. En aquellos días, donde no existían las grandes cadenas de hipermercados ni las cadenas de farmacias abiertas las 24 hs., el hombre tenía que satisfacer todas sus necesidades con los recursos que la naturaleza le ofrecía. Seguramente, la búsqueda de alimento en el reino vegetal, lo llevó a descubrir por azar que algunas plantas en lugar de ser comestibles eran venenosas, mientras que otras le producían efectos diversos: aliviar el dolor de una articulación, aumentar el sudor, o les hacían defecar con mayor facilidad. Tal vez, empezaron a utilizar las plantas medicinales observando las costumbres de los animales, como ocurre hoy en día con los perros y los gatos que utilizan el pasto para purgarse. La prueba más antigua que existe sobre el uso de las plantas como medicinas en el Paleolítico medio fue encontrada en 1960 por Ralph Solecki, al descubrir una tumba con varios restos fósiles de neandertales en la cueva de Shanidar, situada en las montañas de Zagros (Irak) (1). Uno de los esqueletos, denominado Shanidar IV, estaba cuidadosamente colocado en posición fetal sobre un lecho de belcho junto con varias especies diferentes de flores: milenrama, aciano, cardo de San Banaby, hierba cana, jacinto, y una especie de malva, según se desprende del análisis de las muestras de polen y semillas halladas en el lugar. Estudios posteriores revelaron que siete de las ocho flores que se encontraron en esta tumba tienen propiedades medicinales que abarcan desde el alivio del dolor de muelas y la inflamación hasta su uso como cataplasma y para las convulsiones (2). Este análisis hace suponer que la gente de Shanidar tenía conocimiento de algunas de las propiedades medicinales de las flores y que por eso las seleccionaron para el entierro de este individuo que, según Solecki, podía haber sido una especie de curandero o chamán en su grupo. Antes del nacimiento de la escritura, todos los conocimientos se transmitían oralmente, recién alrededor del año 2800 a.C. se encuentra el primer documento escrito que registra el uso de las plantas medicinales. Aparece en unas tablillas de arcilla en escritura cuneiforme pertenecientes a la cultura de los Sumerios, un pueblo que vivía al sur de los ríos Éufrates y Tigris. Aunque el primer tratado sobre el tema, el Pen Tsao, se le atribuye al emperador chino Shen Nung) que reinó en el siglo XXVII a.C., donde se describen y clasifican 366 hierbas con aplicaciones medicinales para aquella época (3-5). Los egipcios también utilizaban las plantas con fines curativos, el documento impreso más interesante es el Papiro de Ebers que comprende una extensa lista de plantas medicinales que se utilizan aún hoy en día como el opio y el aloe. Redactado alrededor del 1550 a.C., el papiro de 20,25m de longitud y 30cm de ancho, está escrito en 108 columnas de entre 20 y 22 líneas cada una, y fue encontrado entre las piernas de una momia en una tumba de Assasif. En 1862 fue vendido a Edwin Smith por un comerciante egipcio y posteriormente fue adquirido por el egiptólogo alemán George Moritz Ebers, a quien debe su nombre (6). También en la India, donde la medicina Ayurveda se ha practicado durante 5.000 años, los antiguos libros sagrados del brahmanismo, como el Rig Veda, mencionan el empleo de las hierbas medicinales estableciendo verdaderos rituales para la recolección de las plantas. Un ejemplo extraído de uno de ellos: "solo serán recolectadas por un hombre puro y religioso, que antes habrá ayunado como es debido. Las plantas frescas producen los mayores efectos. Sólo se las recogerá en los lugares de difícil acceso para el hombre, en suelo fértil, con una favorable evacuación para las aguas, donde no haya ni templos ni lugares sagrados, ni tampoco cementerios. La propia planta deberá estar bien enraizada, alimentada de agua; según la hora lo mismo estará expuesta al sol que protegida por la sombra y orientada al Norte". Los griegos y los romanos recogen la tradición de la Mesopotamia y Egipto y hacen uso de las plantas para curar las enfermedades y mantener un buen estado de salud. Hipócrates de Cos (460-377 a.C.), considerado el padre de la medicina, sistematizó los grupos de medicamentos, dividiéndolos en purgantes, narcóticos y febrífugos, para prepararlos se usaban simples vegetales y minerales y algunas sales de naturaleza inorgánica. El primer escrito de naturaleza científica en la época clásica es De Materia Médica, escrita por Dioscórides (40-90). Este médico griego, trabajaba con los romanos como botánico, lo que le permitió viajar mucho. Durante sus viajes estudió las propiedades de más de 600 plantas y de muchos principios químicos y su obra sirvió de referencia hasta el siglo XV (3). Se han hecho sobre ella muchas revisiones y traducciones. La revisión más importante en castellano es Plantas medicinales: El Dioscórides renovado del farmacéutico leridano Dr. Pío Font Quer. Claudio Galeno (130-200), considerado el fundador de la actual farmacia galénica, también hace referencia al uso de las plantas medicinales en su obra De Simplicibus medicinis. Durante la Edad Media, cuando decae la cultura europea, el estudio de las plantas medicinales queda en manos de los monjes cristianos, quienes cultivaron y estudiaron en sus monasterios, centenares de especies descritas en los textos clásicos. Las obras de Hipócrates, Dioscórides y Galeno entran en la Europa medieval a través de las traducciones de los médicos árabes. El más famoso de todos los traductores fue Hunayn Ibn-Is’haq, un cristiano nestoriano que fue médico del Califa al-Mutawakkil. La tradición grecorromana fue enriquecida con los conocimientos de la medicina árabe, que en esta época realizó sus mayores aportes como por ejemplo: el descubrimiento del sistema inmune; el ensayo en animales; el desarrollo de instrumental de cirugía; además de fundar el verdadero punto de partida de la Farmacia como ciencia autónoma, separada de la Medicina. El médico Ibn Sina o Avicena (980-1037), como se lo llamó en occidente, escribió numerosos libros sobre medicina, filosofía, matemática y astronomía. En cuanto a las plantas medicinales, publicó el libro Alkanoon Fi Altib (Los roles de la medicina) que fue traducido a diferentes idiomas y todavía hoy se encuentra en diferentes bibliotecas de Europa (7). En el renacimiento, con la fundación de la escuela de Salerno, mejoró la situación en Europa. Esta escuela debe su universal celebridad a la amplia obra Regimen Sanitatis Salernitatum sobre las virtudes medicinales de las plantas. A finales del siglo XII, la medicina laica trajo consigo el declive de la medicina llamada monástica. Por otra parte, las civilizaciones Prehispánicas del Nuevo Mundo también hacían uso de las plantas con propósitos curativos aunque los del Viejo Mundo no se enteraron hasta que Colón desembarcó en América. Los Aztecas, Mayas e Incas tenían extensas farmacopeas. Una pintura del muralista Diego Rivera (figura 1) muestra a una indígena azteca preparando plantas medicinales junto a un curandero azteca. En el otro lado del mural hay unos científicos trabajando con un microscopio para analizar los constituyentes químicos de tales medicinas. El primer libro de herbolaria medicinal azteca y una de las más importantes fuentes bibliográficas históricas de la materia médica en América, lleva por título Libellus de medicinalibus indorum herbis (librito de las yerbas medicinales de los indios), que se conocería cuatro siglos después como Códice badiano. En 1552, Martín de la Cruz, un médico azteca que asistía al colegio de la Santa Cruz en Tlatelolco, escribió esta obra con una descripción del uso medicinal de más de 150 platas originarias de México (8). Durante la época de la conquista, el uso de las plantas medicinales se extendía a lo largo de todo el continente, desde el Ártico hasta Tierra del Fuego. Los chamanes o curanderos eran los que tenían el poder de utilizar la magia y las plantas medicinales para curar las enfermedades.
Figura 1. “El pueblo en demanda de salud”. Mural de Diego Rivera pintado en el vestíbulo del hospital del Seguro Social "La Raza". Disponible en: http://www.diegorivera.com/index.php.
Maravillados sobre la variedad de hierbas y raíces que se vendían en las calles de la ciudad de Tenochtitlán y en el mercado de Tlatelolco para su uso médico, los conquistadores llevaron estas noticias Europa. En Sevilla, el médico Nicolás Monardes fue comisionado para clasificar las plantas medicinales que llegaban de México. A su vez, Felipe II, envía a su médico Francisco Hernández para estudiar la flora y la fauna de México, quién realiza una obra en 16 volúmenes que se destruye en el incendio del Escorial. Afortunadamente, Francisco Hernández había resumido aquella obra y esta síntesis pudo ser editada. En 1630, la cinchona fue una de las primeras plantas medicinales en cruzar el Atlántico hacia España. Según una historia legendaria, en la región donde hoy se encuentra el Perú, un árbol gigante, derribado durante una tormenta, cayó sobre una charca de agua estancada. Con el correr de los días, el agua se enriqueció con los distintos componentes de la corteza del árbol. Un nativo, que casualmente pasaba por el lugar, bebió del agua porque estaba muy sediento, a raíz de la fiebre intermitente que lo aquejaba (malaria). El hombre se desmayó y al despertarse, milagrosamente se había curado. No sabemos si fue así como los indígenas descubrieron las virtudes curativas de este árbol (3). Tampoco sabemos como este secreto fue develado por los españoles, si fueron los misioneros, observando las prácticas de los herbalistas andinos, o por la cura que experimentara Lady Chinchón, la esposa del Virrey del Perú, al utilizar la corteza de este árbol. El primer registro escrito de su utilización en Inglaterra data del 1656 pero su popularidad se extiende en 1672 cuando Talbor aplica este remedio para curar al rey Carlos II de una fiebre persistente. En 1742, el naturalista Carl Linnaeus hace la primera descripción científica de este árbol, dándole el nombre genérico de Cinchona inmortalizando el de Lady Chinchón (9). Como hemos visto, hay muchos documentos que relatan como las plantas se utilizan con fines terapéuticos en todo el mundo y desde tiempos remotos. Sin embargo, la idea de utilizar como medicamento un compuesto “puro” obtenido a partir de una planta con acción terapéutica, surge en 1803 con el aislamiento de los primeros alcaloides. El farmacéutico alemán Friedrich W.A. Sertürner los descubre intentando obtener el principio activo del opio (3). En 1819, Pelletier y Caventou, dos químicos franceses aislaron dos alcaloides diferentes a partir de muestras de corteza de cinchona, la quinina y la cinchonina. En 1826, E. Merck obtiene la morfina a partir del opio (Papaver somniferum L.) y en 1831 se aísla la atropina de la planta Atropa belladonna L. (10). La primera droga semisintética, la aspirina, creada por Bayer aparece en 1899.
Plantas medicinales en la actualidad.
Tal ha sido el éxito de las plantas como fuente para aislar compuestos bioactivos para su uso directo o como precursores de moléculas modificadas por síntesis química para producir nuevas entidades patentables con mayor actividad y/o menor toxicidad que, en la actualidad, casi el 25% de los fármacos que se prescriben contienen uno o más principios activos derivados de alguna planta, según datos del National Prescription Audit de los Estados Unidos obtenidos sólo de farmacias (11).
Compuesto
Acción terapéutica
Planta
Acetildigoxina
Tónico cardíaco
Digitalis lanata Ehrh.
Aescina
Anti-inflamatorio
Aesculus hippocastanum L.
Aesculetina
Antidisentérico
Fraxinus rhynchophylla Hance
Ajmalicina
Antihipertensivo
Rauvolfia serpentina (L.) Benth ex. Kurz
Anisodamina
Anticolinérgico
Anisodus tanguticus (Maxim.) Pascher
Anisodina
Anticolinérgico
Anisodus tanguticus (Maxim.) Pascher
Arecolina
Antihelmíntico
Areca catechu L.
Asiaticósido
Vulnerario
Centella asiatica (L.) Urban
Atropina
Anticolinérgico
Atropa belladonna L.
Berberina
Tratamiento de la disentería bacilar
Berberis vulgaris L.
Bromelaína
Anti-inflamatorio, proteolítico
Ananas comosus (L.) Merrill
Cafeína
Estimulante del SNC
Camellia sinensis (L.) Kuntze
Camptotecina
Antitumoral
Camptotheca acuminata Decne.
(+)-Catequina
Homeostático
Potentilla fragaroides L.
Cocaína
Anestésico local
Erythroxylum coca Lamk.
Codeína
Analgésico, antitusivo
Papaver somniferum L.
Colchicina
Antitumoral
Colchicum autumnale L.
Curcumina
Colerético
Curcuma longa L.
Cynarina
Colerético
Cynara scolymus L.
Deserpidina
Antihipotensivo, sedante
Rauvolfia canescens L.
Deslanósido
Tónico cardíaco
Digitalis lanata Ehrh.
Digitalina
Tónico cardíaco
Digitalis purpurea L.
Digitoxina
Tónico cardíaco
Digitalis purpurea L.
Digoxina
Tónico cardíaco
Digitalis lanata Ehrh.
Efedrina
Simpaticomimético
Ephedra sinica Stapf.
Emetina
Amebicida
Cephaelis ipecacuanha (Brotero) A. Richard
Etopósido
Antitumoral
Podophyllum peltatum L.
Gitalina
Tónico cardíaco
Digitalis purpurea L.
Glaucarubina
Amebicida
Simarouba glauca DC.
Gossypol
Anticonceptivo masculino
Gossypium spp.
Hyoscamina
Anticolinérgico
Hyoscamus niger L.
Kavaína
Sedante
Piper methysicum Forst. f.
Kelina
Broncodilatador
Ammi visnaga (L.) Lamk.
Lanatósidos A B C
Tónico cardíaco
Digitalis lanata Ehrh.
L-Dopa
Tratamiento del Parkinson
Mucuna deeringiana (Bort) Merr.
Lobelina
Tratamiento del tabaquismo
Lobelia inflata L.
Morfina
Analgésico
Papaver somniferum L.
Noscapina
Antitusivo
Papaver somniferum L.
Ouabaína
Tónico cardíaco
Strophanthus gratus Baill.
Paclitaxel
Antitumoral
Taxus brevifolia Nutt.
Papaína
Mucolítico, proteolítico
Carica papaya L.
Papaverina
Antiespasmódico
Papaver somniferum L.
Pilocarpina
Parasimpaticomimético
Pilocarpus jaborandi Holmes
Podofilotoxina
Tratamiento de condilomas
Podophyllum peltatum L.
Protoveratrinas A y B
Antihipertensivos
Veratrum album L.
Pseudoefedrina
Simpaticomimético
Ephedra sinica Stapf.
Quimopapaína
Mucolítico, proteolítico
Carica papaya L.
Quinidina
Antimalárico, antiarrítmico
Cinchona ledgeriana Moens ex. Trimen
Quinina
Antimalárico
Cinchona ledgeriana Moens ex. Trimen
Reserpina
Antihipertensivo
Rauvolfia serpentina (L.) Benth ex. Kurz
Salicina
Analgésico
Salix alba L.
Santonín
Ascaricida
Artemisia maritima L.
Scopolamina
Sedante
Datura metel L.
Senósidos A y B
Laxantes
Cassia spp.
Silymarin
Antihepatotóxico
Silybum marianum (L.) Gaertn.
Tenipósido
Antitumoral
Podophyllum peltatum L.
Teobromina
Diurético, broncodilatador
Theobroma cacao L.
Teofilina
Diurético, broncodilatador
Camellia sinensis (L.) Kuntze
Timol
Desinfectante, fungicida
Thymus vulgaris L.
Tubocurarina
Relajante muscular
Chondodendron tomentosum R. & P.
Valepotriatos
Sedante
Valeriana officinalis L.
Vinblastina
Antitumoral
Catharanthus roseus (L.) G. Don
Vincamina
Vasodilatador cerebral
Vinca minor L.
Vincristina
Antitumoral
Catharanthus roseus (L.) G. Don
Yohimbina
Afrodisíaco
Pausinystalia yohimbe (K.Schum.) Pierre
Cuadro 1. Ejemplos de compuestos derivados de plantas con acción terapéutica (12).
Algunas de estas drogas (cuadro 1) surgieron a partir de programas de investigación creados especialmente para la búsqueda de nuevos agentes terapéuticos, particularmente contra el cáncer. Con dicha finalidad, en 1960, el Instituto Nacional del Cáncer (NCI) de los Estados Unidos inició junto con el Departamento de Agricultura (USDA) un programa de recolección de plantas, principalmente de regiones templadas del planeta (13). Hasta la finalización del programa, en el año 1982, se evaluaron 114.000 extractos correspondientes a unas 35.000 especies diferentes de plantas. La actividad antitumoral de los extractos se ensayó principalmente usando dos modelos de leucemia en ratones, el L1210 y el P388. Solamente dos compuestos clínicamente activos surgieron a partir de esta búsqueda, el paclitaxel (nombre comercial: Taxol, registrado por la compañía Bristol-Myers Squibb) obtenido del árbol Taxus brevifolia Nutt. y la camptothecina a partir del árbol nativo de China Camptotheca acuminata Decae (14). Una de las preguntas que se plantean los investigadores que trabajan en el aislamiento de compuestos bioactivos naturales es con qué criterio seleccionar las plantas que serán evaluadas, al azar o teniendo en cuenta si poseen antecedentes en la medicina tradicional. La pregunta no es menor si consideramos que recién menos del 10% del total de las plantas que se estima hay en el planeta (promedio de 250.000) han sido evaluadas científicamente con fines terapéuticos (15); y cerca de 15.000 plantas medicinales ya estarían amenazadas de extinción según la Lista Roja de la International Union for the Conservation of Nature and Natural Resources (UICN) 2000 (16). Con este ritmo, tal vez se agoten los recursos naturales antes que podamos confirmar sus potenciales propiedades beneficiosas para la salud. Hoy día se dispone de avanzadas técnicas para la purificación e identificación de compuestos químicos; y de rápidos ensayos biológicos desarrollados in-vitro y en forma automatizada para la detección de muchas actividades farmacológicas, que aceleran y facilitan la búsqueda de nuevas drogas. También, a lo largo de la historia del uso de las hierbas medicinales, se ha acumulado la valiosa información sobre las propiedades terapéuticas de muchas especies de plantas. Entonces, resulta lógico pensar que la mejor combinación para arribar con éxito al descubrimiento de un compuesto vegetal con potencial uso clínico es, seleccionar la planta por sus datos etnomédicos y realizar el ensayo biológico que se correlacione con la actividad terapéutica descripta (12). Una vez que se dispone del compuesto “candidato”, el camino que debe transitar para llegar a ser aprobado para su uso en humanos es largo, durará de entre 10 a 20 años y el costo será de unos 231 millones de dólares (17). Además, en el caso de candidatos derivados de una fuente natural, se presentan otros problemas que se deben tener en cuenta, la factibilidad de obtener biomasa y los problemas relacionados con la posibilidad de proteger el conocimiento generado (18). El Taxol, es buen ejemplo para ilustrar cómo la demanda creciente de una droga obtenida a partir de una fuente natural llevó al desarrollo de métodos alternativos para aumentar la producción de biomasa (19). Mientras que con una muestra inicial de 0,3 a 1 Kg de la planta seca se obtiene suficiente extracto (10 - 40 g) para permitir el aislamiento y la identificación de un compuesto puro, los ensayos secundarios y preclínicos pueden requerir de 5 a 50 Kg de material seco. Cuando el paclitaxel fue aprobado para el tratamiento del cáncer de mama y de ovario, la demanda del compuesto puro aumentó a más de 25 Kg por año (14). Considerando que, el paclitaxel se obtiene de la corteza con un rendimiento promedio del 0,01% del peso seco, y el crecimiento del árbol es muy lento, había que encontrar una fuente alternativa para abastecer el mercado. Los primeros intentos consistieron en probar si otras partes del árbol u otras especies relacionadas de Taxus producían el compuesto. Así se llegó a recolectar las agujas de especies salvajes y de árboles cultivados, evitando los métodos de recolección destructivos. Las investigaciones llevadas a cabo por varios grupos de los Estados Unidos, como el de Robert Holton, llevaron a obtener una vía de síntesis total a partir de derivados petroquímicos. Sin embargo, la técnica de producción era poco práctica. En cambio, el grupo francés de Pierre Potier describe una vía semisintética de producción a partir del compuesto intermediario 10-deacetil bacatina aislado de las agujas del Taxus baccata. En 1992, el grupo de Holton patenta otra vía semisintética con un rendimiento del 80%, mucho mayor al de Potier, y firma un contrato con la Bristol-Myers Squibb. Esta empresa, actualmente produce el paclitaxel utilizando la tecnología de cultivo de células vegetales (plant cell fermentation) desarrollada por la compañía de biotecnología Phyton, en su planta de Alemania. El proceso se inicia con la propagación de una línea celular de Taxus específica en medio líquido en tanques de fermentación. Luego se purifica directamente el paclitaxel por cromatografía y se aísla por cristalización (20). Aún hoy, continúan las investigaciones sobre los aditivos que se pueden agregar a estos cultivos para aumentar la producción de paclitaxel en estas células, por ej., es necesario adicionar fenilalanina y sulfato de vanadio a las líneas de Taxus baccata (21). Si bien a partir de las plantas se han obtenido alrededor de 119 drogas que se emplean para el tratamiento de muchas afecciones ninguna se utiliza para curar infecciones provocadas por virus. Por cierto, se dispone de un número escaso de antivirales, tan sólo 37 han sido aprobados en el mercado mundial, y por lo tanto muchas enfermedades virales todavía son fatales. Los científicos dedicados al descubrimiento de agentes antivirales, especialmente para controlar las infecciones provocadas por el virus herpes y por el virus del SIDA, vienen realizando extensas investigaciones en el área de las plantas medicinales para identificar compuestos con posible acción terapéutica (10). En tal sentido, nosotros venimos trabajamos con extractos semipurificados obtenidos a partir de hojas del árbol del paraíso o cinamomo (nombre científico: Melia azedarach L.) que inhiben la multiplicación de virus, tanto con genoma a ADN como a ARN, en ausencia de citotoxicidad (22-24). En el año 2003 publicamos el aislamiento y la identificación del 1-cinnamoil- 3,11-dihidroximeliacarpina (CDM) que presenta actividad antiviral frente a los virus de la estomatitis vesicular (VSV) y al virus Herpes simplex tipo 1 (HSV-1) en condiciones in vitro (25). Al estudiar su mecanismo de acción se pudo establecer que CDM induce un estado refractario a la infección viral cuando las células son tratadas con el compuesto durante dos horas antes de la adsorción viral (pre-tratamiento). Dicho estado se correlacionó con la acción que CDM ejerce sobre el pH de los endosomas que al basificarse impiden que tenga lugar la fusión, entre la membrana de las vesículas endocíticas y la envoltura viral, imposibilitando la entrada del virus a la célula. También se pudo demostrar que CDM bloquea el transporte intracelular de la glicoproteína G de VSV impidiendo su expresión a nivel de la membrana plasmática, siendo retenida en el aparato de Golgi (26). Resultados similares se obtuvieron con distintas glicoproteínas de HSV-1 y en los diferentes sistemas celulares ensayados (27). Por lo cual suponemos que CDM podría ser la molécula responsable de la actividad antiviral presente en los extractos semipurificados que se denominaron meliacina (MA). En condiciones in-vivo, MA impide el desarrollo de la queratitis herpética estromal murina, un modelo experimental que reproduce en los animales el desarrollo de la patología que provoca el virus en los humanos (28-29). Los ratones, inoculados con HSV-1 en la córnea, presentan el máximo título viral en el día 2 post-inoculación (p.i.) mientras que, alrededor del día 4 p.i., el virus desaparece del ojo. El proceso inflamatorio comienza entre los días 5-8 p.i., y aumenta su severidad con el transcurso de los días. Esta separación temporal de la acción del virus y la respuesta inflamatoria asociada al mismo nos permitió analizar el efecto de MA frente a ambos procesos. Por un lado, aplicamos un esquema de tratamiento tópico durante los días 1, 2 y 3 p.i. (MA 24) para evaluar la acción antiviral de MA y por el otro, un esquema de tratamiento tópico durante los días 4, 5 y 6 p.i. (MA 96) para estudiar su eventual capacidad como antiinflamatorio. Ambos esquemas de tratamiento con MA disminuyen significativamente la aparición de los signos de enfermedad (cuadro 2), la severidad de las lesiones oculares y la detección de infectividad en los ojos (28-29). Estos resultados sugieren que MA ejerce tanto una acción antiviral como antiinflamatoria en dicho modelo de infección in-vivo.
Tratamiento
% de ratones con
Blefaritis
Neovascularización
Queratitis
Control
90
90
MA 24
25
12
12
MA 96
0
12
12
Cuadro 2. Incidencia de los signos de queratitis herpética estromal en ratones tratados con MA. Tres grupos de 20-25 ratones cada uno se infectaron con HSV-1 en la córnea y se trataron en forma tópica con MA. Al día 16 p.i. se registró el número de ratones con signos de blefaritis, neovascularización y queratitis estromal (29).
Un antiviral derivado de una planta que se encuentra en estudios en fase II en humanos es la calanolida A, producido por la empresa Sarawak MediChem Pharmaceuticals. Investigadores del Instituto Nacional del Cáncer aislaron el compuesto de extractos de látex producidos por un árbol llamado Calophyllum langerium, el cual es nativo de las selvas tropicales de Sarawek, Malasia. Como la fuente orgánica del extracto es relativamente escasa, se elaboró una versión química. La calanolida A es un nuevo inhibidor no nucleósido de la transcriptasa inversa (INNTI), eficaz contra varias cepas del virus de la inmunodeficiencia humana tipo 1 (HIV 1) pero no contra cepas del HIV tipo 2. Parece acoplarse de manera única con la enzima transcriptasa inversa, por un mecanismo de acción diferente al de los demás INNTI. Además puede atravesar la barrera hematoencefálica (sangre-cerebro) y permanece en la sangre por largo tiempo (30-31).
Perspectivas sobre el uso de las plantas medicinales.
En el año 2006, el mercado farmacéutico mundial fue de 643 miles de millones de dólares (32) y el mercado de las plantas medicinales llegó a los 62 miles de millones de dólares con una tasa anual de crecimiento estimada según un informe del Banco Mundial de entre el 5 y el 15% (33-34). Es decir, además de los fármacos derivados de plantas que se comercializan a través de la industria farmacéutica, existe un mercado de hierbas medicinales que se venden como suplementos dietarios o “medicinas naturales o tradicionales” que se encuentra en expansión. Si bien en muchos países pobres de África y Asia no tienen otra opción que usar medicinas naturales, los tratamientos con este tipo de fármacos se han convertido en una alternativa en muchos países ricos (figuras 2 y 3).
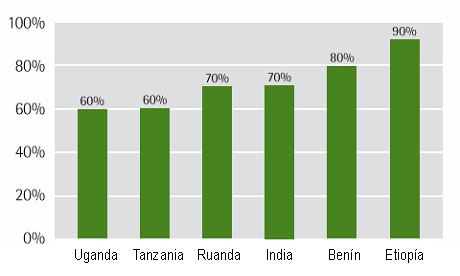
Figura 2. Porcentaje de la población de distintos países que utilizan la Medicina Tradicional para su atención primaria (41)
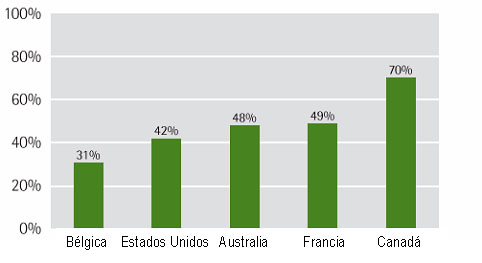
Figura 3. Porcentaje de la población de distintos países que utilizaron al menos una vez Medicina Alternativa o Complementaria (41)
En el mundo creció el interés por las terapias alternativas y/o complementarias que se utilizan en lugar de o conjuntamente con la medicina convencional. Un ejemplo de terapia complementaria es el uso de aromaterapia para ayudar a mitigar la falta de comodidad del paciente después de la cirugía. Un ejemplo de una terapia alternativa es el empleo de una dieta especial para el tratamiento del cáncer en lugar de la cirugía, la radiación o la quimioterapia recomendados por un médico convencional. El Centro Nacional de Medicina Complementaria y Alternativa (NCCAM, por sus siglas en inglés) clasifica las terapias de la medicina complementaria y alternativa en cinco categorías o dominios mencionando dentro de los sistemas médicos alternativos tanto a los que se han desarrollado en culturas occidentales (la homeopatía y la naturopatía) como los que se han formulado en culturas no occidentales (la Medicina China Tradicional y Ayurveda) (34). Para el 2010 se estima que al menos los dos tercios de la población de los Estados Unidos estarán usando una o más terapias alternativas o complementarias (34). Considerando que todas ellas incluyen la utilización de plantas medicinales está claro que la demanda de este tipo de productos seguirá aumentando. Los suplementos herbales pueden contener plantas enteras o partes de plantas; vienen en todas formas: secos, picados, pulverizados, en cápsulas, o en líquidos. Como se los considera alimentos, no drogas, no están sujetos a las mismas regulaciones que tienen los medicamentos tradicionales. Sin embargo, al igual que los medicamentos, los suplementos de hierbas pueden causar problemas médicos si no se utilizan correctamente o si se ingieren en grandes cantidades. Es importante saber que un suplemento de hierbas no significa que sea inocuo o que no tenga efectos perjudiciales porque lleve una etiqueta que lo califica de "natural". Algunas personas han sufrido efectos adversos a pesar de haber seguido las instrucciones que figuraban en la etiqueta del suplemento. Por eso es conveniente seguir los consejos de un profesional que tenga la formación adecuada en plantas medicinales. Además, se han descubierto suplementos de hierbas contaminados con metales, medicamentos que requieren receta médica pero que no están indicados en la etiqueta, microorganismos y otras sustancias (34). Algunos de los suplementos herbales más utilizados son:
- La echinácea (Echinacea purpurea) usada para fortalecer el sistema inmunológico, también se considera que previene los resfríos y la gripe.
- El ajo (Allium sativum) generalmente se usa para las condiciones cardiovasculares, incluyendo el colesterol alto y los niveles de triglicéridos asociados con el riesgo de aterosclerosis. También ayuda en la prevención de los resfríos, la gripe y otras enfermedades infecciosas.
- El ginko (Gingko biloba) es usado para muchas condiciones asociadas con el envejecimiento, incluyendo la circulación pobre y la pérdida de la memoria.
- El ginseng (Panax ginseng) usado como un tónico general para aumentar el tono general del cuerpo, se considera que ayuda a elevar los niveles de energía y la resistencia al estrés.
- La hierba de San Juan (Hypericum perforatum) usada por siglos en el tratamiento de enfermedades mentales. Hoy en día, es popular en los casos de depresión de leve a moderada.
Todos estos suplementos han sido y están siendo examinados clínicamente para comprobar su efectividad en el tratamiento o en el manejo de las condiciones médicas (35-40). El NCCAM lleva a cabo algunos de dichos estudios. La Organización Mundial de la Salud (OMS), también reconoce la importancia de la Medicina Tradicional y se ha propuesto aumentar el control sobre las plantas medicinales. En estos momentos, sólo 25 países tienen legislaciones específicas sobre hierbas medicinales. La OMS insiste en que es necesaria una investigación científica que dé información adicional sobre la eficacia y seguridad de estas medicinas para garantizar las condiciones de uso sin riesgos, sobre todo cuando se emplean estos remedios fuera de las regiones donde han demostrado su inocuidad durante siglos. Además, la organización sanitaria estableció una guía de controles como los que hay sobre el resto de los medicamentos convencionales (41). Una aplicación muy prometedora y reciente de las plantas es, su uso como herramientas para la obtención de proteínas con acción terapéutica, médica o veterinaria (cuadro 3). Productos que tradicionalmente son sintetizados utilizando microbios recombinantes o células de mamíferos transformadas, se están intentando expresar en plantas. Este sistema de elaboración se perfila como uno de los mayores desarrollos comerciales de la biotecnología, ya que las ventajas que ofrece en términos de producción económica, a gran escala, segura, de fácil almacenamiento y distribución, no se encuentran en ninguno de los sistemas comerciales actuales. Además, brinda una posibilidad alentadora de poder proveer drogas y vacunas de bajo costo a los países que más lo necesitan (42).
Producto
Uso potencial
Planta
Vacunas
Toxina lábil al calor de E. coli
Diarrea
Maíz, papa
Antígeno de superficie del virus de Hepatitis B (HbsAg)
Hepatitis B
Lechuga, papa
Proteína de la cápside del virus Norwalk
Gastroenteritis
Papa
Glicoproteína del virus Rabia
Rabia
Vectores virales en espinaca
Anticuerpos
Fragmento variable de cadena simple producido por LSBCâ
Linfoma No Hodgkin
Vectores virales en tabaco
Avicidina
Cáncer colonrectal
Maíz transgénico
CaroRXä (anti S. mutans)
Caries dentales
Tabaco transgénico
Otras proteínas
Lipasa gástrica
Fibrosis quística del páncreas
Maíz transgénico
Factor intrínseco humano
Deficiencia de Vitamina B12
Arabidopsis transgénica
Lactoferrina
Infecciones gastrointestinales
Maíz transgénico
Cuadro 3. Proteínas producidas en plantas para uso médico y que están siendo probadas en ensayos clínicos (42).
Conclusiones
La importancia de las plantas para el cuidado de la salud humana es invaluable. Las virtudes curativas de muchas de ellas nos han permitido controlar distintas enfermedades desde el comienzo de la historia de la humanidad, cuando no podíamos explicar ni el cómo ni el por qué de su acción. La purificación e identificación de los principios bioactivos presentes en sus constituyentes les quitó la magia y el escepticismo, colocándolas en un lugar respetable y peligroso al mismo tiempo. Garantizar su conservación es una responsabilidad primordial que le debemos exigir a la industria farmacéutica que las utiliza como negocio. Por nuestra parte, como comunidad científica, debemos seguir avanzando en aquellas investigaciones que permitan garantizar la calidad, seguridad y criterios de eficacia de las hierbas medicinales ya que la atención primaria del 80% de la población mundial depende, casi exclusivamente, de estas plantas sanadoras (43).
Referencias
Solecki R, 1975. Shanidar IV, a Neandertal flower burial in Northern Iraq. Science 190: 880-881.
Lietava J, 1992. Medicinal plants in a Middle Paleolithic grave Shanidar IV?. J Ethnopharmacol 35: 263-266.
Tyler V. Natural products and medicine: an overview. Medicinal resources of the tropical forest, Columbia University Press, New York, 1996, 1-10.
Davison D, Hylands P, Sharp W, Stahlhut R. Development of pharmaceutical companies based on plant products: suggested approches. Medicinal resources of the tropical forest, Columbia University Press, New York, 1996,19-40.
Hou J, 1977. The development of Chinese herbal medicine and the Pen-ts'ao. Comp Med East West 5: 117-22.
Ebbell B. The Papyrus Ebers : The greatest Egyptian medical document, Levin & Munksgaard, Copenhagen and London, 1937.
Saad B, Azaizeh H, Said O, 2005. Tradition and perspectives of arab herbal medicine: a review. Evid Based Complement Alternat Med 2: 475-479.
Valverde J, 1984.The aztec herbal of 1552. Martín de la Cruz' "Libellus de medicinalibus indorum herbis"; context of the sources on nahualt materia medica. Veroff Int Ges Gesch Pharm 53: 9-30.
Bruce-Chwatt L, 1988. Three hundred and fifty years of the Peruvian fever bark.Br Med J (Clin Res Ed) 296:1486-1487.
Chattopadhyay D, Naik T, 2007. Antivirals of ethnomedicinal origin: structure-activity relationship and scope. Mini Rev Med Chem 7: 275-301.
Pushpam Kumar, 2004. Valuation of medicinal plants for pharmaceutical uses. Curr Sci 86: 930-937.
Fabricant D, Farnsworth N, 2001. The value of plants used in traditional medicine for drug discovery. Environ Health Perspect 109: 69-75.
Perdue Jr. R, 1976. Procurement of plant materials for antitumor screening. Cancer Treat Rpt 60: 987-998.
Cragg G, Boyd M. Drug discovery and development at the national Cancer Institute: the role of natural products of plan origin. Medicinal resources of the tropical forest, Columbia University Press, New York, 1996,102-136.
Verpoorte R, 2000. Pharmacognosy in the new millennium: leadfinding and biotechnology. J Pharm Pharmacol 52: 253-262.
Ximena Buitrón, 2007. Las plantas medicinales y aromáticas en América del Sur: balance entre conservación, desarrollo y rescate de conocimientos. Boletín Especies Amenazadas número 12, disponible en http://www.sur.iucn.org/listaroja/boletin/boletin12/index.htm
Vagelos P, 1991. Are prescription drug prices high? Science 252: 1080-1084.
Kartal M, 2007. Intellectual property protection in the natural product drug discovery, traditional herbal medicine and herbal medicinal products. Phytother Res 21:113-119.
Cragg G, Schepartz S, Suffness M, Grever M, 1993. The taxol supply crisis. New NCI policies for handling the large-scale production of novel natural product anticancer and anti-HIV agents. J. Nat. Prod. 56:1657-1668.
Goodman J, Walsh V. The Story of Taxol: Nature and Politics in the Pursuit of an Anti-Cancer Drug, University Press, Cambridge, 2001.
Khosroushahi A, Valizadeh M, Ghasempour A, Khosrowshahli M, Naghdibadi H, Dadpour M, Omidi Y, 2006. Improved Taxol production by combination of inducing factors in suspension cell culture of Taxus baccata. Cell Biol Int 30: 262-9.
Andrei G, Damonte E, de Torres R, Coto C, 1988. Induction of a refractory state to viral infection in mammalian cells by a plant inhibitor isolated from leaves of Melia azedarach L. Antiviral Res 9: 221-231.
Barquero A, Alché L, Coto C, 1997. Antiviral activity of meliacine on the replication of a thymidine kinase deficient mutant of Herpes simplex virus type 1 alone and in combination with acyclovir. Int J Antimicrob Agents 9: 49-55.
Alché L, Barquero A, Sanjuan N, Coto C, 2002. An antiviral principle present in a purified fraction from Melia azedarach L. leaf aqueous extract restrains Herpes simplex virus type 1 propagation. Phytother Res 16: 348-352.
Alché L, Assad Ferek G, Meo M, Coto C, Maier M, 2003. An antiviral meliacarpin from leaves of Melia azedarach L.. Z für Naturforsch Sect C 58c (3/4): 215-219.
Barquero A, Alché L, Coto C, 2004.Block of VSV endocytic and exocytic pathways by 1-cinnamoyl-3,11-dihydroximeliacarpin, a tetranortriterpenoid of natural origin. J Gen Virol 85: 483-493.
Barquero A, Michelini F, Alché L. 2006. 1-Cinnamoyl-3,11-dihydroxymeliacarpin is a natural bioactive compound with antiviral and nuclear factor κB modulating properties. Biochem Biophys Res Commun 344: 955-962.
Alché L, Berra A, Veloso M, Coto C, 2000. Treatment with meliacine, a plant derived antiviral, prevents the development of herpetic stromal keratitis in mice. J Med Virol 61: 474-480.
Pifarré M, Berra A, Coto C, Alché L, 2002. Therapeutic action of meliacine, a plant-derived antiviral, on HSV-induced ocular disease in mice. Exp Eye Res 75: 327-334.
Kashman Y, Gustafson K, Fuller R, Cardellina J, McMahon J, Currens M, Buckheit R, Hughes S, Cragg G, Boyd M, 1992. The calanolides, a novel HIV-inhibitory class of coumarin derivatives from the rainforest tree, Calophyllum lanigerum. J. Med. Chem. 35: 2735-2743.
Tarby C, 2004. Recent advances in the development of next generation non-nucleoside reverse transcriptase inhibitors. Curr Top Med Chem 4: 1045-1057.
http://www.imshealth.com/ims/portal/front/articleC/0,2777,6266_3665_80560241,00.html
http://www.who.int/medicines/areas/traditional/en/index.html
Patwardhan B, Warude D, Pushpangadan P, Bhatt N, 2005. Ayurveda and traditional Chinese medicine: a comparative overview. Evid Based Complement Alternat Med 2: 465-473.
Taylor J, Weber W, Standish L, Quinn H, Goesling J, McGann M, Calabrese C, 2003. Efficacy and safety of echinacea in treating upper respiratory tract infections in children: a randomized controlled trial. Journal of the American Medical Association (JAMA) 290: 2824–2830.
Barrett B, Brown R, Locken K, Maberry R, Bobula JA, D'Alessio D, 2002. Treatment of the common cold with unrefined echinacea: a randomized, double-blind, placebo-controlled trial. Ann Intern Med 137: 939–946.
Gardner C, Lawson L, Block E, Chatterjee L, Kiazand A, Balise R, Kraemer H, 2007. Effect of raw garlic vs. commercial garlic supplements on plasma lipid concentrations in adults with moderate hypercholesterolemia: a randomized clinical trial. Arch Intern Med 167: 346-353.
Solomon P, Adams F, Silver A, Zimmer J, DeVeaux R, 2002. Ginkgo for memory enhancement: a randomized controlled trial. Journal of the American Medical Association (JAMA) 288: 835-840.
Kasper S, Anghelescu I, Szegedi A, Dienel A, Kieser M, 2006. Superior efficacy of St John's wort extract WS 5570 compared to placebo in patients with major depression: a randomized, double-blind, placebo-controlled, multi-center trial [ISRCTN77277298]. BMC Med 23: 4-14.
WHO Tradicional medicine strategy 2002-2005. Disponible en: http://www.who.int/medicines/publications/traditionalpolicy/en/index.html
Ma JK, Chikwamba R, Sparrow P, Fischer R, Mahoney R, Twyman RM, 2005. Plant-derived pharmaceuticals-the road forward.Trends Plant Sci. 10: 580-585.
Farnsworth N, Akerele O, Bingel A, Soejarto D, Guo Z, 1985. Medicinal plants in therapy. Bul. World Health Org. 63:965-981.
* Doctora de la Universidad de Buenos Aires, Jefe de trabajos Prácticos DE, Investigadora Asistente del CONICET
ISSN 1666-7948
www.quimicaviva.qb.fcen.uba.arRevista QuímicaViva
Número 2, año 6, Agosto 2007
quimicaviva@qb.fcen.uba.ar