La regeneración del sistema nervioso central: Cambios de paradigma y medicina regenerativa
The regeneration of the central nervous system: changes of paradigm and regenerative medicine
Pablo Francisco Argibay
Unidad de Biología del Cerebro
Instituto de Ciencias Básicas y Medicina Experimental
Hospital Italiano de Buenos Aires
pablo.argibay@hospitalitaliano.org.ar
Recibido el 23/11/06. Aceptado el 30/11/06.
“En el cerebro adulto, las vías nerviosas son fijas e inmutables; todo puede morir, nada puede regenerarse.”
Santiago Ramón y Cajal, 1928
“El hombre que acoge un nuevo paradigma en una etapa temprana debe hacerlo a menudo desafiando la evidencia acumulada por la resolución de problemas. Esto es, debe tener fe en que el nuevo paradigma triunfará con los muchos grandes problemas a que se verá enfrentado, sabiendo solamente que el antiguo paradigma ha fallado con unos
pocos. Una decisión de este carácter solo puede hacerse sobre un acto de fe.”
Thomas Kuhn
Abstract
Contrary to the traditional view that neurogenesis in the adult brain ceases during prenatal development, it is now well established that the hippocampus and the subventricular zone continues to produce neurons in the adulthood in several species, including humans. Moreover, accumulating evidence from anatomical, electrophysiological and immunohistochemical studies indicates that the newly generated cells become integrated into the circuitry of the hippocampal system. There remains, however, considerable controversy over the functional significance of these new cells. On the other hand, investigation of the molecular and cellular events sustaining intrinsic brain-repair mechanisms and a better understanding of why they fail over time in chronic disorders might, therefore, provide an attractive working hypothesis within which to develop new and efficacious therapies for neurological diseases. The review here presented intents to describe the current knowledge regarding the process of neurogénesis, their mechanisms, and the potential role for newly generated neurons in terms of neuroplasticity and regenerative medicine.
Resumen
La visión tradicional de que la generación de nuevas neuronas (neurogénesis), cesa luego del desarrollo prenatal, está actualmente siendo modificada; se ha comprobado que al menos en dos regiones del cerebro, el hipocampo y la zona subventricular, se generan nuevas neuronas a lo largo de la vida. Esto se ha confirmado en diversas especies y aun en el ser humano. Por otra parte, se ha determinado que las nuevas neuronas se integran en el hipocampo en los circuitos preexistentes. Obviamente, es bastante dificultoso determinar el significado funcional de estas nuevas neuronas, a pesar de lo cual se considera que intervendrían en procesos fisiológicos relacionados a la esfera cognitiva, más precisamente asociados al almacenamiento y recuperación de la memoria reciente.
El mencionado cambio de paradigma, trae aparejado también un potencial rol terapéutico para la neurogénesis y una nueva interpretación a diversas enfermedades degenerativas del sistema nervioso central. La presente revisión del tema intenta describir el conocimiento actual del fenómeno de neurogénesis, los mecanismos involucrados y su potencial significado funcional en condiciones fisiológicas y de enfermedad.
1. Nuevas neuronas en el cerebro del adulto:
El paradigma de un sistema nervioso central incapaz de restituir las células neuronales que progresivamente se van perdiendo comenzó a ser puesto en duda a mediados de la década del 60. Sin embargo, los trabajos pioneros de la época no fueron tenidos en cuenta principalmente debido a cuestiones técnico-metodológicas (Altman J, 1965) (Kaplan MS, 1977).
Recién en la década del 80, el avance notorio de la inmunohistoquímica, la citología y las técnicas moleculares; cambiaron el paradigma dominante. Investigadores como Goldman y Nottebohm sugirieron que la generación de nuevas neuronas, la neurogénesis, podría ser un fenómeno normal en el cerebro de canarios adultos (Goldman SA, 1983), el mismo grupo demostró en un trabajo posterior que las nuevas neuronas se incorporaban a circuitos funcionales (Paton JA, 1984 ).
A principios de los años 90, Reynolds y Weiss lograron aislar en ratones, en una zona del cerebro, el cuerpo estriado , células con propiedades de células madre (Reynolds BA, 1992) En esa misma época, Lois y Alvarez-Buylla identificaron a la zona subventricular (SVZ) del ratón como sitio de localización de precursores neuronales (Lois C, 1993). Hacia fines de los años 90 se observó que la neurogénesis era un fenómeno extendido a los primates superiores incluido el ser humano. (Gould E, 1999 ). Utilizando bromodeoxiuridina (BrdU), un análogo de la timidina, el grupo de Fred Gage muestra que en el cerebro del ser humano se observa neurogénesis en el giro dentado del hipocampo , una zona de notable interés funcional por estar básicamente relacionada con la memoria y el aprendizaje (Eriksson PS, 1998)
Con el tiempo, diferentes experimentos mostraron que el destino de las nuevas células subgranulares hipocampales era migrar hacia la zona granular, diferenciarse en neuronas y emitir conexiones funcionalmente activas con otras áreas del hipocampo, básicamente el área CA3 (Markakis EA, 1999) ( van Praag H, 2002).
En relación a la neurogénesis en el hipocampo, diversos experimentos mostraron que ésta se encuentra incrementada por las condiciones ambientales y la ejecución de tareas motoras. Por ejemplo, en ratones, la exposición a un ambiente enriquecido es capaz de estimular la neurogénesis (Kempermann G, 1997). Por otro lado, se observó que el ejercicio físico puede producir dicho fenómeno ( van Praag H, 1999). Incluso existe evidencia de que estímulos específicos son capaces de generar neurogénesis y cambios adaptativos en zonas relacionadas con esos estímulos. Un ambiente enriquecido con estímulos odoríferos genera un aumento en la producción y migración de neuronas hacia el bulbo olfatorio sin afectar la neurogénesis del hipocampo (Rochefort C, 2002). Por el contrario, un ambiente enriquecido inespecíficamente o la simple actividad física del correr en una rueda, estimula en ratones, la neurogénesis en el hipocampo, pero no la relacionada con áreas olfatorias (Brown J, 2003).
Finalmente la generación de nuevas neuronas en el cerebro adulto ha sido relacionada con diversas enfermedades. Gould y colaboradores mostraron que en la musaraña una animal arborícola relacionado por ambas partes con los primates y los insectívoros, el estrés psicosocial es un regulador negativo de la neurogénesis del hipocampo. (Gould E, 1997). El mismo grupo mostró que las experiencias estresantes en etapas tempranas del desarrollo inhibe la proliferación de precursores de células granulares del hipocampo en ratas (Tanapat P, 1998) .
En el área de la psiquiatría, la relación entre la enfermedad depresión mayor y el estrés, así como las alteraciones del hipocampo propias de la enfermedad depresiva (Videbech P, 2004), han hecho pensar en una relación entre neurogénesis y esta enfermedad. Sin embargo, si bien en modelos animales de depresión parecería haber una reducción en la neurogénesis, las bases fisiopatológicas de la disminución de la neurogénesis como sustrato de la enfermedad depresiva es aun controversial (Kempermann G. 2002). No obstante lo anterior es clara la relación entre terapias antidepresivas y estimulación de la neurogénesis. Incluso en un elegante modelo experimental, Santarelli y colaboradores parecieron demostrar la necesidad de una neurogénesis intacta para que sea efectiva la acción de algunas drogas antidepresivas (Santarelli L, 2003 ). Es interesante hacer notar que en este trabajo la sola inhibición de la neurogénesis por irradiación selectiva de las zonas de neurogénesis no produjo cambios conductuales en los animales. No obstante lo anterior, en trabajos previos se observó que una supresión selectiva de células recién nacidas afecta tareas relacionadas con el hipocampo (Shors TJ, 2001). En fin, como ha dicho alguna vez Elizabeth Gould, “Los antidepresivos probablemente hagan muchas cosas que no estén relacionadas directamente con su acción terapéutica”. Si este es el caso de la clara estimulación de los antidepresivos sobre la neurogénesis, no lo sabemos a ciencia cierta y es tema de debate (Thomas RM, 2003). Es probable que como lo muestra el trabajo de Santarelli y colaboradores, la inhibición de la neurogénesis per se, no sea la principal causa de la enfermedad depresiva, aunque es necesaria la presencia de nuevas neuronas para la acción de algunos antidepresivos. Como quiera que sea, el concepto de neurogénesis como mecanismo de neuroadaptación a diferentes circunstancias conductuales y patológicas es interesante y merece ser analizado en el futuro con más detenimiento (Schaffer DV, 2004) .
Está de más decir que gran parte de los estudios arriba mencionados, se han llevado a cabo en modelos animales. Y si bien está prácticamente probada la neurogénesis en los seres humanos y su correlación establecida post mortem con ciertas patologías, resta aun un largo camino por recorrer para establecer el significado funcional (si es que lo tiene), de la neurogénesis en el ser humano. Fundamentalmente el desarrollo de métodos por imágenes in vivo a nivel celular y molecular, podrán evidenciar dinámicamente la relación entre la generación de nuevas neuronas en el cerebro humano, su localización y su potencial rol funcional (Oweida AJ, 2004).
2. ¿Posee el organismo mecanismos fisiológicos de reparación cerebral?
Una hipótesis más que provocativa sugiere que las alteraciones crónicas inflamatorias y degenerativas, así como los déficit post isquemia del cerebro adulto, son más el resultado de un mecanismo defectuoso, inapropiado o no lo suficientemente eficaz, dada la magnitud de las agresiones relacionadas al organismo humano, de reparación que de la patogenicidad del insulto en sí (Martino G., 2004).
El accidente cerebro vascular (stroke) la esclerosis múltiple, las enfermedades de Parkinson y Alzheimer, así como otras enfermedades degenerativas, tienen efectos crónicos e incapacitantes con un costo altísimo económico, individual y social. Por otra parte, las terapias disponibles actualmente, distan de ofrecer un tratamiento efectivo en estos enfermos. El fracaso del paradigma clínico convencional, ha hecho que se busquen hipótesis alternativas, basadas obviamente en sólidos hechos clínicos y experimentales. En varios experimentos se ha observado que luego de diversas injurias, se producen cambios en la interacción entre los axones de la zona dañada y las células de la glía. Estos mecanismos prevendrían una muerte neuronal excesiva y la formación de cicatrices, a la vez que estimularían la remielinización y reformarían circuitos y sinapsis compensatorias (Monje M. et al. 2003) (Bereyre F. et al. 2004).
En el caso de una patología crónica y desmielinizante como la esclerosis múltiple se han observado episodios espontáneos de remielinización en particular en las etapas iniciales del problema. Estos mecanismos son finalmente superados por el avance de la enfermedad; lo que ha hecho más sustentable la hipótesis del “fracaso” de los mecanismos de autorreparación cerebral (Trapp B. et al. 1998) (Frankiln R. 2002). Es interesante el hecho de que ante la injuria inflamatoria los linfocitos tienen una acción dual, ya que si bien generan una reacción inflamatoria, por otra parte producen factores neurotróficos que participan directamente en los procesos de neurogénesis, como BDNF (brain-derived neurotrophic factor), NGF (nerve growth factor) y neurotrofinas. Incluso citoquinas altamente tóxicas como el TNF (Tumour necrosis factor), tienen efectos neurotróficos cuando actúan sobre receptores diferentes. (Arnett H. et al. 2001).
Por otra parte, se ha sugerido que a partir de las zonas cerebrales injuriadas se liberarían cascadas de quemoquinas quemoatractoras que activarían la migración y diferenciación neuronal de células progenitoras adultas. (Klassen H. et al. 2003) .
3. Creando una nueva neurona en el cerebro adulto
La generación de nuevas neuronas en el cerebro adulto de varias especies, incluido el ser humano es un tema totalmente aceptado. Independientemente de algunos resultados dispares como consecuencia de dos problemas fundamentales: la marcación con BrdU y sus limitaciones en términos de especificidad, además de la existencia discutible de marcadores exclusivamente neuronales. (Cooper-Kuhn CM, 2002) (Hayes NL, 2002) .
La neurogénesis del adulto, ha sido demostrada en el hipocampo y la zona subventricular (SVZ). Sin embargo, una evidencia reciente muestra que el cuerpo estriado y aun la neocorteza podrían ser sitios activos de neurogénesis (Dayer AG, 2005) .
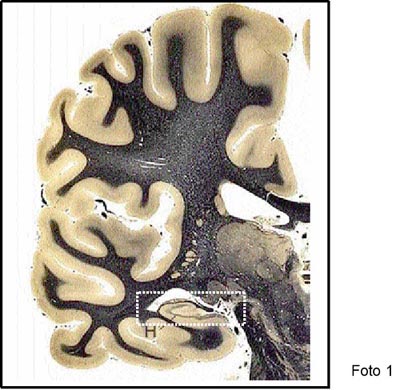
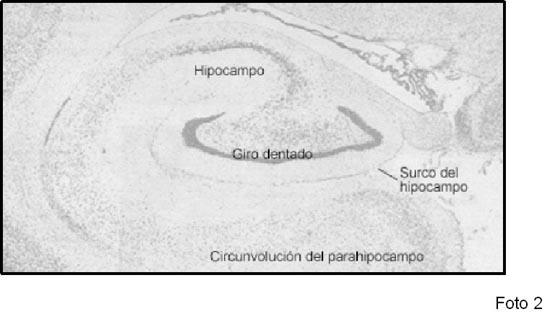
Particularmente en el ser humano se ha puesto atención en la zona subgranular del hipocampo (SGZ), por las implicancias de esta región cerebral en procesos cognitivos diversos. Fotos 1 y 2. En el hipocampo, se han propuesto diversos modelos para explicar la proliferación celular en la SGZ hasta el establecimiento de nuevas conexiones por las neuronas maduras. (Kempermann G, 2004).
|
|
|
|
Foto 1: Corte frontal de un cerebro humano, donde se muestra la ubicación del hipocampo (H). (Tinción de Weigert: se observa teñida de negro la sustancia blanca). Gentileza del Dr. Gabriel Fratícola. |
El desarrollo del sistema nervioso central termina en etapas tempranas postnatales y a partir de ese momento el paradigma imperante indica que la estabilidad de los circuitos establecidos se “fortalece” significativamente a partir de nuevas conexiones (plasticidad sináptica), más que por el agregado de nuevos elementos (neurogénesis). Es decir que si la neurogénesis existe parecería ser como parte de un programa excepcional en el cual se dan todas las condiciones favorables para que algunos progenitores neuronales den origen a células que sobrevivan, a pesar de que muchas sufrirán el proceso de apoptosis (Biebl M, 2000), migren y se integren en circuitos pre-existentes. (Kuhn HG, 1996) (Kempermann G, 2003) (Stanfield BB, 1988) (van Praag H, 2002).
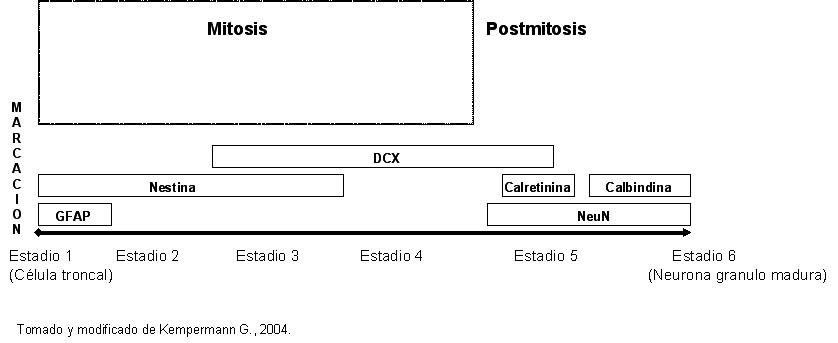
Kempermann y colaboradores proponen un modelo en seis etapas diferenciables morfológicamente y por la expresión de ciertas proteínas características.: (Kempermann G, 2004).
 |
|
|
Foto 2: Corte frontal de un cerebro humano que muestra el hipocampo y el giro dentado (zona de neurogénesis). (Tinción de Nissl: se observan de coloración oscura las zonas correspondientes a cuerpos neuronales). La zona corresponde a la zona marcada con un rectángulo en la foto 1. Gentileza del Dr. Gabriel Fratícola. |
En el estadio 1, en la zona germinal de la SGZ, las células troncales putativas (células con características de astrocitos radiales) (Seri B, 2001), comenzarían su división para dar origen a precursores pasajeros (células D), estadios 2 a 4, que serian los que finalmente darán origen a las nuevas neuronas granulares postmitóticas (Seri B, 2004) . Estas células postmitóticas pasarían por una etapa temprana pasajera de establecimiento de conexiones (estadio 5), para finalmente ser seleccionadas como neuronas granulares maduras postmitóticas (estadio 6). (Brandt MD, 2003) . En algunas etapas existiría un solapamiento de marcadores, siendo algunos de ellos específicos de un estadio. En el estadio 1, la célula troncal putativa expresa como marcador la proteína acídica fibrilar glial (GFAP), típicamente glial. Este marcador no se observaría en los otros estadios. La proteína nestina (considerada un marcador de progenitores), en cambio se expresaría a lo largo de los estadios 1 a 3 con un solapamiento en el estadio 3 con la proteína doblecortina (DCX). La marca de DCX indicaría cierta restricción de linaje y persistiría durante los estadios 4 y 5. En este último estadio existiría un solapamiento entre las marcas de DCX, calretinina (neuronas inmaduras) y la proteína nuclear neuronal (NeuN). NeuN, marcador neuronal definitivo que continuaría presente en el estadío 6 con un solapamiento con la proteína calbindina, típica de neuronas maduras. (Figura 1). Como vemos el proceso de neurogénesis es un proceso complejo potencialmente regulable en diferentes etapas y en el cual la presencia de estadios transitorios podría estar hablando de mecanismos de control en los cuales todavía el destino fenotípico de la célula no esta definido, mientras que en los estadios finales (parte de 4, 5 y 6), la célula ya estaría comprometida en su linaje, no solo neuronal sino quizás también en diversas tareas incluso neuroquímicas. Claro que el mecanismo descrito, si bien tiene sustento experimental, dista aun de estar completamente demostrado.
 |
|
Figura 1: Modelo de seis etapas con las marcas características en cada etapa. Se observa que la putativa célula troncal o progenitor es la única célula de los estadios que expresa GFAP. Por otra parte, nestina, una proteína característicamente atribuida al fenotipo de las células progenitoras se expresa hasta el límite entre los estadios 3 y 4. En este momento (Estadio 4), se producen cambios morfológicos importantes y la célula entraría en un punto de no retorno. La proteína DCX se expresa en los estadios 3, 4 y 5. Finalmente en la etapa postmitótica (5 y 6), la célula adquiere características de neurona grano, inmadura y madura sucesivamente. En esas etapas se produce la expresión de una proteína típicamente neuronal, NeuN. Estadios 5 y 6 se diferencian por la expresión de calretinina y calbindina respectivamente. Para más explicaciones ver el texto. |
4. La misteriosa célula troncal :
Desde hace unos años se tiene evidencia de que células de extirpe glial serian las células troncales del adulto involucradas en los procesos de neurogénesis anteriormente mencionados (Alvarez-Buylla A, 2001) . Las células gliales son las más numerosas en el cerebro e incluso persisten cuando gran parte de la población neuronal se ha visto anulada. Mientras que la microglía y los oligodendrocitos tienen propiedades funcionales relativamente específicas, los astrocitos son células con una enorme plasticidad funcional, involucradas en funciones como el soporte neuronal, la interacción con el endotelio para formar la barrera hematoencefálica, la absorción de neurotransmisores, el mantenimiento de la hemostasis y la producción de mediadores. Por otra parte los astrocitos mantienen una estrecha comunicación con las neuronas formando una verdadera unidad funcional (Fields RD, 2002) .
Clásicamente se ha considerado que durante la embriogénesis cerebral el neuroepitelio que recubre los ventrículos actuaría como reservorio de células troncales neuroepiteliales con la bipotencialidad de dar origen a progenitores neuronales y progenitores gliales. La glía radial, se localiza en la zona ventricular extendiéndose hasta la superficie pial, sirviendo de matriz para la migración de las nuevas neuronas generadas en la zona ventricular a partir de las células troncales neuroepiteliales (Rakic P., 1972). Luego de la migración neuronal la glía radial se transformaría en astrocitos. El modelo clásico, supone entonces que la glía radial está comprometida con el linaje astrocitario y que la célula troncal es de origen neuroepitelial. (Voigt T., 1989).
Este modelo ha sido extrapolado al adulto, dando lugar a la idea de que las células ependimales podrían actuar como células troncales. Sin embargo, investigaciones recientes mostrarían que en realidad las células ependimales del adulto serian postmitóticas y derivarían de la glía radial durante la embriogénesis. Quedan de esta manera cuestionados dos modelos el de la glía radial como derivada del neuroepitelio ventricular y el de la putativa acción de célula troncal de la célula ependimal del adulto (Spassky N, 2005) .
En el cerebro adulto se aceptan sin dudas dos zonas de neurogénesis: la zona subventricular (SVZ), de los ventrículos laterales, que genera las neuronas que poblarán el bulbo olfatorio (Lois C, 1993) y la zona subgranular (SGZ), del hipocampo, que genera las neuronas granulares de dicha zona (Kaplan MS, 1977). De ambas regiones se han aislado células troncales, las cuales cultivadas con los factores adecuados dan origen a nuevas neuronas (Palmer TD, 1995) . Analizaremos brevemente la neurogénesis a partir de las células troncales en ambas zonas:
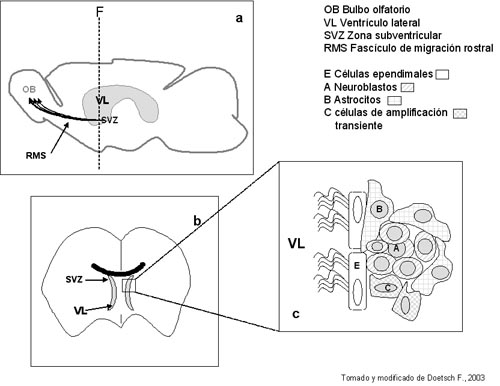
Zona subventricular: es un manto de células que se extiende recubriendo las paredes laterales de los ventrículos laterales. Las células que nacen a lo largo de la SVZ se agrupan en un cordón de neuroblastos migratrices que forman el fascículo de migración rostral (RMS), que une la SVZ con el bulbo olfatorio (OB). En el OB las células se diferencian en dos tipos de neuronas inhibitorias, las granulares y las periglomerulares (Doetsch F, 1996). La arquitectura de la SVZ y del RMS ha sido bien caracterizada (Figura 2) (Doetsch F, 1999) . Las células A (neuroblastos), migran en cadena de células homólogas, a través de un túnel formado por astrocitos en división (células B). A lo largo del túnel se observan racimos de células de división rápida (células C). Por otra parte, la SVZ esta separada del ventrículo por una capa de células ependimales ciliadas. La secuencia sería, los astrocitos subventriculares (células B), con propiedades de célula troncal se autorregenerarían (esta comprobado in vitro), y darían origen a las células C que se dividen para dar las células A (neuroblastos) migratrices.
|
|
|
Figura 2: 2a; Se observa un esquema de un corte parasagital de cerebro de ratón en el cual se puede apreciar el ventrículo lateral (VL) y la zona subventricular (SVZ) donde se produce la neurogénesis. Las células producidas en esta región migraran como neuroblastos a través del fascículo de migración rostral (RMS), hacia el bulbo olfatorio (OB). 2b; en la figura 2a el eje F, esquematiza un corte frontal que pasaría por la zona descripta en 2b. Se observa la SVZ , amplificada esquemáticamente en 2c. En 2c, se esquematiza la organización estructural de la SVZ. La pared del ventrículo lateral (VL), está tapizada por una capa de células multiciliadas ependimales (E). las cadenas de neuroblastos (A), migran a través de un túnel formado por la astroglía (B). En diversos focos dispersos se observan células de división rápida (C). para más explicaciones ver el texto. |
Zona subgranular del hipocampo: la neurogénesis en esta zona fue descripta en el apartado anterior, sin embargo, se puede intentar describir esta zona en forma análoga a lo que se hizo con la SVZ (Doetsch F., 2003) (Seri B, 2004).
Las neuronas del giro dentado (DG) nacen en la zona subgranular (SGZ), que se encuentra entre la capa de células granulares y el hilio. A diferencia de la gran distancia recorrida por las células de la SVZ, las neuronas nacidas en la SGZ recorren un corto trayecto hasta la zona granular del DG. Utilizando la nomenclatura arriba propuesta, la SGZ contiene astrocitos (Células B) y una población de células GFAP (-), ultraestructuralmente oscuras denominadas células D. De la misma manera que en la SVZ, los astrocitos actúan como los precursores neuronales primarios.
Vemos entonces que tanto en la SVZ como en la SGZ, los astrocitos son los precursores primarios, habiendo fuerte evidencia de que serian células troncales autorrenovables. Por otra parte se ha propuesto que las células ependimales multiciliadas podrían ser las células troncales en el adulto (Johansson CB, 1999). Sin embargo, el concepto que seria aceptado recientemente es que las células ependimales crearían un “nicho” neurogénico (Doetsch F., 2003 ), propicio para la neurogénesis a través de la producción del factor noggin un antagonista de la proteína morfogenética ósea (BMP) la cual promueve la diferenciación astroglial de la región (Lim DA, 2000), (Ver mas adelante “Regulación de la neurogénesis”.
En síntesis, la evidencia in vitro, básicamente obtenida a través de los estudios en cultivos con células que generan neuroesferas, indica que la glía actuaría como célula troncal. Sin embargo, los estudios que demuestren este rol in vivo, no son simples de llevar a cabo y los experimentos in vivo solo brindan una fuerte evidencia a favor de que las células gliales serían precursores neuronales y putativamente células troncales. Por otra parte pese a tener evidencia de que los astrocitos podrían ser las células troncales, queda aun el problema de definir claramente a que llamamos “astrocito”. La heterogeneidad de los astrocitos en el cerebro es grande y aun en el propio hipocampo existirían diferentes poblaciones de astrocitos con propiedades funcionales y morfológicas diferentes. (D'Ambrosio R, 1998) ( Zhou M, 2001).
Como quiera que sea, identificar la estirpe de las células troncales neuronales del adulto in vivo es una tarea aun por realizar, cuyas consecuencias no serian menores. Si la astroglía en conjunto o una subpoblación de estas células son las células troncales del adulto que están en un estado latente a lo largo del cerebro, la siguiente cuestión de interés practico directo en el tema de la reparación del daño neuronal sería cómo se puede lograr que estas células troncales desarrollen neuronas nuevas en zonas de injuria y lo que no es menor aun, cómo lograr que las nuevas neuronas se integren en los circuitos existentes y sean funcionales.
5. Regulación de la neurogénesis:
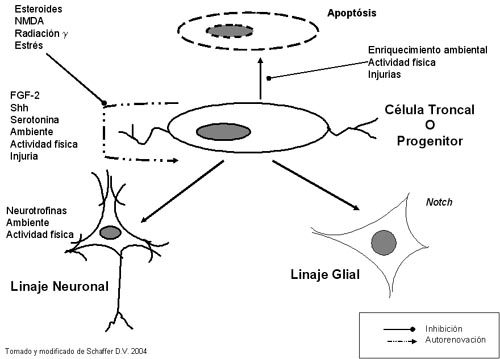
Como hemos visto, la creación de una nueva neurona es un proceso complejo que en forma sintética incluye los pasos de proliferación de una célula troncal, diferenciación, migración e integración funcional. El fenómeno es altamente regulado y tiene numerosas etapas de control y de potencial detenimiento o vuelta atrás del proceso. Factores genéticos y epigenéticos, factores de crecimiento, neurotransmisores, hormonas y obviamente las condiciones ambientales son reguladores de la neurogénesis (Zhao X, 2003). Sin embargo, en forma sintética se pueden describir algunos pasos limitantes y mediadores fundamentales para entender el mecanismo de neurogénesis en el hipocampo adulto, una de las zonas relevantes por sus implicancias fisiológicas y clínicas, (Figura 3).
|
|
|
Figura 3: Esquema simplificado de la regulación del ciclo celular de la célula troncal hipocampal. Una mayor discusión se encuentra en el texto.
|
El factor fibroblástico básico (FGF-2), fue de las primeras moléculas que in vitro demostraron ser necesarias para promover la proliferación de los progenitores neurales (Ray J, 1993). Posteriormente in vivo se mostró también que FGF-2 tiene efectos mitogénicos neurales, describiéndose un cofactor necesario para su acción, la cistatina C glicosilada (CCg), sugiriéndose una necesaria colaboración de factores autócrinos y parácrinos para la estimulación de la neurogénesis (Taupin P, 2000). Por otra parte se ha encontrado una amplia distribución del receptor para FGF-2, (FGFR1), en diversas células del hipocampo, proponiéndose una interacción entre el FGF-2 astrocitario y FGFR1 neuronal. ( Weickert CS, 2005) .
Recientemente, se ha observado que algunos de los efectos ambientales sobre la neurogénesis están mediados también por otro factor de crecimiento, el factor de crecimiento vascular endotelial (VEGF) (Cao L, 2004) .
Por otra parte, si bien es necesario un nicho local para el desarrollo del proceso de neurogénesis, se ha observado que un factor no presente en el hipocampo, el factor “Sonic hedgehog”, (Shh) , expresado en altas concentraciones en la corteza basal, en el cerebelo y motoneuronas (Traiffort E, 1999), es capaz de estimular poderosamente la neurogénesis hipocampal in vivo. Esto sugeriría una vía de regulación extrahipocampal a través de un transporte anterógrado de mediadores como Shh que actuarían sobre receptores de células troncales hipocampales (Traiffort E, 2001) (Lai K, 2003). Recientemente, la regulación de Shh sobre la neurogénesis se ha extendido a la SVZ, en la cual actuaría sobre la astroglía con putativas funciones de célula troncal (Palma V, 2005).
Independientemente de estos y otros factores proliferativos desconocidos, un punto de relevancia en la neurogénesis es el control de la diferenciación celular. Este proceso está bastante bien descifrado en la SVZ. En esta región se sabe que las proteínas morfogenéticas óseas (BMPs), proteínas de la familia de los factores de crecimiento transformantes (TGFs) son capaces de promover la diferenciación astrocitaria de los progenitores embrionarios. (Gross RE, 1996) . Por su parte noggin, otra proteína reguladora, se une a las BMPs y es capaz de inhibir su actividad promoviendo la diferenciación neuronal (Lim DA, 2000).
Recientemente se ha descrito un correceptor (DRAGON), para algunos de los miembros de las BMPs en el embrión. DRAGON potenciaría la acción de las BMPs, siendo esta acción inhibida por noggin (Samad TA, 2005) . Se estaría quizás en presencia de un mecanismo en el cual la función de ligando de algunas BMPs se produciría por defecto, siendo esta inhibida al desplazarse de la unión, factores como DRAGON por otros factores inhibitorios como noggin. De todas maneras resta mostrar que esta acción ocurra en la neurogénesis del adulto. Por otra parte, tampoco esta bien caracterizada la acción de noggin en regiones como el hipocampo adulto. Sin embargo se sabe que estímulos ambientales como tareas de aprendizaje espacial en ratas (prueba del laberinto acuático), incrementan la expresión de noggin en el hipocampo adulto (Fan XT, 2003), mientras que la inhibición de este factor a través de terapias antisentido inhibe la proliferación celular en dicha zona (Fan XT, 2004) .
Entre los factores que promueven la diferenciación in vitro y putativamente in vivo en el cerebro adulto, se ha destacado el factor neurotrófico derivado del cerebro (BDNF) (Maisonpierre PC, 1990. Además la sobreexpresión de este factor en la SVZ, aumenta la diferenciación neuronal (Benraiss A, 2001) Por otra parte otros experimentos indicarían que la acción de BDNF no es tan simple siendo este factor un regulador de la neuroadapatación a través de una estimulación o inhibición de la proliferación celular ambiente dependiente. Se ha visto que la sobreexpresión de BDNF persistente en el hipocampo de animales con injuria isquémica, contrarresta el aumento de neurogénesis que este evento produce (Larsson E, 2002) . Por otra parte, en un modelo de separación maternal temprana en ratas se han detectado niveles elevados de BDNF en presencia de una neurogénesis normal en los animales adultos. Los autores consideran que en este caso, que si bien los niveles de neurogénesis fueron iguales en los controles que en los animales separados de sus madres por largo tiempo, a pesar de los diferentes niveles de BDNF a favor de los últimos, esto se debería a un efecto compensador del BDNF, el cual compensaría los niveles de neurogénesis que deberían estar disminuidos en los animales separados tempranamente de sus madres y en los cuales se producirían altos niveles de estrés un factor ambiental inhibidor de la neurogénesis. (Greisen MH, 2005). De todas maneras los efectos reales del BDNF como regulador o exclusivamente estimulador de la diferenciación neuronal, restan por ser elucidados in vivo, a pesar de lo mucho que se ha estudiado la regulación de este factor. Por ejemplo, a nivel de plasticidad sináptica, el otro mecanismo de neuroadaptación, se ha sugerido hace varios años que los factores tróficos son reguladores, ambiente- dependiente (Thoenen H., 1995) .
Por último, luego de ver brevemente la proliferación y diferenciación neurales, resta por describir los mecanismos que hacen que una nueva neurona sobreviva y se integre a los antiguos circuitos. In vitro, tanto FGF-2 como Shh son capaces de promover además de la proliferación, la supervivencia neuronal (Ray J, 1993) (Lai K, 2003). Sin embargo, no están claros los mecanismos moleculares que regulan la supervivencia neuronal in vivo. El tema es del mayor interés, ya que si bien se produce neurogénesis a lo largo de la vida adulta, también se sabe que gran parte de las neuronas generadas entrarán en apoptosis. En trabajos recientes se sugiere que las nuevas neuronas entrarían en apoptosis en etapas tempranas de su diferenciación a través de un mecanismo Bax-dependiente. En ratones “knock outs” para el gen Bax no se observa apoptosis neuronal, sin embargo la proliferación de los progenitores neurales no se ha visto afectada. Es concebible que luego de la diferenciación, una apoptosis fisiológica Bax-mediada sea necesaria para que sólo se integren en los circuitos existentes aquellas neuronas necesarias y no haya una proliferación innecesaria (Sun W, 2004). Un tema a elucidar sería si la apoptosis es un mecanismo por defecto y de ser así cuáles serian las señales que en casos específicos la inhibirían. En modelos de isquemia cerebral en ratas se ha observado que VEGF tiene un efecto neuroprotector a través de inhibición de mecanismos de apoptosis y de neurogénesis (Sun FY, 2005). Dada la relación entre los efectos ambientales de VEGF y la neurogénesis en condiciones normales ((Cao L, 2004), seria interesante elucidar si la inhibición de la apoptosis en condiciones fisiológicas de neurogénesis es un mecanismo al menos parcialmente mediado por VEGF.
Durante el desarrollo embrionario, se ha mostrado recientemente que señales de tipo Notch participan en la supervivencia neuronal a través de mecanismos distintos de los clásicamente conocidos mecanismos regulatorios. Estas señales actuarían a través de una regulación positiva de los genes antiapoptóticos Bcl-2 y Mcl-1 (Oishi K, 2004) .
Es probable que en la vida adulta se mantengan los mecanismos clásicos de regulación apoptosis-supervivencia. Sin embargo no está claro qué hace que el balance se incline hacia uno u otro lado.
Para terminar este apartado de regulación de la neurogénesis es necesario mencionar el rol de los neurotransmisores. La inhibición o lesión de varias vías neuroquímicas afecta la neurogénesis. Por una parte la administración crónica de inhibidores de la recaptación de serotonina promueve la proliferación y supervivencia celular, mientras que la lesión de las proyecciones serotoninérgicas reduce la acumulación de nuevas neuronas hipocampales (Brezun JM, 1999) (Gould E., 1999). La importancia de este efecto de la serotonina y su influencia sobre la neurogénesis en relación a la acción de los antidepresivos ya ha sido mencionada (Santarelli L, 2003).
Por otra parte la activación de los receptores de N-Metil-D-Aspartato (NMDA), inhibe la neurogénesis, mientras que el tratamiento con antagonistas del receptor NMDA, regulan positivamente la proliferación celular, diferenciación y supervivencia neuronal (Cameron HA, 1995) .
Recientemente se ha mostrado que una lesión de las aferencias colinérgicas sobre el hipocampo, tiene dos efectos sinérgicos, disminuye la neurogénesis y aumenta el nivel de apoptosis (Cooper-Kuhn CM, 2004) .
Otros estudios sugieren un rol en la depleción dopaminérgica sobre la proliferación de precursores neurales y el desarrollo de la enfermedad de Parkinson. En los experimentos realizados en roedores, la eliminación de los precursores inducida por la ablación dopaminérgica es restaurada por agonistas de los receptores dopaminérgicos (Hoglinger GU, 2004) .
Lo expuesto muestra una indudable correlación entre la actividad de numerosos neurotransmisores y la proliferación, diferenciación neuronal y supervivencia. Sin embargo, dado lo complejo de las interacciones entre el ambiente, la homeostasis y otros factores tróficos, antes descriptos, con los neurotransmisores es difícil establecer in vivo el origen de la cadena que desemboca en un incremento de una neurogénesis funcional. Probablemente, falten aún realizar experimentos in vitro para disecar finamente la cadena de eventos moleculares y biológicos.
6. ¿Para qué sirve la neurogénesis?
Como hemos deslizado más arriba, podría ser que la neurogénesis sea un resabio funcional más que realmente un mecanismo o parte de un mecanismo eficaz para el logro de algunas tareas cerebrales, más concretamente tareas cognitivas. Sin embargo, algunos de los hallazgos recientes parecen indicar que la neurogénesis está activamente involucrada en las funciones adjudicadas al hipocampo. (Shiner A. y Gage F., 2004)
La hipótesis propuesta es que las actividades cognitivas dependientes del hipocampo involucrarían el reclutamiento de nuevas neuronas en los circuitos neuronales del giro dentado. Supuestamente, dichas neuronas tendrían un rol central en el procesamiento, almacenamiento y eventual recuperación de nuevas memorias.
Hallazgos recientes de nuestro laboratorio trabajando con un modelo de red neuronal artificial, parecerían reforzar la hipótesis mencionada, sobre todo en términos de ventajas en la recuperación de nuevas memorias. (Weisz V. y Argibay P., 2006). Sin embargo, lo cierto es que la cuestión no ha sido elucidada con una evidencia experimental robusta, sobre todo debido a que los experimentos conductuales para evaluar la memoria episódica en la cual el hipocampo tendría un rol central no son sencillos ni lo suficientemente específicos.
En apoyo de la hipótesis del rol de la neurogénesis en las tareas del hipocampo, recientes experimentos con inhibición de la neurogénesis por irradiación local, muestran que ratas en las cuales se inhibió la neurogénesis se mostraron menos eficaces en la resolución de una prueba en la que se evaluó la memoria para eventos específicos. (Winocur G. et al., 2006). Sin embargo, estos resultados no han sido totalmente reproducibles por otros grupos, lo cual ha sido atribuido a las diferencias en los métodos utilizados para inhibir la neurogénesis. Probablemente se tengan resultados más precisos con la utilización de inhibidores específicos de la neurogénesis.
7. Neuroadaptación
El concepto de neuroadaptación involucra la interacción de dos sistemas extremadamente complejos, el medio ambiente con sus múltiples variables y el cerebro, prácticamente desconocido en sus mecanismos básicos. En general se ha definido la neuroadaptación en psiquiatría como un estado de habituación mediante el cual el organismo de un individuo altera su metabolismo cerebral, neurofisiología y personalidad, estableciendo un vínculo adictivo hacia una sustancia psicoactiva sin la cual presenta trastornos psicofísicos de diverso tipo. Sin embargo en neurobiología el término involucra aquellos cambios por los cuales el cerebro modifica su estructura y función no ya por una sustancia adictiva sino como consecuencia del ambiente todo. De alguna manera y en la época del cognitivismo, la neuroadaptación es un tipo de aprendizaje que involucra una modificación de la estructura cerebral en dos aspectos básicos, sus conexiones (plasticidad sináptica) y sus elementos (proliferación celular). El conocimiento de la neurogénesis en el cerebro del adulto y su regulación por cambios ambientales, tales como el estrés ha significado un gran avance no solo en neurobiología, sino en áreas como la geriatría o los trastornos del aprendizaje, sin hablar de las enfermedades psiquiátricas como la depresión y los trastornos neurológicos como la epilepsia y el infarto cerebral. Aun nuestros conceptos acerca de la denominada “mente” y los procesos cognitivos se modifican con el nuevo paradigma. Si bien, durante los últimos años la modelización cerebral ha girado en torno al denominado “enfoque conexionista” y a la interpretación de los mecanismos de procesamiento cerebral como los emergentes de un sistema de redes neuronales, debemos decir que si el cerebro se comporta aunque más no sea esquemáticamente como una red neuronal artificial (Rolls ET, 1998), ésta debe ser muy particular ya que debería tener una arquitectura dinámica a dos niveles, la fuerza y el cambio de las conexiones (Hebb D.O, 1949) (Van Ooyen A., 2005), y el agregado y desaparición de nuevos componentes en el sistema (neurogénesis y apoptosis). Por otra parte es casi ínfimo lo que se sabe en relación a los procesos de gliogénesis y los cambios adaptativos durante procesos fisiológicos como el aprendizaje, cambios ambientales como el estrés y las diversas noxas que afectan al cerebro. Todo esto sin dejar de lado el hecho de que el cerebro recibe entradas y emite salidas hacia todo el organismo.
Referencias
Altman J, Das GD. Autoradiographic and histological evidence of postnatal hippocampal neurogenesis in rats. J Comp Neurol. 1965 Jun;124(3):319-35.
Alvarez-Buylla A, Garcia-Verdugo JM, Tramontin AD. A unified hypothesis on the lineage of neural stem cells. Nat Rev Neurosci. 2001 Apr;2(4):287-93.
Arnett HA, Mason J, Marino M, Suzuki K, Matsushima GK, Ting JP. TNF alpha promotes
proliferation of oligodendrocyte progenitors and remyelination. Nat Neurosci 2001; 4: 1116–22.
Benraiss A, Chmielnicki E, Lerner K, Roh D, Goldman SA. Adenoviral brain-derived neurotrophic factor induces both neostriatal and olfactory neuronal recruitment from endogenous progenitor cells in the adult forebrain. J Neurosci. 2001 Sep 1;21(17):6718-31.
Bereyre FM, Kerschensteiner M, Raineteau O, Mettenleiter TC, Weinmann O, Schwab ME. The injured spinal cord spontaneously forms a new intraspinal circuit in adult rats. Nat Neurosci 2004; 427: 740–744.
Biebl M, Cooper CM, Winkler J, Kuhn HG. Analysis of neurogenesis and programmed cell death reveals a self-renewing capacity in the adult rat brain.Neurosci Lett. 2000 Sep 8;291(1):17-20.)
Brandt MD, Jessberger S, Steiner B, Kronenberg G, Reuter K, Bick-Sander A, von der Behrens W, Kempermann G. Transient calretinin expression defines early postmitotic step of neuronal differentiation in adult hippocampal neurogenesis of mice. Mol Cell Neurosci. 2003 Nov;24(3):603-13.
Brezun JM, Daszuta A. Depletion in serotonin decreases neurogenesis in the dentate gyrus and the subventricular zone of adult rats. Neuroscience. 1999;89(4):999-1002
Brown J, Cooper-Kuhn CM, Kempermann G, Van Praag H, Winkler J, Gage FH, Kuhn HG. Enriched environment and physical activity stimulate hippocampal but not olfactory bulb neurogenesis. Eur J Neurosci. 2003 May;17(10):2042-6
Brown JP, Couillard-Despres S, Cooper-Kuhn CM, Winkler J, Aigner L, Kuhn HG. Transient expression of doublecortin during adult neurogenesis. J Comp Neurol. 2003 Dec 1;467(1):1-10
Cameron HA, McEwen BS, Gould E. Regulation of adult neurogenesis by excitatory input and NMDA receptor activation in the dentate gyrus. J Neurosci. 1995 Jun;15(6):4687-92.
Cao L, Jiao X, Zuzga DS, Liu Y, Fong DM, Young D, During MJ. VEGF links hippocampal activity with neurogenesis, learning and memory. Nat Genet. 2004 Aug;36(8):827-35.
Cooper-Kuhn CM, Kuhn HG. Is it all DNA repair? Methodological considerations for detecting neurogenesis in the adult brain. Brain Res Dev Brain Res. 2002 Mar 31;134(1-2):13-21.
Cooper-Kuhn CM, Winkler J, Kuhn HG. Decreased neurogenesis after cholinergic forebrain lesion in the adult rat. J Neurosci Res. 2004 Jul 15;77(2):155-65.
D'Ambrosio R, Wenzel J, Schwartzkroin PA, McKhann GM 2nd, Janigro D. Functional specialization and topographic segregation of hippocampal astrocytes. J Neurosci. 1998 Jun 15;18(12):4425-38)
Dayer AG, Cleaver KM, Abouantoun T, Cameron HA. New GABAergic interneurons in the adult neocortex and striatum are generated from different precursors. J Cell Biol. 2005 Jan 31;168(3):415-27.
Doetsch F, Alvarez-Buylla A. Network of tangential pathways for neuronal migration in adult mammalian brain. Proc Natl Acad Sci U S A. 1996 Dec 10;93(25):14895-900.
Doetsch F, Caille I, Lim DA, Garcia-Verdugo JM, Alvarez-Buylla A. Subventricular zone astrocytes are neural stem cells in the adult mammalian brain. Cell. 1999 Jun 11;97(6):703-16
Doetsch F. A niche for adult neural stem cells. Curr Opin Genet Dev. 2003 Oct;13(5):543-50.
Doetsch F. The glial identity of neural stem cells. Nat Neurosci. 2003 Nov;6(11):1127-34.
Eriksson PS, Perfilieva E, Bjork-Eriksson T, Alborn AM, Nordborg C, Peterson DA, Gage FH. Neurogenesis in the adult human hippocampus. Nat Med. 1998 Nov;4(11):1313-7.
Fan XT, Cai WQ, Yang Z, Xu HW, Zhang JH. Effect of antisense oligonucleotide of noggin on spatial learning and memory of rats. Acta Pharmacol Sin. 2003 May;24(5):394-7
Fan XT, Xu HW, Cai WQ, Yang H, Liu S. Antisense Noggin oligodeoxynucleotide administration decreases cell proliferation in the dentate gyrus of adult rats. Neurosci Lett. 2004 Aug 5;366(1):107-11.
Fields RD, Stevens-Graham B. New insights into neuron-glia communication. Science. 2002 Oct 18;298(5593):556-62.
Filippov V, Kronenberg G, Pivneva T, Reuter K, Steiner B, Wang LP, Yamaguchi M, Kettenmann H, Kempermann G. Subpopulation of nestin-expressing progenitor cells in the adult murine hippocampus shows electrophysiological and morphological characteristics of astrocytes.
Mol Cell Neurosci. 2003 Jul;23(3):373-82.
Franklin RJ. Why does remyelination fail in multiple sclerosis?. Nat Rev Neurosci 2002; 3: 705–14.
Goldman SA, Nottebohm F. Neuronal production, migration, and differentiation in a vocal control nucleus of the adult female canary brain. Proc Natl Acad Sci U S A. 1983 Apr;80(8):2390-4.
Gould E, McEwen BS, Tanapat P, Galea LA, Fuchs E. Neurogenesis in the dentate gyrus of the adult tree shrew is regulated by psychosocial stress and NMDA receptor activation. J Neurosci. 1997 Apr 1;17(7):2492-8
Gould E, Reeves AJ, Fallah M, Tanapat P, Gross CG, Fuchs E. Hippocampal neurogenesis in adult Old World primates. Proc Natl Acad Sci U S A. 1999 Apr 27;96(9):5263-7.
Gould E. Serotonin and hippocampal neurogenesis. Neuropsychopharmacology. 1999 Aug;21(2 Suppl):46S-51S
Greisen MH, Altar CA, Bolwig TG, Whitehead R, Wortwein G. Increased adult hippocampal brain-derived neurotrophic factor and normal levels of neurogenesis in maternal separation rats. J Neurosci Res. 2005 Feb 2.
Gross RE, Mehler MF, Mabie PC, Zang Z, Santschi L, Kessler JA. Bone morphogenetic proteins promote astroglial lineage commitment by mammalian subventricular zone progenitor cells. Neuron. 1996 Oct;17(4):595-606.
Hastings NB, Gould E. Rapid extension of axons into the CA3 region by adult-generated granule cells. J Comp Neurol. 1999 Oct 11;413(1):146-54
Hastings NB, Seth MI, Tanapat P, Rydel TA, Gould E. Granule neurons generated during development extend divergent axon collaterals to hippocampal area CA3. J Comp Neurol. 2002 Oct 28;452(4):324-33
Hayes NL, Nowakowski RS. Dynamics of cell proliferation in the adult dentate gyrus of two inbred strains of mice. Brain Res Dev Brain Res. 2002 Mar 31;134(1-2):77-85.
Hebb D.O. The organization of Behavior.. 1949 (Rimpresion 2002), LEA, New Jersey
Hoglinger GU, Rizk P, Muriel MP, Duyckaerts C, Oertel WH, Caille I, Hirsch EC. Dopamine depletion impairs precursor cell proliferation in Parkinson disease. Nat Neurosci. 2004 Jul;7(7):726-35.
Jessberger S, Kempermann G. Adult-born hippocampal neurons mature into activity-dependent responsiveness. Eur J Neurosci. 2003 Nov;18(10):2707-12
Johansson CB, Momma S, Clarke DL, Risling M, Lendahl U, Frisen J. Identification of a neural stem cell in the adult mammalian central nervous system. Cell. 1999 Jan 8;96(1):25-34.
Kaplan MS, Hinds JW. Neurogenesis in the adult rat: electron microscopic analysis of light radioautographs. Science. 1977 Sep 9;197(4308):1092-4.
Kempermann G, Kuhn HG, Gage FH. More hippocampal neurons in adult mice living in an enriched environment. Nature. 1997 Apr 3;386(6624):493-5.
Kempermann G. Regulation of adult hippocampal neurogenesis - implications for novel theories of major depression. Bipolar Disord. 2002 Feb;4(1):17-33.
Kempermann G, Gast D, Kronenberg G, Yamaguchi M, Gage FH. Early determination and long-term persistence of adult-generated new neurons in the hippocampus of mice. Development. 2003 Jan;130(2):391-9
Kempermann G, Jessberger S, Steiner B, Kronenberg G. Milestones of neuronal development in the adult hippocampus. Trends Neurosci. 2004 Aug;27(8):447-52.
Klassen HJ, Imfeld KL, Kirov II, et al. Expression of cytokines by multipotent neural progenitor cells. Cytokine 2003; 22: 101–06.
Kuhn HG, Dickinson-Anson H, Gage FH. Neurogenesis in the dentate gyrus of the adult rat: age-related decrease of neuronal progenitor proliferation. J Neurosci. 1996 Mar 15;16(6):2027-33.
Lai K, Kaspar BK, Gage FH, Schaffer DV. Sonic hedgehog regulates adult neural progenitor proliferation in vitro and in vivo. Nat Neurosci. 2003 Jan;6(1):21-7
Lai K, Robertson MJ, Schaffer DV. The sonic hedgehog signaling system as a bistable genetic switch. Biophys J. 2004 May;86(5):2748-57.
Larsson E, Mandel RJ, Klein RL, Muzyczka N, Lindvall O, Kokaia Z. Suppression of insult-induced neurogenesis in adult rat brain by brain-derived neurotrophic factor. Exp Neurol. 2002 Sep;177(1):1-8.
Lim DA, Tramontin AD, Trevejo JM, Herrera DG, Garcia-Verdugo JM, Alvarez-Buylla A. Noggin antagonizes BMP signaling to create a niche for adult neurogenesis. Neuron. 2000 Dec;28(3):713-26
Lois C, Alvarez-Buylla A. Proliferating subventricular zone cells in the adult mammalian forebrain can differentiate into neurons and glia. Proc Natl Acad Sci U S A. 1993 Mar 1;90(5):2074-7
Maisonpierre PC, Belluscio L, Friedman B, Alderson RF, Wiegand SJ, Furth ME, Lindsay RM, Yancopoulos GD. NT-3, BDNF, and NGF in the developing rat nervous system: parallel as well as reciprocal patterns of expression. Neuron. 1990 Oct;5(4):501-9.
Markakis EA, Gage FH. Adult-generated neurons in the dentate gyrus send axonal projections to field CA3 and are surrounded by synaptic vesicles. J Comp Neurol. 1999 Apr 19;406(4):449-60.
Martino Gianvito. How the brain repairs itself: New therapeutic strategies in inflammatory and degenerative CNS disorders Lancet Neurol 2004; 3: 372–78
Monje ML, Toda H, Palmer TD. Inflammatory blockade restores adult hippocampal neurogénesis. Science 2003; 302: 1760–65.
Oishi K, Kamakura S, Isazawa Y, Yoshimatsu T, Kuida K, Nakafuku M, Masuyama N, Gotoh Y. Notch promotes survival of neural precursor cells via mechanisms distinct from those regulating neurogenesis. Dev Biol. 2004 Dec 1;276(1):172-84.
Oweida AJ, Dunn EA, Foster PJ. Cellular imaging at 1.5 T: detecting cells in neuroinflammation using active labeling with superparamagnetic iron oxide. Mol Imaging. 2004 Apr;3(2):85-95.
Palma V, Lim DA, Dahmane N, Sanchez P, Brionne TC, Herzberg CD, Gitton Y, Carleton A, Alvarez-Buylla A, Altaba AR. (Sonic hedgehog controls stem cell behavior in the postnatal and adult brain. Development. 2005 Jan;132(2):335-44.
Palmer TD, Ray J, Gage FH. FGF-2-responsive neuronal progenitors reside in proliferative and quiescent regions of the adult rodent brain. Mol Cell Neurosci. 1995 Oct;6(5):474-86
Paton JA, Nottebohm FN. Neurons generated in the adult brain are recruited into functional circuits. Science. 1984 Sep 7;225(4666):1046-8.
Rakic P. Mode of cell migration to the superficial layers of fetal monkey neocortex. J Comp Neurol. 1972 May;145(1):61-83.
Ray J, Peterson DA, Schinstine M, Gage FH. Proliferation, differentiation, and long-term culture of primary hippocampal neurons. Proc Natl Acad Sci U S A. 1993 Apr 15;90(8):3602-6
Reynolds BA, Weiss S. Generation of neurons and astrocytes from isolated cells of the adult mammalian central nervous system. Science. 1992 Mar 27;255(5052):1707-10.
Rochefort C, Gheusi G, Vincent JD, Lledo PM. (Enriched odor exposure increases the number of newborn neurons in the adult olfactory bulb and improves odor memory. J Neurosci. 2002 Apr 1;22(7):2679-89)
Rolls ET, Treves A. Eds. Neural Networks and Brain Function. 1998, Oxford University Press, Oxford
Rutishauser U, Landmesser L. Polysialic acid in the vertebrate nervous system: a promoter of plasticity in cell-cell interactions. Trends Neurosci. 1996 Oct;19(10):422-7
Samad TA, Rebbapragada A, Bell E, Zhang Y, Sidis Y, Jeong SJ, Campagna JA, Perusini S, Fabrizio DA, Schneyer AL, Lin HY, Brivanlou AH, Attisano L, Woolf CJ. DRAGON: a bone morphogenetic protein co-receptor. J Biol Chem. 2005 Jan 25
Santarelli L, Saxe M, Gross C, Surget A, Battaglia F, Dulawa S, Weisstaub N, Lee J, Duman R, Arancio O, Belzung C, Hen R . Requirement of hippocampal neurogenesis for the behavioral effects of antidepressants. Science. 2003 Aug 8;301(5634):805-9
Schaffer DV, Gage FH. Neurogenesis and neuroadaptation. Neuromolecular Med. 2004;5(1):1-9.
Seri B, Garcia-Verdugo JM, McEwen BS, Alvarez-Buylla A. Astrocytes give rise to new neurons in the adult mammalian hippocampus. J Neurosci. 2001 Sep 15;21(18):7153-60
Seri B, Garcia-Verdugo JM, Collado-Morente L, McEwen BS, Alvarez-Buylla A. Cell types, lineage, and architecture of the germinal zone in the adult dentate gyrus. J Comp Neurol. 2004 Oct 25;478(4):359-78.
Shors TJ, Miesegaes G, Beylin A, Zhao M, Rydel T, Gould E. Neurogenesis in the adult is involved in the formation of trace memories. Nature. 2001 Mar 15;410(6826):372-6
Schinder AF, Gage FH. A Hypothesis About the Role of Adult Neurogenesis in Hippocampal Function. Physiology 2004; 19:253-261
Spassky N, Merkle FT, Flames N, Tramontin AD, Garcia-Verdugo JM, Alvarez-Buylla A. Adult ependymal cells are postmitotic and are derived from radial glial cells during embryogenesis. J Neurosci. 2005 Jan 5;25(1):10-8.
Stanfield BB, Trice JE. Evidence that granule cells generated in the dentate gyrus of adult rats extend axonal projections. Exp Brain Res. 1988;72(2):399-406.
Sun FY, Guo X. Molecular and cellular mechanisms of neuroprotection by vascular endothelial growth factor. J Neurosci Res. 2005 Jan 1-15;79(1-2):180-4.
Sun W, Winseck A, Vinsant S, Park OH, Kim H, Oppenheim RW. Programmed cell death of adult-generated hippocampal neurons is mediated by the proapoptotic gene Bax. J Neurosci. 2004 Dec 8;24(49):11205-13
Tanapat P, Galea LA, Gould E. Stress inhibits the proliferation of granule cell precursors in the developing dentate gyrus. Int J Dev Neurosci. 1998 Jun-Jul;16(3-4):235-9.
Taupin P, Ray J, Fischer WH, Suhr ST, Hakansson K, Grubb A, Gage FH. FGF-2-responsive neural stem cell proliferation requires CCg, a novel autocrine/paracrine cofactor. Neuron. 2000 Nov;28(2):385-97.
Thoenen H. Neurotrophins and neuronal plasticity. Science. 1995 Oct 27;270(5236):593-8.
Thomas RM, Peterson DA. A neurogenic theory of depression gains momentum. Mol Interv. 2003 Dec;3(8):441-4.
Traiffort E, Charytoniuk D, Watroba L, Faure H, Sales N, Ruat M. Discrete localizations of hedgehog signalling components in the developing and adult rat nervous system. Eur J Neurosci. 1999 Sep;11(9):3199-214.
Traiffort E, Moya KL, Faure H, Hassig R, Ruat M. High expression and anterograde axonal transport of aminoterminal sonic hedgehog in the adult hamster brain. Eur J Neurosci. 2001 Sep;14(5):839-50.
Trapp BD, Peterson J, Ransohoff RM, Rudick R, Mork S, Bo L. Axonal transection in the lesions of multiple sclerosis. N Engl J Med 1998; 338: 278–85.
Van Ooyen A. Competition in neurite outgrowth and the development of nerve connections. Prog Brain Res. 2005;147:81-99.
van Praag H, Kempermann G, Gage FH. (Running increases cell proliferation and neurogenesis in the adult mouse dentate gyrus. Nat Neurosci. 1999 Mar;2(3):266-70.)
van Praag H, Schinder AF, Christie BR, Toni N, Palmer TD, Gage FH. (Functional neurogenesis in the adult hippocampus. Nature. 2002 Feb 28;415(6875):1030-4.)
Videbech P, Ravnkilde B. (Hippocampal volume and depression: a meta-analysis of MRI studies. Am J Psychiatry. 2004 Nov;161(11):1957-66.)
Voigt T. (Development of glial cells in the cerebral wall of ferrets: direct tracing of their transformation from radial glia into astrocytes. J Comp Neurol. 1989 Nov 1;289(1):74-88)
Weickert CS, Kittell DA, Saunders RC, Herman MM, Horlick RA, Kleinman JE, Hyde TM. (Basic fibroblast growth factor and fibroblast growth factor receptor-1 in the human hippocampal formation. Neuroscience. 2005;131(1):219-33.
Weisz V., Argibay P. A computational model of neurogenesis in the hippocampus: implications in episodic memory. Annual Meeting of the Society for Neuroscience, Atlanta, USA 2006. Enviado para su publicación Journal of Neuroscience 2006
Winocur G., Wojtowicz JM., Sekeres M., Snyder JS. and Wang S. Inhibition of Neurogenesis Interferes With Hippocampus-Dependent Memory Function. HIPPOCAMPUS 2006; 16:296–304.
Zhao X, Shaffer D.V, GageF.H Neurogenesis in the adult brain: understanding its mechanism and regulation. En: Stem cells in the nervous system: Functional and Clinical implications. 2003. Gage F.H, Bjorklund A, Christen Y. Eds. Foundation IPSEN, Springer-Verlag, Berlin. 2003
Zhou M, Kimelberg HK. Freshly isolated hippocampal CA1 astrocytes comprise two populations differing in glutamate transporter and AMPA receptor expression. J Neurosci. 2001 Oct 15;21(20):7901-8.
|
|
Revista QuímicaViva Número 3, año 5, diciembre 2006 quimicaviva@qb.fcen.uba.ar |