Crecimiento, metabolismo y producción de baculovirus en cultivos en suspensión de una línea celular del insecto lepidóptero Anticarsia gemmatalis
Gioria, Verónica Viviana (1) ; Beccaría, Alejandro José (2), Claus, Juan Daniel (1)
(1)Laboratorio de Virología y (2)Laboratorio de Fermentaciones, Facultad de Bioquímica y Ciencias Biológicas, Universidad Nacional del Litoral, CC 242, (S3000ZAA) Santa Fe, República Argentina
Recibido: 17/03/2006
Aceptado: 24/03/2006
Resumen
La línea UFL-AG-286, establecida a partir de embriones del insecto lepidóptero Anticarsia gemmatalis, podría constituir un sustrato celular adecuado para la producción in vitro del virus de la poliedrosis nuclear múltiple de Anticarsia gemmatalis (AgMNPV), un baculovirus extensamente utilizado como insecticida biológico para controlar la oruga de las leguminosas, una plaga principal de los cultivos de soja. Con el objetivo de caracterizar las propiedades tecnológicas de esta línea celular, y evaluar la factibilidad de su uso para la producción industrial de AgMNPV, las células UFL-AG-286 fueron adaptadas al cultivo en suspensión agitada. En medio TC-100 suplementado con 10% de suero fetal bovino, los cultivos adaptados crecieron con un tiempo de duplicación de 28,9 horas, y alcanzaron una densidad celular máxima de 3,70 x 106 células.ml-1. La glucosa del medio de cultivo fue consumida casi totalmente, pero sin producción de lactato. Los aminoácidos, con la excepción de glutamina, asparagina, metionina y leucina, fueron consumidos en una muy baja proporción respecto a sus respectivas concentraciones iniciales en el medio de cultivo, o bien incrementaron su concentración. Por otro lado, las células UFL-AG-286 parecen no producir alanina como una vía metabólica para la eliminación de amonio, que se acumula en el sobrenadante de cultivo. La infección sincrónica de los cultivos en suspensión de UFL-AG-286 con AgMNPV durante la fase de crecimiento temprano, que generó altos rendimientos específicos de las dos progenies virales (virus brotados y poliedros), redujo las demandas nutricionales celulares específicas con respecto a los cultivos no infectados.
Abstract
The UFL-AG-286 cell line could be a proper substrate to develop a process for the in vitro production of Anticarsia gemmatalis multicapsid nucleopolyhedrovirus (AgMNPV), a baculovirus widely used as bioinsecticide. In order to characterize the technological properties of this cell line, and to evaluate their feasibility to be use in the production of AgMNPV, UFL-AG-286 cells were adapted to grow in agitated suspension cultures in spinner-flasks. Batch suspension cultures grew with a doubling time of 28.9 hours, reaching a maximum cell density of 3.75 x 106 viable cells/ml in serum-supplemented TC-100 medium. Glucose was almost exhausted from culture medium, but lactate was not produced. Amino acids, with the exception of glutamine and asparagine, were only negligibly consumed or produced. UFL-AG-286 cells appeared to be unable to synthesize alanine as a metabolic way to dispose the by-product ammonia. Synchronic infection of UFL-AG-286 cell cultures with AgMNPV in the early -medium exponential growth phase, that yielded high amounts per cell of both viral progenies, reduced the specific nutritional demands of UFLAg-286 cells.
Palabras clave
Virus de la poliedrosis nuclear múltiple de Anticarsia gemmatalis – Baculovirus – Cultivos celulares en suspensión – Línea de células de insecto lepidóptero – UFL-AG-286
Keywords
Anticarsia gemmatalis multicapsid nucleopolyhedrovirus – Baculovirus – Cell suspension culture - Lepidopteran insect cell line – UFL-AG-286
Introducción
Anticarsia gemmatalis Hübner (Lepidoptera: Noctuidae) es una de las principales plagas defoliadoras de los cultivos de soja en Latinoamérica (1). Este insecto es efectivamente controlado con un baculovirus, el virus de la poliedrosis nuclear múltiple de Anticarsia gemmatalis (AgMNPV) (2, 3). Actualmente, la producción comercial de AgMNPV está basada en la propagación viral in vivo sobre larvas del insecto. Esta tecnología ha demostrado ser robusta y económicamente competitiva como para satisfacer los requerimientos de este bioinsecticida hasta el presente. Sin embargo, previsiones de una creciente demanda, y la posibilidad de introducir baculovirus genéticamente modificados que no se propaguen eficientemente en larvas, han estimulado el interés por desarrollar procesos alternativos de producción basados en la propagación viral in vitro en cultivos de células de insecto (4). Una característica relevante de estos procesos es que su rendimiento económico mejora a medida que aumenta en escala, haciéndolos atractivos para la producción industrial de baculovirus. Además, un mejor control de proceso y una calidad superior del producto son atractivos adicionales de los procesos de producción de baculovirus en cultivos celulares.
La selección de una línea celular susceptible a la infección viral y capaz de producir elevados rendimientos volumétricos de poliedros, el fenotipo viral con propiedades insecticidas, es el primer requisito para desarrollar un proceso factible para la producción de un baculovirus insecticida en cultivos de células de insecto. La replicación de AgMNPV ha sido evaluada en diferentes líneas celulares (4, 5, 6, 7, 8). Del análisis de esta información parece evidente que la línea celular homóloga UFL-AG-286 (9) exhibe una mayor susceptibilidad a la infección y mayores niveles de producción viral que el resto de las líneas celulares evaluadas. Por lo tanto, la línea celular UFL-AG-286 podría constituir un sustrato promisorio para desarrollar un proceso industrial de producción de AgMNPV in vitro.
El desarrollo de un proceso de producción de un baculovirus in vitro a gran escala también requiere que las células de insecto soporten el cultivo en suspensión agitada (10). Las líneas de células de insecto mejor caracterizadas difieren en su habilidad para proliferar en cultivos en suspensión agitada. Las líneas IPLB-Sf-21 y Sf-9, derivadas del insecto Spodoptera frugiperda, se adaptan espontáneamente al cultivo en suspensión (11, 12). Por otro lado, las líneas celulares Tn-5 y High-5, derivadas del insecto Trichoplusia ni, requieren de agregado de heparina (13), o selección de subpoblaciones celulares (14, 15) para poder ser cultivadas en suspensión de células aisladas. La línea celular UFL-AG-286 fue originalmente establecida en forma de cultivos estáticos de células adherentes, obtenidas a partir de embriones de Anticarsia gemmatalis (9), y no existe información publicada acerca de su adaptabilidad al crecimiento en cultivos en suspensión agitada. En consecuencia, los parámetros cinéticos de los cultivos en suspensión de UFL-AG-286 tampoco han sido determinados.
El conocimiento de los requerimientos nutricionales y las características metabólicas es necesario cuando se planea utilizar una línea de células animales en el desarrollo de un proceso productivo. La cuantificación de las demandas de los nutrientes más importantes permite anticipar, y eventualmente también evitar, limitaciones nutricionales que podrían afectar el rendimiento del proceso. Además, las características metabólicas de una línea celular pueden determinar la selección de una estrategia de cultivo particular. Por ejemplo, la falta de producción de metabolitos tóxicos en cultivos bien oxigenados de las líneas celulares IPLB-Sf-21 y Sf-9 hace posible el uso de estrategias de suplementación nutricional para mantener los cultivos en producción a muy altas densidades celulares (16, 17, 18). Por el contrario, la línea celular High-5 presenta un comportamiento metabólico diferente, caracterizado por la acumulación de lactato y amonio (14), que podría limitar la aplicabilidad de una estrategia de alimentación con nutrientes para obtener cultivos de alta densidad celular (19). Estas diferencias, además, ilustran acerca de la diversidad de perfiles metabólicos que es posible encontrar en distintas líneas de células de insecto, y enfatizan la importancia de caracterizarlos en cualquier línea celular con potencial utilización en procesos productivos. Los requerimientos nutricionales de la línea celular UFL-AG-286 no han sido investigados, y sus particulares propiedades metabólicas permanecen aún desconocidas.
En este trabajo se demuestra que la línea celular UFL-AG-26 puede ser fácilmente adaptada al crecimiento en cultivos en suspensión agitada, cuyos parámetros cinéticos fueron determinados luego de su adaptación. Por otro lado, se caracterizaron los perfiles nutricionales y metabólicos de cultivos no infectados e infectados con AgMNPV. La producción viral de los cultivos adaptados a suspensión e infectados con AgMNPV fue también evaluada.
Materiales y métodos
Línea celular y medio de cultivo
Se utilizaron células de la línea UFL-AG-286, que fueron gentilmente cedidas por el Dr. Víctor Romanowski, (IBBM, Facultad de Ciencias Exactas y Naturales, Universidad Nacional de La Plata). Las células fueron mantenidas en forma de cultivos adherentes en frascos plásticos de 25 cm2 de superficie, en medio de cultivo TC-100 (Invitrogen, USA), suplementado con 10% de suero fetal bovino (Bioser, República Argentina), a 27°C de temperatura. Los cultivos se repicaron en medio fresco, a una dilución 1:10, cada cuatro a cinco días.
Cultivos en suspensión y procesamiento de muestras
Los cultivos en suspensión se realizaron en frascos de vidrio de 500 ml de volumen nominal (50 ml de volumen de trabajo), provistos con un agitador magnético pendular con una velocidad de giro de 80 rpm, y colocados sobre una plataforma de agitación (Techne, Gran Bretaña). Las muestras obtenidas de los cultivos en suspensión fueron procesadas de la siguiente manera: una alícuota de cada muestra de suspensión celular se tiñó con Trypan blue 0,4% para realizar el recuento de células totales y viables en una cámara de Neubaer; otra alícuota se centrifugó a baja velocidad, el sobrenadante se separó del sedimento celular y se conservó a -20°C para determinar posteriormente las concentraciones de nutrientes y metabolitos. Para diferenciar células aisladas de aquellas asociadas en agregados, los recuentos celulares se realizaron antes y después de disociar los agregados celulares con pipeta.
Análisis de nutrientes y metabolitos
Las concentraciones de glucosa y lactato en los sobrenadantes de cultivo se determinaron, mediante reacciones enzimáticas automatizadas en un analizador YSI 2700 (Yellow Spring Instruments,Estados Unidos). Las concentraciones de dieciocho aminoácidos diferentes se determinaron por cromatografía líquida de alto rendimiento (HPLC) (Beckmann,Estados Unidos), utilizando una columna de fase reversa, con una derivatización previa con o-ftalaldialdehído. La concentración de amonio en los sobrenadantes de cultivo se determinó utilizando un equipo comercial (Wiener Lab, República Argentina).
Determinación de los parámetros cinéticos de los cultivos en suspensión
La velocidad específica de crecimiento de los cultivos fue calculada a partir de la región lineal de una representación gráfica semilogarítimica de la densidad celular en función del tiempo de cultivo. Para cultivos en la fase exponencial de crecimiento, las velocidades celulares específicas de consumo o producción se determinaron calculando primero el rendimiento celular, obtenido a partir de la representación gráfica de la concentración del componente de interés en función de la densidad de células viables, y luego multiplicando ese valor por la velocidad celular específica de crecimiento del cultivo. En cultivos infectados, las velocidades celulares específicas de consumo/producción de los diferentes nutrientes se determinaron calculando primero la velocidad de cambio de la concentración del componente de interés, en el período de tiempo correspondiente, y luego dividiendo por la densidad promedio de células viables.
Virus y cuantificación viral
La cepa de virus AgMNPV utilizada fue originalmente aislada en la localidad de Oliveros (Provincia de Santa Fe, República Argentina) (20). El stock de virus utilizado en estos experimentos fue preparado por infección de cultivos estáticos de células UFL-AG-286 (2 x 105 cells.ml-1), con el segundo pasaje en cultivos celulares del aislamiento original, a una multiplicidad de infección de 0,1 dosis infecciosas para cultivos celulares 50% (DICC50%) por célula, Las muestras obtenidas de los cultivos infectados se procesaron como se describió para los cultivos no infectados, pero se tomaron, además, muestras adicionales de sobrenadante de cultivo para la cuantificación de virus brotados, y del sedimento celular para la cuantificación de poliedros, las cuales fueron conservadas a -80°C hasta su procesamiento.
Los virus brotados se cuantificaron mediante un ensayo de dilución límite y punto final. Brevemente, para determinar la DICC50%, una suspensión de células UFL-AG-286 conteniendo 3 x 105 cells.ml-1 fue sembrada en pocillos de una placa de cultivos celulares de 96 orificios (50 µ/ml por pocillo), para luego agregar en cada pocillo un volumen igual de diluciones seriadas logarítmico-decimales de la muestra a cuantificar (cinco réplicas por cada dilución). Luego de incubar a 27°C durante una semana, las placas fueron observadas para registrar los pocillos infectados, calculándose el título viral por el método desarrollado por Reed y Muench (21). Por otro lado, el título de poliedros asociados a células de cada muestra se determinó luego de extraer cada culote celular con SDS 1%, contándose los poliedros liberados en una cámara de Neubauer.
Resultados
Adaptación de la línea celular UFL-AG-286 al cultivo en suspensión
Cultivos de la línea celular UFLAg-286 en el medio TC-100 suplementado con 10 % SFB fueron adaptados al crecimiento en suspensión. Para ello, cultivos estáticos se desprendieron de la superficie de la botella plástica mecánicamente. La suspensión celular resultante se centrifugó, se resuspendió en medio fresco a una densidad celular de 3,5 x 105 células viables.ml-1, se colocó en un frasco de cultivo, y se comenzó a agitar sobre una plancha magnética con agitador pendular hasta que el cultivo alcanzó una densidad de 1,5 x 106 células viables.ml-1, momento en el cual se realizó el primer subcultivo. Los primeros pasajes en suspensión se caracterizaron por una elevada proporción de células agrupadas en agregados de diversos tamaños. Con el objetivo de seleccionar una población de células capaces de proliferar en forma aislada en cultivos en suspensión, antes de cada repique el cultivo se trasvasó a un tubo plástico cónico de 50 ml y se dejó sedimentar durante 1 minuto. Al cabo de ese tiempo se cosechó la parte superior del cultivo, enriquecida en células aisladas, y se resuspendió en medio fresco para obtener una densidad de 3,5 x 105 células viables / ml. La proporción de células aisladas se incrementó progresivamente con los subcultivos sucesivos, hasta que luego de 30 pasajes el 80% de las células no formó agregados. En cultivos en suspensión mantenidos sin sedimentación previa a cada pasaje, el porcentaje de células aisladas no varió significativamente a lo largo de los sucesivos subcultivos. La línea celular resultante del proceso de adaptación al cultivo en suspensión se denominó saUFL-AG-286.
Determinación de los parámetros cinéticos de los cultivos en suspensión
Para caracterizar los parámetros cinéticos de los cultivos de células UFL-AG-286 adaptadas al crecimiento en suspensión (saUFL-AG-286), un cultivo en el pasaje trigésimo en suspensión se diluyó en medio fresco a una densidad de 3,7 x 105 células viables.ml-1. El cultivo fue incubado en estufa a 28ºC, y cada 24 horas se tomó una alícuota de la suspensión celular para cuantificación de células totales y viables. No se observó fase “lag” al comienzo del cultivo, cuyo crecimiento se extendió hasta las 96 horas (figura 1). La velocidad de multiplicación celular específica mantuvo un valor constante de 0,024 h-1 (tiempo de duplicación: 28,9 h). La densidad celular máxima, alcanzada a las 96 horas de cultivo, fue de 3,7 x 106 células viables. ml-1. La viabilidad del cultivo se mantuvo en porcentajes superiores al 98% hasta las 96 horas, y luego decayó abruptamente sin mediar fase estacionaria.
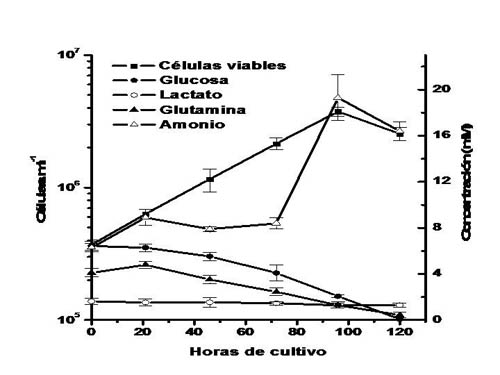 |
| Figura 1. Curva de crecimiento, consumo de nutrientes y producción de metabolitos en cultivos en suspensión de la línea celular saUFL-AG-286, en el medio de cultivo TC-100 + 10% SFB. Se representan en la figura los promedios y las desviaciones estándar de los valores obtenidos de tres réplicas independientes. |
Consumo de nutrientes y producción de metabolitos
Para caracterizar el perfil nutricional y metabólico de los cultivos de células saUFL-AG-286, se determinaron las concentraciones de glucosa, lactato, amonio y dieciocho aminoácidos en los sobrenadantes de las muestras obtenidas a los distintos tiempos de cultivo. Como se puede observar en la figura 1, la concentración de glucosa decayó constantemente desde el comienzo, hasta agotarse entre las 96 y 120 horas de cultivo. La velocidad de consumo celular específica de glucosa se mantuvo constante hasta las 96 horas, en un valor de 3,2 x 10-11 mmol.cell-1.h-1. La glutamina, luego de un incremento inicial de su concentración durante las primeras 24 horas de cultivo, que se verificó también para el resto de los aminoácidos (no se muestra), fue consumida rápidamente hasta agotarse a las 120 horas. La velocidad de consumo celular específica de glutamina alcanzó un valor máximo de 5,87 x 10-11 mmol.cell-1.h-1 y luego decayó exponencialmente. La concentración de lactato, un producto del metabolismo de la glucosa y la glutamina en muchas líneas de células animales, se mantuvo constante durante toda la evolución del cultivo. Por otro lado, la concentración de amonio, un producto del metabolismo de los aminoácidos, se mantuvo casi constante hasta las 72 horas de cultivo, para luego crecer abruptamente y alcanzar un valor máximo apenas inferior a 20 mM a las 96 horas.
La mayoría de los aminoácidos no fueron significativamente consumidos en los cultivos de células saUFL-AG-286 (cuadro 1). Sólo glutamina (89%), asparagina (31%), metionina (29%) y leucina (20%) fueron consumidos en porcentajes superiores al 20% de su concentración inicial. Serina y tirosina fueron consumidos en porcentajes cercanos al 15%, mientras que alanina, arginina, glicina, lisina, fenilalanina, treonina y triptofano lo fueron sólo en mínimas proporciones respecto a sus respectivas concentraciones iniciales Por otro lado, glutamato, aspartato, valina, isoleucina e histidina incrementaron su concentración en el transcurso del cultivo. Cabe destacar que el consumo de glutamina representó el 50% del total del consumo de aminoácidos en los cultivos en suspensión de saUFL-AG-286.
Cuadro 1. Concentraciones iniciales y finales de aminoácidos en los sobrenadantes de cultivo de células saUFL-AG-286 no infectados e infectados con AgMNPV (mM).
|
Compuesto |
Cultivo no infectado |
Cultivo infectado* |
||
|
0 h |
120 h |
0 hpi |
96 hpi |
|
|
Alanina |
2,78 |
2,44 |
2,75 |
2,40 |
|
Arginina |
3,52 |
3,32 |
3,24 |
3,38 |
|
Asparagina |
3,47 |
2,38 |
3,26 |
3,04 |
|
Aspartato |
3,25 |
3,51 |
3,23 |
3,54 |
|
Fenilalanina |
1,34 |
1,29 |
1,28 |
1,31 |
|
Glicina |
8,81 |
8,71 |
8,40 |
8,97 |
|
Glutamina |
4,11 |
0,44 |
3,22 |
2,38 |
|
Glutamato |
5,24 |
5,29 |
4,87 |
5,61 |
|
Histidina |
16,56 |
17,59 |
15,92 |
17,64 |
|
Isoleucina |
0,90 |
0,95 |
0,96 |
1,03 |
|
Leucina |
1,27 |
1,02 |
1,19 |
1,19 |
|
Lisina |
4,12 |
3,58 |
3,84 |
3,72 |
|
Metionina |
0,76 |
0,55 |
0,76 |
0,63 |
|
Serina |
5,22 |
4,40 |
4,88 |
4,91 |
|
Tirosina |
0,49 |
0,42 |
0,47 |
0,49 |
|
Treonina |
1,64 |
1,63 |
1,62 |
1,75 |
|
Triptofano |
0,61 |
0,60 |
0,67 |
0,57 |
|
Valina |
1,38 |
1,45 |
1,48 |
1,53 |
* Cultivos de saUFL-AG-286 infectados con AgMNPV a una multiplicidad de infección de 3 DICC50%.célula-1, cuando los cultivos alcanzaron una densidad celular de 8,4x105 células.ml-1.
Infección de células saUFL-AG-286 con AgMNPV
Cultivos en suspensión de células saUFL-AG-286 en medio TC-100 + 10% SFB, sembrados inicialmente a una densidad de 3,5 x 105 células viables.ml-1, fueron infectados 36 horas después con AgMNPV (multiplicidad de infección: 3 DICC50%.ml-1) cuando habían alcanzado una densidad de 8,4 x 105 células viables.ml-1. Se tomaron muestras de los cultivos infectados, cada 24 horas, para realizar recuento de células totales, viables e infectadas (distinguibles por la acumulación de poliedros virales), y se separaron muestras para realizar titulación de virus brotados y recuento de poliedros. La evolución de los cultivos infectados se puede observar en la figura 2. Las primeras 24 horas post-infección se caracterizaron por un ligero incremento de la densidad de células totales, mientras la viabilidad se mantenía por arriba del 90%. Luego, el número de células viables comenzó a disminuir, lentamente hasta las 48 horas, y luego en forma exponencial hasta alcanzar un valor de viabilidad inferior al 30 % a las 96 horas post-infección. La lisis celular no fue importante, de acuerdo a la evolución de los recuentos de células totales, que no decrecieron significativamente hasta las 96 horas (no se muestra). Las primeras células con poliedros virales visibles en su interior se observaron a las 48 horas post-infección (50% del total de las células), si bien desde las 24 horas se pudieron apreciar claros signos de efecto citopático temprano típico de la infección por baculovirus, caracterizado por el aumento de tamaño y redondeamiento celulares. El número de células conteniendo cúmulos de poliedros no se incrementó luego de las 48 horas post-infección.
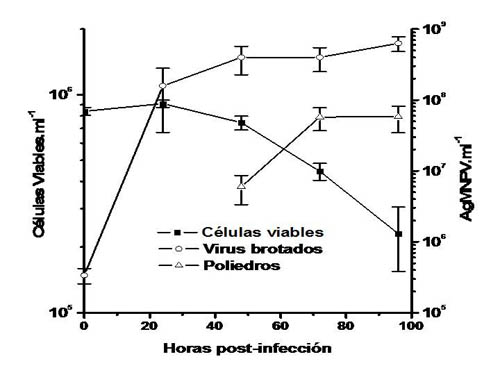 |
| Figura 2. Evolución de cultivos en suspensión de células saUFL-AG-286 infectados con AgMNPV a una multiplicidad de infección de 3 DICC50%.célula-1, cuando los cultivos alcanzaron una densidad celular de 8,4x105 células.ml-1. Se representan en la figura los promedios y las desviaciones estándar de los valores obtenidos de tres réplicas independientes. |
En la figura 2 se puede observar también la evolución en el tiempo de los títulos de virus brotados y poliedros en los cultivos de saUFL-AG-286 infectados con AgMNPV. La producción de virus brotados aumentó rápidamente durante las primeras 24 horas post-infección, y luego mucho más lentamente, hasta alcanzar un título máximo de 6,3 x 108 DICC50%.ml-1 a las 96 hpi (rendimiento celular específico: 692 DICC50%.cel.-1). Los primeros poliedros virales se detectaron a las 48 hpi, en forma coincidente con la observación de las primeras células conteniendo cuerpos de inclusión y con la reducción inicial de la viabilidad celular. La concentración de poliedros se incrementó hasta alcanzar un título máximo de 5,8 x 107 poliedros.ml-1 a las 72 hpi (rendimiento celular específico: 64 poliedros.cel.-1).
Consumo de nutrientes y producción de metabolitos en cultivos infectados
Glucosa y glutamina, al igual que en los cultivos no infectados de saUFL-AG-286, fueron los nutrientes consumidos a mayor velocidad en los cultivos infectados con AgMNPV (figura 3). La velocidad celular específica de consumo de glucosa se redujo con respecto a los cultivos no infectados durante las primeras 24 hpi,, período durante el cual alcanzó un valor de 1,24 x 10-11 mmol.cel.-1.h-1, aproximadamente un tercio de la velocidad correspondiente a la fase de crecimiento exponencial de un cultivo no infectado. Sin embargo, en el período comprendido entre las 24 y 72 hpi la velocidad de consumo de glucosa retomó el valor previo a la infección. La concentración de lactato no se modificó significativamente a la largo del período de infección. El consumo de glutamina también se redujo inmediatamente luego de la infección, a un valor de 1,42 x 10-11 mmol.cel.-1.h-1; esta velocidad se mantuvo constante durante todo el período post-infección. Sólo cinco aminoácidos más se consumieron en cultivos infectados: alanina, asparagina, lisina, metionina y triptofano (cuadro 1). Los otros aminoácidos incrementaron su concentración en los sobrenadantes de cultivos infectados, mientras que la concentración de amonio osciló sin cambios significativos (figura 3).
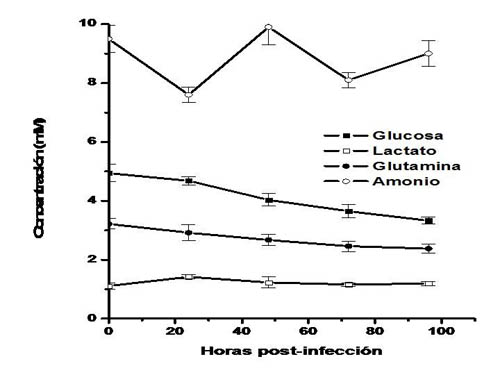 |
| Figura 3. Consumo de nutrientes y producción de metabolitos en cultivos en suspensión de células saUFL-AG-286 infectados con AgMNPV a una multiplicidad de infección de 3 DICC50%.célula-1, cuando los cultivos alcanzaron una densidad celular de 8,4x105 células.ml-1. Se representan en la figura los promedios y las desviaciones estándar de los valores obtenidos de tres réplicas independientes. |
Discusión
La adaptación de la línea celular UFL-AG-286 al cultivo en suspensión agitada fue el primer objetivo de este trabajo. La mayor parte de las células transferidas desde cultivos estáticos a suspensión agitada tendieron a agregar en forma heterogénea, con una minoría de células proliferando en forma aislada. Similar comportamiento ha sido descripto para la línea celular Tn-5 (22). Diversos procedimientos fueron utilizados con el propósito de obtener células de esta línea (o de su derivado comercial High-5) con capacidad de multiplicarse en forma aislada (13, 14, 15). El procedimiento empleado en este trabajo con células UFL-AG-286, aplicando sedimentación diferencial para separar los agregados celulares de mayor tamaño antes de cada subcultivo, permitió seleccionar, en un tiempo relativamente reducido, una subpoblación de células que no tienden a agregarse entre si cuando son agitadas en cultivos en suspensión. Por el contrario, cuando los agregados no fueron separados antes de cada subcultivo, la línea celular no modificó significativamente su comportamiento. Esta diferencia podría ser una evidencia de la complejidad poblacional de la línea celular UFL-AG-286. La mayoría de las líneas de células de insecto fueron establecidas a partir de cultivos primarios de embriones o de órganos de adultos, y por lo tanto no estaban originalmente constituidas por una población celular homogénea. La línea UFL-AG-286, fue establecida a partir de un cultivo primario de embriones de Anticarsia gemmatalis (9). Si bien el procedimiento que se utiliza para establecer una línea celular selecciona una subpoblación celular particular entre los diferentes tipos de células presentes en un cultivo primario heterogéneo, la coexistencia de subpoblaciones celulares diferentes en una línea establecida es aún posible, como se demostró para la línea celular IPLB-Sf-21 (23). El procedimiento de enriquecimiento de células capaces de proliferar en forma aislada en suspensión agitada (saUFL-AG-286) podría, entonces, haber seleccionado una población de composición diferente a la original (UFL-AG-286). En consecuencia, el comportamiento de la subpoblación seleccionada podría no reflejar necesariamente las propiedades de la línea celular no sometida a proceso de selección.
El valor de la velocidad específica de crecimiento de los cultivos en suspensión agitada de saUFL-AG-286 está dentro del rango de velocidades determinadas en cultivos en suspensión de otras líneas de células de insectos lepidópteros (24, 25, 26). Pero, por otro lado, este valor es significativamente mayor que el informado por Sieburth y Maruniak cuando establecieron originalmente la línea celular UFL-AG-286 en 1986 (9). Desde entonces, esta línea ha sido sometida a un número indeterminado de pasajes sucesivos, a través de los cuales se podría haber producido un paulatino mejoramiento de la velocidad específica de multiplicación celular. Este fenómeno ha sido previamente descripto en cultivos de células de Trichoplusia ni (27). Si bien no puede descartarse que la selección de la subpoblación de células capaces de proliferar aisladas en suspensión haya determinado también un mejoramiento de la velocidad específica de crecimiento, este aporte debe ser marginal, ya que la velocidad de crecimiento de los cultivos en monocapa no adaptados a suspensión es también mayor que la descripta por los autores que establecieron la línea celular (Paultroni et al., resultados no publicados).
Una característica destacable de los cultivos de saUFL-AG-286 es la estabilidad de la velocidad específica de proliferación durante la fase de crecimiento. Por el contrario, en cultivos de otras líneas de células de insectos lepidópteros, la velocidad específica se incrementa hasta un máximo durante la fase temprana de crecimiento del cultivo, y luego decrece (28, 29). El nivel de variabilidad de la velocidad específica de proliferación puede considerarse como una expresión de la sensibilidad de los mecanismos de regulación de la proliferación celular a los cambios que ocurren, en la biomasa y en el ambiente, como consecuencia de las actividades celulares en el cultivo. Esa variabilidad, que es notable en cultivos de la línea celular Sf-9, ha sido explicada por el agotamiento de nutrientes o la acumulación de metabolitos (30, 31), o, alternativamente, por la dependencia de la actividad de factores de crecimiento autocrinos (32). De cualquier manera, la regulación de los mecanismos de proliferación de la línea saUFL-AG-286 parece ser relativamente insensible a las modificaciones celulares y ambientales que determinan la variación de la velocidad específica de proliferación en otras líneas de células de insecto.
El fin de la fase de crecimiento fue coetánea con el agotamiento de glucosa y glutamina en el medio de cultivo, y también con una rápida caída de la viabilidad celular. El aumento de la mortalidad luego del agotamiento de los hidratos de carbono contenidos en el medio de cultivo de células de insecto ha sido observado en cultivos de otras líneas de células de insecto (28, 33, 34, 35, 36). Por el contrario, el agotamiento de glutamina es compatible con la supervivencia y capacidad de proliferación de algunas líneas celulares (37). La acumulación de catabolitos podría también ser una causa de la reducción de la viabilidad de los cultivos. El amonio es un catabolito tóxico para las células animales, pero los niveles de concentración alcanzados no deberían limitar la viabilidad de los cultivos de saUFL-AG-286, de acuerdo a los datos obtenidos con otras líneas de células de insecto (37, 38). Por otro lado, el lactato, otro potencial metabolito tóxico en cultivos de células animales, no incrementó su concentración en el medio de cultivo. Por lo tanto, el rápido ascenso de la mortalidad celular en los cultivos de saUFL-AG-286 podría ser producto de una limitación nutricional, más probablemente asociada al agotamiento de glucosa, que una consecuencia de la acumulación de productos metabólicos tóxicos. Por otro lado, no se puede obviar la posibilidad de la contribución del agotamiento de otros nutrientes, no determinados en este trabajo, como lípidos y vitaminas, al rápido incremento de la mortalidad celular.
Los hidratos de carbono constituyen la principal fuente de carbono y energía en cultivos de células animales. La glucosa, el único hidrato de carbono presente en el medio TC-100, fue el nutriente consumido en mayor extensión en cultivos en suspensión de células saUFL-AG-286. La velocidad celular específica de consumo de glucosa fue ligeramente menor que las velocidades máximas determinadas en otras líneas de células de insecto bajo diferentes condiciones de cultivo (15, 35, 28, 38). Esta baja velocidad de consumo podría ser consecuencia de la relativamente baja concentración de glucosa en el medio de cultivo TC-100. Bédard et al. (38) observaron que los cultivos de las líneas celulares Sf-9 y BTI-EAA consumían glucosa a una menor velocidad en medio TNM-FH que en otros medios de cultivo que contenían una mayor concentración inicial de glucosa. Se debe señalar que la glucosa fue consumida, en cultivos de células saUFL-AG-286, a una velocidad constante a lo largo de todo el cultivo, mientras que en cultivos de otras líneas de células de insecto la velocidad de consumo de glucosa incrementa hasta alcanzar un valor máximo en la mitad de la fase de crecimiento, para luego decaer (28).
La velocidad de consumo de glutamina, a diferencia de la de glucosa, no resultó constante. El valor máximo de esta velocidad fue mayor que el observado en cultivos de otras líneas de células de insectos (15, 35, 38). Si se analiza el cociente de los rendimientos de células en glutamina y glucosa, en cultivos de células saUFL-AG-286 se alcanza un valor de 0,84, mientras que en cultivos de otras líneas de células de insectos ese valor varia entre 0,15 y 0,53. Esta inusualmente elevada preferencia por glutamina podría también estar relacionada con la baja concentración de glucosa en el medio TC-100, si se considera que la glutamina puede constituir una fuente de energía alternativa a los hidratos de carbono. Se deberán realizar experimentos adicionales para determinar si este comportamiento es sólo una respuesta adaptativa al nivel de glucosa en el medio de cultivo, o si estas células poseen efectivamente una mayor avidez constitutiva por la glutamina como fuente de energía.
Tres aminoácidos más (asparagina, metionina y leucina) fueron también consumidos en una proporción significativa en los cultivos en suspensión de saUFL-AG-286, pero estuvieron lejos de ser agotados, por lo que no constituirían potenciales limitaciones nutricionales. El resto de los aminoácidos fueron consumidos en mucha menor proporción, o su concentración se incrementó durante la evolución de los cultivos. De esta manera, el medio de cultivo TC-100 aporta aminoácidos en exceso respecto a los reales requerimientos de las células saUFL-AG-286. El exceso de la concentración de aminoácidos en los medios utilizados para el cultivo de células de insecto ha sido demostrado también en cultivos de Sf-9 (38, 39). Se debe hacer notar que en estos experimentos no se siguió la evolución de la concentración de cistina/cisteína, un aminoácido que es consumido a un elevado nivel en cultivos de células Sf-9, y cuya concentración determina la velocidad de consumo de otros aminoácidos (29); por lo tanto no es posible especular acerca de su importancia como nutriente en cultivos de saUFL-AG-286.
La línea celular saUFL-AG-286 expresa un patrón de producción de metabolitos cuyas principales características son la falta de producción de lactato, la producción de amonio y la falta de producción de alanina. Este patrón es diferente de los descriptos para otras líneas de células de insecto caracterizadas previamente: los cultivos de las líneas IPLB-Sf-21 y Sf-9, en condiciones de oxigenación y suministro de glucosa adecuados, se caracterizan por la falta de producción de lactato y amonio, con producción de alanina, mientras que, en las mismas condiciones, en cultivos de células Tn-5 o High-5, con un patrón similar al descripto en cultivos de células de mamíferos, se produce acumulación de lactato, amonio y alanina en el sobrenadante (15). La determinación de diferencias en los patrones de producción de los metabolitos de las principales fuentes nutricionales pone en evidencia la existencia de diferencias a nivel del procesamiento metabólico de los nutrientes en distintas líneas celulares (40, 41). Por tanto, la expresión de un patrón diferente de producción de metabolitos podría estar indicando la existencia de un ordenamiento particular de los flujos metabólicos en la línea celular saUFL-AG-286, en relación a otras líneas de células de insectos. Esta hipótesis deberá corroborarse experimentalmente mediante medición de actividades enzimáticas y seguimiento de moléculas trazadoras, pero mientras tanto, utilizando la información obtenida de estudios realizados con otras líneas de células de insecto, es posible adelantar algunas de las características que tendría el metabolismo de los principales nutrientes en las células saUFL-AG-286. En este sentido, la falta de producción de lactato podría indicar una eficiencia superior para oxidar la glucosa en forma completa en el ciclo de los ácidos tricarboxílicos, tal como sucede con las líneas IPLB-Sf-21 y Sf-9 (40, 41).
Por otro lado, la evolución de los niveles de alanina representa una situación particular. La alanina es un producto principal del metabolismo de la glucosa y la glutamina, tanto en células de insecto como en células de mamífero. Sorprendentemente, los cultivos de saUFL-AG-286 no acumulan alanina, mientras el amonio es activamente producido. De los datos del cuadro 1 se puede deducir que el monto total de amonio producido en un cultivo de saUFL-AG-286
(10,10 mM) iguala, aproximadamente, al rendimiento teórico de amonio proveniente de la completa metabolización de la glutamina (7,34 mM), más el correspondiente a la transformación de asparagina en aspartato (0,26 mM), más el derivado de la metabolización completa de la asparagina (1,66 mM). Estos datos indicarían que el amonio proveniente de la metabolización de la glutamina y la asparagina, los dos aminoácidos más consumidos en los cultivos de saUFL-AG-286, podría ser eliminado como tal, y que estas células carecerían de la capacidad de sintetizar alanina como una forma no tóxica de disponer del amonio. Este comportamiento guarda analogía parcial con el descripto en células Sf-9 en condiciones de limitación de glucosa, en las cuales la glutamina es primero transformada en glutamato por acción de una glutaminasa, para luego dar, en una reacción catalizada por una glutamato deshidrogenasa, 2-oxoglutarato, que luego puede ser completamente oxidado a dióxido de carbono en el ciclo de los ácidos tricarboxílicos (42). En relación al metabolismo de la asparagina, no se puede encontrar analogía con el comportamiento de las células Sf-9, ya que éstas no lo consumen o lo hacen en una baja proporción, pero sí con las células High-5, que si lo hacen, y para las cuales se ha propuesto que la metabolizan a través de una vía que involucra la actividad de una asparaginasa y una aspartato dehidrogenasa (15).
No se pudo detectar ninguna limitación nutricional en los cultivos infectados con AgMNPV, ya que todos los nutrientes cuantificados, en las condiciones de infección empleadas en estos experimentos (infección sincrónica en la fase de crecimiento inicial a intermedia), se encontraron en exceso. Además, la infección con AgMNPV provocó una reducción de las demandas nutricionales específicas de los nutrientes más importantes, en forma más notable durante las primeras 24 hpi. Los efectos de la infección con baculovirus sobre las demandas nutricionales de las células de insecto han sido analizados previamente, con resultados contrastantes. Por un lado, en algunos trabajos se describió un incremento de la velocidad de consumo de nutrientes luego de la infección (4, 14, 43, 44). En otros trabajos, en cambio, no se han observado cambios significativos en las velocidades de consumo de los principales nutrientes (45, 46, 47), mientras que Rhiel y Murhammer mostraron que la infección de células IPLB-Sf-21 resultó en una reducción de la velocidad celular específica de consumo de glucosa (48). En el análisis de estas observaciones se debe tomar en consideración que la demanda nutricional de una célula infectada no debe estar determinada sólo por las necesidades específicas vinculadas a la atención del proceso de replicación viral, y por los efectos que la infección ejerce sobre el metabolismo celular, sino que también debe influir el estado nutricional y metabólico de la célula al momento de la infección. La marcada reducción de la velocidad de consumo de glucosa y glutamina observada inmediatamente luego de la infección con AgMNPV de los cultivos de células saUFL-AG-286 podría ser explicada por la interrupción inmediata de la proliferación celular luego de la infección, en cultivos que se encontraban en estado de activa división. En el balance de la demanda nutricional, el cese de la síntesis de biomasa en un contexto de abundancia intracelular de fuentes de carbono y energía, podría significar la disponibilidad inmediata de precursores para atender la replicación viral, menos demandante de nutrientes que los procesos afectados a la multiplicación de la biomasa, dando como resultado una disminución de la necesidad de incorporar nutrientes extracelulares. Sin embargo, podría ser posible que, cuando la infección se lleva a cabo en otras condiciones de menor disponibilidad intracelular de nutrientes, tal como sucede al final de la fase de crecimiento o en la fase estacionaria del cultivo, la demanda nutricional podría incrementarse luego de la infección.
La replicación de AgMNPV en los cultivos en suspensión de saUFL-AG-286 siguió una cinética similar a la descripta para la replicación in vitro de otros baculovirus, con un pico de producción de virus brotados durante las primeras 24 hpi, seguido por un rápido ascenso de la producción de poliedros en el período comprendido entre las 24 y 72 hpi. Las características de la evolución de la infección con AgMNPV en los cultivos en suspensión de saUFL-AG-286 no difieren de lo descripto anteriormente en infecciones con el mismo virus en cultivos adherentes en monocapa (5, 7). Es evidente, entonces, que el número de pasajes ha que ha sido sometida la línea celular desde su establecimiento, y la selección de la subpoblación celular adaptada al cultivo en suspensión agitada, no han afectado la susceptibilidad a la infección o la permisividad a la replicación viral. Por otro lado, cuando se comparan los rendimientos de poliedros de AgMNPV alcanzados en estos experimentos con los obtenidos en cultivos de otras líneas celulares (4, 6, 8, 49, 50), se puede concluir que, entre las líneas celulares ensayadas hasta el presente, saUFL-AG-286 es la que permite alcanzar los mayores rendimientos de poliedros por célula. En los experimentos realizados en este trabajo se evaluó la producción viral en una única condición de infección, pero es posible que los rendimientos volumétricos obtenidos puedan aún ser mejorados significativamente luego de optimizar los parámetros de tiempo y multiplicidad de infección.
En conclusión, la línea celular UFL-AG-286 pudo ser adaptada al cultivo en suspensión a través de la selección de una subpoblación de células con capacidad para proliferar sin formar agrupaciones (saUFL-AG-286). Los cultivos adaptados crecieron con una cinética similar a otras líneas de células de insecto, pero exhibieron un perfil nutricional y metabólico característico. Los rendimientos de AgMNPV en los cultivos de saUFL-AG-286 resultaron suficientemente elevados como para sostener la factibilidad del uso de esta línea celular en el desarrollo de un proceso industrial de producción del bioinsecticida. El desarrollo de este proceso sólo será posible luego de optimizar la producción viral en un medio de cultivo libre de suero de bajo costo.
Referencias
1. Moscardi F. Soybean integrated pest management in Brazil. Plant Protect. Bull. 1993; 41: 91-100.
2. Moscardi F, Allen GE, Greene GL. Control of the velvetbean caterpillar by nuclear polyhedrosis virus and insecticides and impact of treatments on the natural incidence of the entomopathogenic fungus Nomuraea rileyi. J. Econ. Entomol. 1981;74: 480-485.
3. Moscardi F. Assessment of the application of baculoviruses for control of Lepidoptera. Annu. Rev. Entomol. 1999; 44: 257-289.
4. Rodas VM, Marques FH, Honda MT, Soares DM, Jorge SAC, Antoniazzi MM, Medugno C, Castro MEB, Ribeiro BM, Souza ML, Tonso A, Pereira CA. Cell culture derived AgMNPV bioinsecticide: biological constraints and bioprocess issues. Cytotechnology 2005; 48: 27-39.
5. Sieburth PJ, Maruniak JE. Susceptibility of an established cell line of Anticarsia gemmatalis (Lepidoptera: Noctuidae) to three nuclear polyhedrosis viruses. J. Invertebr. Pathol. 1988; 52: 453-458.
6. Visnovsky G, Claus JD. Influence of time and multiplicity of infection on the batch production of Anticarsia gemmatalisnuclear polyhedrosis virus in lepidopteran insect cell cultures. Advances in Bioprocess Engineering, Kluwer Academic Publishers, Holanda, 1994, 123-128.
7. Castro MEB, Souza ML, Araujo S, Bilimoria SL. Replication of Anticarsia gemmatalis nuclear polyhedrosis virus in four lepidopteran cell lines. J. Invertebr. Pathol. 1997; 69: 40-45.
8. Grasela JJ, McIntosh AH. In vitro and in vivo host range of Anticarsia gemmatalis multiple nuclear polyhedrosis virus. In Vitro Cell. Dev. Biol. – Animal 1998; 34: 79-83.
9. Sieburth PJ, Maruniak JE. Growth characteristics of a continuous cell line from the velvetbean caterpillar, Anticarsia gemmatalis Hübner (Lepidoptera: Noctuidae). In Vitro Cell. Dev. Biol. 1988;24: 195-198.
10. Murhammer DW. Use of viral insecticides for pest control and production in cell culture. Appl. Biochem. Biotechnol. 1996; 59: 199-220.
11. Agathos SN. Insect cell bioreactors. Cytotechnology 1996; 20: 173-189.
12. Schmid G. Insect cell cultivation: growth and kinetics. Cytotechnology 1996; 20: 43-56.
13. Dee KU, Shuler ML, Wood HW. Inducing single-cell suspension cultures of BTI-TN5B1-4 insect cells: 1. The use of sulfated polyanions to prevent cell aggregation and enhance recombinant protein production. Biotechnol. Bioeng. 1997; 54: 191-205.
14. Sugiura T, Amann E. Properties of two insect cell lines useful for the baculovirus expression system in serum-free culture. Biotechnol. Bioeng. 1996; 51: 494-499.
15. Rhiel M, Mitchell-Logean CN, Murhammer DW. Comparison of Trichoplusia ni BTI- Tn5B1-4 (High Five) and Spodoptera frugiperda Sf-9 insect cell line metabolism in suspension cultures. Biotechnol. Bioeng. 1997; 55: 909-920.
16. Nguyen B, Jarnagin S, Williams S, Chan H, Barnett J. Fed-batch culture of insect cells: a method to increase the yield of recombinant human nerve growth factor (rhNGF) in the baculovirus expression system. J. Biotechnol. 1993; 31: 205-217.
17. Bédard C, Perret S, Kamen AA. Fed- batch culture of Sf-9 cells supports 3 x 107 cells per ml and improves baculovirus-expressed recombinant protein yields. Biotechnol Lett. 1997; 19: 629-632.
18. Elias CB, Zeiser A, Bédard C, Kamen AA. Enhanced growth of Sf-9 cells to a maximum density of 5,2 x 107 cells per ml and production of β-galactosidase at high cell density by fed-batch culture. Biotechnol. Bioeng. 2000; 68: 381-388.
19. Ikonomou L, Schneider Y-J, Agathos SN. Insect cell culture for industrial production of recombinant proteins. Appl. Microbiol. Biotechnol. 2003; 62: 1-20.
20. Claus JD, Remondetto GE, Guerrero SA, Demonte AM, Murguía M, Marcipar AJ. Anticarsia gemmatalis nuclear polyhedrosis virus replication in serum-free and serum-reduced insect cell cultures. J. Biotechnol. 1993; 31: 1-15.
21. Reed L, Muench H. A simple method for estimating fifty percent endpoints. Am. J. Hyg. 1938; 27: 493-497.
22. Wickham TJ, Nemerow GR. Optimization of growth methods and recombinant protein production in BTI-Tn5B1-4 insect cells using the baculovirus expression system. Biotechnol Prog. 1993; 9: 25-30.
23. Pasumarthy MK, Murhammer DW. Clonal variation in the Spodoptera frugiperda IPLB-Sf-21 AE insect cell population. Biotechnol. Prog. 1994; 10: 314-319.
24. Zhang J, Kalogerakis N, Behie LA, Iatrou K. Investigation of reduced serum and serum-free media for the cultivation of insect cells Bm-5 and the production of the baculovirus BmNPV. Biotechnol. Bioeng. 1992; 40: 1165-1172.
25. Chakraborty S, Monsour C, Teakle R, Reid S. Yield, biological activity and field performance of a wild-type Helicoverpa nucleopolyhedrovirus produced in H. zea cell cultures. J. Invertebr. Pathol. 1999; 73:199-205.
26. Taticek RA, Choi C, Phan S-E, Palomares LA, Shuler ML. Comparison of growth and recombinant protein expression in two different insect cell lines in attached and suspension culture. Biotechnol Prog. 2001; 17: 676-684.
27. Donaldson MS, Shuler ML. Effects of long-term passaging of BTI-Tn5B1-4 insect cells on growth and recombinant protein production. Biotechnl. Prog. 1998; 14: 543-548.
28. Drews M, Paalme T, Vilu R. The growth and nutrient utilization of the insect cell line Spodoptera frugiperda Sf9 in batch and continuous culture. J. Biotechnol. 1995; 40: 187-198.
29. Doverskog M, Han L, Häggström L. Cystine/cysteine metabolism in cultured Sf9 cells: influence of cell physiology on biosynthesis, amino acid uptake and growth. Cytotechnology 1998; 26: 91-102.
30. Bédard C, Kamen AA, Tom R, Massie B. Maximization of recombinant protein yield in the insect cell/baculovirus system by one-time addition of nutrients to high density batch cultures. Cytotechnology 1994; 15: 129-138.
31. Tom RL, Debanne MT, Bédard C, Caron AW, Massie B, Kamen AA. Improved yields of the extracellular domain of the epidermal growth factor receptor produced using the baculovirus expression system by medium replacement following infection. Appl. Microbiol. Biotechnol. 1995; 44: 53-58.
32. Doverskog M, Ljunggren J, Öhman L, Häggström L. Physiology of cultured animal cells. J. Biotechnol. 1997; 59: 103-115.
33. Deutschmann SM, Jäger V. Optimization of the growth conditions of Sf21 cells for high density perfusion culture in stirred-tank reactors. Enzyme Microb. Technol. 1994; 16: 506-512.
34. Palomares LA, Ramírez OT. The effect of dissolved oxygen tension and the utility of oxygen uptake rate in insect cell culture. Cytotechnology 1996; 22: 225-237.
35. Mendonça RZ, Palomares LA, Ramírez OT. An insight into insect cell metabolism through selective nutrient manipulation. J. Biotechnol. 1999; 72: 61-75.
36. Meneses-Acosta A, Mendonça RZ, Merchant H, Covarrubias L, Ramírez OT. Comparative characterization of cell death between Sf9 insect cells and hybridoma cultures. Biotechnol. Bioeng. 2001; 72: 441-457.
37. Öhman L, Alarcón M, Ljunggren J, Ramqvist AK, Häggström L. Glutamine is not an essential amino acid for Sf-9 insect cells. Biotechnol Lett. 1996; 18: 765-770.
38. Bédard C, Tom R, Kamen AA. Growth, nutrient consumption, and end-product accumulation in Sf-9 and BTI-EAA insect cell cultures: insights into growth limitation and metabolism. Biotechnol Prog. 1993; 9: 615-624.
39. Férrance JP, Goel A, Ataai AM. Utilization of glucose and amino acids in insect cell cultures: quantifying the metabolic flows within the primary pathways and medium development. Biotechnol. Bioeng. 1993; 42: 615-624.
40. Neerman J, Wagner R. Comparative analysis of glucose and glutamine metabolism in transformed mammalian cell lines , insect and primary liver cells. J. Cell. Physiol. 1996; 166: 152-169.
41. Benslimane C, Elias CB, Hawari H, Kamen A. Insights into the central metabolism of Spodoptera frugiperda (Sf-9) and Trichoplusia ni BTI-Tn-5B1-4 (Tn-5) insect cells by radiolabeling studies. Biotechnol. Prog. 2005; 21: 78-86.
42. Drews M, Doverskog M, Öhman L, Chapman BE, Jacobsson U, Kuchel PW, Häggström L. Pathways of glutamine metabolism in Spodoptera frugiperda (Sf9) insect cells: evidence for the presence of the nitrogen assimilation system, and a metabolic switch by 1H/15N NMR*. J. Biotechnol. 2000; 78: 23-37.
43. Kamen AA, Tom RL, Caron AW, Chavarie C, Massie B, Archambault J. Culture of insect cells in a helical ribbon impeller bioreactor. Biotechnol. Bioeng. 1991; 38: 619-628.
44. Radford, KM, Reid S, Greenfield PF. Substrate limitation in the baculovirus expression vector system. Biotechnol. Bioeng. 1997; 56: 32-44.
45. Wong TKK, Nielsen LK, Greenfield PF, Reid S. Relationship between oxygen uptake rate and time of infection of Sf-9 insect cells infected with a recombinant baculovirus. Cytotechnology 1994; 15: 157-167.
46. Kamen AA, Bédard C, Tom R, Perret S, Jardin B. On-line monitoring of respiration in recombinant-baculovirus-infected and uninfected insect cell bioreactor cultures. Biotechnol. Bioeng. 1996; 50: 36-48.
47. Palomares LA, López S, Ramírez OT. Utilization of oxygen uptake rate to assess the role of glucosa and glutamina in the metabolismo f infected insect cell cultures. Biochem. Eng. J. 2004; 19: 87-93.
48. Rhiel M, Murhammer DW. The effect of oscillating dissolved oxygen concentrations on the metabolism of a Spodoptera frugiperda IPLB-Sf-21 AE clonal isolate. Biotechnol. Bioeng. 1995; 47: 640-650.
49. Batista FRX, Pereira CA, Mendonça RZ, Moraes AM. Enhancement of Sf9 cells and baculovirus production employing Graces´s medium supplemented with milk whey ultrafiltrate. Cytotechnology 2005; 49: 1-9.
50. Zhang YH, Enden G, Merchuk JC. Insect cells-Baculovirus system: Factors affecting growth and low MOI infection. Biochem. Eng. J. 2005: 27: 8-16.
Agradecimientos
Este trabajo fue realizado con el apoyo de ANPCyT (PICT 08-04411) y de la Universidad Nacional del Litoral (CAI+D 2002).
Correspondencia
Juan Daniel Claus
Laboratorio de Virología
Facultad de Bioquímica y Ciencias
Biológicas
Universidad Nacional del Litoral
Ciudad Universitaria
CC 242
S3000ZAA Santa Fe
Tel-FAX: 0054-342-4575216 int. 118
E-mail: jclaus@fbcb.unl.edu.ar