|
|
Revista QuímicaViva Número 3, año 3, septiembre 2004 quimicaviva@qb.fcen.uba.ar |
Ontogenia B: el delicado equilibrio
entre la diversidad y la autoinmunidad
Romina Gamberale*
Laboratorio de Inmunología, IIHema, Academia Nacional de Medicina
Recibido 10 de agosto de 2004/ Aceptado 29 de agosto de
2004
Resumen
Los
linfocitos B, al igual que el resto de las células del sistema inmune, se
originan en médula ósea a partir de un precursor común. Las células B comienzan
su maduración en la médula ósea y la finalizan en el bazo. Durante las primeras
etapas de desarrollo, los esfuerzos se centran en la generación de la
inmunoglobulina de superficie que es parte del receptor B (BCR). Una vez que el
BCR puede ser expresado en la membrana, los mecanismos de control evalúan la
especificidad del mismo, eliminando a aquellos linfocitos B cuyos BCR
reconozcan moléculas propias. Si bien durante la ontogenia de linfocitos B la
mayoría de las células muere por apoptosis antes de alcanzar la madurez, este
proceso, lejos de ser un gasto innecesario de energía, mantiene el delicado
equilibrio entre la diversidad y la autoinmunidad.
Palabras claves:
Abstract titulo en ingles
B lymphocytes, as other
cells of the immune system, arise from hematopoietic stem cells in the bone
marrow. B cells mostly develop in the bone marrow and complete their maturation
in the spleen. During the early stages of B cell development control mechanisms
are focused on the generation of the surface immunoglobulin, which is part of
the BCR. Once the cell can express this receptor the focus shifts to its
specificity, eliminating those B lymphocytes with self-reactive BCRs. During B
cell development, most of the cells die before become mature. This process, far
from being an unnecessary waste of energy, maintains the subtle balance between
diversity and autoimmunity.
Key words
Introducción
Los seres humanos nos encontramos expuestos continuamente a una gran
cantidad de microorganismos potencialmente patógenos, sin embargo, sólo nos
enfermamos en forma ocasional. Esto es así gracias a nuestro sistema inmune, el
cual constituye un sistema muy eficiente de defensa contra la infección.
Distintos tipos de células sanguíneas tales como, neutrófilos, basófilos,
eosinófilos, monocitos/macrófagos, linfocitos T y linfocitos B, participan en la respuesta inmunológica. La estrategia de defensa contra la infección
involucra distintas etapas: una etapa temprana, conocida
con el nombre de inmunidad innata, y una etapa tardía denominada inmunidad
adaptativa.
Los linfocitos B y T son los principales protagonistas de
la respuesta inmune adaptativa y, a diferencia del resto de las células del
sistema inmune, poseen en su membrana receptores antigénicos capaces de reconocer en
forma específica pequeñas porciones del patógeno (para el caso de los
linfocitos B) o células infectadas con los mismos (en el caso de los linfocitos
T). Luego de este reconocimiento, pueden activarse, multiplicarse y
diferenciarse en células efectoras capaces de defendernos contra ese
microorganismo en particular. La estrategia utilizada en la inmunidad
adaptativa para reconocer a la gran cantidad de microorganismos existentes,
involucra a una inmensa variedad de linfocitos B y T, cada uno de los cuales
porta en su superficie un receptor particular para el antígeno. Gracias a esta
gran diversidad de receptores antigénicos, un individuo tiene la capacidad de
desarrollar una respuesta inmune adaptativa contra la amplísima variedad de
patógenos con los que puede encontrarse durante su vida.
En este artículo, veremos:
v Las
características del receptor antigénico de los linfocitos B.
v Las etapas de
maduración de los linfocitos B durante su desarrollo.
v Cómo es posible
generar la gran diversidad de receptores antigénicos existentes.
¿Cómo es el
receptor antigénico de los linfocitos B?
El
receptor antigénico de los linfocitos B se denomina BCR (B cell receptor) y está constituido por una inmunoglobulina (Ig)
asociada con un heterodímero formado por las moléculas Iga e Igb (Figura 1). La Ig que forma parte del
BCR no es otra cosa que una molécula de anticuerpo anclada a la membrana.
Mientras que esta molécula es la responsable del reconocimiento antigénico, la
transducción de la señal al interior de la célula B se lleva a cabo por el
heterodímero Iga-Igb.
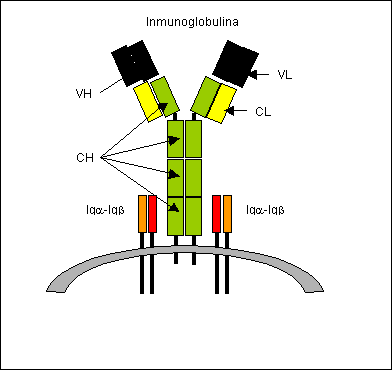
Figura 1: El BCR está constituido por una
inmunoglobulina (Ig) de superficie y el heterodímero Iga-Igb. La Ig esta constituida por dos cadenas pesadas (H)
idénticas entre si, asociadas por puentes disulfuro y dos cadenas livianas (L)
idénticas entre si, asociadas a las H por puentes disulfuro. Comparando un gran
número de Ig, se observó que la porción amino-terminal de ambas cadenas es
variable (V) y está involucrada en el reconocimiento del antígeno. Por el
contrario, la porción carboxi-terminal de ambas cadenas es relativamente
constante (C). En la
figura se observan las cadenas H en color verde, las cadenas L en color
amarillo y los dominios variables rayados.
¿Qué función
cumplen los linfocitos B?
Aquellos linfocitos B que reconocen al antígeno específico a través del
BCR, pueden activarse y proliferar originando un clon de células hijas, para
diferenciarse posteriormente a plasmocitos (Figura 2). Estos últimos
tienen la capacidad de secretar moléculas de Ig (anticuerpos), los cuales
poseen la misma especificidad de la Ig que formaba parte inicialmente del BCR.
Por lo tanto, los anticuerpos secretados podrán reconocer al microorganismo y
reclutar una variedad de mecanismos efectores a fin de destruirlo.
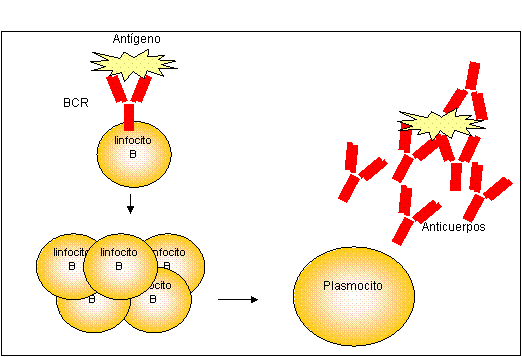
Figura 2
Las distintas porciones constantes de la cadena pesada (CH) dan origen
a los diferentes tipos de anticuerpos conocidos (IgM, IgG, IgE, IgA e IgD), y
cada una de estas clases de Ig es particularmente eficiente en la activación de
los distintos mecanismos efectores. Sin embargo, la Ig que forma parte del BCR
no lleva a cabo esas funciones ya que se encuentra anclada en la membrana de la
célula B, por lo tanto, solamente es capaz de reconocer al antígeno específico
a través de la región variable.
ONTOGENIA de LINFOCITOS B
¿Dónde se
originan los linfocitos B?
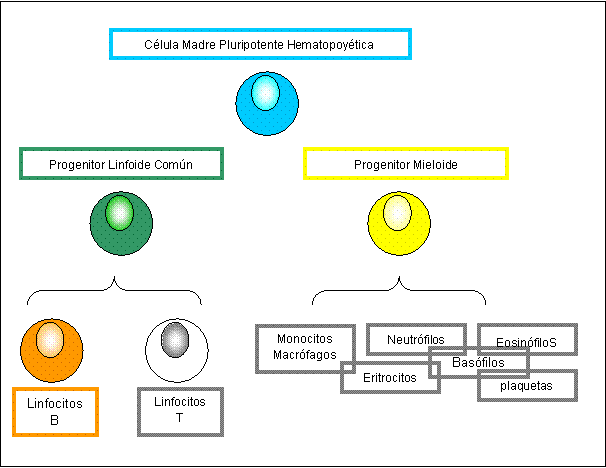
Los
linfocitos B, al igual que el resto de las células del sistema inmune, se
originan en la médula ósea a partir de un precursor común, denominado stem cell o célula madre pluripotente hematopoyética (CMPH) (Figura 3).
Dichas células tienen la capacidad de autorrenovarse y son, tal como su nombre
lo indica, potencialmente capaces de dar lugar a distintos tipos celulares. En
el hombre, las CMPH aparecen en el saco vitelino embrionario alrededor de la
tercera semana de vida y, a medida que el feto se desarrolla, algunas de estas
células migran al hígado. Recién al cuarto mes de vida fetal la médula ósea
comienza a ser el sitio donde mayoritariamente ocurrirá la hematopoyesis. Si
bien en los adultos la mayor cantidad de CMPH se encuentra en la médula ósea,
estas células tienen la capacidad de migrar hacia la circulación, por lo que
puede hallarse una pequeña proporción en sangre periférica.
A partir de las CMPH se generan dos tipos de progenitores con potencial
pluripotente más acotado que se denominan: progenitor
mieloide, el cual podrá diferenciarse en células de estirpe mieloide
(eritrocitos, plaquetas, monocitos y granulocitos neutrófilos, basófilos y
eosinófilos) y progenitor linfoide común (PLC), a partir del cual se
generarán los linfocitos B y T. ¿Cómo se decide si el PLC se diferenciará hacia
el linaje B ó T? Hasta el momento no está del todo claro este punto, sin
embargo, numerosas evidencias sugieren que la señalización a través de una
molécula presente en la membrana de los PLC, denominada Notch1, induciría la
diferenciación hacia el linaje T, mientras que la ausencia ó inhibición de esa
señal favorecería la diferenciación B.
Figura
3
¿Dónde se
desarrollan los linfocitos B?
Los
linfocitos B se desarrollan mayoritariamente en la médula ósea pero culminan su
maduración en el bazo. Su generación se produce en distintas etapas o pasos que
deben ir completándose, uno a uno, en forma correcta para poder avanzar en el
proceso de maduración. El concepto mismo de maduración linfocitaria implica la
generación de un receptor antigénico particular para cada linfocito y su
expresión en la membrana antes del ingreso del antígeno. Dado que existen miles
de millones de linfocitos B distintos, cada uno de los cuales porta
inmunoglobulinas de superficie con una especificidad única, un individuo posee
una gran diversidad de inmunoglobulinas. Tal como veremos a continuación, en
las primeras etapas del desarrollo linfocitario, los esfuerzos se centran en la
generación de esta Ig y, si esto no es posible, el linfocito no continúa con su
desarrollo y se ponen en marcha mecanismos que llevan a la muerte celular
programada conocida como apoptosis,
sin alcanzar la madurez.
¿Cómo es posible
generar tanta diversidad de inmunoglobulinas?
Las
inmunoglobulinas presentan muchísima diversidad. El número total de
especificidades de anticuerpos disponibles en un individuo se conoce con el
nombre de repertorio de anticuerpos o de inmunoglobulinas y en el ser humano,
ese número, es por lo menos de cien mil
millones. Antes de que se pudieran analizar directamente los genes que
codifican para las Ig, existían dos teorías que intentaban explicar el origen
de semejante diversidad. La TEORÍA DE LA LÍNEA GERMINAL postulaba que existía
un gen distinto para cada cadena de Ig diferente y, por lo tanto, proponía que
el repertorio de Ig era hereditario. Por el contrario, la TEORÍA DE LA
DIVERSIFICACION SOMÁTICA postulaba que el amplísimo repertorio se generaba a
partir de un conjunto de genes hereditarios que codifican para la porción
variable de las las Ig los cuales se modificaban de una manera particular en
cada una de las células B. El clonado de los genes de las Ig reveló que, tal
como proponía esta última teoría, la generación de diversidad se produce por
rearreglos del ADN que codifica para las porciones variables de las Ig durante el desarrollo de los linfocitos B.
Las cadenas H y L de las Ig están codificadas por distintos grupos de
genes y, para cada una de las cadenas, existen varios fragmentos génicos
involucrados en la generación de sus porciones variables. En las células que
darán lugar a los linfocitos B, estos fragmentos génicos se rearreglan a través
de un proceso que se conoce con el nombre de recombinación somática (Figura 4).
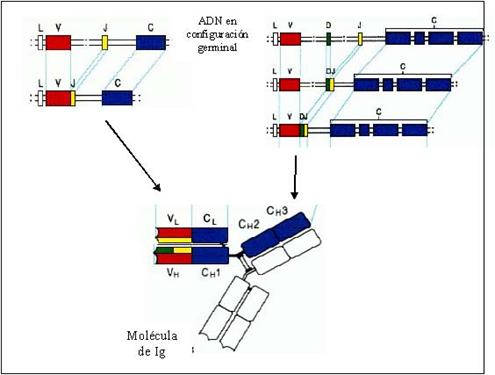
Figura 4: Recombinación somática. La porción variable de la cadena L (VL)
se constituye por combinación de fragmentos denominados V (rojo) y J
(amarillo), mientras que la región variable de la cadena H (VH)
involucra, además, fragmentos D (verde). Los fragmentos génicos presentes en el
ADN en configuración germinal sufren el proceso de recombinación somática,
dando lugar a una combinación única de fragmentos V-J para la porción VL
y V-D-J para la región VH en cada linfocito B.
Hasta
aquí hemos visto de qué manera es posible que se constituya la porción variable
de las cadena L y H pero, para simplificar, hemos presentado las cosas como si
sólo existiera una copia de cada uno de los genes involucrados en el proceso de
recombinación somática. En realidad, en el ADN en configuración germinal,
existen múltiples copias de cada uno de los genes involucrados en este proceso
y es la selección de un segmento u otro lo que hace posible la gran diversidad
de regiones variables entre las distintas Ig. La unión entre los fragmentos
recombinados (VL-JL ó VH-DH-JH)
es imprecisa, lo cual es una fuente extra de variabilidad para la porción
variable de las Ig. Los rearreglos del ADN que generan proteínas no funcionales
se denominan "no-productivos" y suelen ser los más frecuentes. Para
que un linfocito B pueda desarrollarse normalmente debe lograr un rearreglo
productivo de su Ig, de no ser así, no podrá continuar con su desarrollo y
morirá por apoptosis.
Etapas de
maduración de los linfocitos B
Tal
como hemos mencionado anteriormente, las células B maduran mayoritariamente en
la medula ósea. El desarrollo de los linfocitos B depende de la presencia
de células estromales que actúan, no sólo como una red de sostén necesaria para
que los linfocitos B continúen su desarrollo, sino también como fuente de
factores de crecimiento críticos que estimulan la diferenciación y
proliferación.
En el primer estadio de diferenciación, conocido con el nombre de
estadio pro-B, los linfocitos poseen
una capacidad limitada de auto-renovación. Durante este estadio es que se
produce el rearreglo de la cadena H de las Ig, el cual se lleva a cabo en dos
etapas: primero se asocian los fragmentos DH-JH (pro-B
temprano) y luego se une el fragmento VH al DHJH
previamente rearreglado (pro-B tardío). Tal como se observa en la Figura 5, la asociación DH-JH
se produce en ambos cromosomas. Por el contrario, la unión del fragmento VH
al DHJH se intentará primeramente en un cromosoma y en
caso de no ser exitoso, se intentará rearreglar el segundo cromosoma. Este
fenómeno se conoce con el nombre de exclusión
alélica y garantiza que sólo se exprese la cadena H de uno de los dos
alelos del genoma.
Figura
5
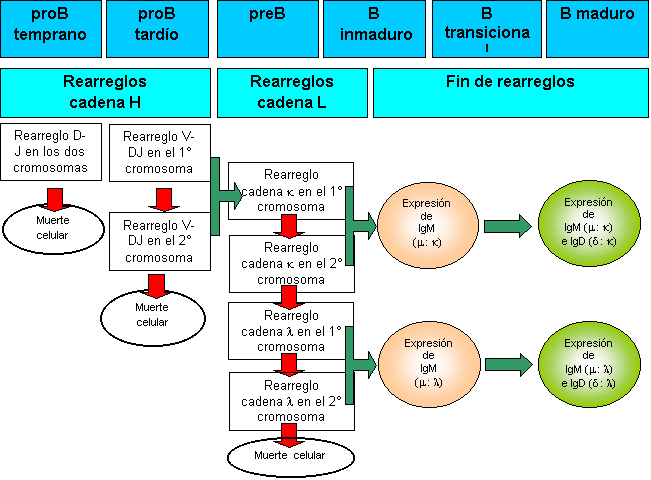

La ausencia de rearreglos exitosos de la cadena H lleva a la apoptosis
del linfocito B. El rearreglo productivo de la porción VH permite la expresión
en la membrana de una cadena pesada m (Hm) asociada con
dos proteínas producidas por el linfocito que están unidas en forma no
covalente constituyendo una cadena liviana sustituta (Ls). El ensamblado de la
cadena H rearreglada a la cadena Ls y su asociación al heterodímero IgaIgb en la membrana
del linfocito constituye el pre-BCR. La presencia del pre-BCR en la membrana
caracteriza el siguiente estadio de maduración denominado pre-B, en donde los linfocitos finalizan con los rearreglos de la
cadena H, realizan varios ciclos de proliferación y comienzan posteriormente a
rearreglar la cadena L. De esta manera, cada una de las células hijas de la
progenie que poseen genes de cadena H ya rearreglados recombinan en forma
independiente los fragmentos de la porción variable de la cadena L, aumentando
nuevamente la diversidad. Para que todo esto sea posible, se necesita la
transducción de señales de sobrevida del pre-BCR. Si bien hasta el momento no
está claro qué es lo que gatilla la transducción de la señal a través de dicho
receptor, existen evidencias que indican que la proteína quinasa Btk está
involucrada. En este sentido, los pacientes que presentan mutaciones en dicha
proteína (enfermedad de Bruton) poseen los linfocitos arrestados en el estadio
pro-B.
Los rearreglos de la porción variable de la cadena L también están
gobernados por el fenómeno de exclusión alélica e involucran la asociación de
fragmentos VL y JL.. Existen dos tipos distintos de
cadena L:, la cadena liviana kappa (Lk) o la lambda (Ll). Primeramente se intentará un rearreglo productivo de la cadena Lk en uno de lo cromosomas y, en los casos en que no se consiga, se
procederá a intentar rearreglar esa misma cadena en el otro cromosoma. Si estos
intentos no fueran exitosos, comenzarán los rearreglos de la cadena Ll, primero en un cromosoma y luego en el otro. Normalmente, un 65% de
linfocitos B logra un rearreglo exitoso de cadena Lk, mientras que el restante 35% presenta rearreglos productivos de la
cadena Ll. No existen
linfocitos con rearreglos no productivos de cadena L ya que éstos no son
viables y mueren por apoptosis.
Una vez que los genes de la cadena L son rearreglados exitosamente, la
cadena L comienza a sintetizarse y se combina con la cadena Hm a fin de formar la molécula de IgM. Dicha molécula se expresará en la
membrana junto con el heterodímero Iga-Igb constituyendo el BCR de clase IgM característico del estadio B inmaduro.
En las etapas de maduración de los linfocitos B que hemos visto hasta
el momento lo crucial es generar rearreglos productivos de los genes de cadena
H y L que permitan la expresión de una molécula de Ig en la membrana. Aquellas
células que logran generar su receptor antigénico y expresarlo pueden avanzar a
la siguiente etapa de maduración, en donde los mecanismos de control cambian el
foco de atención hacia la especificidad del BCR. Es decir que, una vez que el
linfocito alcanza el estadio B inmaduro y expresa el BCR en la membrana , dicho
receptor será evaluado en función de su capacidad de reconocer antígenos
presentes en el ambiente del órgano linfático primario. La finalidad de esta
"evaluación" es controlar a aquellos linfocitos cuyos BCR pueden
reconocer moléculas propias, los cuales serían potencialmente peligrosos ya que
podrían generar respuestas de tipo autoinmunes. Este proceso de
"evaluación" se conoce como inducción de tolerancia central. La especificidad y la avidez del receptor por
esos antígenos determinará el camino a seguir por el linfocito: sobrevivir y
continuar madurando, o morir por apoptosis sin alcanzar la madurez.
Inducción de
tolerancia central de linfocitos B
Los
linfocitos B inmaduros que no reciban señal alguna a través de su BCR en la
médula ósea, son capaces de salir del órgano para continuar con su proceso de
maduración en el bazo. Por el contrario, aquellos linfocitos B inmaduros
capaces de reconocer antígenos propios en la médula ósea son considerados
peligrosos y "controlados" a través de diversos mecanismos dependiendo
de la intensidad de la señal recibida por el BCR. Es así, que los que reciben una señal intensa a
través del BCR morirán por apoptosis en la medula ósea. Antes de morir, al
linfocito B inmaduro se le da la oportunidad de reemplazar el BCR autorreactivo
por otro que no lo sea, a fin de evitar la muerte por apoptosis. Este proceso
se conoce con el nombre de edición del
receptor. Si el nuevo BCR generado no es autorreactivo, el linfocito B
inmaduro no entra en apoptosis y sale de la médula ósea para continuar su proceso
de maduración. Si los distintos intentos de "editar" el BCR continúan
generando un receptor autorreactivo, la célula morirá por apoptosis en la
médula ósea.
Por otro lado, aquellos linfocitos B inmaduros que en la médula ósea
reciban señales débiles a través de su BCR, serán inactivados y entrarán en un
estado permanente de no-respuesta, también denominado anergia. Estos linfocitos autorreactivos abandonan la médula ósea
pero, al no ser capaces de activarse en la periferia, mueren relativamente pronto.
Vale la pena mencionar que, dado que no todos los antígenos propios
pueden alcanzar la médula ósea a fin de protagonizar la inducción de tolerancia
central B, muchos de los linfocitos B que continúan con su proceso de
maduración poseen BCR capaces de interaccionar con moléculas propias. Dichos
linfocitos son controlados en la periferia, a través de mecanismos de inducción
de tolerancia periférica.
Maduración
periférica de linfocitos B
Del
total de linfocitos B inmaduros que se genera diariamente sólo un pequeño
porcentaje logra salir de médula ósea y alcanzar el bazo, donde continúan con
su proceso de maduración. ¿Por qué se generan tantos linfocitos B inmaduros y
sólo algunos sobreviven? Todavía esta pregunta sigue sin tener una respuesta
clara pero probablemente, la mayoría de los linfocitos B inmaduros sean
seleccionados negativamente en la médula ósea durante la inducción de
tolerancia central debido a que sus BCR son capaces de reconocer moléculas
propias. Sólo aquellos linfocitos B inmaduros, que sobrevivan a la inducción de
tolerancia central, saldrán de la médula ósea hacia el bazo, el órgano donde
culminarán su maduración. En este estadio los linfocitos B, que se encuentran
en la periferia en un estado de transición entre el estadio B inmaduro y
maduro, reciben el nombre de linfocitos
B transicionales (BTr). Dentro
de esta población de linfocitos pueden diferenciarse dos subpoblaciones bien
definidas, BTr de tipo 1 (BTr1) o de tipo 2 (BTr2), que se encuentran en el
bazo ubicadas en distintos lugares anatómicos.
Durante el estadio BTr1, los BCR de dichos linfocitos también son
"controlados" y sufren un proceso de selección negativa si reciben
señales a través de su BCR para reconocer moléculas propias. A través de este
mecanismo de inducción de tolerancia periférica, nos aseguramos que los
linfocitos B autorreactivos que han sobrevivido a la inducción de tolerancia
central en la médula ósea no continúen su desarrollo y mueran por apoptosis en
el bazo. Posteriormente, aquellos sobrevivientes, darán lugar a los BTr2, los
cuales aparentemente necesitan recibir señales de sobrevida a través de su BCR,
aún no bien definidas, para alcanzar el estadio de B maduro.
Numerosas evidencias demostraron que es necesaria además la presencia
de ciertos factores de sobrevida, tales como la citoquina BAFF, para la
transición de los linfocitos BTr1 hacia el estadio BTr2 y B maduras. Una vez
que los linfocitos han alcanzado su madurez, co-expresan en su membrana BCR de
tipo IgM e IgD, sin embargo presentan una única especificidad dada por la
porción variable de las Igs, que es
idéntica. Esto se explica gracias a que una misma porción VH generada por
recombinación somática puede asociarse con los genes Cm (para dar la IgM) ó Cd (para dar la IgD).
Conclusiones
Los
linfocitos B, al igual que el resto de las células del sistema inmune, se
originan en la médula ósea a partir de un precursor común. Existen miles de
millones de linfocitos B distintos entre sí, cada uno de los cuales expresa en
su membrana un receptor antigénico particular. La naturaleza se las ha
ingeniado para generar semejante diversidad de receptores utilizando sólo un
conjunto de genes, los cuales son rearreglados en forma distinta en cada uno de
los linfocitos B en desarrollo.
Debido a cómo se generan las inmunoglobulinas, una vez que el BCR puede
ser expresado en la membrana, necesariamente deben existir mecanismos de
control que evalúen la especificidad del mismo. Si bien durante la ontogenia de
linfocitos B la mayoría de las células mueren por apoptosis antes de alcanzar
la madurez, este proceso, lejos de ser un gasto innecesario de energía,
mantiene el delicado equilibrio entre la diversidad y la autoinmunidad. El
proceso de generación de las inmunoglobulinas nos asegura la gran diversidad
necesaria para estar protegidos contra la amplísima variedad de microorganismos
existentes, sin embargo esta situación acarrea conjuntamente la aparición de
rearreglos capaces de interaccionar con moléculas propias. Es por ello que
existen numerosos mecanismos de control para evaluar la especificidad de las
inmunoglobulinas generadas, a fin de evitar la aparición de fenómenos
autoinmunes.
Aquellos linfocitos que sobreviven a
los mecanismos de control y alcanzan el estadio B maduro, co-expresan en su
membrana BCR de tipo IgM e IgD, los
cuales son específicos para antígenos que aún no conocen, por lo que también
reciben el nombre de linfocitos B vírgenes. Dichas células comienzan un tráfico
linfocitario en busca del antígeno para el cual son específicas y, aquellas que
lo encuentren, podrán activarse, proliferar y diferenciarse a células
productoras de anticuerpos. Estos anticuerpos tendrán la capacidad de reconocer
al antígeno específico y reclutar distintos mecanismos efectores a fin de
destruirlo.
Agradecimientos:
A la
Dra. Mirta Giordano, por su crítica revisión del manuscrito.
Referencias.
Tonegawa S., 1983. Somatic generation of
antibody diversity.
Nature, 302:575.
D Zipori , 1992. The
renewal and differentiation of hemopoietic stem cells.
FASEB J., 6:2691.
Gay D, Saunders T, Camper S,Weigert M., 1993. Receptor
editing: an approach by autoreactive B cells to escape tolerance. Journal
Experimental Medicine, 177:999.
E Beutler, M Lichtman, B Coller and
T Kipps. 1995. Williams Hematology. Fifth edition.
Sandel PC, Monroe JG., 1999. Negative
selection of immature B cells by receptor editing or deletion is determined by
site of antigen encounter. Immunity, 10:289.
Marcel Batten,Joanna Groom,Teresa G. Cachero,
Fang Qian, Pascal Schneider,Jurg Tschopp,Jeffrey L. Browning,Fabienne Mackay,
2000. BAFF Mediates Survival of Peripheral Immature B Lymphocytes. Journal
Experimental Medicine, 192:1453.
Richard R. Hardy, yoko Hayakawa, 2001. B cell
development pathways.
Annual Review of Immunology, 19:595.
Charles Janeway, Paul Travers, Mark Walport,
Mark Shlomchik, 2001. Immuno Biology. The immune system in health and disease.
5th edition,
Stephen B. Gauld, Joseph M. Dal Porto, John C.
Cambier, 2002. B Cell Antigen Receptor Signaling: Roles in Cell Development and
Disease. Science, 296:1641.
Freddy Radtke, Anne Wilson and H Robson
MacDonald, 2004. Notch signaling in T- and B-cell development. Current Opinion
in Immunology, 16:174.
Antonius G. Rolink, Jan Andersson, Fritz
Melchers, 2004. Molecular mechanisms guiding late stages of B-cell development.
Immunological Reviews, 197:41.
Thomas T. Su, Beichu Guo, Bo Wei, Jonathan
Braun, David J. Rawlings, 2004. Signaling in transitional type 2 B cells is
critical for peripheral B-cell development.
Immunological Reviews, 197:161.
Mila Jankovic, Rafael Casellas, Nikos
Yannoutsos, Hedda Wardemann, Michel C. Nussenzweig, 2004. Rags and regulation
of autoantibodies. Annual Review of Immunology, 22:485.
* Dra. Romina Gamberale. Laboratorio de
Inmunología, IIHema, Academia Nacional de Medicina. E-mail:
rgamberale@hematologia.anm.edu.ar