Toxicidad aguda comparativa de insecticidas anticolinesterásicos
María José Tejedor1, Daira Safi1,2, María Gimena Paredes1,3, Karina Alesia Bianco1,3, Alan Daniel Vojnov1,3, Claudia Noemí Martini1,3, Gisela Kristoff1,3
1 Universidad de Buenos Aires (UBA), Facultad de Ciencias Exactas y Naturales (FCEN), Departamento de Química Biológica, Laboratorio de Evaluación Ecotoxicológica del Agua Invertebrados Nativos y otros Modelos (EEAINM). Pabellón II, Ciudad Universitaria, Buenos Aires, Argentina.
2 Universidad Argentina de la Empresa (UADE), Facultad de Ingeniería y Ciencias Exactas. Libertad 1340, Ciudad de Buenos Aires, Argentina.
3 CONICET - UBA. Instituto de Química Biológica de la Facultad de Ciencias Exactas y Naturales (IQUIBICEN). Pabellón II, Ciudad Universitaria, Ciudad de Buenos Aires, Argentina.
Recibido: 04/02/2025 - Aceptado: 23/04/2025
Resumen
Los insecticidas organofosforados y carbamatos actúan inhibiendo la acetilcolinesterasa tanto en los insectos como en organismos “no blanco”, sin embargo, en trabajos previos reportamos que el organofosforado metilazinfos no causa inhibición de la actividad enzimática en el caracol de agua dulce Biomphalaria straminea. El objetivo de este trabajo consistió en evaluar efectos agudos de otros insecticidas anticolinesterásicos: clorpirifos y carbaril en esta especie. Se realizaron bioensayos de 48 horas utilizando 3 concentraciones de cada insecticida, durante los cuales se registraron la supervivencia y las alteraciones del comportamiento. Al finalizar el bioensayo se realizaron los homogenatos del tejido blando total y en los sobrenadantes (N = 8 por tratamiento) se determinó la actividad de colinesterasas, glutatión S-transferasa y carboxilesterasas. El carbaril no causó efectos en los biomarcadores evaluados. Por el contrario, el clorpirifos causó un comportamiento de huida, inhibió la actividad de colinesterasas y carboxilesterasas y aumentó la actividad de glutatión S- transferasa dependiendo de la concentración. Las carboxilesterasas estarían cumpliendo un rol protector siendo un blanco alternativo de unión del insecticida. Sin embargo, a la concentración más alta (1 mg/L) la inhibición marcada de su actividad, sin un aumento de la actividad de glutatión S-transferasa indican una menor capacidad detoxificante, lo cual coincide con la disminución de la supervivencia de los caracoles expuestos a esta concentración. El clorpirifos resultó más tóxico que el carbaril en B. straminea.
Palabras clave: carbamatos, carboxilesterasas, colinesterasas, gasterópodos, organofosforados
Comparative acute toxicity of anticholinesterase insecticides
Summary
Organophosphate and carbamate insecticides act by inhibiting acetylcholinesterase in both insects and non-target organisms. However, in a previous work we reported that the organophosphate methyl-azinphos does not cause inhibition of its enzymatic activity in the freshwater snail Biomphalaria straminea. The aim of this work was to evaluate the acute effects of other anticholinesterase insecticides: chlorpyrifos and carbaryl in this species. 48 hours bioassays were performed using 3 concentrations of each insecticide and survival and behavioral alterations were recorded. At the end of the bioassays, total soft tissues were homogenized and the activity of cholinesterase, glutathione S-transferase and carboxylesterases were determined in the supernatants (N = 8 per treatment). Carbaryl did not cause any effect on the evaluated biomarkers. In contrast, chlorpyrifos caused behavior alterations, inhibition of cholinesterase and carboxylesterases activities, and an increase in glutathione S-transferase activity depending of the concentration. Carboxylesterases would be playing a protective role as an alternative target for insecticide binding. However, at the highest concentration (1 mg/L) the marked inhibition of their activity, without an increase in glutathione S-transferase, indicates a lower detoxifying capacity, which coincides with the decrease of the survival in the organisms exposed to this concentration. Chlorpyrifos resulted more toxic than carbaryl in B. straminea.
Keywords: carbamates, carboxylesterases, cholinesterases, gastropods, organophosphates
Introducción
El blanco molecular primario de los insecticidas organofosforados (OPs) y carbamatos (CBs) es la acetilcolinesterasa (AChE). Actúan inhibiendo su actividad de manera irreversible y reversible respectivamente, lo cual causa la acumulación de la acetilcolina en el espacio sináptico. Esto genera una hiperexcitación colinérgica seguida de un bloqueo de las transmisiones sinápticas, lo que finalmente conduce a la mortalidad de los insectos [1]. Teniendo en cuenta el mecanismo de acción, resultan poco selectivos y pueden causar efectos tóxicos en organismos “no blanco”: otros invertebrados y vertebrados incluyendo al ser humano.
Los moluscos son considerados muy buenos modelos para la evaluación de toxicidad de distintos compuestos químicos, así como de muestras ambientales. Los gasterópodos de agua dulce que pertenecen al género Biomphalaria (gastropoda, Planorbidae) presentan muchas ventajas para la cría y el uso en bioensayos ya que tienen bajos requerimientos, una alta tasa de reproducción, rápido desarrollo embrionario, crecimiento y madurez sexual [2, 3]. Por otro lado, los organismos de este género son huéspedes intermediarios del parásito Schistosoma mansoni que produce esquistosomiasis en los humanos [4], siendo un grave problema sanitario en distintos países, lo cual derivó en numerosos estudios de toxicidad de molusquicidas [5, 6]. En los últimos años ha crecido el uso de Biomphalaria spp. en el estudio de otros plaguicidas, principalmente insecticidas [7, 8].
B. straminea es una especie nativa de América del Sur que habita en Argentina [9] y que ha colonizado otras partes del mundo por ser considerada una especie resistente a distintos tipos de ambientes [9, 10]. En Argentina, ha surgido el interés por la incorporación de invertebrados como bioindicadores en la gestión ambiental y gracias a nuestros trabajos ha sido incorporada en el Informe del Ambiente de la Nación [11] como especie prioritaria para su estudio y monitoreo.
En esta especie se comprobó la presencia de una colinesterasa (ChE) con características similares a la AChE de los vertebrados debido a la inhibición in vitro con eserina (inhibidor específico de ChEs totales) y con BW284c51 inhibidor específico de AChE) y la nula inhibición con iso-OMPA (inhibidor específico de butirilcolinesterasa) [12]. Sin embargo, la actividad no disminuyó luego de la exposición aguda al OP metilazinfos, contrariamente a lo observado en otra especie del género Biomphalaria [13] y otros gasterópodos [14, 15].
Las enzimas glutatión S-transferasas (GSTs) y carboxilesterasas (CEs) son enzimas detoxificantes que catalizan la conjugación de compuestos electrofílicos con glutatión (GSH) y la hidrólisis de carboxil ésteres, respectivamente, participando en la metabolización de distintos compuestos endógenos y exógenos en los seres vivos [16, 17]. La actividad incrementada de GST y CEs está asociada con una mayor tolerancia a los plaguicidas en general y a la resistencia a insecticidas en los insectos [18, 19]. Sin embargo, en el caso particular de las CEs, estas enzimas pueden ser inhibidas por OPs y CBs, siendo un blanco alternativo de unión a los mismos y disminuyendo la unión de los insecticidas a AChE. En general, en invertebrados “no blanco”, las CEs resultan más sensibles o se inhiben en un % mayor que las ChEs, cumpliendo un rol fundamental en la defensa de los organismos [20]. En cuanto al uso como biomarcadores en estas especies, se ha sugerido el uso conjunto de ChEs y CEs combinando la alta especificidad por un lado y la alta sensibilidad por el otro [21].
El objetivo de este trabajo consistió en evaluar efectos comportamentales y sobre la actividad de ChE, CEs y GST en B. straminea luego de la exposición aguda a dos insecticidas anticolinesterásicos (el OP clorpirifos y el CB carbaril).
Teniendo en cuenta los resultados previos se plantearon las siguientes hipótesis: 1) los insecticidas no inhiben la actividad de ChE; 2) no producen alteraciones del comportamiento; 3) disminuyen la actividad de CEs y aumentan la actividad de GST.
Materiales y métodos
B. straminea
Los organismos de B. straminea se crían desde el año 2012 en nuestro laboratorio a una temperatura del agua de 22 ± 1 ºC y bajo un fotoperíodo artificial 12:12 horas (luz:oscuridad). Son mantenidos en peceras de vidrio con agua declorada pasivamente y aireación, alimentándose con Lactuca sativa var. Capitata ad livitum. El uso de estas especies se encuentra aprobado por el Servicio de Higiene y Seguridad, FCEN, UBA (Resol. 1722/2003; 1401/2018).
Insecticidas
El clorpirifos PESTANAL® 98% de pureza (O,O-dietil O-3,5,6-trichloro-2-piridil fosforotioato) y el carbaril PESTANAL® 99% de pureza (1-naftil-N-metilcarbamato) fueron adquiridos en Sigma–Aldrich. Para los bioensayos, se prepararon soluciones concentradas en acetona que fueron conservadas a -20°C.
Las soluciones de trabajo se diluyeron en el momento, con agua declorada pasivamente.
Reactivos
Todos los reactivos empleados para las determinaciones fueron adquiridos en Sigma-Aldrich.
Bioensayos
Se realizaron 2 bioensayos de exposición bajo las mismas condiciones. En el primero se expusieron a los organismos a clorpirifos y en el segundo a carbaril. Previamente a cada bioensayo se seleccionaron los caracoles a utilizar y se colocaron al azar en los recipientes del bioensayo por una semana con fines de aclimatación. Para el bioensayo de clorpirifos se usaron ejemplares adultos de 0,070 ± 0,005 g y para el de carbaril de 0,089 ± 0.007 g. Ambos bioensayos se realizaron a 22 ± 1 ºC, bajo un fotoperíodo artificial 12:12 horas (luz:oscuridad), sin alimento ni aireación y tuvieron una duración de 48 horas (exposición aguda).
Los bioensayos se realizaron en vasos de vidrio de 250 mL de capacidad colocando 4-6 caracoles por vaso. Para cada tratamiento se utilizaron 8 vasos. Los tratamientos fueron: control de agua, control de acetona 0,25 %, clorpirifos I: 0,01 mg/L, clorpirifos II: 0,1 mg/L, clorpirifos III: 1 mg/L, carbaril I: 0,01 mg/L, carbaril II: 0.1 mg/L, carbaril III: 1 mg/L. En ambos bioensayos se incluyeron los controles. El recambio de soluciones se realizó según trabajos previos para mantener estables las concentraciones de trabajo [16, 22].
Cada 24 h de exposición se registró la supervivencia [3] y se calculó el % de letalidad con respecto al total de caracoles de cada tratamiento. Se evaluó también a simple vista si los caracoles presentaban alguna alteración del comportamiento como falta de adherencia, disminución del movimiento o cambios en la locomoción. Se calculó el % de caracoles alterados con respecto al total de caracoles por tratamiento.
Al finalizar las 48 horas de exposición se realizaron los homogenatos de tejido blando total [3] con los caracoles de cada vaso, obteniéndose 8 homogenatos por tratamiento (N = 8). Luego se centrifugaron a 11000 xg por 15 min a 4 ºC y los sobrenadantes se utilizaron para determinar las actividades de ChE, CEs y GST y el contenido total de proteínas [23].
Determinación de la actividad de ChE
La actividad de ChE se determinó utilizando ioduro de acetiltiocolina como sustrato. La formación de tio-nitrobenzoico (TNB) se monitoreó a 412 nm durante 1 min y la actividad se expresó como μmoles de TNB/min/mg de proteínas [24]
Determinación de la actividad de GST
La actividad de GST fue medida usando GSH y 2,4-dinitroclorobenceno. La formación del conjugado S-(2,4-dinitrofenil) glutatión (DNF-SG) se monitoreó por 1 min a 340 nm y la actividad se expresó como µmoles de DNF-SG/min/mg de proteínas [25].
Determinación de la actividad de CEs
La determinación de CEs se realizó utilizando por separado dos sustratos: p-nitrofenilacetato (p-NFA) y p-nitrofenilbutirato (p-NFB). La actividad se midió a 400 nm durante 1 min y se expresó como μmoles de p-nitrofenol/min/mg de proteínas [16].
Análisis estadístico
Los resultados obtenidos de ChE, GST y CEs y proteínas se analizaron a través de análisis de varianza (ANOVA) de un factor. Previamente se verificó el cumplimiento de los supuestos de normalidad (Test de Kolmogorov-Smirnov) y de homogeneidad de las varianzas (Test de Bartlett). Las diferencias significativas entre tratamientos se analizaron con el Test de Tukey. Cuando no se cumplieron los supuestos, se utilizó el Test no paramétrico de Dunn.
Los datos de los grupos controles (control de agua y control de acetona) se compararon entre sí usando el Test de Student.
Las significancias en los % de alteraciones del comportamiento y de letalidad entre tratamiento se analizaron usando el Test Chi cuadrado de Pearson.
Los análisis estadísticos se hicieron mediante los programas InStat y R. Se consideraron diferencias estadísticamente significativas cuando p < 0,05.
Resultados
Supervivencia
La exposición por 48 horas a 1 mg/L de clorpirifos causó una letalidad del 26 % en los organismos expuestos, siendo estadísticamente significativa con respecto a los otros tratamientos (p < 0,001).
El carbaril no causó letalidad significativa en B. straminea, siendo la supervivencia del 87-96 %.
En los organismos controles, la supervivencia fue del 96-100 %.
Alteraciones del comportamiento
Un alto número de caracoles expuestos a las dos concentraciones más altas de clorpirifos mostraron un comportamiento de huida de las soluciones. El % de caracoles que presentaron este comportamiento fue estadísticamente significativo (p < 0,001) luego de 48 horas de exposición a 0,1 mg/L (33 %) y a las 24 y 48 horas de exposición a 1 mg/L (72 y 43 %, respectivamente).
Parámetros bioquímicos
No se observaron diferencias estadísticamente significativas entre los grupos control de agua y control de solvente en ninguno de los bioensayos (p $gt; 0,05), por lo cual se descarta el efecto del solvente en los parámetros evaluados. Tampoco se encontraron diferencias significativas en el contenido de proteínas totales entre los tratamientos (p > 0,05), por lo que se utilizaron para relativizar las actividades enzimáticas.
Las tres concentraciones de clorpirifos inhibieron significativamente la actividad de ChE con respecto al control, un 33 % con la concentración más baja (p < 0,05) y un 51 % con las otras dos concentraciones (p < 0,001) (Fig. 1A).
La actividad de GST aumentó significativamente luego de la exposición a las dos concentraciones más bajas de clorpirifos con respecto al control (clorpirifos I: 62 %, p < 0,01; clorpirifos II: 55 % p < 0,05) y con respecto a la concentración más alta de clorpirifos (67 %, p < 0,01; 60 %, p < 0,05). No se observaron diferencias significativas entre el control y la concentración más alta (p > 0,05), como puede observarse en la Fig. 1B.
Con respecto a las CEs, se observó inhibición de la actividad enzimática con ambos sustratos. Sin embargo, con p-NFB la actividad resultó más sensible disminuyendo la actividad significativamente (p < 0,001) por exposición a las 3 concentraciones de clorpirifos y en un mayor porcentaje (clorpirifos I: 41 %, clorpirifos II: 68 %, clorpirifos III: 83 %). Con p-NFA la actividad disminuyó un 38 % con clorpirifos II (p < 0,05) y un 66 % con clorpirifos III (p < 0,05) (Fig. 1 C, D).
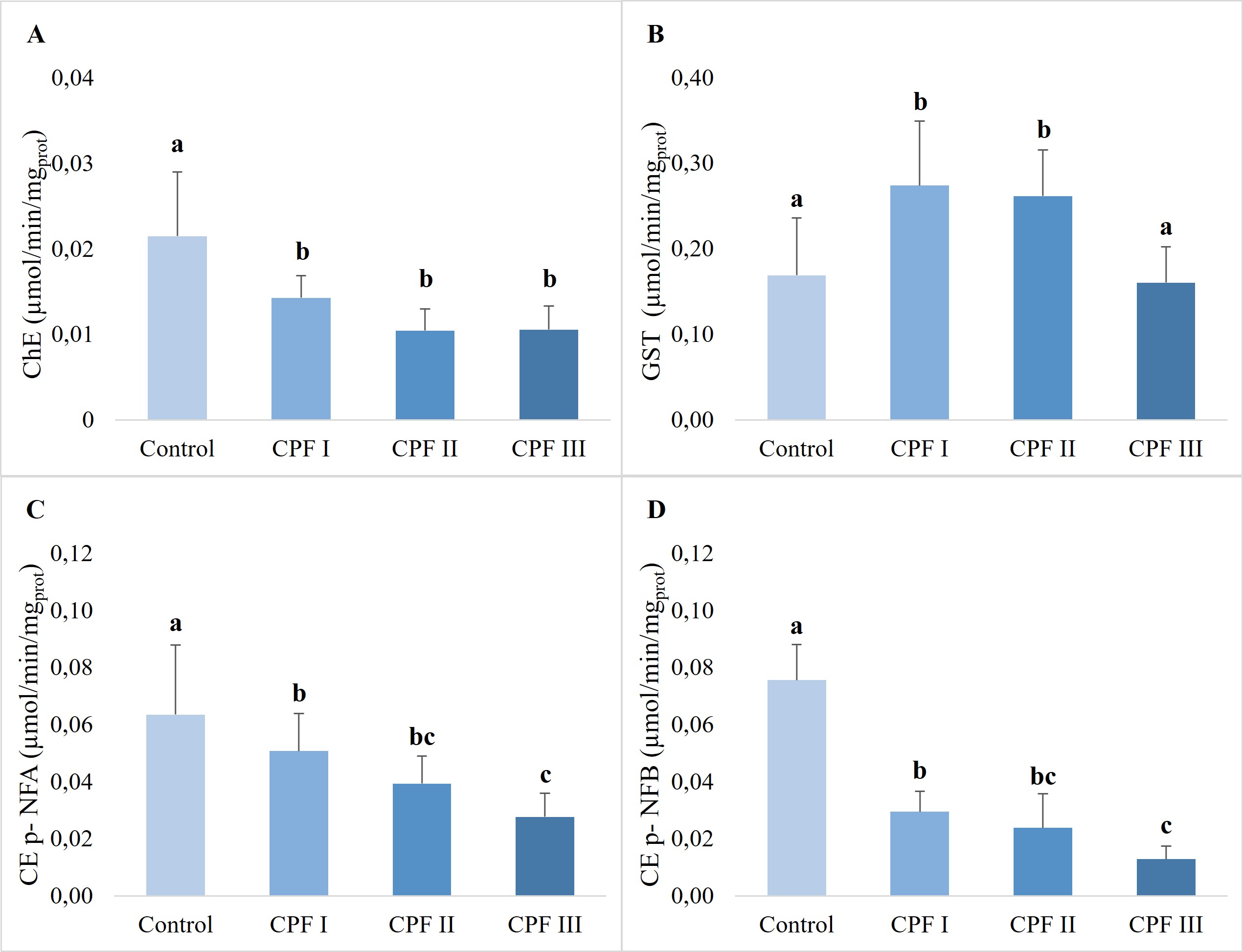
Figura 1: Actividades enzimáticas relativas al contenido proteico total (promedio ± DE) en Biomphalaria straminea luego de 48 h de exposición al control de solvente y a 0,01 mg/L, 0,1 mg/L y 1 mg/L de clorpirifos (CPF I, CPF II y CPF III). A) Actividad de colinesterasas (ChE), B) Actividad de glutatión S-transferasa (GST), C) Actividad de carboxilesterasa (CE) usando p-nitrofenilacetato (p-NFA) como sustrato, D) Actividad de carboxilesterasa (CE) usando p-nitrofenilbutirato (p-NFB). Las letras distintas indican diferencias estadísticamente significativas entre tratamientos (p < 0,05).
El carbaril no causó alteraciones en las actividades enzimáticas de ChEs, GST ni CEs (p > 0,05) como puede observarse en la Fig 2.
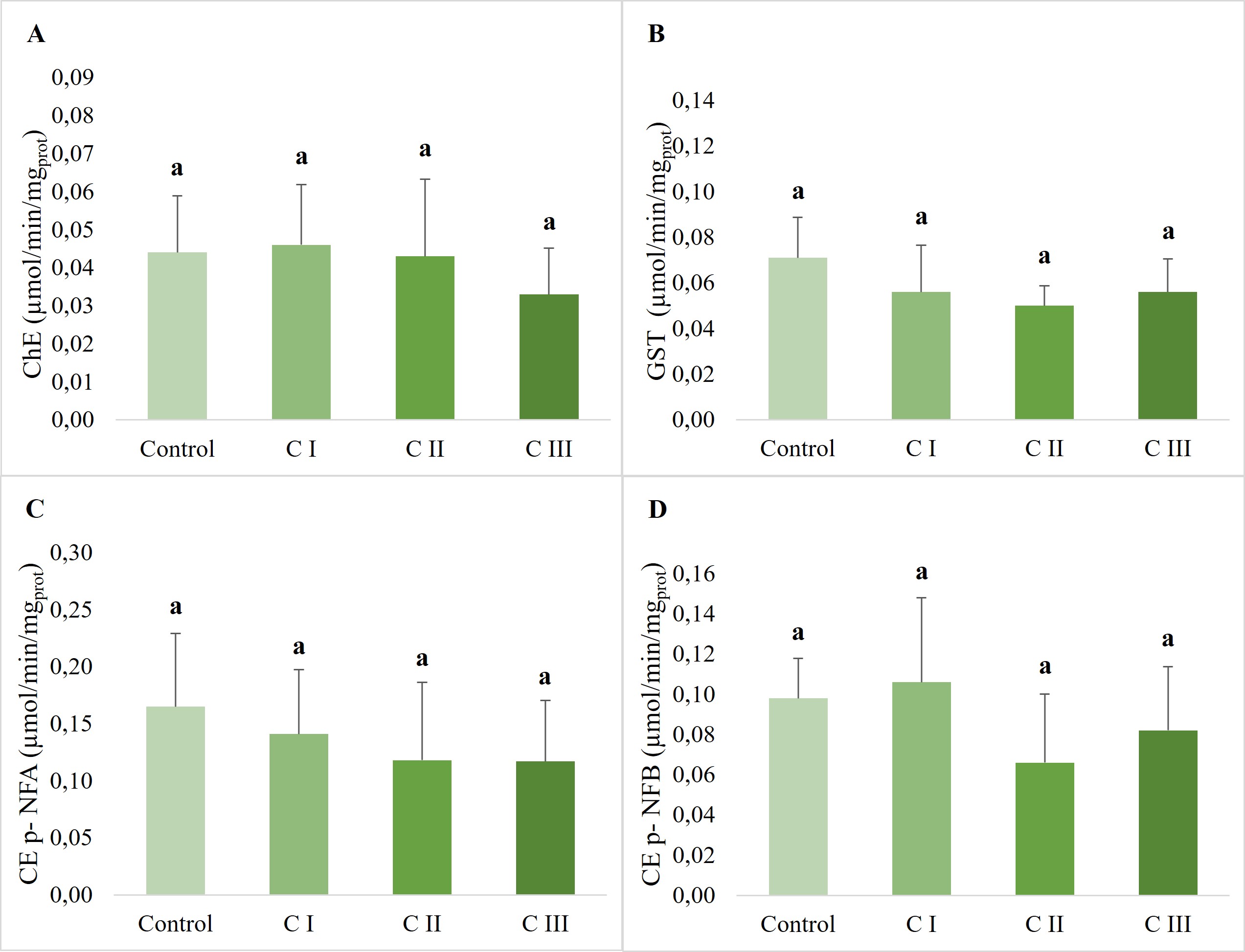
Figura 2: Actividades enzimáticas relativas al contenido proteico total (promedio ± DE) en Biomphalaria straminea luego de 48 h de exposición al solvente y a 0,01 mg/L, 0,1 mg/L y 1 mg/L de carbaril (C I, C II y C III). A) Actividad de colinesterasas (ChE), B) Actividad de glutatión S-transferasa (GST), C) Actividad de carboxilesterasa (CE) usando p-nitrofenilacetato (p-NFA) como sustrato, D) Actividad de carboxilesterasa (CE) usando p-nitrofenilbutirato (p-NFB) como sustrato. Las mismas letras indican que no hubo diferencias estadísticamente significativas entre tratamientos (p > 0,05).
Discusión
El clorpirifos y el carbaril comparten el blanco molecular primario y el mecanismo de acción, sin embargo, los efectos que producen varían entre sí en B. straminea, siendo más tóxico el clorpirifos.
B. straminea es considerada una especie resistente debido a que tolera distintas condiciones ambientales [26], sin embargo, en condiciones de laboratorio el CPF causó letalidad aguda como fue previamente reportado [27], pero a concentraciones mayores a las determinadas en el ambiente, donde se detectaron concentraciones cercanas a 10 µg/L en Argentina [28]. Además, un alto % de los caracoles expuestos a las 2 concentraciones más altas mostraron un comportamiento de huida al plaguicida. Otros autores reportaron un comportamiento de escape de las soluciones tóxicas en organismos acuáticos, como por ejemplo, en el pez Poecilia reticulata expuesto al antiinflamatorio diclofenac [29] y en B. straminea expuesto a un molusquicida [6].
El clorpirifos además inhibió la actividad de ChE. Sin embargo, la respuesta no fue dependiente de la concentración. La actividad de CEs (con p-NFB) también disminuyó con las 3 concentraciones en un mayor porcentaje que ChE. Las CEs estarían actuando como un blanco alternativo de unión disminuyendo la inhibición de AChE y por lo tanto protegiendo a los organismos de la neurotoxicidad. Sin embargo, la disminución de la actividad de CEs podría estar afectando los mecanismos de detoxificación por esta vía.
Por otro lado, la actividad de GST aumentó luego de la exposición a las dos concentraciones más bajas de clorpirifos, por lo cual podría estar implicada en la detoxificación del plaguicida vía GSH. Cabe destacar que, a la concentración más alta, no se observó un aumento de GST, hubo mayor inhibición de CEs, lo cual indica que los caracoles tienen menor capacidad de detoxificación, lo cual podría contribuir a la letalidad observada en los caracoles expuestos a esta concentración.
En esta especie, la exposición aguda al carbaril no mostró efectos tóxicos significativos, contrariamente a lo observado en otros caracoles, como Biomphalaria glabrata y Chilina gibbosa [16, 22]. Sin embargo, no se puede descartar que el carbaril cause efectos negativos sobre otros parámetros bioquímicos o a otro nivel de organización, lo cual será evaluado en futuras investigaciones. Coincidiendo con nuestros resultados el carbaril resultó menos tóxico que el clorpirifos en C. gibbosa [22].
Los resultados indican que la toxicidad de los insecticidas anticolinesterásicos depende del tipo de compuesto y de la especie. Como reportaron otros autores no sólo intervienen los procesos toxicocinéticos y toxicodinámicos, sino que también las características fisiológicas y ecológicas de cada especie contribuyen a la sensibilidad a la contaminación por plaguicidas [13, 30].
Resaltamos la necesidad de incluir distintas especies y distintos plaguicidas en las evaluaciones de toxicidad con el fin de mejorar los análisis de riesgo, aumentar el conocimiento de los mecanismos de toxicidad y de resistencia, y con el fin último de disminuir los efectos perjudiciales del uso de plaguicidas sobre la salud humana y ambiental.
Agradecimientos
Agradecemos al Departamento de Química Biológica, FCEN, UBA y al IQUIBICEN por facilitarnos el uso de equipos departamentales, a la Agencia Nacional de Promoción Científica y Tecnológica y a la UBA por los subsidios otorgados y al CONICET por financiar las becas doctorales de M. G. Paredes, K. A. Bianco y A. D. Vojnov.
Referencias:
1. Casarett & Doull’s. (2019) Toxicology: The Basic Science of Poisons, 9th edition. (Curtis D. Klaassen, Ed). McGraw-Hill Education, New York, USA.
2. Caixeta MB, Araújo PS, Pereira AC, Tallarico L de F, and Rocha TL. (2022) Biomphalaria embryotoxicity test (BET): 60 years of research crossing boundaries for developing standard protocols. Science of the Total Environment 833: 155211 DOI: 10.1016/j.scitotenv.2022.155211.
3. Cossi PF, Herbert LT, Yusseppone MS, Pérez AF, and Kristoff G. (2018) Environmental concentrations of azinphos-methyl cause different toxic effects without affecting the main target (cholinesterases) in the freshwater gastropod Biomphalaria straminea. Ecotoxicology and Environmental Safety 162: 287–295 DOI: 10.1016/j.ecoenv.2018.06.091.
4. Coustau C, Gourbal B, Duval D, Yoshino TP, Adema CM, and Mitta G. (2015) Advances in gastropod immunity from the study of the interaction between the snail Biomphalaria glabrata and its parasites: A review of research progress over the last decade. Fish & Shellfish Immunology 46: 5–16 DOI: 10.1016/j.fsi.2015.01.036.
5. Martins D de L, do Amaral e Silva NA, Ferreira VF, Rangel L da S, dos Santos JAA, and Faria RX. (2022) Molluskicidal activity of 3-aryl-2-hydroxy-1,4-naphthoquinones against Biomphalaria glabrata. Acta Tropica 231: 106414 DOI: 10.1016/j.actatropica.2022.106414.
6. Sarquis O, Pieri OS, and dos Santos JAA (1997) Effects of Bayluscide WP 70® on the Survival and Water-leaving Behaviour of Biomphalaria straminea, Snail Host of Schistosomiasis in Northeast Brazil. Memórias do Instituto Oswaldo Cruz 92: 619–623 DOI: 10.1590/S0074-02761997000500011.
7. Kristoff G, Chiny Barrionuevo D, Cacciatore LC, Verrengia Guerrero NR, and Cochón AC. (2012) In vivo studies on inhibition and recovery of B-esterase activities in Biomphalaria glabrata exposed to azinphos-methyl: Analysis of enzyme, substrate and tissue dependence. Aquatic Toxicology 112–113: 19–26 DOI: 10.1016/j.aquatox.2012.01.016.
8. Ibrahim AM, Ahmed AK, Bakry FA, and Abdel-Ghaffar F. (2018) Hematological, physiological and genotoxicological effects of Match 5% EC insecticide on Biomphalaria alexandrina snails. Ecotoxicology and Environmental Safety 147: 1017–1022 DOI: 10.1016/j.ecoenv.2017.09.059.
9. Rumi A, E. Gutiérrez Gregoric D, Núñez V, and A. Darrigran G. (2006) Malacología Latinoamericana: Moluscos de agua dulce de Argentina. Revista de Biología Tropical 56 DOI: 10.15517/rbt.v56i1.5510.
10. Habib MR, Lv S, Guo Y-H, Gu W-B, Standley CJ, Caldeira RL, et al. (2018) Morphological and molecular characterization of invasive Biomphalaria straminea in southern China. Infectious Diseases of Poverty 7: 120 DOI: 10.1186/s40249-018-0505-5.
11. Secretaría de Ambiente y Desarrollo Sustentable. (2017) Informe del estado del ambiente. Presidencia de la Nación. https://www.argentina.gob.ar/sites/default/files/completo-compressed.pdf Accedido el 30 de enero de 2025.
12. Bianco K, Otero S, Balazote Oliver A, Nahabedian D, and Kristoff G. (2014) Resistance in cholinesterase activity after an acute and subchronic exposure to azinphos-methyl in the freshwater gastropod Biomphalaria straminea. Ecotoxicology and Environmental Safety 109: 85–92 DOI: 10.1016/j.ecoenv.2014.07.038.
13. Kristoff G, Guerrero NV, de D’Angelo AMP, and Cochón AC. (2006) Inhibition of cholinesterase activity by azinphos-methyl in two freshwater invertebrates: Biomphalaria glabrata and Lumbriculus variegatus. Toxicology 222: 185–194 DOI: 10.1016/j.tox.2006.02.018.
14. Agrelo M, Rivadeneira PR, Cossi PF, Cacciatore LC, and Kristoff G. (2019) Azinphos-methyl causes in Planorbarius corneus toxic effects on reproduction, offspring survival and B-esterases depending on the exposure time. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology 217: 114–121 DOI: 10.1016/j.cbpc.2018.12.002.
15. Bianco K, Yusseppone MS, Otero S, Luquet C, Ríos de Molina M del C, and Kristoff G. (2013) Cholinesterases and neurotoxicity as highly sensitive biomarkers for an organophosphate insecticide in a freshwater gastropod (Chilina gibbosa) with low sensitivity carboxylesterases. Aquatic Toxicology 144–145: 26–35 DOI: 10.1016/j.aquatox.2013.09.025.
16. Kristoff G, Verrengia Guerrero NR, and Cochón AC. (2010) Inhibition of cholinesterases and carboxylesterases of two invertebrate species, Biomphalaria glabrata and Lumbriculus variegatus, by the carbamate pesticide carbaryl. Aquatic Toxicology 96: 115–123 DOI: 10.1016/j.aquatox.2009.10.001.
17. Stephensen E, Sturve J, and Förlin L. (2002) Effects of redox cycling compounds on glutathione content and activity of glutathione-related enzymes in rainbow trout liver. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology 133: 435–442 DOI: 10.1016/S1532-0456(02)00129-1.
18. Cui F, Li M-X, Chang H-J, Mao Y, Zhang H-Y, Lu L-X, et al. (2015) Carboxylesterase-mediated insecticide resistance: Quantitative increase induces broader metabolic resistance than qualitative change. Pesticide Biochemistry and Physiology 121: 88–96 DOI: 10.1016/j.pestbp.2014.12.016.
19. Pavlidi N, Vontas J, and Van Leeuwen T. (2018) The role of glutathione S-transferases (GSTs) in insecticide resistance in crop pests and disease vectors. Current Opinion in Insect Science 27: 97–102 DOI: 10.1016/j.cois.2018.04.007.
20. Otero S, and Kristoff G. (2016) In vitro and in vivo studies of cholinesterases and carboxylesterases in Planorbarius corneus exposed to a phosphorodithioate insecticide: Finding the most sensitive combination of enzymes, substrates, tissues and recovery capacity. Aquatic Toxicology 180: 186–195 DOI: 10.1016/j.aquatox.2016.10.002.
21. Wheelock CE, Phillips BM, Anderson BS, Miller JL, Miller MJ, and Hammock BD. (2008) Applications of Carboxylesterase Activity in Environmental Monitoring and Toxicity Identification Evaluations (TIEs). In: Whitacre, D.M. (Eds) Reviews of Environmental Contamination and Toxicology. Reviews of Environmental Contamination and Toxicology, vol 195. Springer, New York, NY.
22. Herbert LT, Cossi PF, Painefilú JC, Mengoni Goñalons C, Luquet CM, and Kristoff G. (2021) Acute neurotoxicity evaluation of two anticholinesterasic insecticides, independently and in mixtures, and a neonicotinoid on a freshwater gastropod. Chemosphere 265: 129107 DOI: 10.1016/j.chemosphere.2020.129107.
23. Lowry OliverH, Rosebrough NiraJ, Farr AL, and Randall Rose J. (1951) Protein measurement with the folin phenol reagent. Journal of Biological Chemistry 193: 265–275 DOI: 10.1016/S0021-9258(19)52451-6.
24. Ellman GL, Courtney KD, Andres V, and Featherstone RM. (1961) A new and rapid colorimetric determination of acetylcholinesterase activity. Biochemical Pharmacology 7: 88–95 DOI: 10.1016/0006-2952(61)90145-9.
25. Habig WH, Pabst MJ, and Jakoby WB. (1974) Glutathione S-Transferases. Journal of Biological Chemistry 249: 7130–7139 DOI: 10.1016/S0021-9258(19)42083-8.
26. Yipp MW. (1983) The ecology of Biomphalaria straminea (Dunker, 1848 (Gastropoda : pulmonata introduced into Hong Kong. (Ph.D. thesis). University of Hong Kong, Pokfulam, Hong Kong.
27. Bianco KA, Martini CN, Tejedor MJ, Paredes MG, and Kristoff G. (2024) Multi-biomarker approach to evaluate the toxicity of chlorpyrifos (active ingredient and a commercial formulation) on different stages of Biomphalaria straminea. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology 281: 109923 DOI: 10.1016/j.cbpc.2024.109923.
28. Marino D, and Ronco A. (2005) Cypermethrin and Chlorpyrifos Concentration Levels in Surface Water Bodies of the Pampa Ondulada, Argentina. Bulletin of Environmental Contamination and Toxicology 75: 820–826 DOI: 10.1007/s00128-005-0824-7.
29. Colombo E. (2024) Efectos del diclofenac sobre la reproducción y el desarrollo de crustáceos y peces. Tesis de Licenciatura en Ciencias Biológicas, Facultad de Ciencias Exactas y Naturales, Universidad de Buenos Aires, Argentina.
30. Velki M, and Hackenberger BK. (2012) Species-specific differences in biomarker responses in two ecologically different earthworms exposed to the insecticide dimethoate. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology 156: 104–112 DOI: 10.1016/j.cbpc.2012.05.001.
|
Revista QuímicaViva Número 1, año 24, Abril 2025 quimicaviva@qb.fcen.uba.ar |