miRNAs: Reguladores de la función ovárica y potencial uso como biomarcadores
Elizabeth Soczewski1, Lourdes Materazzi1, Ana Schafir1, Daniel Paparini1, Antonio Cattaneo2, Agostina Occhiuzzi2, Marcela Irigoyen2, Soledad Gori1, Rosanna Ramhorst1, Esteban Grasso1
1 Laboratorio de Inmunofarmacología, Departamento de Química Biológica. Facultad de Ciencias Exactas y Naturales, Universidad de Buenos Aires, Cdad Autónoma de Buenos Aires, Argentina.
2 Fertilis Medicina Reproductiva, Buenos Aires, Argentina.
Recibido: 08/11/2024 - Aceptado: 04/12/2024
Resumen
Los microARNs (miRNAs) son moléculas de ARN pequeñas no codificantes, cruciales para procesos celulares y el mantenimiento de la homeostasis. Su desregulación se encuentra asociada a una gran variedad de patologías en todo el organismo. En el ovario, los miRNAs desempeñan un papel fundamental en la foliculogénesis, ovulación y comunicación intercelular. En este sentido, se ha observado que su expresión varía con la edad y la calidad ovocitaria, así como en patologías ováricas tales como el síndrome de ovario poliquístico y la falla ovárica prematura. Su detección en fluidos foliculares los posiciona como biomarcadores prometedores para el diagnóstico clínico, destacándose por su estabilidad y fácil detección. En esta actualización, discutiremos el rol de los miRNAs en el ovario y su potencial uso en la clínica.
Palabras clave: miRNAs, Ovario, Fluido foliculares
Summary
MicroRNAs (miRNAs) are small non-coding RNA molecules that are crucial for cellular processes and homeostasis maintenance. Their dysregulation is associated with a wide range of pathologies throughout the body. In the ovary, miRNAs play a fundamental role in folliculogenesis, ovulation, and intercellular communication. In this sense, their expression has been shown to vary with age and oocyte quality, as well as in ovarian pathologies such as polycystic ovary syndrome and premature ovarian failure. Their detection in follicular fluids positions them as promising biomarkers for clinical diagnosis, standing out for their stability and ease of detection. In this review, we will discuss the role of miRNAs in the ovary and their potential clinical applications.
Keywords: miRNAs, Ovary, Follicular fluids
miRNAs: biosíntesis y función
Los miRNAs o microRNAs son pequeñas moléculas de ARN no codificante, simple cadena y de aproximadamente 22 nucleótidos que afectan la traducción de los ARNm. Reconocen por complementariedad de secuencia a sus ARN mensajeros blancos o target y mediante diferentes mecanismos pueden regular su estabilidad afectando de este modo la expresión de los genes a los que codifican.
Están involucrados en prácticamente todos los procesos celulares y son esenciales para el desarrollo, diferenciación y homeostasis al punto que se ha demostrado que deleciones en las enzimas encargadas de la biogénesis de los miRNAs, resultan letales en los embriones de ratón [1, 2]. Dada esta multiplicidad de procesos, la desregulación en la biogénesis de los miRNAs está generalmente asociada a diversas enfermedades como cáncer, hepatitis, trastornos del desarrollo, neurodegenerativas y metabólicas [3–7]. Esto ha llevado a que algunos miRNAs se utilicen como biomarcadores que permiten establecer el diagnóstico y el pronóstico de la enfermedad [8, 9]. Además, se han desarrollado tratamientos contra diferentes enfermedades basados en la sobreexpresión de los miRNAS con moléculas sintéticas que mimetizan su función (en inglés mimics) o bien bloqueando su actividad con antagomiRs (en inglés antagonist) [10].
El mecanismo a través del cual los miRNAs silencian sus ARNm target ha sido estudiado durante las últimas décadas. En humanos, los genes que codifican para los miRNAs se encuentran distribuidos a lo largo de todo el genoma. Pueden encontrarse en clusters que producen transcriptos policistrónicos, en regiones intergénicas, y también dentro de intrones o exones [11]. La biogénesis de los miRNAs es un proceso de múltiples pasos que se encuentra altamente regulado [12]. El procesamiento de los miRNAs involucra a la proteína Drosha de ARNasa III, sintetizada en el núcleo, la cual procesa un miRNA primario largo y lo transporta para formar un miRNA pequeño en forma de horquilla, denominado pre-miRNA. Luego, el pre-miRNA es translocado por la proteína exportina 5 (XPO5) desde el complejo de poro nuclear al citoplasma, donde es escindido por Dicer, en un pequeño dúplex de ARN. Posteriormente, la hebra con un extremo relativamente inestable en el extremo 5’ del dúplex se elige como la hebra guía que se unirá a la familia de proteínas Argonauta (AGO) para formar un complejo efector denominado complejo silenciador inducido por ARN (RISC) [13–15]. El complejo RISC se unirá a la región 3’ UTR del ARNm target, llevando así a su silenciamiento (figura 1).
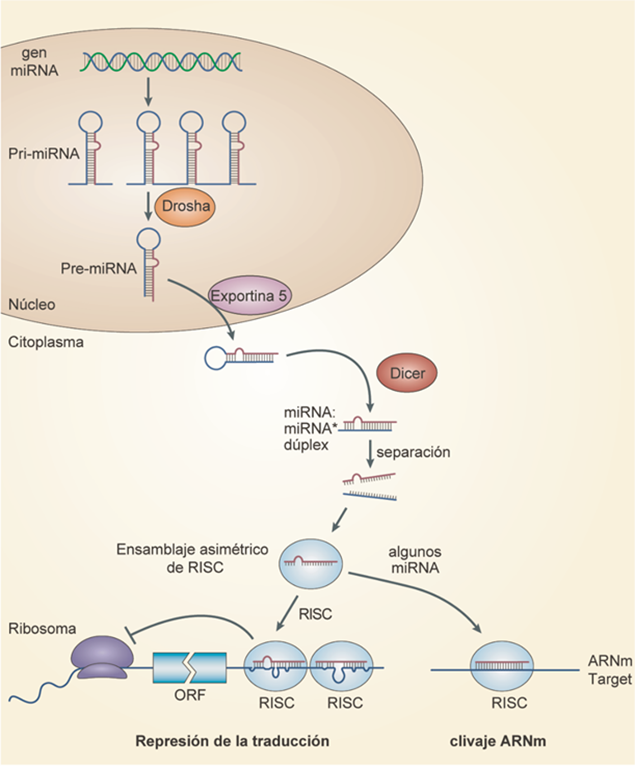
Figura 1: Biogénesis de los miRNAs y mecanismo de acción. Los miRNAs son transcriptos como un miRNA primario, el cual es clivado por Drosha en pre-miRNAs diferentes que son exportados al citoplásma. Allíse terminan de procesar, se unen al complejo RISC y luego, por complementariedad, reconocen a sus ARNm target. Según el grado de complementariedad, se reprime la traducción o se cliva el ARNm. Adaptado de [12].
El apareamiento puede ser perfecto o imperfecto y de eso dependerá si el ARNm target será clivado o si se bloqueará su traducción. Cuando el miRNA es totalmente complementario al sitio de unión del ARNm, este último será degradado al unirse una proteína AGO catalítica, aunque también se ha reportado que este apareamiento perfecto acelera desacople de AGO y el miRNA. [16]. En el caso de que las secuencias no sean perfectamente complementarias, el bloqueo de la traducción puede ocurrir en cualquier de sus etapas: iniciación, elongación o terminación [17] (figura 2).
El sitio de unión de los miRNAs al ARNm target se ubica generalmente en el extremo 3′ UTR del mensajero. En esta región suele encontrarse una fuerte complementariedad con la región semilla [19], la cual es una secuencia fundamental para el reconocimiento del ARNm, que se extiende desde la posición 2 a 7 del extremo 5' del miRNA y es el criterio principal que se utiliza para la predicción de ARNm targets [20–22]. Esta caracterización continúa siendo un desafío debido a que cada miRNA puede tener múltiples targets y viceversa, por esta razón, la forma de resolver este problema es a través de la predicción computacional de dichas interacciones y posterior validación experimental [23].
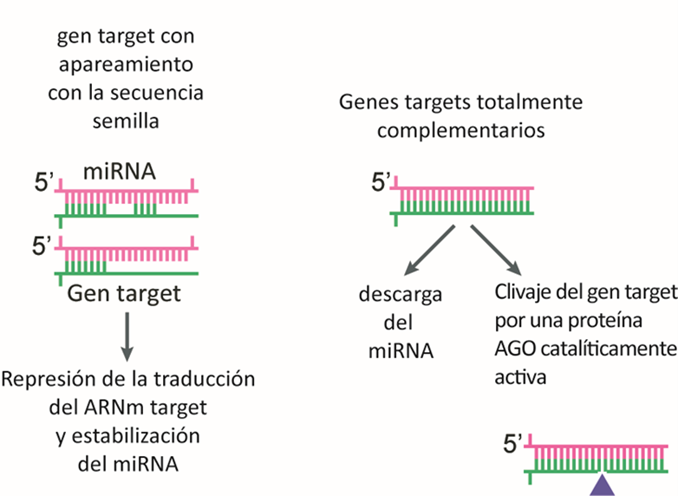
Figura 2: Mecanismos de regulación mediado por miRNAs. El ARNm target puede ser degradado o inhibida su traducción dependiendo el apareamiento con la secuencia semilla del miRNA. Adaptado de [18].
Además de su rol intracelular, los miRNAs pueden ser secretados y hallados en los fluidos corporales tales como en el suero, plasma, saliva y orina. Los miRNAs circulantes o extracelulares son estables y están protegidos contra la degradación de las RNasas. En respuesta a una variedad de estímulos, pueden ser empaquetados y liberados dentro de vesículas extracelulares (EV) pequeñas (sEV; 30–100 nm) y microvesículas (MV; 100 nm–1 µm), permitiendo ser absorbidos por otras células y provocar cambios en la expresión génica celular tanto en condiciones patológicas como fisiológicas [24]. Esto muestra que los miRNAs extracelulares pueden tener funciones biológicas similares a otras moléculas de señalización como las hormonas (figura 3).
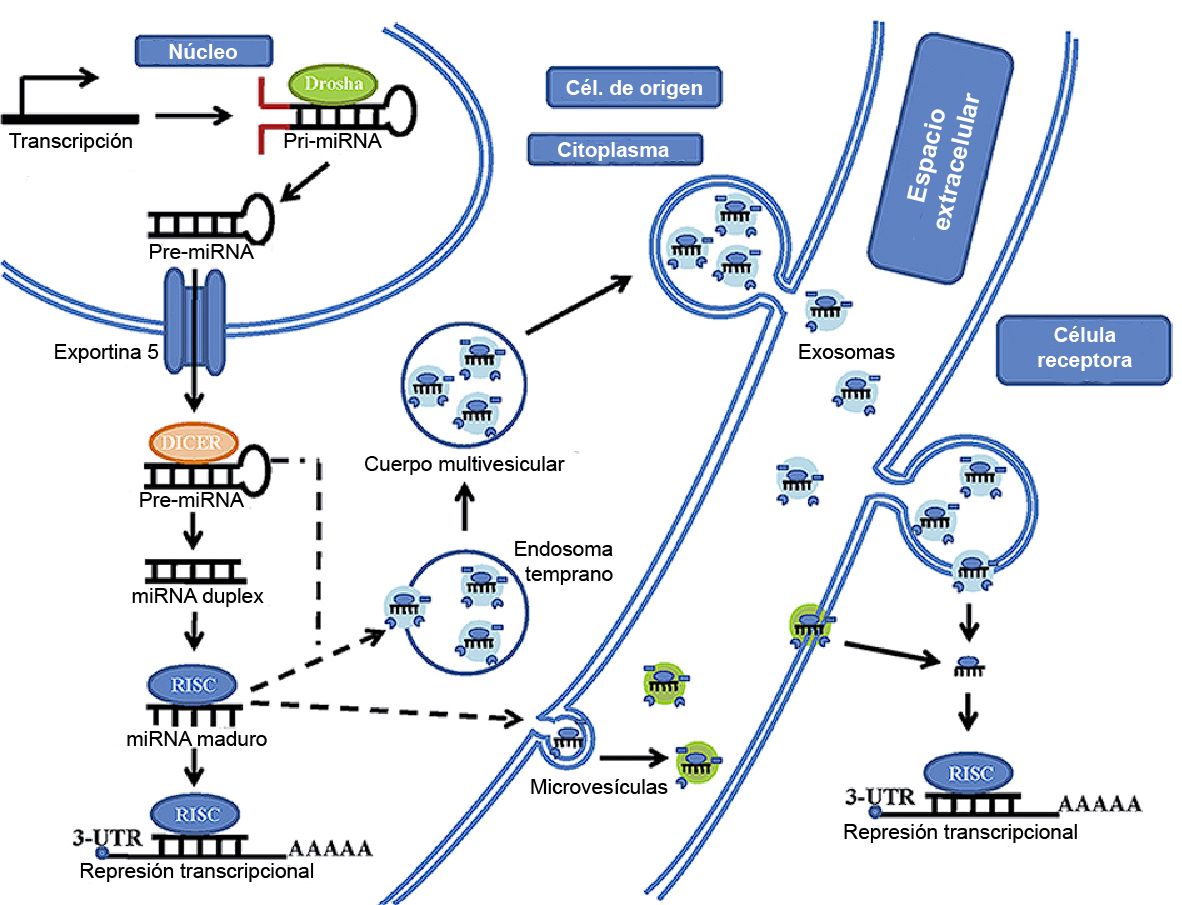
Figura 3: Empaquetamiento de miRNAs. Además de su rol intracelular, los miRNAs pueden ser empaquetados en microvesiculas y exosomas, los cuales pueden ser incorporados por células blanco y actuar de forma paracrina. Adaptado de [25]
Rol de los miRNAs en el ovario
El ovario desempeña una función vital en el sistema reproductivo femenino, siendo su tarea principal la generación, almacenamiento, desarrollo y liberación de los oocitos. Estos oocitos inician su formación durante la vida fetal y, eventualmente, actúan como gametas competentes, listas para la fecundación y el subsiguiente desarrollo embrionario. Además, el ovario actúa como el principal productor de hormonas femeninas, creando un entorno propicio para la implantación y desarrollo del cigoto.
La reactivación, selección, crecimiento de los folículos, atresia y ovulación son parte del proceso denominado foliculogénesis, y están bajo el control de factores endocrinos y paracrinos. La correcta realización de estos procesos depende de la expresión coordinada de genes de manera espacial y temporalmente específica [26]. En consecuencia, la expresión de genes está altamente regulada y controlada tanto a nivel transcripcional como traduccional.
En este sentido, los miRNAs juegan un papel importante en la regulación del desarrollo folicular. La mayoría de los folículos primordiales permanecen en estado de reposo, mientras que un pequeño número se activa y recluta en el grupo en crecimiento. De estos folículos en crecimiento, solo uno será seleccionado como el folículo dominante mientras que el resto degeneran y se vuelven atrésicos. Se han identificado familias y clusters específicos de miRNAs involucrados en el desarrollo del folículo dominante como por ejemplo miR-21, familia de let 7 y el cluster miR-17-92 (figura 4) [27–29]. Asimismo, junto a otros factores y hormonas, los miRNAs parecen desempeñar un papel crucial durante el proceso de atresia [28]. Algunos de los miRNAs más caracterizados incluyen la familia let-7, miR-22 y los clusters miR-23-27-24, miR-183-96-182 y miR-17-92c [30]. En un estudio in vitro, se identificó que la sobreexpresión de miR-23 y miR-27 en células de la granulosa humana promueve la apoptosis vía FAS-FASL, tras la regulación de su gen target SMAD5 [31].
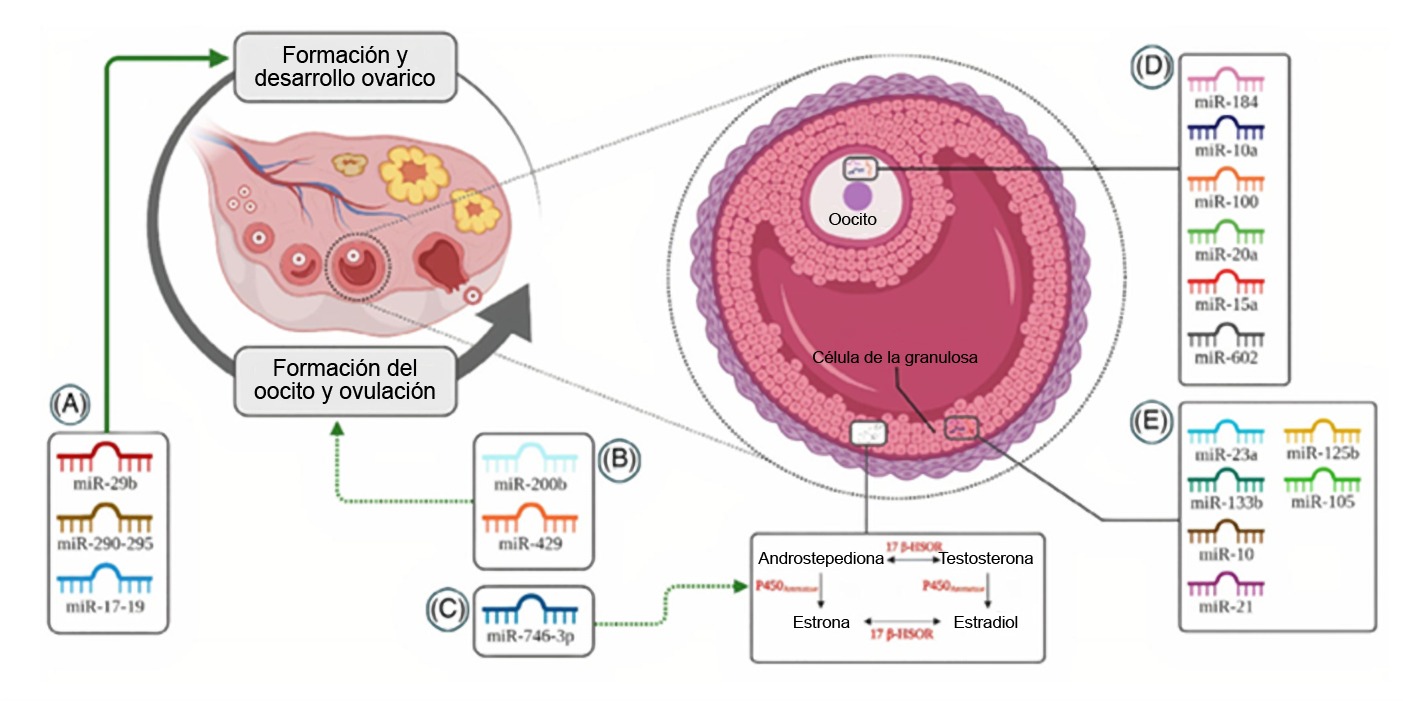
Figura 4: miRNAs claves en la modulación de la función del ovario. (A) implicados en la formación y desarrollo de los ovarios. (B) reguladores de la ovulación (C) de la síntesis de 17 β-estradiol (D) presentes en el ovocito (E) y en las células de la granulosa. Adaptado de [29]
miRNAs en patologías reproductivas
Múltiples reportes han asociado alteraciones en la expresión de miRNAs con patologías reproductivas, tanto a nivel del ovario como del endometrio [32–34]. Un caso extremo, aunque en modelos murinos, es el de ratones deficientes en la enzima Dicer, la cual impacta negativamente en la expresión de todos los miRNAs. Estos ratones resultan ser infértiles debido a alteraciones en el desarrollo del oviducto y del útero [35].
Una de las desregulaciones de los miRNAs más estudiadas a nivel ovárico son aquellas que pueden afectar su función, llevando al síndrome de ovario poliquístico (SOP). En particular, el miR-21 ha sido ampliamente estudiado en el SOP y puede utilizarse como biomarcador, dado que se observó su expresión en células de la granulosa y en el fluido folicular de pacientes con SOP y también un aumento de su expresión en el suero [36, 37].
Otros trabajos también han relacionado a los miRNAs en el desarrollo de la endometriosis y su uso como posible blanco terapéutico [38]. Sobre este último punto, Liang et al. demostraron que el miR-200c podría utilizarse para inhibir el crecimiento de lesiones ectópicas de endometriosis al dirigirse al lncRNA MALAT1, un transcripto no codificante asociado a la proliferación y metástasis tumoral [39].
De la misma manera, a nivel del endometrio, se ha asociado la expresión de ciertos miRNAs a las distintas fases del ciclo menstrual y en particular a la receptividad del mismo [40]. Más aún, al comparar biopsias endometriales de mujeres sanas contra mujeres con fallas recurrentes de implantación, se encontraron alteraciones en múltiples miRNAs que tienen como blancos a genes esenciales para la correcta diferenciación del endometrio a un estado receptivo, entre ellos, genes asociados a uniones adherentes, adhesión celular, la vía de p53, la señalización por Wnt y el ciclo celular [41–43].
Además de patologías asociadas a la fertilidad, y al igual que se ha ocurrido en otros contextos, diversos estudios revelaron cambios transcripcionales en pacientes con cáncer de ovario, identificando a múltiples miRNAs alterados [44]. Un caso interesante es el de miR-16 y miR-126-3p, los cuales se encuentran disminuidos en estados avanzados de este tipo de cáncer comparado con el tejido adyacente sano [45–47]. En experimentos in vitro, la sobreexpresión de estos miRNAs llevan a un arresto del ciclo celular, indicando así su rol en la proliferación en invasión de las células malignas [45, 47].
miRNAs como biomarcadores
Como mencionamos anteriormente, los miRNAs pueden ser secretados a fluidos y permanecer estables en los mismos. Su característica única de permanecer en gran medida intactos en muestras clínicas destaca su potencial en la fenotipificación molecular, a la vez que permite utilizarlos como biomarcadores para el diagnóstico clínico y el pronóstico de enfermedades, complementando los marcadores convencionales existentes, como metabolitos, antígenos y ARN mensajeros. Los miRNAs presentes en suero/plasma ofrecen grandes ventajas como biomarcadores diagnósticos ya que el método de detección es mínimamente invasivo al a vez que proporcionan pruebas sensibles y específicas.
Actualmente se propone su uso como biomarcadores para una gran variedad de patologías, tales como cáncer, hipertensión, enfermedades neurodegenerativas, autoinmunidades, asma y complicaciones del embarazo, entre otras [48–53]. A continuación, nos enfocaremos en los asociados a la función ovárica.
Además de los fluidos corporales ya mencionados, los miRNAs extracelulares se pueden detectar en el fluido folicular, lo cual nos permite asociar su expresión a condiciones fisiológicas y de patologías reproductivas, demostrando su potencial como biomarcadores de patologías ováricas [54]. Si bien el acceso a los fluidos foliculares implica una dificultad agregada con respecto a muestras sanguíneas, la obtención de los mismos es rutinaria en los centros de fertilidad, dado que forma parte de la obtención de oocitos y es un material que normalmente se descarta.
El fluido folicular se origina tanto de los constituyentes del plasma sanguíneo como de las secreciones de las células de la granulosa y la teca, y su contenido afecta el desarrollo del ovocito [55]. Se ha reportado que los miRNAs encapsulados en vesículas extracelulares del fluido folicular son similares a los presentes en las células de la granulosa y en las células del cúmulus, por lo tanto, su patrón de expresión podría convertirse en una herramienta fundamental para evaluar la función de diferentes componentes ováricos [56]. En este sentido, tanto los estudios in vitro como in vivo han revelado que estas vesículas podrían ser absorbidas por las células de la granulosa, lo que sugiere un rol en la comunicación intercelular [57].
En mujeres con reserva ovárica reducida o edad materna avanzada, tanto los metabolitos del fluido folicular, como la composición de proteínas, son diferentes en comparación con las mujeres con reserva ovárica normal [58]. En 2014, Diez-Fraile et al. demostraron que, en humanos, cuatro miRNAs presentes en fluidos foliculares, específicamente hsa-miR-21-5p, hsa-miR-134, hsa-miR-190b y hsa-miR-99b-3p, se expresaron diferencialmente entre mujeres jóvenes y mayores, sugiriendo una asociación con el envejecimiento ovárico [59, 60]. Los hallazgos confirman los resultados de estudios anteriores sobre el papel de la edad materna avanzada en la composición de los microentornos del fluido folicular y aportan más evidencia sobre el uso de los miRNAs extracelulares en el fluido folicular como posibles biomarcadores para evaluar la calidad ovocitaria. Más aún, distintos grupos de investigación reportaron el efecto de diferentes miRNAs sobre el funcionamiento y sobrevida de las células de la granulosa, encontrando miRNAs alterados en mujeres con falla ovárica prematura, tanto en etapas tempranas como con una manifestación completa [61, 62]. Entre otros, podemos destacar que la sobreexpresión de miR-133b inhibe la producción de estradiol por parte de las células de la granulosa, mientras que la de miR-3061-5p inhibe su proliferación, llevando en ambos casos a la falla ovárica prematura [63, 64].
De forma similar a la falla ovárica prematura, existen múltiples reportes que demuestran la asociación entre la sobreexpresión o déficit de miRNAs en fluidos foliculares y el SOP, a través de la alteración de niveles hormonales de AMH y FSH y favoreciendo un entorno inflamatorio, entre otros efectos reportados [65–67].
Conclusiones
Los miRNAs desempeñan un papel clave en todos los aspectos asociados a la reproducción. En el ovario, regulan diversos procesos biológicos, incluyendo la foliculogénesis, la ovulación y la producción de hormonas. Su asociación a patologías reproductivas, como el síndrome de ovario poliquístico y la falla ovárica prematura, resalta la relevancia de los miRNAs como moduladores de la homeostasis ovárica y como mediadores de alteraciones patológicas. Además, la identificación de perfiles específicos de miRNAs asociados a estas condiciones plantea una oportunidad prometedora para su uso como biomarcadores, no sólo de diagnóstico, sino también para la detección temprana de patologías ováricas. La investigación futura en este campo permitirá comprender mejor su función y aprovechar su potencial clínico en el manejo de trastornos reproductivos.
Referencias
1. Chong MMW, Zhang G, Cheloufi S, Neubert TA, Hannon GJ, and Littman DR. (2010) Canonical and alternate functions of the microRNA biogenesis machinery. Genes Dev. 24: 1951–1960 DOI: 10.1101/gad.1953310.
2. Bernstein E, Kim SY, Carmell MA, Murchison EP, Alcorn H, Li MZ, et al. (2003) Dicer is essential for mouse development. Nat. Genet. 35: 215–217 DOI: 10.1038/ng1253.
3. Esteller M. (2011) Non-coding RNAs in human disease. Nat. Rev. Genet. 12: 861–874 DOI: 10.1038/nrg3074.
4. Lin S, and Gregory RI. (2015) MicroRNA biogenesis pathways in cancer. Nat. Rev. Cancer 15: 321–333 DOI: 10.1038/nrc3932.
5. Bracken CP, Scott HS, and Goodall GJ. (2016) A network-biology perspective of microRNA function and dysfunction in cancer. Nat. Rev. Genet. 17: 719–732 DOI: 10.1038/nrg.2016.134.
6. Li S, Lei Z, and Sun T. (2023) The role of microRNAs in neurodegenerative diseases: a review. Cell Biol. Toxicol. 39: 53–83 DOI: 10.1007/s10565-022-09761-x.
7. Rottiers V, and Näär AM. (2012) MicroRNAs in metabolism and metabolic disorders. Nat. Rev. Mol. Cell Biol. 13: 239–250 DOI: 10.1038/nrm3313.
8. Schwarzenbach H, Nishida N, Calin GA, and Pantel K. (2014) Clinical relevance of circulating cell-free microRNAs in cancer. Nat. Rev. Clin. Oncol. 11: 145–156 DOI: 10.1038/nrclinonc.2014.5.
9. Wang Y, Goodison S, Li X, and Hu H. (2017) Prognostic cancer gene signatures share common regulatory motifs. Sci. Rep. 7: 4750 DOI: 10.1038/s41598-017-05035-3.
10. Rupaimoole R, and Slack FJ. (2017) MicroRNA therapeutics: towards a new era for the management of cancer and other diseases. Nat. Rev. Drug Discov. 16: 203–222 DOI: 10.1038/nrd.2016.246.
11. Ha M, and Kim VN. (2014) Regulation of microRNA biogenesis. Nat. Rev. Mol. Cell Biol. 15: 509–524 DOI: 10.1038/nrm3838.
12. He L, and Hannon GJ. (2004) MicroRNAs: small RNAs with a big role in gene regulation. Nat. Rev. Genet. 5: 522–531 DOI: 10.1038/nrg1379.
13. Schwarz DS, Hutvágner G, Du T, Xu Z, Aronin N, and Zamore PD. (2003) Asymmetry in the Assembly of the RNAi Enzyme Complex. Cell 115: 199–208 DOI: 10.1016/S0092-8674(03)00759-1.
14. Khvorova A, Reynolds A, and Jayasena SD. (2003) Functional siRNAs and miRNAs Exhibit Strand Bias. Cell 115: 209–216 DOI: 10.1016/S0092-8674(03)00801-8.
15. Suzuki HI, Katsura A, Yasuda T, Ueno T, Mano H, Sugimoto K, et al. (2015) Small-RNA asymmetry is directly driven by mammalian Argonautes. Nat. Struct. Mol. Biol. 22: 512–521 DOI: 10.1038/nsmb.3050.
16. De N, Young L, Lau PW, Meisner NC, Morrissey DV, and MacRae IJ (2013) Highly Complementary Target RNAs Promote Release of Guide RNAs from Human Argonaute2. Mol. Cell 50: 344–355 DOI: 10.1016/j.molcel.2013.04.001.
17. Huntzinger E, and Izaurralde E. (2011) Gene silencing by microRNAs: contributions of translational repression and mRNA decay. Nat. Rev. Genet. 12: 99–110 DOI: 10.1038/nrg2936.
18. Gebert LFR, and MacRae IJ. (2019) Regulation of microRNA function in animals. Nat. Rev. Mol. Cell Biol. 20: 21–37 DOI: 10.1038/s41580-018-0045-7.
19. Bartel DP. (2009) MicroRNAs: Target Recognition and Regulatory Functions. Cell 136: 215–233 DOI: 10.1016/j.cell.2009.01.002.
20. Betel D, Koppal A, Agius P, Sander C, and Leslie C. (2010) Comprehensive modeling of microRNA targets predicts functional non-conserved and non-canonical sites. Genome Biol. 11: R90 DOI: 10.1186/gb-2010-11-8-r90.
21. Agarwal V, Bell GW, Nam J-W, and Bartel DP. (2015) Predicting effective microRNA target sites in mammalian mRNAs. eLife 4 DOI: 10.7554/eLife.05005.
22. Wong N, and Wang X. (2015) miRDB: an online resource for microRNA target prediction and functional annotations. Nucleic Acids Res. 43: D146–D152 DOI: 10.1093/nar/gku1104.
23. Riffo-Campos Á, Riquelme I, and Brebi-Mieville P. (2016) Tools for Sequence-Based miRNA Target Prediction: What to Choose? Int. J. Mol. Sci. 17: 1987 DOI: 10.3390/ijms17121987.
24. Wang K, Zhang S, Weber J, Baxter D, and Galas DJ. (2010) Export of microRNAs and microRNA-protective protein by mammalian cells. Nucleic Acids Res. 38: 7248–7259 DOI: 10.1093/nar/gkq601.
25. Chen J, Hu C, and Pan P. (2017) Extracellular Vesicle MicroRNA Transfer in Lung Diseases. Front. Physiol. 8: 1028 DOI: 10.3389/fphys.2017.01028.
26. Chen Y, Wang S, and Zhang C. (2024) The Differentiation Fate of Granulosa Cells and the Regulatory Mechanism in Ovary. Reprod. Sci. DOI: 10.1007/s43032-024-01682-w.
27. Naji M, Aleyasin A, Nekoonam S, Arefian E, Mahdian R, and Amidi F. (2017) Differential Expression of miR-93 and miR-21 in Granulosa Cells and Follicular Fluid of Polycystic Ovary Syndrome Associating with Different Phenotypes. Sci. Rep. 7: 14671 DOI: 10.1038/s41598-017-13250-1.
28. Zhang J, Xu Y, Liu H, and Pan Z. (2019) MicroRNAs in ovarian follicular atresia and granulosa cell apoptosis. Reprod. Biol. Endocrinol. 17: 9 DOI: 10.1186/s12958-018-0450-y.
29. Bahmyari S, Jamali Z, Khatami SH, Vakili O, Roozitalab M, Savardashtaki A, et al. (2021)
30. Zhang J, Xu Y, Liu H, and Pan Z. (2019) MicroRNAs in ovarian follicular atresia and granulosa cell apoptosis. Reprod. Biol. Endocrinol. 17: 9 DOI: 10.1186/s12958-018-0450-y.
31. Nie M, Yu S, Peng S, Fang Y, Wang H, and Yang X. (2015) miR-23a and miR-27a Promote Human Granulosa Cell Apoptosis by Targeting SMAD51. Biol. Reprod. 93 DOI: 10.1095/biolreprod.115.130690.
32. Ahmadi M, Fathi M, Malmir A, and Ghafouri-Fard S. (2024) Role of circular RNA/miRNA axes in the pathophysiology of polycystic ovary syndrome. Mol. Biol. Rep. 51: 437 DOI: 10.1007/s11033-024-09376-x.
33. Bagheri M, Khansarinejad B, Mondanizadeh M, Azimi M, and Alavi S. (2024) MiRNAs related in signaling pathways of women’s reproductive diseases: an overview. Mol. Biol. Rep. 51: 414 DOI: 10.1007/s11033-024-09357-0.
34. Santamaria X, and Taylor H. (2014) MicroRNA and gynecological reproductive diseases. Fertil. Steril. 101: 1545–1551 DOI: 10.1016/j.fertnstert.2014.04.044.
35. Hong X, Luense LJ, McGinnis LK, Nothnick WB, and Christenson LK. (2008) Dicer1 Is Essential for Female Fertility and Normal Development of the Female Reproductive System. Endocrinology 149: 6207–6212 DOI: 10.1210/en.2008-0294.
36. Naji M, Nekoonam S, Aleyasin A, Arefian E, Mahdian R, Azizi E, et al. (2018) Expression of miR-15a, miR-145, and miR-182 in granulosa-lutein cells, follicular fluid, and serum of women with polycystic ovary syndrome (PCOS). Arch. Gynecol. Obstet. 297: 221–231 DOI: 10.1007/s00404-017-4570-y.
37. Abdalla M, Deshmukh H, Atkin SL, and Sathyapalan T. (2020) miRNAs as a novel clinical biomarker and therapeutic targets in polycystic ovary syndrome (PCOS): A review. Life Sci. 259: 118174 DOI: 10.1016/j.lfs.2020.118174.
38. Begum MIA, Chuan L, Hong S-T, and Chae H-S. (2023) The Pathological Role of miRNAs in Endometriosis. Biomedicines 11: 3087 DOI: 10.3390/biomedicines11113087.
39. Liang Z, Chen Y, Zhao Y, Xu C, Zhang A, Zhang Q, et al. (2017) miR-200c suppresses endometriosis by targeting MALAT1 in vitro and in vivo. Stem Cell Res. Ther. 8: 251 DOI: 10.1186/s13287-017-0706-z.
40. Shariati MBH, Niknafs B, Seghinsara AM, Shokrzadeh N, and Alivand MR. (2019) Administration of dexamethasone disrupts endometrial receptivity by alteration of expression of miRNA 223, 200a, LIF, Muc1, SGK1, and ENaC via the ERK1/2‐mTOR pathway. J. Cell. Physiol. 234: 19629–19639 DOI: 10.1002/jcp.28562.
41. Goharitaban S, Abedelahi A, Hamdi K, Khazaei M, Esmaeilivand M, and Niknafs B. (2022) Role of endometrial microRNAs in repeated implantation failure (mini-review). Front. Cell Dev. Biol. 10: 936173 DOI: 10.3389/fcell.2022.936173.
42. Shang J, Cheng Y-F, Li M, Wang H, Zhang J-N, Guo X-M, et al. (2022) Identification of Key Endometrial MicroRNAs and Their Target Genes Associated With Pathogenesis of Recurrent Implantation Failure by Integrated Bioinformatics Analysis. Front. Genet. 13: 919301 DOI: 10.3389/fgene.2022.919301.
43. Revel A, Achache H, Stevens J, Smith Y, and Reich R. (2011) MicroRNAs are associated with human embryo implantation defects. Hum. Reprod. Oxf. Engl. 26: 2830–2840 DOI: 10.1093/humrep/der255.
44. Zhao L, Liang X, Wang L, and Zhang X. (2022) The Role of miRNA in Ovarian Cancer: an Overview. Reprod. Sci. 29: 2760–2767 DOI: 10.1007/s43032-021-00717-w.
45. Li N, Yang L, Sun Y, and Wu X. (2019) MicroRNA‑16 inhibits migration and invasion via regulation of the Wnt/β‑catenin signaling pathway in ovarian cancer. Oncol. Lett. DOI: 10.3892/ol.2019.9923.
46. Ghafouri-Fard S, Khoshbakht T, Hussen BM, Abdullah ST, Taheri M, and Samadian M. (2022) A review on the role of mir-16-5p in the carcinogenesis. Cancer Cell Int. 22: 342 DOI: 10.1186/s12935-022-02754-0.
47. Xiang G, and Cheng Y. (2018) MiR-126-3p inhibits ovarian cancer proliferation and invasion via targeting PLXNB2. Reprod. Biol. 18: 218–224 DOI: 10.1016/j.repbio.2018.07.005.
48. Sulek A. (2024) Secretome – the role of extracellular vesicles in the pathogenesisand therapy of neurodegenerative diseases. Postępy Psychiatr. Neurol. 33: 147–162 DOI: 10.5114/ppn.2024.144686.
49. Kostiniuk D, Marttila S, and Raitoharju E. (2024) Circulatory miRNAs in essential hypertension. Atherosclerosis 119069 DOI: 10.1016/j.atherosclerosis.2024.119069.
50. Abebaw D, Akelew Y, Adugna A, Teffera ZH, Tegegne BA, Fenta A, et al. (2024) Extracellular vesicles: immunomodulation, diagnosis, and promising therapeutic roles for rheumatoid arthritis. Front. Immunol. 15: 1499929 DOI: 10.3389/fimmu.2024.1499929.
51. Zhu M, Gao Y, Zhu K, Yuan Y, Bai H, and Meng L. (2024) Exosomal miRNA as biomarker in cancer diagnosis and prognosis: A review. Medicine (Baltimore) 103: e40082 DOI: 10.1097/MD.0000000000040082.
52. Liu X, Gao J, Yang L, and Yuan X. (2024) Roles of Exosomal miRNAs in Asthma: Mechanisms and Applications. J. Asthma Allergy Volume 17: 935–947 DOI: 10.2147/JAA.S485910.
53. Tang C, and Hu W. (2024) Biomarkers and diagnostic significance of non-coding RNAs in extracellular vesicles of pathologic pregnancy. J. Assist. Reprod. Genet. 41: 2569–2584 DOI: 10.1007/s10815-024-03268-6.
54. Santonocito M, Vento M, Guglielmino MR, Battaglia R, Wahlgren J, Ragusa M, et al. (2014) Molecular characterization of exosomes and their microRNA cargo in human follicular fluid: bioinformatic analysis reveals that exosomal microRNAs control pathways involved in follicular maturation. Fertil. Steril. 102: 1751-1761.e1 DOI: 10.1016/j.fertnstert.2014.08.005.
55. Revelli A, Delle Piane L, Casano S, Molinari E, Massobrio M, and Rinaudo P. (2009) Follicular fluid content and oocyte quality: from single biochemical markers to metabolomics. Reprod. Biol. Endocrinol. RBE 7: 40 DOI: 10.1186/1477-7827-7-40.
56. da Silveira JC, de Ávila ACFCM, Garrett HL, Bruemmer JE, Winger QA, and Bouma GJ. (2018) Cell-secreted vesicles containing microRNAs as regulators of gamete maturation. J. Endocrinol. 236: R15–R27 DOI: 10.1530/JOE-17-0200.
57. Xie J, Xu X, and Liu S. (2023) Intercellular communication in the cumulus–oocyte complex during folliculogenesis: A review. Front. Cell Dev. Biol. 11 DOI: 10.3389/fcell.2023.1087612.
58. Pacella L, Zander-Fox DL, Armstrong DT, and Lane M. (2012) Women with reduced ovarian reserve or advanced maternal age have an altered follicular environment. Fertil. Steril. 98: 986-994.e2 DOI: 10.1016/j.fertnstert.2012.06.025.
59. Diez-Fraile A, Lammens T, Tilleman K, Witkowski W, Verhasselt B, De Sutter P, et al. (2014) Age-associated differential microRNA levels in human follicular fluid reveal pathways potentially determining fertility and success of in vitro fertilization. Hum. Fertil. 17: 90–98 DOI: 10.3109/14647273.2014.897006.
60. Zhao H, Wang L, and Wang Y. (2021) Circulating microRNAs as candidate biomarkers for the ovarian response during in vitro fertilization. Medicine (Baltimore) 100: e24612 DOI: 10.1097/MD.0000000000024612.
61. Liu B, Liu L, Sulaiman Z, Wang C, Wang L, Zhu J, et al. (2024) Comprehensive analysis of lncRNA-miRNA-mRNA ceRNA network and key genes in granulosa cells of patients with biochemical primary ovarian insufficiency. J. Assist. Reprod. Genet. 41: 15–29 DOI: 10.1007/s10815-023-02937-2.
62. Xiao S, Du J, Yuan G, Luo X, and Song L. (2024) Granulosa Cells-Related MicroRNAs in Ovarian Diseases: Mechanism, Facts and Perspectives. Reprod. Sci. 31: 3635–3650 DOI: 10.1007/s43032-024-01523-w.
63. Dai A, Sun H, Fang T, Zhang Q, Wu S, Jiang Y, et al. (2013) MicroRNA‐133b stimulates ovarian estradiol synthesis by targeting Foxl2. FEBS Lett. 587: 2474–2482 DOI: 10.1016/j.febslet.2013.06.023.
64. Liu T, Wen Y, Cui Z, Chen H, Lin J, Xu J, et al. (2024) MicroRNA‐3061 downregulates the expression of PAX7/Wnt/Ca2+ signalling axis genes to induce premature ovarian failure in mice. Cell Prolif. 57: e13686 DOI: 10.1111/cpr.13686.
65. Sørensen AE, Wissing ML, Englund ALM, and Dalgaard LT. (2016) MicroRNA Species in Follicular Fluid Associating With Polycystic Ovary Syndrome and Related Intermediary Phenotypes. J. Clin. Endocrinol. Metab. 101: 1579–1589 DOI: 10.1210/jc.2015-3588.
66. Butler AE, Ramachandran V, Hayat S, Dargham SR, Cunningham TK, Benurwar M, et al. (2019) Expression of microRNA in follicular fluid in women with and without PCOS. Sci. Rep. 9: 16306 DOI: 10.1038/s41598-019-52856-5.
67. Duval C, Wyse BA, Tsang BK, and Librach CL. (2024) Extracellular vesicles and their content in the context of polycystic ovarian syndrome and endometriosis: a review. J. Ovarian Res. 17: 160 DOI: 10.1186/s13048-024-01480-7.
|
Revista QuímicaViva Número 3, año 23, Diciembre 2024 quimicaviva@qb.fcen.uba.ar |