Nuevos abordajes in vitro para el estudio de la implantación embrionaria humana
Laura Fernández, Ana Schafir, Lara Castagnola, Esteban Grasso, Marcela Irigoyen, Soledad Gori, Rosanna Ramhorst
Laboratorio de Inmunofarmacología. CONICET, Universidad de Buenos Aires. Instituto de Química Biológica de la Facultad de Ciencias Exactas y Naturales IQUIBICEN, Buenos Aires
Recibido: 29/03/2024 - Aceptado: 12/04/2024
Introducción
El establecimiento del embarazo es un proceso complejo, que requiere de la coordinación temporal de una serie de eventos: la ovulación, la copulación, la fecundación del oocito y la implantación embrionaria [1, 2]. El riguroso control de estos eventos da lugar que solo un 30% de las concepciones lleguen al nacimiento [3, 4]. Más aún, alteraciones en estos procesos ocasionan patologías reproductivas. En este sentido, el porcentaje de personas en edad reproductiva que padecen infertilidad va en aumento. En nuestro país, la Ley 26.862/13 del Código Civil de la Nación garantiza el acceso a los procedimientos y técnicas de reproducción asistida. Por lo tanto, entender los mecanismos involucrados en la implantación embrionaria resulta clave no solo para las personas con trastornos reproductivos, sino también a nivel de salud pública.
Por otro lado, el estudio de la implantación embrionaria y la formación de la interfase materno fetal plantean un gran desafío desde el punto de vista ético y práctico debido a la imposibilidad de estudiarlo dentro del cuerpo humano. Esto condujo a la necesidad de estudiar estos procesos mediante el uso de modelos, tanto in vivo como in vitro [5].
Modelos animales
Los principales modelos animales para el estudio de la reproducción han sido los murinos, ovinos y bovinos, los cuales han contribuido enormemente al estudio del endometrio y la preñez [6]. Sin embargo, existen importantes diferencias inter especie que limitan la extrapolación de las observaciones a los eventos que ocurren en humanos.
Desde un punto de vista funcional, los primates son el modelo más representativo: presentan ovulación y menstruación cíclicas y mensuales, la regulación hormonal antes y durante la preñez es similar a la del humano, y la duración de la gestación en algunas especies de primates es prácticamente idéntica [7, 8]. Sin embargo, la elevada capacidad cognitiva y el complejo comportamiento social de estos animales lleva a cuestionar su uso en investigación desde un punto de vista ético. Si además se consideran los costos de la infraestructura requerida para mantenerlos y estudiarlos, los mismos se convierten en un modelo muy poco viable.
La falta de modelos in vivo adecuados para el estudio de la implantación embrionaria ha llevado al desarrollo de múltiples modelos in vitro que utilizan células endometriales humanas obtenidas a partir de biopsias. A partir de las mismas pueden obtenerse cultivos primarios o líneas celulares derivadas de los mismos (células inmortalizadas). Aunque no sean capaces de simular totalmente los procesos de implantación y placentación, estos modelos permiten estudiar ciertos aspectos del microambiente endometrial, a la vez que facilitan la manipulación de las condiciones experimentales [9].
Modelos in vitro para el estudio del embrión humano
La presencia de un blastocisto viable es uno de los puntos determinantes para una implantación exitosa. Por lo tanto, el estudio del desarrollo embrionario es de vital importancia para mejorar su cultivo durante los tratamientos de reproducción asistida. Sin embargo, en muchos países, incluyendo a la Argentina, no existe un contexto legal claro que permita o prohíba el uso de embriones humanos en investigación. Incluso en los países donde la investigación con embriones humanos está permitida, su disponibilidad es limitada. En estas condiciones, se han desarrollado diversos modelos in vitro para el estudio del desarrollo embrionario y de su interacción con el endometrio.
Uno de los modelos más simples para el estudio de embrión humano consiste en el uso de esferoides similares a blastocistos. Estos esferoides se establecen a partir del cultivo de líneas celulares de trofoblasto humano en placas de baja adherencia. En estas condiciones, se obtienen estructuras esféricas macizas que simulan al blastocisto en su capa externa. Los esferoides pueden ser cultivados individualmente para evaluar cómo distintas condiciones alteran su crecimiento; o bien pueden co-cultivarse con células endometriales para evaluar su interacción.
Los avances en técnicas de modelado tridimensional han llevado al desarrollo de organoides, estructuras que remedan la arquitectura de un tejido u órgano en un cultivo in vitro. Los organoides se generan a partir del cultivo de células en una gota de hidrogel, y en presencia de un medio de cultivo que simula el microambiente fisiológico [10]. Bajo estas condiciones, las células se organizan de forma espontánea en una arquitectura similar a la del tejido u órgano del que provienen [5]. Recientemente, algunos trabajos reportaron el desarrollo de un tipo particular de organoides denominados blastoides, los cuales se originan a partir de células madre pluripotentes dando origen a estructuras similares a los blastocistos [11, 12]. Estas similitudes se reflejan en su morfología, el número de células y sus linajes celulares. En este sentido, se observa la presencia de una estructura similar al MCI, otra similar al trofoectodermo, y una cavidad que remeda al blastocele [13].
Mas allá de los aspectos morfológicas, los blastoides se asemejan a los blastocistos en otros aspectos. En cuanto a la expresión génica, mediante single-cell RNAseq, se determinó que los perfiles transcriptómicos de los blastoides y los blastocistos son muy similares [11]. En cuanto a su funcionalidad, a partir de células de ratón se desarrollaron blastoides capaces de implantarse al ser transferidos al útero [14].
Los protocolos para generar blastoides involucran el uso de células madre pluripotentes. Estas pueden ser de origen embrionario, o bien tratarse de células madre pluripotentes inducidas (iPSC) generadas a partir de fibroblastos adultos. En ambos casos, las células forman agregados que dan origen a los blastoides de manera espontánea [13].
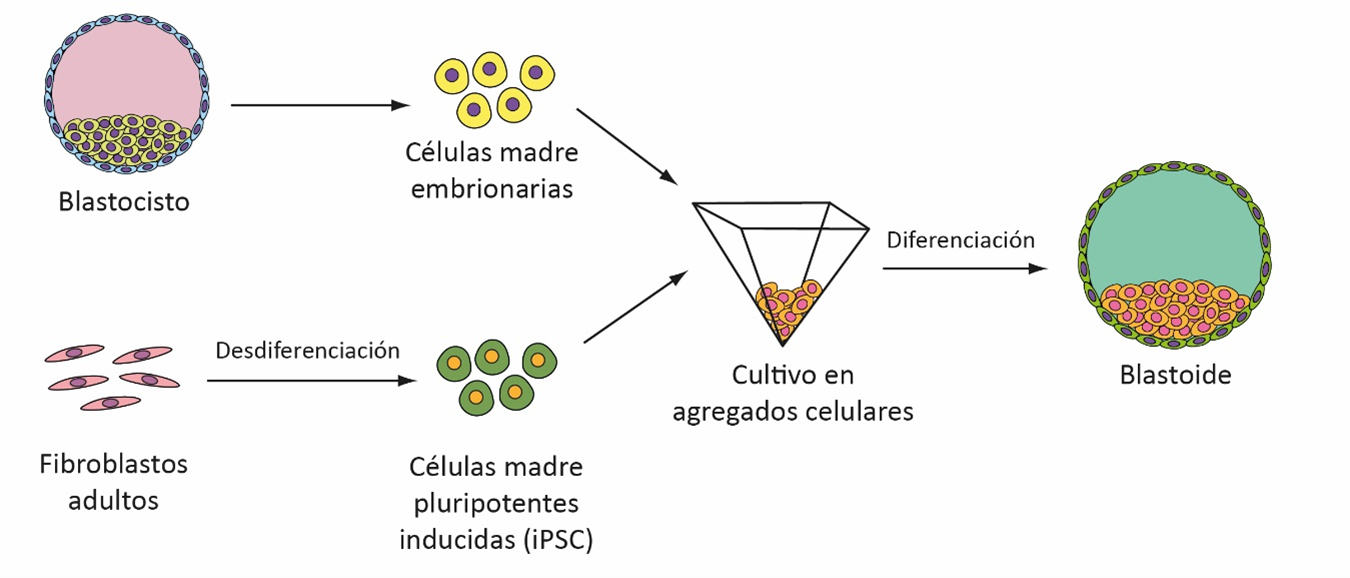
Esquema 1: Establecimiento de blastoides a partir de células madre pluripotentes. Adaptado de Niemann, 2021.
Modelos in vitro para el estudio del diálogo embrio-endometrial
Los modelos in vitro para el estudio de la implantación humana han ido evolucionando a lo largo del tiempo. Los más simples y ampliamente utilizados son los cultivos en monocapa de células estromales o epiteliales (ver Esquema 2 A). Estas células han sido exitosamente co cultivadas, tanto con embriones como con esferoides similares a blastocistos [15–17]. Asimismo, también es posible estudiar ciertos aspectos de la interacción embrio endometrial mediante la estimulación de las células endometriales con medios condicionados de embriones obtenidos por tratamientos de fertilización in vitro [18–20].
El estudio de la implantación in vitro avanzó gracias al uso de modelos tridimensionales. En este caso, las células estromales crecen embebidas en una matriz de hidrogel que simula la matriz extracelular, mientras que las epiteliales se siembran por encima (ver Esquema 2 B) [21, 22]. De esta manera, se recrea con mayor fidelidad la arquitectura del endometrio. Estos modelos también permiten el co cultivo de esferoides de células trofoblásticas para el estudio de la interacción embrio endometrial [23]. Sin embargo, una limitación de estos modelos es que carecen de estructuras glandulares y poblaciones inmunes.
Tal como se mencionó previamente, el modelado tridimensional ha sido recientemente revolucionado gracias a la generación de diversos protocolos para el establecimiento de organoides. En el campo del estudio del endometrio, Turco y colaboradores establecieron organoides de glándulas epiteliales uterinas a partir de fragmentos glandulares purificados de biopsias endometriales (ver Esquema 2 C). En presencia de hormonas ováricas, estas estructuras desarrollan un fenotipo similar al de las glándulas durante la fase secretoria del ciclo menstrual [24].
En los últimos años, los estudios con organoides han avanzado en su complejidad al incorporar el co cultivo con células estromales. Estas estructuras, denominadas asembloides, representan un modelo más fisiológico del órgano o tejido en estudio, y han sido exitosamente utilizados para el estudio del cerebro y la vejiga [25, 26]. Muy recientemente, Rawlings y colaboradores desarrollaron asembloides endometriales, formados por una gota de hidrogel de colágeno que embebe tanto a células estromales como a organoides de glándulas epiteliales (ver Esquema 2 D). Estos asembloides fueron decidualizados y co cultivados con embriones humanos, permitiendo su adhesión y expansión [27].
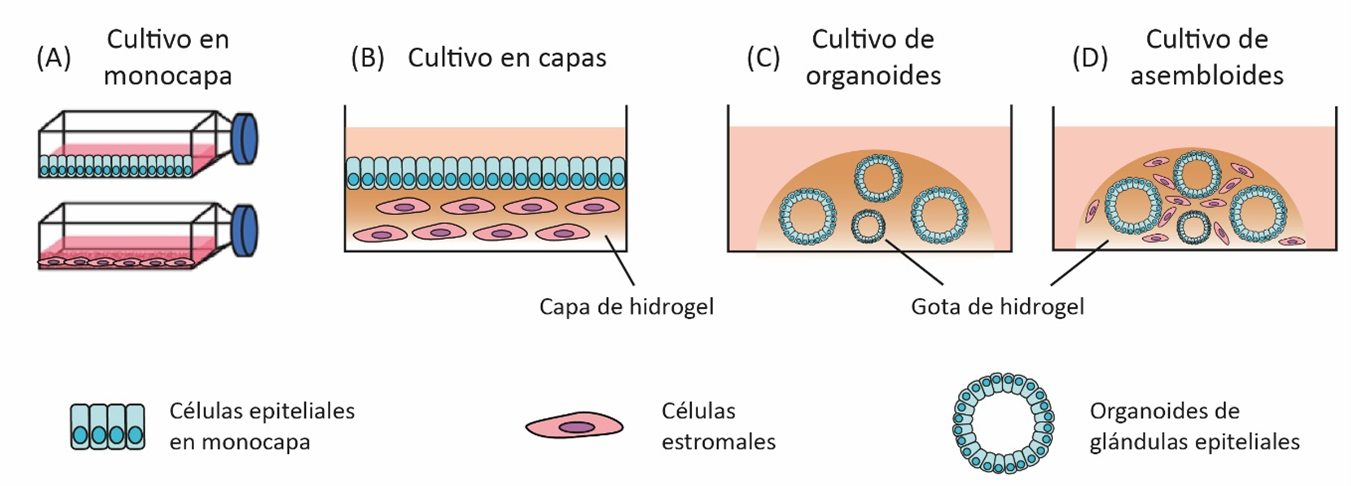
Esquema 2: Modelos in vitro para el estudio de la implantación embrionaria humana. Se muestran los cultivos en monocapa (A), en varias capas (B), el modelo de organoides de glándulas epiteliales (C) y el de asembloides (D). Adaptado de Rawlings, 2021.
Los primeros asembloides endometriales fueron establecidos a partir de cultivos primarios obtenidos de biopsias endometriales. Sin embargo, recientemente también se lograron establecer a partir de sangre menstrual (ver Esquema 3). Esta forma menos invasiva de obtener los asembloides abre la posibilidad de obtener un mayor número de muestras, tanto de diversas patologías como de controles fértiles. El desafío actual para el modelo de asembloides endometriales humanos es la incorporación de un epitelio luminal, así como de poblaciones de células inmunes.
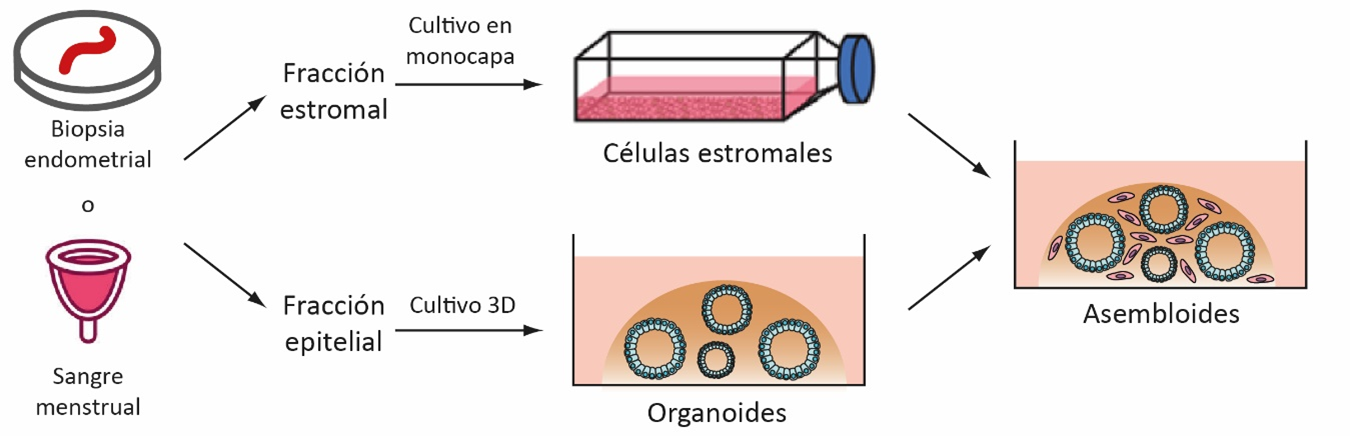
Esquema 3: Establecimiento de asembloides a partir de muestras endometriales
Conclusiones
La implantación embrionaria es un proceso sumamente complejo que requiere no solo de la presencia de embrión competente, sino también de un endometrio receptivo y una adecuada interacción entre ambos. Pese a ser un paso clave en el establecimiento del embarazo, su estudio resulta sumamente desafiante teniendo en cuenta distintos factores, como la imposibilidad de estudiarlo dentro del cuerpo humano, las diferencias con otras especies animales y el acceso limitado a muestras humanas.
El uso de modelos in vitro ha permitido superar algunas de estas limitaciones, haciendo que hoy en día sea más accesible el estudio de distintos aspectos de la implantación, como el desarrollo del embrión humano y la fisiología endometrial. Por su parte, los modelos animales, pese a las diferencias con el humano, siguen presentando la ventaja de permitir estudiar la implantación embrionaria en un contexto fisiológico. Teniendo en cuenta las fortalezas y limitaciones de ambos tipos de modelo, su uso de forma complementaria resulta clave para estudiar distintos aspectos de la implantación embrionaria humana, delineando un futuro promisorio para el avance de este campo de investigación y de la mejora en los tratamientos de reproducción asistida.
Referencias:
1. Mor G, Cardenas I, Abrahams V, and Guller S. (2011) Inflammation and pregnancy: the role of the immune system at the implantation site. Annals of the New York Academy of Sciences 1221: 80–7 DOI: 10.1111/j.1749-6632.2010.05938.x.
2. Gellersen B, Reimann K, Samalecos A, Aupers S, and Bamberger AM. (2010) Invasiveness of human endometrial stromal cells is promoted by decidualization and by trophoblast-derived signals. Human Reproduction 25: 862–873 DOI: 10.1093/humrep/dep468.
3. Larsen EC, Christiansen OB, Kolte AM, and Macklon N. (2013) New insights into mechanisms behind miscarriage. BMC medicine 11: 154 DOI: 10.1186/1741-7015-11-154 [doi].
4. Norwitz ER, Schust DJ, and Fisher SJ. (2001) Implantation and the survival of early pregnancy. New England Journal of Medicine 345: 1400–1408 DOI: 10.1056/NEJMra000763.
5. Rawlings TM, Makwana K, Tryfonos M, and Lucas ES. (2021) Organoids to model the endometrium: implantation and beyond. Reproduction and Fertility 2: R85–R101 DOI: 10.1530/RAF-21-0023.
6. Carter AM. (2021) Alternatives To the Mouse. Reproduction 160: 1470–1626.
7. Phillips KA, Bales KL, Capitanio JP, Conley A, Czoty PW, ’t Hart BA, et al. (2014) Why primate models matter. American Journal of Primatology 76: 801–827 DOI: 10.1002/ajp.22281.
8. Hewitson L, and Schatten G. (2002) The use of primates as models for assisted reproduction. Reproductive biomedicine online 5: 50–55 DOI: 10.1016/S1472-6483(10)61598-2.
9. Weimar CHE, Uiterweer EDP, Teklenburg G, Heijnen CJ, and Macklon NS. (2013) In-vitro model systems for the study of human embryo–endometrium interactions TL - 27. Reproductive BioMedicine Online 27 VN-r: 461–476 DOI: 10.1016/j.rbmo.2013.08.002.
10. Kim J, Koo BK, and Knoblich JA. (2020) Human organoids: model systems for human biology and medicine. Nature Reviews Molecular Cell Biology 21: 571–584 DOI: 10.1038/s41580-020-0259-3.
11. Yu L, Wei Y, Duan J, Schmitz DA, Sakurai M, Wang L, et al. (2021) Blastocyst-like structures generated from human pluripotent stem cells. Nature 591: 620–626 DOI: 10.1038/S41586-021-03356-Y.
12. Liu X, Tan JP, Schröder J, Aberkane A, Ouyang JF, Mohenska M, et al. (2021) Modelling human blastocysts by reprogramming fibroblasts into iBlastoids. Nature 591: 627–632 DOI: 10.1038/S41586-021-03372-Y.
13. Niemann H, and Seamark B. (2021) Blastoids: a new model for human blastocyst development. Signal Transduction and Targeted Therapy 6: 1–2 DOI: 10.1038/s41392-021-00663-8.
14. Li R, Zhong C, Yu Y, Liu H, Sakurai M, Yu L, et al. (2019) Generation of Blastocyst-like Structures from Mouse Embryonic and Adult Cell Cultures. Cell 179: 687-702.e18 DOI: 10.1016/J.CELL.2019.09.029.
15. Teklenburg G, and Macklon NS. (2009) Review: In Vitro Models for the Study of Early Human Embryo-Endometrium Interactions. Reproductive Sciences DOI: 10.1177/1933719109334966.
16. Ruane PT, Buck CJ, Babbington PA, Aboussahoud W, Berneau SC, Westwood M, et al. (2020) The effects of hyaluronate-containing medium on human embryo attachment to endometrial epithelial cells in vitro. Human Reproduction Open 2020: 1–10 DOI: 10.1093/hropen/hoz033.
17. Grasso E, Gori S, Soczewski E, Fernández L, Gallino L, Vota D, et al. (2018) Impact of the Reticular Stress and Unfolded Protein Response on the inflammatory response in endometrial stromal cells. Scientific reports 8: 12274 DOI: 10.1038/s41598-018-29779-8.
18. Brosens JJ, Salker MS, Teklenburg G, Nautiyal J, Salter S, Lucas ES, et al. (2015) Uterine Selection of Human Embryos at Implantation. Scientific Reports 4: 3894 DOI: 10.1038/srep03894.
19. Durairaj RRP, Aberkane A, Polanski L, Maruyama Y, Baumgarten M, Lucas ES, et al. (2017) Deregulation of the endometrial stromal cell secretome precedes embryo implantation failure. Molecular Human Reproduction 23: 478–487 DOI: 10.1093/molehr/gax023.
20. Kong CS, Ordoñez AA, Turner S, Tremaine T, Muter J, Lucas ES, et al. (2021) Embryo biosensing by uterine natural killer cells determines endometrial fate decisions at implantation. FASEB Journal 35: 1–15 DOI: 10.1096/fj.202002217R.
21. Bentin-Ley U, Pedersen B, Lindenberg S, Falck Larsen J, Hamberger L, and Horn T. (1994) Isolation and culture of human endometrial cells in a three-dimensional culture system. Journal of Reproduction and Fertility 101: 327–332 DOI: 10.1530/jrf.0.1010327.
22. Evron A, Goldman S, and Shalev E. (2011) Effect of primary human endometrial stromal cells on epithelial cell receptivity and protein expression is dependent on menstrual cycle stage. Human Reproduction 26: 176–190 DOI: 10.1093/humrep/deq296.
23. Wang H, Pilla F, Anderson S, Martínez-Escribano S, Herrer I, Moreno-moya JM, et al. (2012) A novel model of human implantation: 3D endometrium-like culture system to study attachment of human trophoblast (Jar) cell spheroids. Molecular Human Reproduction 18: 33–43 DOI: 10.1093/molehr/gar064.
24. Luddi A, Pavone V, Governini L, Capaldo A, Landi C, Ietta F, et al. (2021) Emerging role of embryo secretome in the paracrine communication at the implantation site: a proof of concept. Fertility and Sterility 115: 1054–1062 DOI: 10.1016/j.fertnstert.2020.10.058.
25. Kim E, Choi S, Kang B, Kong JH, Kim Y, Yoon WH, et al. (2020) Creation of bladder assembloids mimicking tissue regeneration and cancer. Nature 588: 664–669 DOI: 10.1038/s41586-020-3034-x.
26. Andersen J, Revah O, Miura Y, Thom N, Amin ND, Kelley KW, et al. (2020) Generation of Functional Human 3D Cortico-Motor Assembloids. Cell 183: 1913-1929.e26 DOI: 10.1016/j.cell.2020.11.017.
27. Rawlings TM, Makwana K, Taylor DM, Molè MA, Fishwick KJ, Tryfonos M, et al. (2021) Modelling the impact of decidual senescence on embryo implantation in human endometrial assembloids. eLife 10: 1–24 DOI: 10.7554/eLife.69603.
|
Revista QuímicaViva Número 1, año 23, Abril 2024 quimicaviva@qb.fcen.uba.ar |