Explorando las celdas de combustible microbianas sedimentarias: una herramienta educativa aplicada a la biorremediación de sedimentos
Agustín Juarez1; Martín Pergola2; Laura J Raiger Iutsman1,3; Natalia Sacco1,3
1Laboratorio de Microbiología Ambiental y Nanotecnología. Departamento de Química Biológica, FCEN, UBA- Ciudad Autónoma de Buenos Aires- Buenos Aires-Argentina. 2Centro de Formación e Investigación en Enseñanza de las Ciencias. Facultad de Ciencias Exactas y Naturales, Universidad de Buenos Aires. Pabellón 2, Ciudad Universitaria. Ciudad Autónoma de Buenos Aires, C1428EGA, Argentina. Telephone/Fax: INT + 54-11-4576-3342. 3Instituto de Química Biológica de la Facultad de Ciencias Exactas y Naturales (IQUIBICEN)-Ciudad Autónoma de Buenos Aires- Buenos Aires-Argentina.
Recibido: 03/12/2022 - Aceptado: 19/12/2022
Resumen
Actualmente existe una preocupación por desarrollar nuevas herramientas, y mejorar las ya existentes, para la biorremediación de cuerpos de agua o sedimentos contaminados. En este trabajo presentamos una potencial alternativa para la biorremediación de sedimentos, basada en el uso de celdas de combustible microbianas. Asimismo, presentamos una propuesta didáctica experimental sencilla para implementar el uso de celdas de combustibles microbianas en procesos de biorremediación, que plantea como desafío el abordaje de una problemática genuina y compleja, que implica un enfoque interdisciplinario y la integración de conceptos de microbiología, bioquímica, química y física. Encarar este tipo de problemáticas desde lo educativo supone la toma de decisiones en el diseño experimental (en este caso en el armado de la celda de combustible) que conlleva el desarrollo de competencias sumamente importantes para estudiantes de grado como futuros profesionales.
Palabras clave: Celdas de combustible microbianas sedimentarias, biorremediación, hidrocarburos, propuesta didáctica.
Exploring sedimentary microbial fuel cells: an educational tool applied to sediment bioremediation
Summary
Currently there is a concern to develop new tools, and improve the existing ones, for the bioremediation of contaminated bodies of water or sediments. In this work we present a potential alternative for sediment bioremediation, based on the use of microbial fuel cells. Likewise, we present a simple experimental didactic proposal to implement the use of microbial fuel cells in bioremediation processes, which poses as a challenge the approach of a genuine and complex problem, which implies an interdisciplinary approach and the integration of concepts of microbiology, biochemistry, chemistry and physics. Facing this type of problem from an educational point of view involves decision-making in the experimental design (in this case in the assembly of the fuel cell) which implies the development of extremely important skills for undergraduate students as future professionals.
Keywords: Sedimentary microbial fuel cells, bioremediation, hydrocarbons, didactic proposal.
Celdas de combustible microbianas y biorremediación
Los suelos y sedimentos representan no sólo un sumidero natural sino también una fuente potencial, a largo plazo, de liberación de contaminantes al agua y al aire [1], por lo tanto, el saneamiento de los sedimentos es un eslabón clave de la remediación del medio ambiente. Existen muchos métodos de remediación de sedimentos que involucran tratamientos fisicoquímicos, como por ejemplo el dragado, la ozonización y la degradación electroquímica. Sin embargo, el alto costo y consumo de energía involucrados en estas estrategias, limitan su aplicación generalizada [2]. En comparación, la biorremediación ha ganado popularidad en las últimas décadas debido a su rentabilidad y a su inocuidad para con el ambiente [3-5]. Los sedimentos son habitados naturalmente por un amplio espectro de microorganismos adaptados a las condiciones presentes en ese entorno, sin embargo, suelen encontrar limitaciones en la disponibilidad de ciertos nutrientes dificultando su proliferación. Por eso, dentro de las estrategias de biorremediación, se incluye la bioestimulación que radica en la incorporación de distintos nutrientes y aditivos con la finalidad de estimular el metabolismo de la microbiota nativa, y por otro lado la bioaumentación en donde se aumenta la microbiota con la adición de microorganismos exógenos o por el incremento de microorganismos nativos con capacidades de degradación de los compuestos contaminantes [6].
En el caso de los sedimentos, un factor importante a tener en cuenta es la disponibilidad de compuestos que actúen como aceptores de electrones adecuados, según el metabolismo de los distintos microorganismos presentes en el mismo, que participan en la cadena de transporte de electrones (CTE) microbiana [7].
El descubrimiento de que muchos microorganismos ambientales pueden establecer una comunicación electroquímica (microorganismos electrogénicos) con un electrodo sólido ha llevado al rápido desarrollo de las celdas de combustible microbianas (Microbial Fuel Cells, MFCs) [8]. Una MFC es un dispositivo bioelectroquímico que puede generar electricidad mediante el uso de electrones obtenidos de la oxidación de sustratos. Este proceso ocurre cuando los microorganismos son capaces de reemplazar el último aceptor soluble de electrones por un aceptor sólido de electrones, como el ánodo de la MFC. El flujo de electrones que entregan es proporcional a la tasa respiratoria y constituye en sí mismo una corriente eléctrica. La transferencia de electrones (de las bacterias al ánodo) puede ocurrir a través de compuestos asociados a la membrana celular o bien gracias a la producción de mediadores solubles que facilitan el transporte exocelular de electrones [9-10].
Debido a las condiciones y naturaleza propia en las que viven las bacterias que suelen utilizarse para desarrollar MFCs, es difícil establecer el mecanismo preciso mediante el cual realizan la transferencias de electrones, aunque actualmente se pudo elucidar para ciertos grupos bacterianos específicos. Se han descripto una serie de mecanismos que se los clasifica de acuerdo a si el traspaso de electrones desde la bacteria hacia el ánodo ocurre de manera directa o indirecta. Los mecanismos directos se pueden llevar a cabo gracias a proteínas de membrana como puede ser el citocromo C o mediante una interacción entre el ánodo y los pilis de la bacteria [11-12], por otro lado, el hablar de transferencia indirecta se refiere al uso de algún intermediario que puede ser secretado tanto de manera endógena o exógena [11].
Generalmente, la MFC consta de dos partes, un ánodo y un cátodo, que están separados por una membrana de intercambio de protones (proton exchange membrane, PEM). La oxidación anaeróbica de sustancias orgánicas como acetato, glucosa, lactato, etanol ocurre en el compartimiento del ánodo, proceso durante el cual se liberan protones, electrones y dióxido de carbono. En este caso, los protones y electrones pasan a través de la cámara del ánodo a la cámara del cátodo a través del PEM y un circuito externo, respectivamente. Esta transferencia de electrones del ánodo al cátodo produce una corriente eléctrica (figura 1a) [11].
Las celdas de combustibles sedimentarias (Sedimentary Microbial Fuel Cells, SMFCs), son un tipo de MFCs que ha tenido una atención significativa, debido a su propiedad única de eliminar compuestos orgánicos del suelo/sedimento. Las SMFCs generalmente consisten en un ánodo enterrado en una matriz reducida (suelo/sedimento) y un cátodo ubicado en la capa de agua que la cubre y que generalmente está aireada [14-17] (figura 1B). En las SMFCs por lo general, se utiliza la microbiología autóctona, por lo que para que este sedimento/suelo sea plausible de utilizar es necesario que las bacterias presentes en el consorcio sean electrogénicas [18].
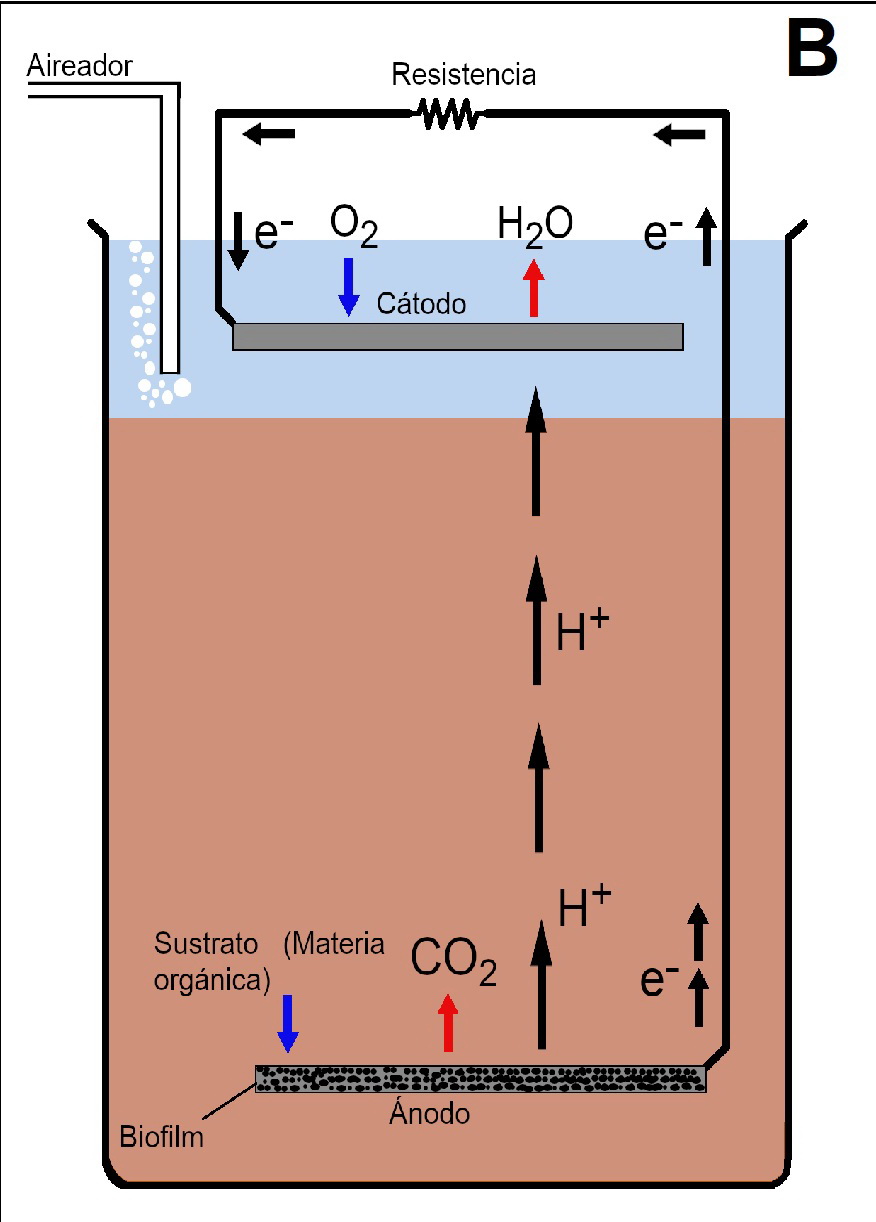
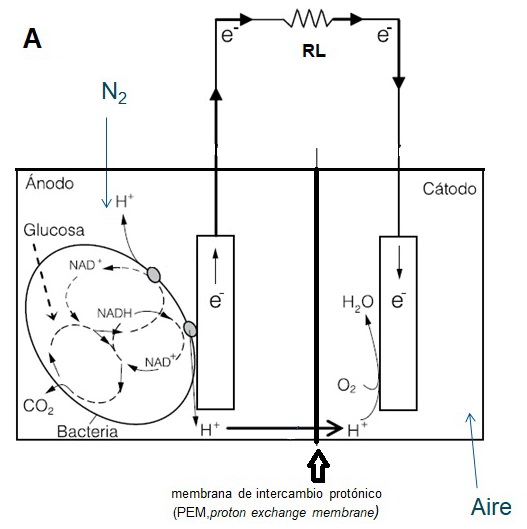
Figura 1: Esquema de diferentes tipos de sistemas MFC. A) MFC y B) SMFC. El modelo MFC es una configuración de dos cámaras y una membrana de intercambio protones (PEM), generalmente Nafion. En ambos tipos de MFC, los electrones viajan por un circuito externo hasta el cátodo a través de una resistencia de carga (RL) en la que realizamos las medidas de potencial y corriente. En SMFC no se necesita PEM.
Estos dispositivos presentan varias ventajas a la hora de la remediación de sedimentos: 1) el electrodo proporciona un aceptor de electrones menos agresivo, inagotable, limpio y portátil; 2) se pueden operar de forma autosostenida; 3) son de implementación y control relativamente fáciles y 4) causan un mínimo impacto ambiental [19-22]. Es por todo lo anteriormente mencionado que las técnicas de remediación bioelectroquímica han sido recomendadas por el proyecto europeo MINOTAURUS, como una nueva opción deseable para la remediación del medio ambiente [23]. En los últimos años se han publicado varios trabajos donde se utilizan MFCs en la remediación de hidrocarburo [24-29]
Por lo general, la producción de corriente en estos sistemas es baja (del orden de los microamperes), mientras que la diferencia de potencial es inferior a 1 V, determinando que la generación de energía ocurra a muy baja potencia. Más allá de esto, atendiendo a que normalmente el área de los electrodos es grande y la producción de corriente es permanente y sin costo adicional, la posibilidad de recuperar energía de forma simultánea al proceso de remediación es un valor añadido que promueve el uso de estas tecnologías.
A la hora llevar a cabo la construcción de una SMFC hay diversos factores a tener en cuenta que definirán el rendimiento de la misma, es decir, la tasa de remoción y/o la cantidad de energía generada. Como un sistema de bioaumentación, los sedimentos contaminados pueden ser inoculados con cultivos puros o mixtos de microorganismos electrogénicos. Si se inocula un cultivo puro se tiene que considerar que los microorganismos pueden degradar un limitado número de sustratos, la ventaja que posee utilizar cultivos mixtos yace en la variedad de sustratos que pueden llegar a utilizar los microorganismos [30-31]. Por otro lado, la desventaja de los cultivos mixtos es que no todas las bacterias presentes en la muestra tendrán la capacidad de realizar la transferencia de electrones, consecuentemente la colonización del ánodo por estas bacterias para formar el biofilm electroactivo demorará más tiempo en comparación con una SMFC que utilice un cultivo puro [31-32].
La transferencia de masa en el sedimento es otra cuestión a tener en cuenta. Los hidrocarburos (sustrato) que se encuentren cercanos al ánodo serán constantemente consumidos por acción de los microorganismos pudiendo ser un problema el acceder a los que están físicamente alejados del mismo [33]. En el caso de realizar una SMFC con un suelo poco poroso, la remoción de los polutantes se verá disminuida o detenida [34].
Otro factor a tener en cuenta es que de la misma manera esto puede causar que se acumulen los protones cerca del ánodo, generando una diferencia de pH en diferentes zonas de la SMFC, principalmente se vería la baja del pH en la región cercana al ánodo, afectando nuevamente la actividad microbiana [35]. En este sentido, se demostró que adicionando arena al sedimento se reduce la resistencia otorgada por el suelo a los protones y a las mismas fuentes de carbono. De esta manera se puede mejorar la tasa de degradación del polutante o por lo menos no limitar la transferencia de masa en el caso de suelos poco porosos [34].
Si se asocia el crecimiento y la tasa metabólica de una bacteria con un determinado pH [36] es fácil pensar que hay que establecer, de acuerdo con las bacterias presentes [37], un pH óptimo para mejorar el rendimiento del dispositivo. En la mayoría de los casos estas bacterias electrogénicas conviven con un pH neutro o a lo sumo levemente alcalino, ya que es normal que produzcan ciertos ácidos al medio que le ayudan a mantener su pH intracelular [38]. Sin embargo es prudente tener en cuenta el consorcio microbiano que tiene el sedimento para poder elegir el pH adecuado de acuerdo con las necesidades que presenten, por ejemplo las bacterias acidófilas o alcalófilas [39-40].
Para promover una alta tasa metabólica en las bacterias es necesario el control de la temperatura. Preferentemente, salvando excepciones de microorganismos termófilos, se suele elegir trabajar en condiciones ambientales del orden de los 29±2°C [41], viéndose que a temperaturas menores de 20°C la actividad se mostró significativamente inhibida [42].
Por otro lado, si bien es importante la capacidad electrogénica de las bacterias y las condiciones a las que se las enfrenta para poder llevar a cabo las oxidaciones de los compuestos orgánicos es crucial tener en cuenta los materiales del electrodo, el cual funcionará como último aceptor de esos electrones obtenidos. A la hora de elegir los materiales hay que tener en cuenta las propiedades fisicoquímicas de los mismos, como por ejemplo la conductividad que posee [33], y que sea anticorrosivo, duradero [43] y también es importante determinar la superficie que estará en contacto con las bacterias. Esto último viene acompañado de la idea de que mientras mayor sea la superficie, más eficaz será la interacción de las bacterias con el mismo, pudiendo también establecer un biofilm de una manera uniforme a lo largo de toda la superficie del electrodo. En ese sentido, se está estudiando ampliamente la utilización de diferentes materiales para poder establecer una relación costo/beneficio que sea aplicable [44]. Actualmente la gran mayoría de las SMFCs se basan en electrodos de carbono los cuales tienen la ventaja de promover una unión eficiente de las bacterias, ser anticorrosivos y además tener el beneficio del bajo costo [31] teniendo como contra la baja conductividad en comparación con los metales [44]. Frente a esta desventaja se realizan ciertas modificaciones a los ánodos, como por ejemplo el agregado de mallas de nanotubos de carbono entrelazados los cuales aumentan significativamente el área de contacto posible entre los microorganismos y el electrodo. Otro tipo de modificaciones incluyen el agregado de nanopartículas de metales como por ejemplo de plata, estos arreglos si bien logran aumentar la conductividad del electrodo no mantiene la relación costo/beneficio buscada en estos diseños experimentales.
Fundamentación didáctica de la propuesta
Los enfoques didácticos actuales, así como las investigaciones en didáctica de las ciencias naturales, sugieren una enseñanza de las disciplinas científicas desde enfoques que favorezcan la modelización y la contextualización de los contenidos científicos [45].
Asimismo, existen recomendaciones generalizadas para que el tratamiento educativo de los contenidos científicos se proponga abordar desde problemáticas de la vida real, cuya resolución requiera habitualmente miradas inter y multidisciplinarias. La resolución de problemas reales genuinos y contextualizados, requiere integrar y aplicar modelos científicos de distintas disciplinas por parte de los estudiantes, así como desarrollar habilidades para efectuar recortes pertinentes que permitan un abordaje específico desde los contenidos disciplinares que se pretenden enseñar. Esto último resulta particularmente dificultoso para los docentes, y puede ser un obstáculo para la implementación de secuencias que se propongan trabajar con problemáticas del mundo real contextualizadas [46].
El abordaje didáctico desde estas perspectivas resulta potente para incorporar en la enseñanza de las ciencias aspectos fundamentales de la actividad científica, que no suelen ser tratados o son tratados superficialmente en el nivel universitario. Estos aspectos están enmarcados dentro de la denominación Naturaleza de las Ciencias (Nature of the science, NOS) y permiten abordar qué tipos de problemas se pueden trabajar desde modelos científicos de una determinada disciplina, cómo es la estructura y la naturaleza de dicha disciplina, la construcción histórica de los modelos científicos, los recortes y transposiciones necesarias para convertir los modelos científicos eruditos en modelos científicos escolares que se puedan tratar de forma didáctica.
Este abordaje va en el sentido de las investigaciones de las últimas décadas en didácticas de las ciencias, que reconocen que para la enseñanza de las disciplinas científicas es necesario conocer los modelos científicos propios de esas disciplinas -el conocimiento disciplinar- así como la estructura, la naturaleza y la construcción histórica de dicho conocimiento disciplinar.
Por último, el abordaje sustentado en estos enfoques resulta muy relevante en la formación de futuros científicas y científicos, pues presenta una visión de la ciencia mucho más contextualizada y menos idealizada.
Las Celdas de Combustible Microbianas Sedimentarias como dispositivo experimental didáctico
Las SMFCs son un tipo de celdas adaptables como dispositivos experimentales educativos de forma sencilla. Por un lado, no requieren el uso de métodos microbiológicos complejos para preparar cultivos microbianos puros o específicos, sino que se utiliza la microbiota nativa del suelo. Por otro lado, porque la separación física entre el ánodo y el cátodo en las SMFCs, necesaria para el funcionamiento de la celda, no requiere que los electrodos se coloquen en compartimientos separados entre sí, lo cual requiere a menudo el uso de membranas de intercambio de protones (que encarece la construcción de la celda), debido a que el propio sedimento actúa como una barrera que impide la difusión del oxígeno al ánodo, pero permite la difusión de protones al cátodo.
En las SMFCs el ánodo se encuentra sumergido varios centímetros bajo el lodo, y el cátodo se encuentra suspendido en agua sobre el lodo, sin estar en contacto con el mismo (figura 1b).
En el ánodo ocurre un proceso anaeróbico donde se oxida una sustancia orgánica, que puede expresarse según la siguiente ecuación [47]:
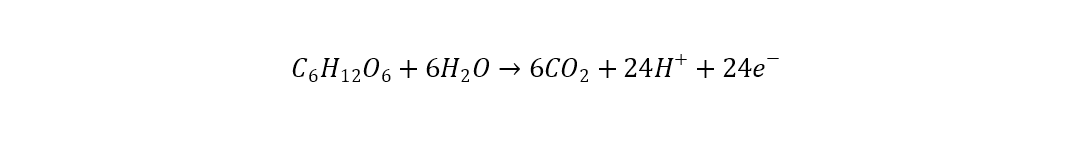
En el cátodo (tomando como ejemplo medio ácido) ocurre la reducción de oxígeno según la siguiente ecuación [48]:
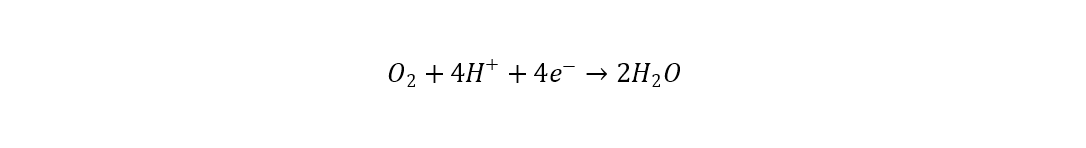
En la superficie del ánodo se genera un biofilm de bacterias anaeróbicas que oxidan la materia orgánica desprendiendo CO2, mientras que la hemirreacción redox complementaria ocurre en el cátodo, donde el oxígeno es el aceptor final de electrones reduciéndose a agua. En este proceso, los electrones son “forzados” a desplazarse a través de un cable, desde el ánodo al cátodo, generando un circuito eléctrico macroscópico, con parámetros medibles, tales como voltaje e intensidad de corriente.
Una vez construidas y estabilizadas las celdas se podrá medir el voltaje de las celdas con un multímetro. La aparición de voltaje es un indicador de actividad metabólica bacteriana y de funcionamiento de la celda. El voltaje puede medirse periódicamente para evaluar el funcionamiento de la celda y la actividad microbiana en la misma. En este trabajo, la experimentación con SMFCs estará orientada al tratamiento de biorremediación de sedimentos contaminados con hidrocarburos.
El funcionamiento a lo largo del tiempo de la SMFCs, dependerá de la cantidad de materia orgánica que contenga el sedimento/suelo con que se construyó la celda.
A su vez, mientras la SMFCs se encuentra en funcionamiento se pueden agregar compuestos y evaluar el efecto que los mismos producen sobre la población bacteriana, midiendo el voltaje, antes y después del agregado. Es esperable que el agregado de fuentes de carbono a la celda implique un aumento del metabolismo microbiano y por consiguiente un aumento del voltaje medido; por el contrario, el agregado de sustancias biocidas implicaría la muerte de la población bacteriana y por consiguiente una disminución significativa del voltaje [49]
Para entrar más en detalle sobre las posibilidades de experimentación educativa con SMFCs en laboratorios, y los diversos contenidos científicos que se pueden trabajar a partir de las mismas se puede consultar la tesis doctoral de uno de los autores de este trabajo [49], y publicados en artículos de revistas científicas.
Propuesta didáctica experimental
Armado de la Celda de Combustible
Para el armado de las celdas de combustible nos basamos en diseños de dispositivos armados y probados previamente, cuyo funcionamiento resultó comprobado [50], e inclusive se experimentó con el agregado de sustancias que actuarán como biocidas o fuentes de materia orgánica para comprobar la variación de generación de corriente de la celda luego del agregado (figura 2) [49]. En esta sección desarrollaremos brevemente el diseño del dispositivo experimental de la celda de combustible utilizado en nuestra propuesta. Para profundizar en los fundamentos del diseño pueden consultarse los trabajos originales mencionados [49-50].
Construcción de los electrodos: para los cuales suelen utilizarse discos de grafito de alta pureza (en nuestro caso utilizamos discos de pureza 99,8 %), intentando maximizar su área superficial, ya que a mayor área superficial mayor será la transferencia de electrones por parte de los microorganismos. También es posible utilizar otros materiales a base de carbono como tejido de fibra de carbono, papel de carbón, carbones para motores comerciales, varillas, o inclusive minas de lápiz. Si se utilizan discos, los mismos son agujereados y se les coloca un tornillo de acero inoxidable, al cual se le ajusta un cable conductor sellando la conexión con adhesivo epoxi, para evitar se oxide el cable. Luego, se deben pulir con una lija para generar una superficie homogénea. Seguidamente, los electrodos se lavan durante 60 minutos con ácido clorhídrico 0,1 M, se enjuagan con agua destilada, por último se lavan por 60 minutos en hidróxido de sodio 0,1 M, y enjuagan con agua destilada. Este procedimiento se realiza para evitar la contaminación con materia orgánica e inorgánica.
Armado de la celda: es necesario definir el recipiente donde se armará, y el suelo que se elegirá. Hay diferentes opciones dependiendo del espacio físico y el tamaño de los electrodos que disponga. Una parte fundamental de estos sistemas es el suelo que se selecciona dado que este será la fuente de los microorganismos. Para asegurarnos un resultado exitoso debemos seleccionar un sitio de muestreo donde el suelo está crónicamente contaminado, rico en microorganismos degradadores que serán estimulados electroquímicamente para acelerar la remediación.
El sedimento/suelo se debe recoger cavando a una profundidad superior a 5-10 cm, donde el sedimento presente un color negro intenso y olor a podrido, que son indicadores de actividad de microorganismos anaeróbicos y condiciones anóxicas. El suelo debe recogerse rápidamente, manteniendo su estructura depositándose en un recipiente y cubriéndose con agua, para sostener las condiciones anóxicas, evitando todo posible contacto con oxígeno.
Para el armado de la celda es recomendable utilizar un recipiente de vidrio, recipientes plásticos como botellas o bidones (no se debe usar recipientes metálicos que pueden interferir con las reacciones redox que ocurren en el ánodo). En nuestro caso, utilizamos vasos de precipitados de vidrio de 1000 ml. Al sedimento recogido se le adiciona una concentración conocida de hidrocarburo a remediar, por ejemplo diesel, y mezclar rápidamente. En el recipiente deben colocarse aproximadamente 3 cm de altura del sedimento contaminado, y encima se coloca uno de los electrodos que actuará como ánodo (dejando el cable conductor del electrodo libre), que se cubre a su vez con 6 cm adicionales de sedimento. Una vez armada la celda se debe pesar para luego comparar al final del ensayo con el peso final para determinar la cantidad de hidrocarburo remediado.
Una vez pesado, se debe verter agua sobre el mismo (agua destilada) y se debe suspender en agua el otro electrodo (cátodo), evitando su contacto con el lodo. El agua que cubre al cátodo se burbujea continuamente con un aireador de pecera para asegurar que la misma se encuentre saturada en O2. El cátodo no debe secarse, permaneciendo completamente sumergido en agua.
Los cables de los electrodos deben conectarse a una resistencia externa fija para cerrar el circuito. Para la elección de la resistencia hay que tener en cuenta que si el valor de la misma es muy alto, impedirá la transferencia de electrones del ánodo al cátodo y no habrá corriente eléctrica; si el valor es muy bajo, no habrá resistencia a la transferencia de electrones entre ánodo y cátodo, y no habrá diferencia de potencial entre ambos.
Una vez construida la celda es conveniente no perturbarla moviéndola para conservar las condiciones anóxicas en el sedimento.

Figura 2: Fotos de SMFC armada y de los electrodos. A) Electrodo de grafito conectado al cable y sellado con epoxy. B) Parte inferior del electrodo de grafito. Ambos electrodos tienen 7,5 cm de diámetro. C) Celda de combustible armada, donde se puede apreciar el cátodo sumergido en el agua y sin tocar sedimentos. D) SMFC conectada a caja de resistencias mientras se realizan las curvas de potencia y polarización.
Seguimiento y mediciones de las SMFCs:
Una vez que los SMFC están conectados a la resistencia de carga externa, es necesario dejarlas estabilizar 2-3 días antes de medir el voltaje. Los estudiantes pueden medir el potencial (E) con un multímetro. Brevemente, la corriente (i) se calculó como i = E/R, donde R es la resistencia del circuito externo (resistencia de carga, RL), que se puede reemplazar fácilmente. La potencia (P) se calculó como P = iE. Los valores de densidad de potencia (PD) y densidad de corriente (J) son los valores P e i que siempre se usaron y normalizaron por el área de superficie total del ánodo. Luego de 15 días de armadas y conectadas las celdas se dejan por 24-48h a circuito abierto (open circuit, OC), se mide el potencial de OC y luego se realizan las curvas de polarización. Se realiza la medición de los valores de E mientras se varía el RL (valores entre 100 kΩ y 100 Ω) lo que permite la construcción de curvas de polarización y potencia. Se registra el valor de E en cada RL al alcanzar un estado pseudo-estacionario [49, 50].
Conclusiones
El trabajo educativo con celdas de combustible microbianas, es una excelente oportunidad para trabajar dispositivos experimentales que remiten a problemáticas científicas genuinas, lo cual habilita la posibilidad de integrar distintas disciplinas de ciencias naturales, matemática e ingeniería. Encarar el diseño del dispositivo experimental de MFCs requiere considerar conceptos de microbiología, bioquímica, química y física, al tiempo que proporciona contextos auténticos de la vida real en temas de biorremediación, energía alternativa y sostenibilidad. Esta lógica de trabajo va en consonancia con recomendaciones didácticas actuales como las que propone el enfoque de aprendizaje STEM [51] y el enfoque de Enseñanza de Ciencias Naturales en Contexto [46,49]. En este sentido, creemos que esta propuesta didáctica desde un enfoque intrínsecamente integrador es una buena oportunidad para incorporar en distintos espacios curriculares de las distintas carreras de Ciencias Naturales y de Ingeniería, que paulatinamente van adoptando este tipo de miradas.
Creemos que el estudios de las MFCs, y en particular las SMFCs como diseño específico elegido por la sencillez para su armado, tienen un gran potencial para su uso en una amplia gama de problemáticas científicas adaptables al contexto de educación, y a distintos niveles educativos, pudiendo proponer incluso alternativas para la educación media, técnica o terciaria ya que presenta una propuesta de enseñanza contextualizada novedosa, motivadora e intelectualmente estimulante para los alumnos [46,49].
Referencias
1. Kanzari F, Syakti AD, Asia L, Malleret L, PiramA,Mille G, et al. (2014) Sci Total Environ 2014;478:141–51.
2. Hashim MA, Mukhopadhyay S, Sahu JN, Sengupta B. (2011). J Environ Manag 92:2355–2388.
3. Chisti Y. (2005) Biotechnol Adv 23:371–2.
4. Pandey B, Fulekar MH. B. (2012) Biol Med 4:51-59.
5. Meghara M, Ramakrishnan B, Venkateswarlu K, Sethunathan N, Naidu R.(2011) Environ Int 37:1362–75.
6. Juwarkar A, Singh S, Mudhoo A. (2010) Rev. Environ. Sci. Biotechnol 9:215-288.
7. Perelo LW. (2010) J Hazard Mater 177:81–9.
8. Slate AJ, Whitehead KA, Brownson DAC, Banks CE. (2019). Renewable Sustainable Energy Rev. 101:60–81.
9. Marsili E, Baron,DB, Shikhare ID, Coursolle D, Gralnick JA, Bond DR.(2008). PNAS 105:3968–3973.
10. Sacco NJ, Bonetto MC, Cortón E.(2017) PLoS ONE 12(2): e0169955.
11. Varanasi, J.L., Das, D. (2018). Characteristics of Microbes Involved in Microbial Fuel Cell. In: Das, D. (eds) Microbial Fuel Cell. Springer, Cham. https://doi.org/10.1007/978-3-319-66793-5_3
12. Revelo, Dolly M, Hurtado, Nelson H, & Ruiz, Jaime O. (2013). Celdas de combustible microbianas (CCMs): un reto para la remoción de materia orgánica y la generación de energía eléctrica. Información tecnológica, 24(6), 17-28. https://dx.doi.org/10.4067/S0718-07642013000600004
13. Logan, B. E. (2008). Microbial Fuel Cells. Wiley-Interscience.
14. Pant D, Van Bogaert G, Diels L, Vanbroekhoven K. (2010) Bioresour Technol 101:1533–1543.
15. Zhang Q, Hu J, Lee DJ. (2016) Bioresour. Technol. 217:121–128.
16. Rezaei F, Richard TL, Brennan RA, Logan BE. (2007). Environ Sci Technol 41:4053–8.
17. Logan BE. (2009). Nat Rev Microbiol 7:375–81.
18. Tender LM, Reimers CE, Stecher HA, Holmes DE, Bond DR, Lowy DA, et al.(2002) Nat Biotechnol 20:821–5.
19. Huang L, Cheng S, Chen GB. (2010) J Chem Technol Biotechnol 86:481–91.
20. Thrash JC, Coates JD. (2008) Environ Sci Technol 42:3921–31.
21. Ueno Y, Kitajima Y, Fava F, Gavrilescu M.(2012) Environ Eng Manag J. 11:1833–1837.
22. Wang W, Zhang Y, Li M, Wei X, Wang Y, Liu L, Wang H, Shen S. (2020) Bioresour Technol 314:123808.
23. Kabutey FT, Zhao Q, Wei L, Ding J, Antwi P, Quashie FK, Wang W. (2019) Renew. Sust. Energ. Rev. 110: 402–414.
24. Hochstrat R, Corvini PFX, Wintgens T. (2013) Rev Environ Sci Biotechnol 12:1–4.
25. Alvarez-Benítez L, Silva-Martínez S, Hernandez-Perez A, Kamaraj SK, Abbas SZ, Alvarez-Gallegos A. (2022) Catalysts 12:871.
26. Guo H, Ren W, Huang C, Yang Q, Tang S, Geng X, and Jia X. (2022) ACS Omega 7: 29959−29966
27. Li, X.; Zheng, R.; Zhang, X.; Liu, Z.; Zhu, R.; Zhang, X. (2019) J. Environ. Manag. 2235: 70–76
28. Yu, B.; Tian, J.; Feng, L. (2017) J. Hazard. Mater 336:110–118
29. Lu, L.; Yazdi, H.; Jin, S.; Zuo, Y.; Fallgren, P.H.; Ren, Z.J. (2014) J. Hazard. Mater. 274:8–15.
30. Y. Yang, M. Xu, J. Guo, G. Sun, Bacterial extracellular electron transfer in bioelectrochemical systems, Process Biochem. 47 (2012) 1707e1714, https://doi.org/10.1016/j.procbio.2012.07.032
31. Jung, S. P., & Pandit, S. (2019). Important Factors Influencing Microbial Fuel Cell Performance. Microbial Electrochemical Technology, 377–406. doi:10.1016/b978-0-444-64052-9.00015-7
32. Greenman, J., Gajda, I., You, J., Mendis, B. A., Obata, O., Pasternak, G., & Ieropoulos, I. (2021). Microbial fuel cells and their electrified biofilms. Biofilm, 3, 100057. doi:10.1016/j.bioflm.2021.100057
33. Hao D-C, Li X-J, Xiao P-G and Wang L-F (2020) The Utility of Electrochemical Systems in Microbial Degradation of Polycyclic Aromatic Hydrocarbons: Discourse, Diversity and Design. Frontiers in Microbiology. 11:557400. doi: 10.3389/fmicb.2020.557400
34. Li, X., Wang, X., Ren, Z. J., Zhang, Y., Li, N., & Zhou, Q. (2015). Sand amendment enhances bioelectrochemical remediation of petroleum hydrocarbon contaminated soil. Chemosphere, 141, 62–70. https://doi.org/10.1016/j.chemosphere.2015.06.025
35. Hsu, L., Chadwick, B., Kagan, J., Thacher, R., Wotawabergen, A., and Richter, K. (2013). Scale up considerations for sediment microbial fuel cells. RSC Adv. 3, 15947–15954. doi: 10.1039/c3ra43180k
36. Rousk, J., Brookes, P. C., & Bååth, E. (2009). Contrasting soil pH effects on fungal and bacterial growth suggest functional redundancy in carbon mineralization. Applied and environmental microbiology, 75(6), 1589–1596. https://doi.org/10.1128/AEM.02775-08
37. Kaushik, A., & Chetal, A. (2013). Power generation in microbial fuel cell fed with post methanation distillery effluent as a function of ph microenvironment. Bioresource Technology, 147, 77–83. https://doi.org/10.1016/j.biortech.2013.08.004
38. He, Z., Huang, Y., Manohar, A. K., & Mansfeld, F. (2008). Effect of electrolyte pH on the rate of the anodic and cathodic reactions in an air-cathode microbial fuel cell. Bioelectrochemistry, 74, 78–82
39. Borole, A. P., O’Neill, H., Tsouris, C., & Cesar, S. (2008). A microbial fuel cell operating at low pH using the acidophile Acidiphilium cryptum. Biotechnology Letters, 30, 1367–1372
40. Dopson, M., Ni, G., & Sleutels, T. H. (2016). Possibilities for extremophilic microorganisms in microbial electrochemical systems. FEMS Microbiology Reviews, 40, 164–181.
41. Venkata Mohan, S., Veer Raghavulu, S., & Sarma, P. N. (2008). Biochemical evaluation of bioelectricity production process from anaerobic wastewater treatment in a single chambered microbial fuel cell (MFC) employing glass wool membrane. Biosensors & Bioelectronics, 23, 1326–1332
42. Zhao, Q., Ji, M., Li, R., & Ren, Z. J. (2017). Long-term performance of sediment microbial fuel cells with multiple anodes. Bioresource Technology, 237, 178-185. https://doi.org/10.1016/j.biortech.2017.03.002
43. Hindatu, Y., Annuar, M. S. M., & Gumel, A. M. (2017). Mini-review: Anode modification for improved performance of Microbial Fuel Cell. Renewable and Sustainable Energy Reviews, 73, 236–248. https://doi.org/10.1016/j.rser.2017.01.138
44. Baudler, A., Schmidt, I., Langner, M., Greiner, A., & Schröder, U. (2015). Does it have to be carbon? metal anodes in microbial fuel cells and related bioelectrochemical systems. Energy & Environmental Science, 8(7), 2048–2055. https://doi.org/10.1039/c5ee00866b
45. Izquierdo-Aymerich, M. (2004). Un Nuevo Enfoque De La Enseñanza De La Química: contextualizar y modelizar. The Journal of the Argentine Chemical Society, 92(4–6), 115–136.
46. Pérgola, M. S., & Galagovsky, L. (2020). Enseñanza en contexto: la importancia de revelar obstáculos implícitos en docentes. Enseñanza de Las Ciencias, 38(2), 45–64. https://doi.org/https://doi.org/10.5565/rev/ensciencias.2822
47. Bennetto, H. P. (1990). Electricity generation by microorganisms. Biotechnology education, 1(4), 163–168.
48. Logan, B. E. (2011). Microbial Fuel Cells. New Jersey: John Wiley & Sons. doi:10.1016/B978-0-444-53199-5.00098-1
49. Pérgola, M., S., (2021). Estudio didáctico epistemológico sobre la enseñanza y el aprendizaje de aspectos redox de la respiración celular. Tesis Doctoral. Universidad de Buenos Aires. Facultad de Ciencias Exactas y Naturales. Recuperado de https://hdl.handle.net/20.500.12110/tesis_n7053_Pergola
50. Sacco, N. J., Figuerola, E. L., Pataccini, G., Bonetto, M. C., Erijman, L., y Cortón, E. (2012). Performance of planar and cylindrical carbon electrodes at sedimentary microbial fuel cells. Bioresource Technology, 126, 328–335. doi:10.1016/j.neuroimage.2012.02.035
51. Ortiz-Revilla, J., Adúriz-Bravo, A., & Greca, I. M. (2020). A framework for epistemological discussion on integrated STEM education. Science & Education, 29(4), 857-880..
|
Revista QuímicaViva Número 2, año 20, Agosto 2021 quimicaviva@qb.fcen.uba.ar |