La diversidad de los ribosomas
Paula Portela
Laboratorio de transducción de señales: especificidad de la señalización y adaptación celular al estrés. Departamento de Química Biológica, Facultad de Ciencias Exactas y Naturales. Universidad de Buenos Aires. IQUIBICEN-CONICET. Buenos Aires, Argentina.
Resumen
El control de la traducción es un paso clave en la determinación de los niveles proteicos celulares. Los ribosomas han sido descriptos como complejos ribonúcleoproteicos homogéneos que sintetizan proteínas a partir de mRNA. Estudios recientes han demostrado que los ribosomas no son todos iguales. La composición de los ribosomas difiere no solo en las proteínas ribosomales sino también en las proteínas asociadas o accesorias según el compartimiento subcelular o tejido. Se ha demostrado que ciertas poblaciones de ribosomas heterogéneos traducen un grupo de mRNAs específicos, es decir que presentan una especialización de la función ribosomal. En este artículo, se describen los mecanismos que generan heterogeneidad ribosomal y qué funciones especializadas presentan en respuesta a estrés, especialmente haciendo foco en la levadura Saccharomyces cerevisiae. Por último, se discute una de las preguntas emergentes en la biología del ribosoma: ¿la heterogeneidad ribosomal implica especificidad?
Palabras clave: Traducción, Heterogeneidad ribosomal; Especialización ribosomal
Ribosome diversity
Summary
Control of translation is a key step to state cellular protein levels. Ribosomes have been described as homogeneous ribonucleoprotein complexes that synthesize proteins from mRNA. Recent studies have shown that ribosomes are not all equal. The composition of ribosomes differs not only in ribosomal proteins but also in associated or accessory factor proteins according to the subcellular compartment or tissue. It has been shown that in some cases, heterogeneous population of ribosomes can exhibit functional specialization through the translation of particular subsets of mRNAs. In this article, we describe the mechanisms that produce ribosomal heterogeneity and their specialized functions in response to stress, specially focusing on the yeast Saccharomyces cerevisiae. Finally, one of the emerging question in ribosomal biology is discussed: does ribosomal heterogeneity imply specificity?
Keywords: Translation; Ribosome heterogeneity; Ribosome specialization
Ribosomas: biogénesis y composición.
La regulación de la traducción de proteínas es un proceso clave para el ajuste del proteoma celular en respuesta a la disponibilidad de nutrientes, diferenciación celular y crecimiento [1]. La composición del proteoma y la abundancia de las proteínas están reguladas por diferentes mecanismos, tales como el nivel de transcripción y decaimiento de los mRNAs y la asociación de éstos a ribosomas, la modulación de la tasa de traducción y la estabilidad de las proteínas [2].
Los ribosomas son complejos ribonucleoproteicos formados por RNA ribosomal (rRNAs) y proteínas ribosomales (PRs). Los ribosomas traducen el código genético del RNA mensajero (mRNA) y catalizan la síntesis de proteínas en todos los tipos celulares. Si bien los dominios funcionales de los ribosomas están conservados entre bacterias y eucariotas, los ribosomas eucariotas son más complejos tanto en los rRNAs como en las PRs. En bacterias, los ribosomas poseen una subunidad menor 30S compuesta por rRNA 16S (1,5 kb) y 21 PRs y una subunidad mayor 50S por el rRNA 23S (2,9 Kb), rRNA 5S (120 nt) y 31 PRs [3]. El ribosoma eucariota está formado por una subunidad mayor 60S, compuesto por tres rRNAs 25S (5 Kb), rRNA 5.8S (160 nt), 5S) y 46 PRs, y la subunidad pequeña 40S, compuesta por 18S rRNA (1,9 kb) y 33 PRs [4].
En eucariotas, la biogénesis ribosomal es mediada por 200 factores de ensamblaje (AFs, ribosome assembly factors) y aproximadamente 80 RNAs nucleolares pequeños (snoRNA). Las partículas pre-ribosomales son ensambladas en el nucleolo y conforme éstas maduran son transportadas a través del nucleoplasma, atraviesan el poro nuclear y completan su maduración, a subunidades 60S y 40S competentes, en citoplasma. Los factores que participan en la biogénesis ribosomal se encuentran muy conservados entre los eucariotas, e incluyen proteínas de unión a RNA, endo y exonucleasas, RNA helicasas, GTPasas y ATPasas. En la transcripción de los rRNA participan las tres RNA polimerasas: la RNA Pol I sintetiza el precursor rRNA 35S, la RNA Pol III sintetiza el rRNA 5S and la RNA Pol II sintetiza los snoRNAs y los mRNA de las PRs. Los pre-rRNA son procesados co-transcripcionalmente en el nucleolo, adquieren estructura, sufren digestión endo-nucleotídica y las bases nucleotídicas son modificadas por metilación o pseudouridinilación. Inmediatamente, los factores de ensamblado y las PRs se asocian con los pre-rRNAs para formar las partículas pre-ribosomales, las cuales sufren el proceso de maduración, son exportados al citoplasma donde completan su maduración para formar las partículas 60S y 40S. En los artículos de revisión de Kressler et al y Bassler y Hurt [5] [6] se describe en detalle el proceso de síntesis de ribosomas, la relación con otras vías celulares y cómo alteraciones en la biosíntesis de ribosomas está asociada con enfermedades en humanos.
Proteínas ribosomales.
En hongos y plantas la mayoría de las PRs están codificadas por más de un gen, mientras que los genomas de animales presentan solo algunos genes de PRs duplicados [7] [8] [9].
Específicamente en Saccharomyces cerevisiae, 118 de los 137 genes de PRs se encuentran duplicados. Éstos se ubican en diferentes cromosomas y su expresión es controlada por diferentes promotores. Actualmente se postula que las PR parálogas se originaron como consecuencia de un evento de duplicación de genoma completo hace 150 millones de años, antes de que los linajes Saccharomyces y Kluyveromyces divergieran. Posteriormente a esta duplicación se produjo la pérdida de los genes duplicados por un proceso de degeneración. Sólo algunos pocos genes, entre los que se encontraban las PRs, mantuvieron ambos pares de parálogos [10]. Los genes de PRs duplicados lograron preservarse ya que los pares de parálogos evolucionaron con funciones diferentes. Se ha probado que una copia cumple funciones durante el crecimiento en condiciones normales y la otra copia durante la adaptación a condiciones de estrés [11].
En S. cerevisiae los promotores de los genes de PRs se clasifican según qué tipo de factor de transcripción que los regulan. Los de clase I unen Rap1, el complejo FIS y Hmo1; los de clase II unen Rap1 y el complejo FIS y los de clase III poseen sitios de unión para Abf1 [12]. Se ha demostrado que no existe una correlación directa entre la actividad de los promotores con arquitectura similar y los niveles de mRNA que se transcriben a partir de ellos. Esta observación se hace evidente para el caso de genes de PRs duplicados, donde un parálogo del par se expresa más que el otro, produciendo poblaciones de ribosomas mayoritarias en el parálogo más abundante [13] [14] [11] [15].
En S. cerevisiae la mayoría de los genes PRs se expresan y las proteínas son incorporados a la partícula ribosomal [13] [16]. La partícula ribosomal está formada por 79 PRs, de las cuales 20 PRs son codificadas por un gen y 59 PRs son codificadas por pares de genes parálogos. De los 59 pares de PR parálogas, 22 son proteínas idénticas y 37 son proteínas que difieren en al menos un aminoácido. Los pares de PR parálogas con diferencias en su secuencia peptídica se expresan diferencialmente en condiciones óptimas de crecimiento, a excepción de los pares Rpl 34A/B, Rpl 6A/B y Rps 29A/B que producen cantidades similares de ambos parálogos [13]. El parálogo que se expresa preferencialmente se denomina “parálogo mayor”, y el parálogo que se expresa en menor cantidad “parálogo menor”. Cabe aclarar que la designación usada en la nomenclatura de las PR parálogas de “A” y “B” no tiene relación con la cantidad de proteína producida [13].
Las diferencias en la expresión proteica entre parálogos en Sacharomyces cerevisae se debe a diferencias en la eficiencia de splicing y traducción. La asociación de los mRNAs de cada parálogo a polirribosomas se correlaciona en la mitad de los casos con la abundancia proteica de las PR. Generalmente, los parálogos mayores presentan mayor asociación de sus mRNAs a polirribosomas. Únicamente en los pares Rpl 37 A/B y Rps 8 A/B se observó una correlación negativa entre la abundancia proteica y la asociación a polirribosomas. En los pares de parálogos Rpl37A/B y Rps 8A/B la menor abundancia del mRNA del parálogo menor se compensa con una mayor traducción de dicho parálogo [13]. Bajo estrés, la expresión de los parálogos mayores es reprimido específicamente desplazando la formación de ribosomas conformados por el parálogo menor.
Para los casos en los cuales los genes de PRs duplicadas no poseen intrón, la regulación de la expresión entre parálogos depende del 3´UTR (untranslated region) de sus mRNAs. El largo y secuencia de los 5´y 3´UTR promueven una regulación diferencial en la expresión proteica en base a diferencias en las eficiencias de terminación de la transcripción, estabilidad y traducción. Los mecanismos de expresión génica y la regulación post transcripcional que controla la expresión de PRs son descriptos Petibon et al [17].
Ribosomas heterogéneos y especializados.
El rol de ribosomas especializados en la adaptabilidad del proteoma frente a cambios en el medio ambiente ha ganado gran relevancia en los últimos años. Previamente se consideraba que los ribosomas presentes en las células, tejidos u organismos eran homogéneos, es decir todos iguales. Sin embargo, se ha demostrado la existencia de distintas poblaciones de ribosomas a lo largo de todo el árbol filogenético. La presencia de ribosomas con composición diferente es definida con el término “heterogeneidad ribosomal” (Figura 1). En algunos casos se ha podido demostrar que la heterogeneidad ribosomal genera ribosomas con actividad traduccional diferente y/o selectividad específica hacia subgrupos de mRNAs. A partir de estas observaciones se define el mecanismo de “especialización de ribosomas” [18].
Se ha descripto que la heterogeneidad ribosomal es generada por cambios en la estequiometría de PRs [19], la presencia de PRs parálogas [20] [21] [13], presencia/ausencia de PRs [22], presencia/ausencia de factores proteicos asociados a ribosomas [23], modificación post traduccional de PRs o factores auxiliaries [24] [25]. Además, los rRNAs proveen variabilidad en los ribosomas ya que existen diferencias en la secuencia nucleotídica y longitud de los rRNA, así como en las modificaciones de las bases nucleotídicas [26] [27] [28].
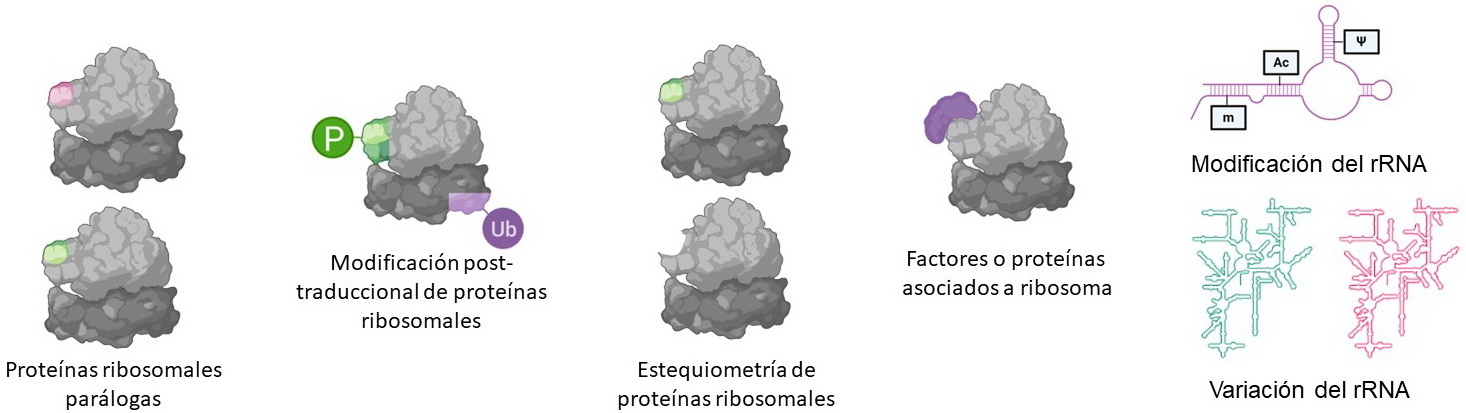
Figura 1: Representación esquemática de algunos mecanismos que contribuyen a la heterogeneidad ribosomal.
En la mosca Drosophila melanogaster se demostró que durante la espermatogénesis se producen ribosomas heterólogos por la presencia de PR parálogas de eRpL22 los cuales regulan la traducción de mRNAs específicos [29]. En la planta Arabidopsis thaliana se describió que los parálogos de Rpl10 tienen diferentes roles en la traducción de proteínas en respuesta a irradiación con luz ultravioleta o durante el desarrollo de la planta [30]. Si bien en mamíferos la mayoría de las PRs están codificadas por gen único, se ha reportado excepciones, como por ejemplo la expresión diferencial de los parálogos Rpl22 y Rpl22L1 que afecta la morfología y viabilidad de embriones de ratones [31]. Además, se demostró en ratones que la expresión de Rpl38 regula la traducción de un grupo de mRNAs de genes Homeobox, lo que impacta en el desarrollo del esqueleto axial en embriones [32].
En S cerevisiae las condiciones de crecimiento impactan en la estequiometria de las PRs que conforman la partícula ribosomal. La transición del metabolismo fermentativo a respiratorio cambia la proporción de ribosomas que contienen Rpl8A o Rpl8B, y cada parálogo posee funciones específicas [33]. Además se ha descripto que el parálogo Rpl 1B mejora la eficiencia de traducción de mRNAs que codifican para proteínas mitocondriales bajo metabolismo respiratorio [21]. Por otro lado, se ha demostrado que la exposición de células de S. cerevisiae al estrés osmótico o a pH ácido promueve la formación de ribosomas que no poseen Rps26. Ribosomas que carecen de Rps26 reconocen mRNAs con desviaciones de las secuencias Kozak favoreciendo la traducción de proteínas con funciones en la regualción de la transcripción, reparación de DNA y ciclo celular [34]. Además, en respuesta a etanol o concentraciones bajas de glucosa, los niveles relativos de las PRs cambian según el número de ribosomas asociados al mRNA (es decir, monosoma, diosma, trisoma o polirribosoma) [35]. Durante el estadio quiescente las células pausan transitoriamente el crecimiento. Se ha determinado que la composición de los ribosomas varía entre monosomas y polisomas en células quiescentes estimuladas con nutrientes. La deleción individual de genes correspondientes a las PRs resulta en alteraciones de la traducción sugiriendo que la heterogeneidad ribosomal durante la quiescencia conduce a diferencias en la traducción (resultados no publicados Solari y Portela, 2019). Ya que las células de levaduras y mamíferos presentan características conservadas durante la quiescencia [36], las levaduras son un organismo modelo que permite estudiar el mecanismo molecular que controla la quiescencia en las células de los mamíferos.
Además de las variaciones en la PRs, las proteínas asociadas a la superficie del ribosoma también le confieren a éste funciones especializadas. En levaduras, el segmento ES27L (segmento expandido más grande del rRNA 25S) del ribosoma expone una superficie de andamiaje en la cual se recluta la enzima amino-peptidasa de metionina que regula la fidelidad de la traducción [37]. También se ha descripto en levaduras que la proteína Asc1 (RACK1 en humanos) junto con las proteínas ribosomales Rps2, Rps3, y Rps20 forman una zona expuesta de contacto que queda ubicada en la región head de la subunidad 40S. En esta región interaccionan factores que participan en varios procesos como ubiquitiquinación-deubiquitinacion de PRs, unión de las subunidades ribosomales inactivas, control calidad de mRNA, autofagia y señalización vía proteínas quinasas [38].
Se ha demostrado en mamíferos que la proteína SMN (Survival Motor Neuron)- cuya pérdida causa la atrofia muscular espinal- se une a los ribosomas traduccionalmente activos en tejido neuronal. Los ribosomas asociados con SMN se encontraron preferentemente enriquecidos en los primeros 5 codones de un grupo de mRNAs que poseen un contenido mayor de codones raros y elementos enhancer de traducción. Dichos mRNAs están asociados con diferentes procesos como la neurogénesis, metabolismo de lípidos, ubiquitinación de proteínas, regulación de la cromatina y traducción [39].
La importancia de la especialización de ribosomas tejido específico se evidencia en las ribosomopatías las cuales se originan por mutaciones en los genes ribosomales. Estas mutaciones afectan la abundancia y/o la función de la PRs manifestándose en tejidos específicos como linajes derivados de medula ósea [40] [41] y tejido esquelético [42]. Por ejemplo, la mutación de la proteína RPSA/uS2 provoca asplenia (ausencia de bazo) congénita en la cual los pacientes nacen sin bazo [43]. Otro ejemplo corresponde a la anemia de Diamond y Blackfan (ADB), la cual se caracteriza por una disminución de precursores eritroides en medula ósea. Se ha descripto, entre otros genes, a RPS7, RPL15, RPL35A, RPL9, RPS10, RPL26, RPS15A, RPL27, RPS19 como genes asociados a ADB [44, 45].
¿La presencia de heterogeneidad ribosomal implica especialización ribosomal?
La biosíntesis de ribosomas representa un gran gasto energético para las células y éstas poseen mecanismos muy controlados para asegurar la integridad funcional de los ribosomas. Las modificaciones en la composición del ribosoma pueden llevar a variaciones en la actividad traduccional que desencadenen, por ejemplo, mecanismos de control del tipo NGD (Non-Go Decay:) ,mecanismo de control de la traducción que lleva a la degradación de los mRNA que poseen ribosomas frenados [46]. Mas aún, dichas modificaciones pueden tener efectos nocivos sobre la viabilidad celular o el funcionamiento del organismo. Esto es evidente, como hemos mencionado anteriormente, en las diferentes enfermedades asociadas a variación en la composición de ribosomas por falta de alguna PR. Sin embargo, esto no descarta la existencia de ribosomas heterogéneos con roles funcionales en procesos fisiológicos específicos. Las modificaciones que producen heterogeneidad ribosomal pueden ser sub-estequiométricas en condiciones normales, mientras que, la proporción puede aumentar en respuesta a un estímulo especifico, como el hambreado, estrés o estadio del ciclo celular. Sin embargo, el efecto de los ribosomas especializados en la traducción global podría ser pequeño por lo que la identificación del mecanismo regulatorio sobre la traducción se convierte en un desafío complejo. Las evidencias acerca de la heterogeneidad ribosomal han ganado fuerza a partir del avance en técnicas como la purificación de ribosomas con composición diferente y espectrometría de masa.
Si bien existen estudios que han demostrado que la heterogeneidad puede generar especialización, en la actualidad el mayor desafío es la caracterización bioquímica de los ribosomas con composición diferente. Las estrategias empleadas involucran la purificación por afinidad de ribosomas (empleando células que expresan PRs etiquetadas como proteínas de fusión con flags) a partir de fracciones de polirribosomas obtenidas desde un gradiente de sacarosa. A continuación, se realiza la secuenciación de los mRNA asociados a los ribosomas purificados para identificar que mRNAs que son traducidos por diferentes tipos de ribosomas [47] [48]. Además, se emplean estrategias que determinan la identidad de todas las proteínas que se traducen vía marcación con puromicina de cadenas polipeptídicas nacientes y posterior espectrometría de masas [49].
Aún queda por avanzar en la caracterización estructural de las interacciones mRNA-ribosoma para dilucidar el mecanismo molecular que rige la especialización de los ribosomas heterogéneos. En la actualidad, la comunidad científica interesada en los ribosomas pone en discusión los avances y dificultades en la caracterización funcional de los ribosomas heterogéneos [50] [51] [52] [21].
Referencias
1. Shu XE, Swanda RV, Qian SB. Nutrient Control of mRNA Translation. Annu Rev Nutr. 2020;40:51-75. Epub 20200706. doi: 10.1146/annurev-nutr-120919-041411.
2. Liu Y, Beyer A, Aebersold R. On the Dependency of Cellular Protein Levels on mRNA Abundance. Cell. 2016;165(3):535-50. doi: 10.1016/j.cell.2016.03.014.
3. Vasiliev VD, Selivanova OM, Baranov VI, Spirin AS. Structural study of translating 70 S ribosomes from Escherichia coli. I. Electron microscopy. FEBS Lett. 1983;155(1):167-72. doi: 10.1016/0014-5793(83)80232-4.
4. Pena C, Hurt E, Panse VG. Eukaryotic ribosome assembly, transport and quality control. Nat Struct Mol Biol. 2017;24(9):689-99. doi: 10.1038/nsmb.3454.
5. Kressler D, Hurt E, Bassler J. A Puzzle of Life: Crafting Ribosomal Subunits. Trends Biochem Sci. 2017;42(8):640-54. Epub 20170601. doi: 10.1016/j.tibs.2017.05.005.
6. Bassler J, Hurt E. Eukaryotic Ribosome Assembly. Annu Rev Biochem. 2019;88:281-306. Epub 20181219. doi: 10.1146/annurev-biochem-013118-110817.
7. Dharia AP, Obla A, Gajdosik MD, Simon A, Nelson CE. Tempo and mode of gene duplication in mammalian ribosomal protein evolution. PLoS One. 2014;9(11):e111721. Epub 20141104. doi: 10.1371/journal.pone.0111721.
8. Nakao A, Yoshihama M, Kenmochi N. RPG: the Ribosomal Protein Gene database. Nucleic Acids Res. 2004;32(Database issue):D168-70. doi: 10.1093/nar/gkh004.
9. Wapinski I, Pfiffner J, French C, Socha A, Thompson DA, Regev A. Gene duplication and the evolution of ribosomal protein gene regulation in yeast. Proc Natl Acad Sci U S A. 2010;107(12):5505-10. Epub 20100308. doi: 10.1073/pnas.0911905107.
10. Langkjaer RB, Cliften PF, Johnston M, Piskur J. Yeast genome duplication was followed by asynchronous differentiation of duplicated genes. Nature. 2003;421(6925):848-52. doi: 10.1038/nature01419.
11. Parenteau J, Lavoie M, Catala M, Malik-Ghulam M, Gagnon J, Abou Elela S. Preservation of Gene Duplication Increases the Regulatory Spectrum of Ribosomal Protein Genes and Enhances Growth under Stress. Cell Rep. 2015;13(11):2516-26. Epub 20151210. doi: 10.1016/j.celrep.2015.11.033.
12. Knight B, Kubik S, Ghosh B, Bruzzone MJ, Geertz M, Martin V, et al. Two distinct promoter architectures centered on dynamic nucleosomes control ribosomal protein gene transcription. Genes Dev. 2014;28(15):1695-709. doi: 10.1101/gad.244434.114.
13. Ghulam MM, Catala M, Abou Elela S. Differential expression of duplicated ribosomal protein genes modifies ribosome composition in response to stress. Nucleic Acids Res. 2020;48(4):1954-68. doi: 10.1093/nar/gkz1183.
14. Parenteau J, Durand M, Morin G, Gagnon J, Lucier JF, Wellinger RJ, et al. Introns within ribosomal protein genes regulate the production and function of yeast ribosomes. Cell. 2011;147(2):320-31. doi: 10.1016/j.cell.2011.08.044.
15. Petibon C, Parenteau J, Catala M, Elela SA. Introns regulate the production of ribosomal proteins by modulating splicing of duplicated ribosomal protein genes. Nucleic Acids Res. 2016;44(8):3878-91. Epub 20160303. doi: 10.1093/nar/gkw140.
16. Simoff I, Moradi H, Nygard O. Functional characterization of ribosomal protein L15 from Saccharomyces cerevisiae. Curr Genet. 2009;55(2):111-25. Epub 20090128. doi: 10.1007/s00294-009-0228-z.
17. Petibon C, Malik Ghulam M, Catala M, Abou Elela S. Regulation of ribosomal protein genes: An ordered anarchy. Wiley Interdiscip Rev RNA. 2021;12(3):e1632. Epub 20201010. doi: 10.1002/wrna.1632.
18. Genuth NR, Barna M. The Discovery of Ribosome Heterogeneity and Its Implications for Gene Regulation and Organismal Life. Mol Cell. 2018;71(3):364-74. doi: 10.1016/j.molcel.2018.07.018.
19. Emmott E, Jovanovic M, Slavov N. Ribosome Stoichiometry: From Form to Function. Trends Biochem Sci. 2019;44(2):95-109. Epub 20181122. doi: 10.1016/j.tibs.2018.10.009.
20. Whittle CA, Krochko JE. Transcript profiling provides evidence of functional divergence and expression networks among ribosomal protein gene paralogs in Brassica napus. Plant Cell. 2009;21(8):2203-19. Epub 20090825. doi: 10.1105/tpc.109.068411.
21. Segev N, Gerst JE. Specialized ribosomes and specific ribosomal protein paralogs control translation of mitochondrial proteins. J Cell Biol. 2018;217(1):117-26. Epub 20171108. doi: 10.1083/jcb.201706059.
22. Komili S, Farny NG, Roth FP, Silver PA. Functional specificity among ribosomal proteins regulates gene expression. Cell. 2007;131(3):557-71. doi: 10.1016/j.cell.2007.08.037.
23. Simsek D, Tiu GC, Flynn RA, Byeon GW, Leppek K, Xu AF, et al. The Mammalian Ribo-interactome Reveals Ribosome Functional Diversity and Heterogeneity. Cell. 2017;169(6):1051-65 e18. doi: 10.1016/j.cell.2017.05.022.
24. Ruvinsky I, Sharon N, Lerer T, Cohen H, Stolovich-Rain M, Nir T, et al. Ribosomal protein S6 phosphorylation is a determinant of cell size and glucose homeostasis. Genes Dev. 2005;19(18):2199-211. doi: 10.1101/gad.351605.
25. Ceci M, Gaviraghi C, Gorrini C, Sala LA, Offenhauser N, Marchisio PC, et al. Release of eIF6 (p27BBP) from the 60S subunit allows 80S ribosome assembly. Nature. 2003;426(6966):579-84. doi: 10.1038/nature02160.
26. Gunderson JH, Sogin ML, Wollett G, Hollingdale M, de la Cruz VF, Waters AP, et al. Structurally distinct, stage-specific ribosomes occur in Plasmodium. Science. 1987;238(4829):933-7. doi: 10.1126/science.3672135.
27. Parks MM, Kurylo CM, Dass RA, Bojmar L, Lyden D, Vincent CT, et al. Variant ribosomal RNA alleles are conserved and exhibit tissue-specific expression. Sci Adv. 2018;4(2):eaao0665. Epub 20180228. doi: 10.1126/sciadv.aao0665.
28. Sloan KE, Warda AS, Sharma S, Entian KD, Lafontaine DLJ, Bohnsack MT. Tuning the ribosome: The influence of rRNA modification on eukaryotic ribosome biogenesis and function. RNA Biol. 2017;14(9):1138-52. Epub 20161202. doi: 10.1080/15476286.2016.1259781.
29. Mageeney CM, Ware VC. Specialized eRpL22 paralogue-specific ribosomes regulate specific mRNA translation in spermatogenesis in Drosophila melanogaster. Mol Biol Cell. 2019;30(17):2240-53. Epub 20190612. doi: 10.1091/mbc.E19-02-0086.
30. Ferreyra ML, Biarc J, Burlingame AL, Casati P. Arabidopsis L10 ribosomal proteins in UV-B responses. Plant Signal Behav. 2010;5(10):1222-5. Epub 20101001. doi: 10.4161/psb.5.10.12758.
31. Zhang Y, O'Leary MN, Peri S, Wang M, Zha J, Melov S, et al. Ribosomal Proteins Rpl22 and Rpl22l1 Control Morphogenesis by Regulating Pre-mRNA Splicing. Cell Rep. 2017;18(2):545-56. doi: 10.1016/j.celrep.2016.12.034.
32. Kondrashov N, Pusic A, Stumpf CR, Shimizu K, Hsieh AC, Ishijima J, et al. Ribosome-mediated specificity in Hox mRNA translation and vertebrate tissue patterning. Cell. 2011;145(3):383-97. doi: 10.1016/j.cell.2011.03.028.
33. Samir P, Browne CM, Rahul, Sun M, Shen B, Li W, et al. Identification of Changing Ribosome Protein Compositions using Mass Spectrometry. Proteomics. 2018;18(20):e1800217. doi: 10.1002/pmic.201800217.
34. Ferretti MB, Ghalei H, Ward EA, Potts EL, Karbstein K. Rps26 directs mRNA-specific translation by recognition of Kozak sequence elements. Nat Struct Mol Biol. 2017;24(9):700-7. Epub 20170731. doi: 10.1038/nsmb.3442.
35. Slavov N, Semrau S, Airoldi E, Budnik B, van Oudenaarden A. Differential Stoichiometry among Core Ribosomal Proteins. Cell Rep. 2015;13(5):865-73. Epub 20151022. doi: 10.1016/j.celrep.2015.09.056.
36. Valcourt JR, Lemons JM, Haley EM, Kojima M, Demuren OO, Coller HA. Staying alive: metabolic adaptations to quiescence. Cell Cycle. 2012;11(9):1680-96. Epub 20120501. doi: 10.4161/cc.19879.
37. Fujii K, Susanto TT, Saurabh S, Barna M. Decoding the Function of Expansion Segments in Ribosomes. Mol Cell. 2018;72(6):1013-20 e6. doi: 10.1016/j.molcel.2018.11.023.
38. Schmitt K, Kraft AA, Valerius O. A Multi-Perspective Proximity View on the Dynamic Head Region of the Ribosomal 40S Subunit. Int J Mol Sci. 2021;22(21). Epub 20211028. doi: 10.3390/ijms222111653.
39. Lauria F, Bernabo P, Tebaldi T, Groen EJN, Perenthaler E, Maniscalco F, et al. SMN-primed ribosomes modulate the translation of transcripts related to spinal muscular atrophy. Nat Cell Biol. 2020;22(10):1239-51. Epub 20200921. doi: 10.1038/s41556-020-00577-7.
40. Boria I, Garelli E, Gazda HT, Aspesi A, Quarello P, Pavesi E, et al. The ribosomal basis of Diamond-Blackfan Anemia: mutation and database update. Hum Mutat. 2010;31(12):1269-79. doi: 10.1002/humu.21383.
41. Aspesi A, Ellis SR. Rare ribosomopathies: insights into mechanisms of cancer. Nat Rev Cancer. 2019;19(4):228-38. doi: 10.1038/s41568-019-0105-0.
42. Dauwerse JG, Dixon J, Seland S, Ruivenkamp CA, van Haeringen A, Hoefsloot LH, et al. Mutations in genes encoding subunits of RNA polymerases I and III cause Treacher Collins syndrome. Nat Genet. 2011;43(1):20-2.
43. Bolze A, Mahlaoui N, Byun M, Turner B, Trede N, Ellis SR, et al. Ribosomal protein SA haploinsufficiency in humans with isolated congenital asplenia. Science. 2013;340(6135):976-8. Epub 20130411. doi: 10.1126/science.1234864.
44. Skorodumova LO, Davydenko KA, Filatova AY, Skoblov MY, Kulemin NA, Khadzhieva MB, et al. Splice-site variant in the RPS7 5'-UTR leads to a decrease in the mRNA level and development of Diamond-Blackfan anemia. Clin Genet. 2022. Epub 20220904. doi: 10.1111/cge.14221.
45. Tamefusa K, Muraoka M, Washio K, Wakamatsu M, Shimada A. Late-onset familial Diamond-Blackfan anemia with neutropenia caused by RPL35A variant. Pediatr Int. 2022;64(1):e15275. doi: 10.1111/ped.15275.
46. Doma MK, Parker R. Endonucleolytic cleavage of eukaryotic mRNAs with stalls in translation elongation. Nature. 2006;440(7083):561-4. doi: 10.1038/nature04530.
47. Halbeisen RE, Scherrer T, Gerber AP. Affinity purification of ribosomes to access the translatome. Methods. 2009;48(3):306-10. Epub 20090503. doi: 10.1016/j.ymeth.2009.04.003.
48. Emmott E, Jovanovic M, Slavov N. Approaches for Studying Ribosome Specialization. Trends Biochem Sci. 2019;44(5):478-9. Epub 20190218. doi: 10.1016/j.tibs.2019.01.008.
49. Aviner R, Geiger T, Elroy-Stein O. Genome-wide identification and quantification of protein synthesis in cultured cells and whole tissues by puromycin-associated nascent chain proteomics (PUNCH-P). Nat Protoc. 2014;9(4):751-60. Epub 20140306. doi: 10.1038/nprot.2014.051.
50. Barna M, Karbstein K, Tollervey D, Ruggero D, Brar G, Greer EL, et al. The promises and pitfalls of specialized ribosomes. Mol Cell. 2022;82(12):2179-84. doi: 10.1016/j.molcel.2022.05.035.
51. Ferretti MB, Karbstein K. Does functional specialization of ribosomes really exist? RNA. 2019;25(5):521-38. Epub 20190207. doi: 10.1261/rna.069823.118.
52. Norris K, Hopes T, Aspden JL. Ribosome heterogeneity and specialization in development. Wiley Interdiscip Rev RNA. 2021;12(4):e1644. Epub 20210209. doi: 10.1002/wrna.1644.
|
Revista QuímicaViva Número 3, año 21, Diciembre 2022 quimicaviva@qb.fcen.uba.ar |