Efecto de la melaza sobre parámetros de calidad del agua usada en la cría del camarón blanco (Litopenaeusvannamei).
Yudelquis Aldana Calderón1, Eugenio Torres Rodríguez2, Yans Guardia Puebla2 ,Jesús Armando Álvarez Hidalgo1, Yuneikis Fonseca Turruella3
1 Camaronera del Litoral Sur (Calisur). Rio Cauto, Granma, 2Centro de Estudios de Química Aplicada. Universidad de Granma. 3Centro Universitario Municipal. Yara. Cuba.
Recibido: 09/03/2021 - Aceptado: 25/08/2021
Resumen
El presente trabajo fue realizado en la Camaronera del Litoral Sur (Calisur), localizada en la costa sur oriental de Cuba, donde la precría intensiva de poslarvas es una etapa crucial en el ciclo productivo de la camaronera. Se realizó un diseño Multi-factor categórico con el empleo del software StatgraphicsCenturion, con la estimación del efecto de tres factores (densidad de siembra, método de adición de melaza y relación C:N). Se midieron parámetros físico-químicos y microbiológicos de calidad del agua. Se llevaron a cabo ciclos de 15 días de cultivo intensivo de poslarvas, en recipientes de 20 L con aireación constante. La alimentación fue realizada en 8 dosis diarias, utilizando para ello alimento con 45 % de proteína, y la melaza fue añadida diariamente en las siguientes cantidades:1,58g, 2,36g y 3,15g, por cada gramo de alimento. Para las relaciones C: N: 10:1; 15:1 y 20:1 se añadieron directamente al agua 62,5 mg, 93,75 mg y 125 mg respectivamente, por cada 0,1 mg/L de nitrógeno amoniacal total (NAT). La aplicación de la melaza resultó ser una alternativa para el control de los niveles de amonio. Los mejores resultados se obtuvieron con la adición de melaza en el alimento, siendo la mejor corrida experimental la que utilizó una densidad de 15 poslarvas por litro y la relación C:N 15:1.
Palabras clave: Litopenaeusvannamei, poslarvas, melaza, calidad de agua.
Effect of molasses on quality parameters of the water used in the breeding of white shrimp (Litopenaeusvannamei)
Summary
The present work was carried out in the Camaronera (Shrimp farming station) from Litoral Sur (Calisur), located on the south-eastern coast of Cuba, where intensive post-larval breeding is a crucial stage in the shrimp production cycle. A categorical Multi-factor design was made using the Statgraphics Centurion software, with the estimation of the effect of three factors (stocking density, molasses addition method and C:N ratio). Physicochemical and microbiological parameters of water quality were measured. Cycles of 15 days of intensive culture of postlarvae were carried out in 20 L containers with constant aeration. The feeding was carried out in 8 daily doses, using for it food with 45% of protein, and the molasses was added daily in the following amounts: 1.58 g, 2.36 g and 3.15 g, for each gram of food. For the C:N: 10: 1 ratios; 15: 1 and 20: 1 62.5 mg, 93.75 mg and 125 mg respectively were added directly to the water, for each 0.1 mg / L of total ammoniacal nitrogen (NAT). The application of molasses turned out to be an alternative for controlling ammonium levels. The best results were obtained with the addition of molasses in the feed, the best experimental run being that which used a density of 15 postlarvae per liter and the C:N ratio 15: 1.
Keywords: Litopenaeusvannamei, poslarvae, molasses, water quality
Introducción
El camarón blanco del Pacífico Litopenaeusvannameies la especie de crustáceo más ampliamente cultivada a nivel mundial [1]. Se introdujo en Cuba en el 2003 y constituye una actividad priorizada, debido a su alta demanda en el mercado y por ser un rubro de exportación importante [2]. La Camaronera del Litoral Sur (Calisur) con 957,9 hectáreas es la de mayor extensión de Cuba, en los últimos años ha incrementado el rendimiento productivo, aunque la sobrevivencia en la precría intensiva no ha mostrado los mejores resultados [3].
El cultivo intensivo se caracteriza por la alta densidad de animales por unidad de área, por lo que una gran cantidad de alimento, con alto contenido proteico, debe ser añadido al sistema de cultivo. En el alimento del camarón las proteínas constituyen el principal nutriente, no solo por su rol importante en el crecimiento y la sobrevivencia, sino además por su impacto en la calidad del agua como la principal fuente de nitrógeno. Solo del 10–20% del nitrógeno contenido en el alimento es retenido por el camarón, el restante quedará en el agua como resultado del metabolismo de las proteínas y de la descomposición por microorganismos, en la forma ionizada o como amoníaco, este último tóxico [4,5], afectando la salud de los animales cultivados e impactando negativamente el crecimiento y la sobrevida [6].
La toxicidad del amonio sobre el camarón ha sido reportada por numerosos investigadores [6,7], por lo que la conversión del amonio tóxico a la forma no tóxica de nitrógeno es una de las cuestiones más importantes en el manejo de calidad de agua en sistemas de cultivo intensivo [8].
Numerosos estudios han reportado que fuentes de carbono añadidas a los sistemas acuícolas estimulan el crecimiento de microorganismos heterótrofos y el nitrógeno es utilizado para generar proteínas microbianas [4,8,9,10]. El incremento de la comunidad microbiana puede mejorar la calidad del agua mediante remoción de compuestos de nitrógeno tóxicos, mientras que las proteínas microbianas pueden ser usadas como alimento [11].
Esta investigación tuvo como objetivo evaluar el efecto de la aplicación de la melaza de caña de azúcar en la precría de poslarvas de camarón Litopenaeusvannamei, sobre los parámetros físico-químicos y microbiológicos de calidad de agua.
Materiales y métodos
El presente trabajo se realizó a escala de laboratorio de la Camaronera Calisur, localizada en la costa sur oriental de Cuba, en el Golfo de Guacanayabo, coordenadas geográficas 10º latitud N y 83º longitud W.
Se llevaron a cabo ciclos de 15 días de cultivo intensivo de poslarvas, en recipientes de 20 L con aireación constante mediante el empleo de aireadores y piedras difusoras. La disminución del volumen por evaporación se controló, añadiendo una cantidad de agua equivalente al volumen perdido. Las poslarvas se adquirieron del Centro de Desove de Litopeusvanamei en Manzanillo, perteneciente a la empresa para el cultivo del camarón (ECCAM). La alimentación se realizó en 8 dosis diarias, con un alimento cuyo contenido de proteína es 45 %. Para las dosis del alimento se tuvo en cuenta la biomasa estimada (25 % inicialmente con disminución gradual) y la melaza se añadió una sola vez al día (10) de dos formas: directamente en el agua y mezclada en el alimento.
Se realizó un diseño Multi-factor categórico con el empleo del software Statgraphics Centurion, con la estimación del efecto de tres factores: densidad de siembra, método de adición de melaza y relación C:N (10:1; 15:1 y 20:1) sobre siete variables de respuesta relacionados con la calidad de agua y el crecimiento). La densidad de siembra fue de 15 y 30 poslarvas por litro.
Determinación de los parámetros de calidad del agua
Los parámetros físico-químicos del agua se midieron diariamente. El oxígeno disuelto y la temperatura se midieron con un oxímetro YSI Pro2030. Las mediciones de pH se realizaron con un pH-chimetro HM-25R. El amonio no ionizado se determinó con el espectrofotómetro SpectroDirect marca Lovibond con su respectivo kit de materiales y reactivos, según las recomendaciones del fabricante. El método que se empleó fue el de salicilato, con silicato de amonio a 655 nm. El período de reacción fue de 15 minutos y el resultado se expresó en mg/L.
La determinación de bacterias heterótrofas se realizó cada tres días. La siembra microbiológica se realizó por inundación de superficie del medio de cultivo Agar triptona soya (BIOCEN Cuba) con la inoculación de 100 µL en cada caso e incubando a 30 ºC durante 24 horas. Finalmente las colonias se contaron con ayuda del contador de colonia (Suntex) y se reportó en unidades formadoras de colonias por mililitro (UFC/mL).
Cálculo de la melaza
La cantidad de melaza que se añadió mezclada en el alimento (CMalimento) se calculó con la fórmula de Avnimelech, 1999: CMalimento = (A*B*C*D*E)/F, el significado de cada letra en la ecuación se muestra a continuación A: cantidad de balanceado, B: % de proteína del balanceado, C Rango C:N (10-15-20:1), D % de la tasa de excreción- asimilación, E: cantidad denitrógeno en proteína (16 %) y F: % de carbono en la melaza [9]. La cantidad de melaza requerida por cada gramo de alimento fue 1,58 g, 2,36 g y 3,15 g, para la relación C:N 10:1, 15:1 y 20:1 respectivamente.
Para el cálculo de la cantidad de melaza añadida directamente en el agua (CMagua), se utilizó la fórmula: agua = [NAT*V*R(C:N)]/C%, donde NAT, nitrógeno amoniacal total (NH4+, NH3), V volumen experimental (20 L), y R (C:N)(10-15-20:1). (12) La cantidad de melaza requerida por cada 0,1 mg/L de NAT fue 62,5 mg, 93,75 mg y 125 mg, para la relación C:N 10:1, 15:1 y 20:1 respectivamente.
El porciento de carbono en la melaza se determinó mediante el análisis elemental de la melaza en los equipos de las firmas CARLO ERBA CHNS-O EA-1108 y Leco CHNS-932, de Laboratorios de la Universidad de Rostock Alemania.
Análisis estadístico
Los datos fueron analizados con el empleo del software Statgraphics Centurion. La normalidad fue evaluada usando la prueba de Shapiro Wilk, seguido del Anova multifactorial. Cuando se encontraron diferencias significativas, se usó la prueba de rangos múltiples LSD de Fisher para identificar diferencias entre los tratamientos.
Resultados
Análisis elemental de la melaza de caña de azúcar
La melaza de caña de azúcar tiene una composición muy compleja, además de carbono aporta nitrógeno, fosforo y minerales. La cantidad de carbono en la melaza depende del proceso productivo y de la materia prima (caña de azúcar). Para suministrar melaza en los estanques de camarón, es necesario conocer la cantidad real de este elemento y así incluir este valor en el cálculo de la cantidad necesaria para lograr una determinad relación C:N
El contenido de carbono (% C) en la melaza fue de 32,2 % (Tabla 1).
Tabla I: Resultados del análisis elemental de la melaza.
| Contenido/ % | Valor teórico | Valor experimental |
|---|---|---|
| C | 32,205 | 32,203 |
| H | 7,297 | 7,286 |
Parámetros de calidad del agua
Contenido de amonio.
El principal objetivo de la adición de fuentes de carbono en los estanques de cría de camarón es el control de la cantidad de amonio en el ambiente acuícola. La relación óptima C:N puede mejorar la producción y el reciclado de nutrientes, así como los disminución de los niveles de amonio. Según Pérez-Fuentes et al., la relación C:N debe ser superior a 10:1, [15]. Sin embargo, Schneider et al., aseveran que la mejor relación C:N es aproximadamente 15:1 [16]. Los resultados de este experimento se muestran en la Tabla II.
Tabla II: Variación de la concentración de amonio y NAT, según el método de adición, relación C:N y la densidad de siembra (valores de las medias y desviación estándar).
| Método de adición | Relación (C:N) | Densidad de siembra | NH3 (mg/L) | NAT (mg/L) |
|---|---|---|---|---|
| En el agua | 20:1 | 30xL | 0,31 ± 0,08 | 0,65 ± 0,16 |
| En el alimento | 20:1 | 30xL | 0,12 ± 0,05 | 0,26 ± 0,10 |
| En el agua | 20:1 | 15xL | 0,25 ± 0,07 | 0,53 ± 0,14 |
| En el alimento | 20:1 | 15xL | 0,08 ± 0,04 | 0,18 ± 0,11 |
| En el agua | 15:1 | 30xL | 0,37 ± 0,13 | 0,77 ± 0,27 |
| En el alimento | 15:1 | 30xL | 0,14 ± 0,07 | 0,29 ± 0,12 |
| En el agua | 15:1 | 15xL | 0,31 ± 0,10 | 0,65 ± 0,2 |
| En el alimento | 15:1 | 15xL | 0,14 ± 0,06 | 0,31 ± 0,13 |
| En el agua | 10:1 | 30xL | 0,38 ± 0,15 | 0,79 ± 0,30 |
| En el alimento | 10:1 | 30xL | 0,24 ± 0,07 | 0,5 ± 0,15 |
| En el agua | 10:1 | 15xL | 0,34 ± 0,08 | 0,70 ± 0,16 |
| En el alimento | 10:1 | 15xL | 0,25 ± 0,08 | 0,52 ± 0,17 |
| Grupo de Control | 15xL | 1,83 ± 1,52 | 3,78 ± 3,11 | |
| Grupo de Control | 30xL | 2,25 ± 1,82 | 4,63 ± 3,72 | |
pH del agua
Los valores de pH del agua disminuyeron al añadir la melaza. (Tabla 3).
Tabla III: Influencia del método de adición de melaza, relación C:N y densidad de siembra sobre el pH del agua (valores de las medias y desviación estándar)
| Método de adición | Relación (C:N) | Densidad de siembra | pH |
|---|---|---|---|
| En el agua | 20:1 | 30xL | 8,09 ± 0,11 |
| En el alimento | 20:1 | 30xL | 7,66 ± 0,18 |
| En el agua | 20:1 | 15xL | 8,15 ± 0,11 |
| En el alimento | 20:1 | 15xL | 7,76 ± 0,20 |
| En el agua | 15:1 | 30xL | 8,17 ± 0,09 |
| En el alimento | 15:1 | 30xL | 7,93 ± 0,13 |
| En el agua | 15:1 | 15xL | 8,01 ± 0,13 |
| En el alimento | 15:1 | 15xL | 7,90 ± 0,12 |
| En el agua | 10:1 | 30xL | 8,10 ± 0,09 |
| En el alimento | 10:1 | 30xL | 8,00 ± 0,15 |
| En el agua | 10:1 | 15xL | 8,01 ± 0,11 |
| En el alimento | 10:1 | 15xL | 8,04 ± 0,16 |
| Grupo de Control | 15xL | 8,24 ± 0,12 | |
| Grupo de Control | 30xL | 8,18 ± 0,13 | |
Cantidad de oxígeno disuelto
Los factores estudiados relación C:N, método de adición y densidad de siembra no tuvieron efecto significativo sobre el oxígeno disuelto (p<0.05)(Tabla IV).
Tabla IV: Variación del oxígeno disuelto según el método de adición, relación C:N y densidad de siembra.
| Método de adición | Relación (C:N) | Densidad de siembra | Oxígeno (mg/L) |
|---|---|---|---|
| En el agua | 20:1 | 30xL | 5,85 ± 0,59 |
| En el alimento | 20:1 | 30xL | 4,65 ± 1,03 |
| En el agua | 20:1 | 15xL | 5,92 ± 0,57 |
| En el alimento | 20:1 | 15xL | 5,96 ± 0,57 |
| En el agua | 15:1 | 30xL | 6,16 ± 0,46 |
| En el alimento | 15:1 | 30xL | 5,63 ± 0,63 |
| En el agua | 15:1 | 15xL | 6,21 ± 0,51 |
| En el alimento | 15:1 | 15xL | 5,57 ± 0,67 |
| En el agua | 10:1 | 30xL | 6,03 ± 0,47 |
| En el alimento | 10:1 | 30xL | 5,69 ± 0,63 |
| En el agua | 10:1 | 15xL | 6,03 ± 0,44 |
| En el alimento | 10:1 | 15xL | 5,58 ± 0,74 |
| Grupo de Control | 15xL | 6,39 ± 0,41 | |
| Grupo de Control | 30xL | 6,20 ± 0,45 | |
Conteo de bacterias heterótrofas
Los niveles de bacterias heterótrofas estuvieron en el orden entre 104 y 105UFC/mL mostrando un incremento con los días de cultivo. Los niveles más bajos fueron observados en los grupos controles, mientras que en las corridas donde la melaza fue añadida en el alimento, los niveles de bacterias heterótrofas fueron superiores con respecto a las corridas donde la melaza fue añadida en el agua (Figura 1).
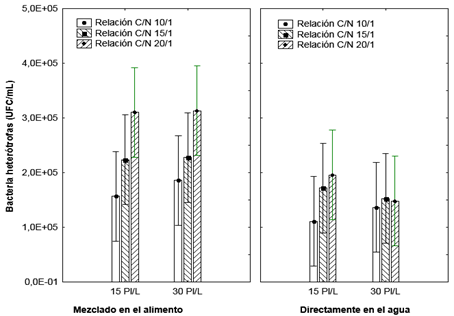
Figura 1: Niveles de bacterias heterótrofas teniendo en cuenta la relación C:N y el método de adición.
Discusión de los resultados
Contenido de carbono en la melaza
Varios autores plantean que el porcentaje de carbono que tienen las diferentes fuentes se aproxima al 50 %, siendo la más utilizada la melaza de caña de azúcar. Sin embargo, estudios realizados han mostrado diferencias en la eficiencia de la remoción del NAT respecto al contenido de carbono en la melaza [12]. Hanif et al., reportaron 36,3 % y de carbono en la melaza, con la más alta reducción del NAT en comparación con otras fuentes de mayor % de C [4]. Por otro lado, por otra Ray y Lotz, reportan 24 % C en la melaza, 41 % en sacarosa y 35 % en glicerol [13], por lo que se hace necesario el análisis del porcentaje de carbono para conocer la cantidad real de este elemento que se añade al estanque y garantizar la relación C:N requerida. En el análisis elemental realizado a la melaza no se detectó la presencia de nitrógeno, lo que puede considerarse una ventaja teniendo en cuenta que el objetivo es reducir los niveles de amonio, el contenido de carbono fue de 32,20 %. Por otra parte no se detectó la presencia de cloro, lo que demuestra la ausencia de compuestos organoclorados que pudieran ser tóxicos para el camarón o influir en su calidad [14].
Contenido de amonio en el agua de cultivo
Los niveles de amonio más bajos se alcanzaron cuando la melaza fue añadida al alimento. Por otra parte, cuando se evaluó la interacción que ejercen la densidad de siembra y la relación C:N sobre la concentración de amonio, los mejores resultados se lograron para una densidad de 15 poslarvas/L y una relación C: N 20:1 (Figura 2).

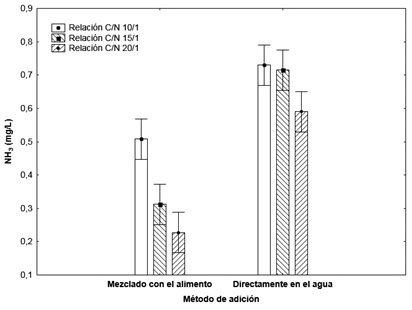
Figura 2: Influencia de la densidad de siembra (superior) y la relación C:N (inferior) y en la concentración de amonio. Los factores: método de adición, relación C:N y densidad de siembra, así como la interacción entre estos, tuvieron efecto significativo sobre los niveles de amonio (P<0,05). Los mejores resultados en este sentido, se obtuvieron cuando la melaza fue añadida mezclada en el alimento, mostrando mayor reducción de los niveles de amonio con el incremento de la relación C:N. Estos resultados pudieran deberse a la alta concentración de carbono en el momento en el que se añade el alimento, estimulando así, el desarrollo de bacterias heterótrofas que consumen en su metabolismo parte del nitrógeno formado. La disminución de los niveles de amonio cuando la densidad de siembra es menor, podría estar relacionada con la menor cantidad alimento necesario, por lo tanto, se genera menor cantidad de amonio.
pH del agua de cultivo
Se observó una considerable disminución del pH cuando la melaza se añadió en el alimento, para las relaciones C:N 15:1 y 20:1 se obtuvieron los valores más bajos Diferencias significativas fueron encontradas entre los tratamientos donde se tuvieron en cuenta los factores: método de adición y relación C:N. La interacción entre estos los dos factores tuvo un efecto significativo sobre el pH, sin embargo, no hubo diferencias significativas entre las densidades de siembra estudiadas, siendo similar su influencia sobre el pH para p<0,05. (Figura 3).
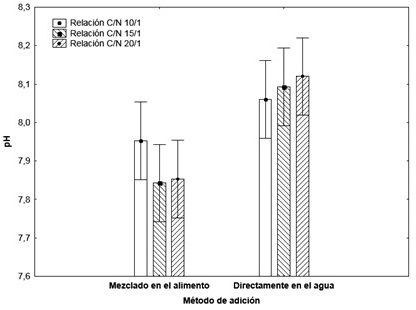
Figura 3: Influencia de la relación C:N sobre el pH del agua. La disminución en el pH al añadir melaza puede deberse al incremento de los niveles de carbono inorgánico (CO2) en el agua debido al aumento de la cantidad de bacterias heterótrofas que causa la adición de melaza, haciendo el medio más ácido debido a la formación de ácido carbónico [17]. El agua con un valor de pH entre 7.5 y hasta 8.5 es considerada como buena para el cultivo de camarón [18], aunque en la Tecnología Biofloc (BFT) valores menores que 7.0 son considerados normales, pero pueden afectar el proceso de nitrificación [12].
Cantidad de oxígeno disuelto en el agua de cultivo
Se observó una considerable disminución del pH cuando la melaza se añadió en el alimento, para las relaciones C:N 15:1 y 20:1 se obtuvieron los valores más bajos Diferencias significativas fueron encontradas entre los tratamientos donde se tuvieron en cuenta los factores: método de adición y relación C:N. La interacción entre estos los dos factores tuvo un efecto significativo sobre el pH, sin embargo, no hubo diferencias significativas entre las densidades de siembra estudiadas, siendo similar su influencia sobre el pH para p<0,05. (Figura 2).
Los resultados obtenidos son alentadores pues demuestran que la adición de melaza no afecta significativamente la cantidad de oxígeno disuelto en el agua. El rango óptimo reportado para el cultivo del camarón es de 3 a 8 mg/L [19], aunque los niveles de oxígeno disuelto deben ser superiores a 4 mg/L para el óptimo crecimiento y respiración de la microbiota [12].
Conteo de bacterias heterótrofas
El método de adición de la melaza y la relación C:N tuvieron efecto significativo sobre los niveles de bacterias heterótrofas (p<0,05) (Figura 1). Estos resultados pueden explicarse si consideramos la capacidad de las bacterias heterotróficas de utilizar una fuente de carbono orgánico está determinada por la complejidad de los compuestos carbonados, considerándose la glucosa y la sacarosa las fuentes de carbono más fácilmente asimilables [4], siendo estos de los principales componentes de la melaza. Panjaitan reportó los mejores resultados en cuanto a la calidad del agua cuando emplea C:N 20:1 [20]. Coincidentemente, Hanif et al. observaron la más alta reducción del NAT cuando usaron melaza como fuente de carbono y la relación 20:1 [4].
De Lorenzo et. al., evaluaron el efecto de las fuentes de carbono melaza y dextrosa en el rendimiento del cultivo de larvas sobre parámetros de calidad del agua,zootécnica ymicrobiológica, igualmente con resultados satisfactorios, demostrando el control eficiente de los niveles de amonio y la estimulación del crecimiento de bacterias heterótrofas [21].
Conclusiones
La aplicación de la melaza resultó ser una alternativa para el control de los niveles de amonio, sin que afectara significativamente la cantidad de oxígeno disuelto en el agua y manteniendo los valores de pH dentro del rango permisible.
Los niveles de amonio fueron más bajos en el experimento en el que la melaza fue añadida con alimento, a una densidad de siembra de 15 poslarvas por litro y con una relación C:N 15:1.
Referencias:
[1] Tang Y, Tao P, Tan J, Mu H, Peng L, Yang D, et al. (2014) Identification of Bacterial Community Composition in Freshwater Aquaculture System Farming of Litopenaeusvannamei Reveals Distinct Temperature-Driven Patterns. International Journal of Molecular Sciences 15:13663–13680.DOI: 10.3390/ijms150813663.
[2] Espinosa López G, Borrel Pichs Y, Bécquer Zúñiga U, Hernández Martínez D, Pérez Beloborodova A, Artiles Valor A,et al.(2014) La genética en el cultivo de camarones en Cuba. Anales de la Academia de Ciencias de Cuba. 4(2):1–6.
[3] ECCAM. Balance Anual de Indicadores de Eficiencia Productiva. La Habana. 2018.
[4] Hanif Azhar M, Eddy Supriyono, Kukuh Nirmala, Julie Ekasari (2016) Organic carbon source and C/N ratio affect inorganic nitrogen profile in the biofloc-based culture media of Pacific white shrimp (Litopenaeusvannamei). ILMU KELAUTAN 21(1):23-28. DOI: 10.14710/ik.ijms.21.1.23-28
[5] Luna-González A, Ávila-Leal J, Fierro-Coronado J A, Álvarez-Ruiz P, Esparza-Leal H, Escamilla-Montes R, Flores-Miranda MC, Montiel-Montoya J, López-Álvarez E S (2017) Effects of bacilli, molasses, and reducing feeding rate on biofloc formation, growth, and gene expression in Litopenaeus vannamei cultured with zero water exchange. Latin American Journal of Aquatic Research 45(5): 900-907. DOI: 10.3856/vol45-issue-fultext-4
[6] Valencia-Castañeda G, Frías-Espericueta M G, Vanegas-Pérez R C, Chávez-Sánchez MC, Páez-Osuna F(2019) Toxicity of ammonia, nitrite and nitrate to Litopenaeusvannamei juveniles in low-salinity water in single and ternary exposure experiments and their environmental implications. Environmental Toxicology and Pharmacology 70: 103-193. DOI: 10.1016/j.etap.2019.05.002
[7] Lourdes Cobo M, Sonnenholzner S, Wille M, Sorgeloos P(2012) Ammonia tolerance of Litopenaeusvannamei (Boone) larvae. Aquaculture Research 1–6. DOI: 10.1111/j.1365-2109.2012.03248.x
[8] WenjingRen, Li Li, Shuanglin Dong, Xiangli Tian, Yiming Xue (2019) Effects of C/N ratio and light on ammonia nitrogen uptake in Litopenaeusvannamei culture tanks. Aquaculture 498: 123–131. DOI: 10.1016/j.aquaculture.2018.08.043
[9] Avnimelech Y (1999) Carbon/nitrogen ratio as a control element in aquaculture systems. Aquaculture 176:227–235.DOI: 10.1016/S0044-8486(99)00085-X
[10] Panjaitan P (2011) Effect of C: N Ratio Levels on Water Quality and Shrimp Production Parameters in PenaeusmonodonShrimp Culture with Limited Water Exchange Using Molasses as a Carbon Source. ILMU KELAUTAN Maret 16 (1): 1–8. DOI:10.14710/IK.IJMS.16.1.1-8
[11] Cardona E, Gueguen Y, Magré K, Lorgeoux B, Piquemal D, Pierrat F, Noguier F,et al. (2016) Bacterial community characterization of water and intestine of the shrimp Litopenaeus stylirostris in a biofloc system. BMC Microbiology, 16(157).DOI: 10.1186/s12866-016-0770-z
[12] Coelho Emerencino M G, Martínez Córdova L R, Martínez Porchas M, Miranda Baeza A (2017) A Tool for Water Quality Management in Aquaculture. Biofloc Technology (BFT): Chapter 5: 91-103. DOI: 10.5772/66416
[13] Ray JA, Lotz JM.(2014) Comparing a chemoautotrophic-based biofloc system and three heterotrophic-based systems receiving different carbohydrate sources. Aquacultural Engineering 63: 54–61 .DOI: 10.1016/j.aquaeng.2014.10.001
[14] Sharon E. Hooka, HaiDoanb, Debra Gonzagob, Dean Mussonc, Jun Dub, RaiKookanab, Melony J. Sellarsc, Anu Kumar (2018)The impacts of modern-use pesticides on shrimp aquaculture: An assessment for north eastern Australia. Ecotoxicology and Environmental Safety 148: 770–780.DOI:10.1016/j.ecoenv.2017.11.028
[15] Pérez-Fuentes, J. A., Hernández- Vergara, M. P., Pérez-Rostro, C. I.,Fogel, I (2016) C: N ratios affect nitrogen removal and production of Nile tilapia Oreochromisniloticusraised in a biofloc system under high density cultivation. Aquaculture 452: 247–251. DOI: 10.1016/j.aquaculture.2015.11.010
[16] Schneider, O. et al. (2005) Analysis of nutrient flows in integrated intensive aquaculture systems. Aquacultural Engineering 32(3-4): 379-401.DOI: 10.1016/j.aquaeng.2004.09.001
[17] Ugo L S, Dario R F, Maurício N P, Eudes DSC (2017) Carbon sources and C:N ratios on water quality for nile tilapia farming in biofloc system. Rev. Caatinga, Mossoró, 30 (4): 1017 – 1027.DOI: 10.1590/1983-21252017v30n423rc
[18] Xu, Wu-Jie, Morris, Timothy C, Samocha, Tzachi M.(2016) Effects of C/N ratio on biofloc development, water quality, and performance of Litopenaeusvannamei juveniles in a biofloc-based, high-density, zero-exchange, outdoor tank system. Aquaculture 453: 169–175. DOI: 10.1016/j.aquaculture.2015.11.021
[19] Boyd CE (1990) Water quality in ponds for Aquaculture. Agricultural Experiment Station Series.2nd Ed. California Alabama Agricultural Experiment Station, Auburn University: Birmingham Publishing Co. .
[20] Panjaitan P (2010) Shrimp culture of Penaeusmonodonwith zero water exchange model (zwem) using molasses. Journal of Coastal Development 14(1): 35–44.
[21] De Lorenzo M A, Schveitzer R, Espírito Santo C M, Souza Candia E W, PedreiraMouri J L, Chamorro Legarda E, QuadrosSeiffert W, Do Nascimento Vieira F (2015) Intensive hatchery performance of the Pacific white shrimp in Biofloc system. Aquacultural Engineering, 67: 53–58. DOI.10.1016/j.aquaeng.2016.04.001
|
Revista QuímicaViva Número 3, año 20, Diciembre 2021 quimicaviva@qb.fcen.uba.ar |