Óxido Nítrico (NO) - Azanona (HNO) en Sistemas Biológicos:
Dos caras de la misma moneda
Sebastián A. Suarez1, Marcelo A. Marti2, Fabio Doctorovich1.
1Departamento de Química Inorgánica, Analítica y Química Física, INQUIMAE-CONICET. 2 Departamento de Química Biológica, IQUIBICEN-CONICET. Facultad de Ciencias Exactas y Naturales, Universidad de Buenos Aires, Ciudad Universitaria, Buenos Aires, C1428EHA, Argentina.
seba@qi.fcen.uba.ar | marti.marcelo@gmail.com | doctorovich@qi.fcen.uba.ar
Resumen
En este trabajo se presentan los últimos avances en la química biológica del sistema NO/HNO y sus efectos posteriores en diferentes contextos, principalmente resumiendo el mecanismo de reacción de más de quince agentes reductores moderados que interaccionan con NO produciendo HNO. Además, se describen las características más importantes del sensor específico para HNO, el cual ha permitido develar parte de estos recientes resultados. Finalmente, se discuten las implicaciones de estas rutas químicas (no enzimáticas), biológicamente compatibles, para la formación de HNO endógeno, quedando demostrado que el NO y el HNO son complementarios, interdependientes y están interconectados en los sistemas biológicos.
Palabras clave: ÓxidoNítrico, NO, Azanona, Nitroxilo, HNO
Nitric Oxide (NO) - Azanone (HNO) in Biological Systems: Two sides of the same coin
Summary
In this work, was discussed the latest progress in the biological chemistry of the NO/HNO system, and its downstream effects in different contexts. The reaction mechanism of more than fifteen moderate reducing agents that interact with NO, producing HNO was summarized. Also, were described the most important characteristics of the specific HNO sensor, which allowed us to disclose these recent results. Finally, was examined the implications of these chemical (non-enzymatic), biologically compatible, routes to endogenous HNO formation: NO and HNO be complementary, interconnected, and interdependent in biological systems.
Keywords: Nitric Oxide, NO, Azanone, Nitroxyl, HNO
Contexto Histórico
El óxido nítrico (NO) fue sintetizado por primera vez hace 400 años, y caracterizado hace más de 200 años por Joseph Priestly[1] pero, al igual que el resto de los gases que intervienen en procesos de señalización, su importancia fisiológica fue reconocida recién muchos años más tarde. Como se describe en la Figura 1, en 1976, Ferid Murad y sus colegas demostraron que el NO generado en el laboratorio o comercialmente disponible podría activar la guanilatociclasa citosólica y elevar los niveles de Guanosin Monofosfato Cíclico (GMP) en los tejidos.[2] Este fue el comienzo del óxido nítrico en el campo las ciencias biológicas. Poco después, se encontró que una serie de nitrovasodilatadores (nitroprusiato, nitroglicerina, otros nitratos orgánicos y ésteres de nitrito) estimulaban la producción de GMP cíclica tisular.[3] En un estudio independiente, se encontró que el NO es un potente inhibidor de la agregación de plaquetas humanas.[4] Hacia 1986, Louis Ignarro reportó la producción endógena de NO en células endoteliales, y descubrió su participación en la vasodilatación arterial, ya que reconoció que el NO se enmascaraba en las arterias como el en aquel entonces llamado factor de relajación derivado del endotelio (EDRF).[5] En 1989 el grupo del Dr. Moncada dilucidó la biosíntesis y el mecanismo de acción del NO haciéndose evidente que es una molécula de señalización producida enzimáticamente.[6] Por dichas investigaciones, el NO fue elegida ``Molécula del Año`` en 1992,[7] y los Dres. Ignarro, Furchgott y Murad obtuvieron el premio Nobel de Medicina en el año 1998. A raíz del descubrimiento de su rol fisiológico, la reactividad química y bioquímica del NO, fueron estudiadas detalladamente durante las siguientes décadas, siendo aun continuamente revisadas.[8, 9]
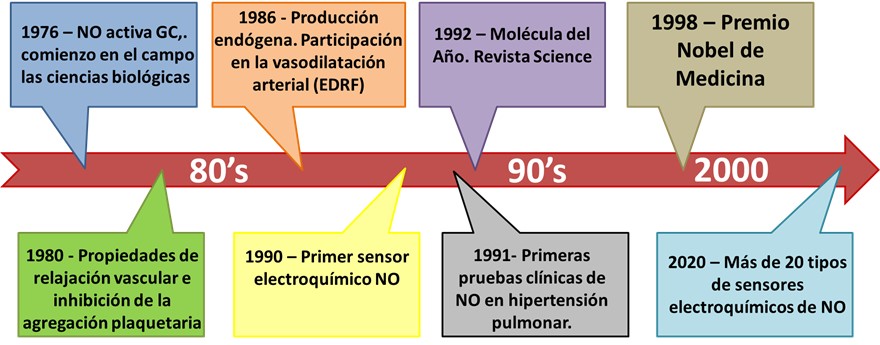
Figura 1: Cronología del desarrollo del NO.
Por otro lado, la historia del HNO es más reciente, siendo considerado como el hermano menor del NO. Aunque en 1901 se habían diseñado los primeros compuestos sólidos liberadores de nitroxilo, recién en 1933 se realizó el primer intento de síntesis de HNO gas.[10] Luego, tuvieron que pasar más de 25 años para lograr caracterizarlo, lográndose recién en 1958 (exactamente, 186 años después que el óxido nítrico).[11] Más aún, a más de 100 años de su primera utilización, recién en 2002 se caracterizaron correctamente parámetros químicos básicos como ser su pKa y su constante de dimerización.[12]
El HNO recién vio la luz como una posible sustancia biológicamente activa a mediados de los años ochenta, con estudios relacionados con la cianamida (H2NCN), un medicamento contra el alcoholismo.[13] Especialmente en la década del 2000, se ha descubierto que el HNO posee efectos farmacológicos relacionados con la protección del sistema cardiovascular en la prevención de isquemias, infartos y ACV (propiedad que no tienen los dadores de NO).[14] El HNO actúa, principalmente, en (1) el aumento de la contractilidad muscular, (2) la aceleración de la relajación ventricular y (3) la disminución en la carga cardíaca.[15–17] Los dadores de HNO causan un aumento en la contractilidad del músculo cardíaco a través de un efecto positivo combinado de la fuerza relacionada con la contracción muscular. Esto, junto con la relajación simultánea de los músculos cardíacos resulta en un aumento y protección de la función cardíaca.[18] Por ello, recientemente, se han patentado numerosos fármacos dadores de HNO para su potencial uso clínico en la prevención de infartos.[19, 20]
Desde entonces, siguen abiertas varias cuestiones relacionadas con el campo relativamente nuevo de la señalización redox biológica del HNO.[21] Para quien dese profundizar en el tema, vale la pena señalar el reciente libro dedicado a varios aspectos de la química y la biología del HNO.[22]
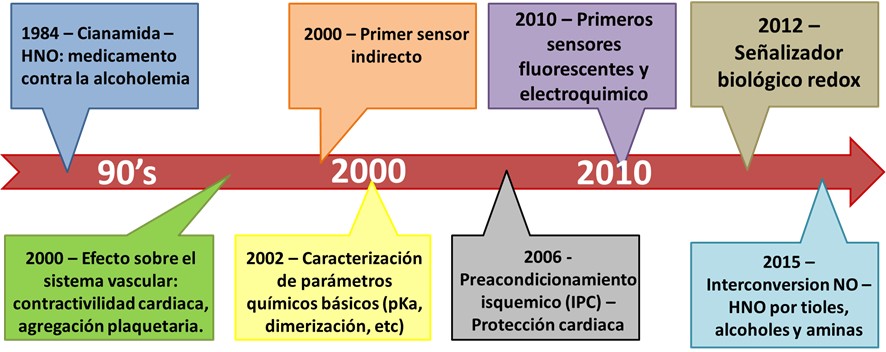
Figura 1: Cronología del desarrollo del HNO.
En general, el patrón de reactividad de ambos es similar en muchos aspectos, lo que hace extremadamente difícil distinguir de manera inequívoca su presencia o sus efectos fisiológicos; aunque en los últimos años esto se ha mejorado con sensores específicos para ambas especies.
Sensor electroquímico de HNO: una herramienta única
Históricamente, los investigadores han desarrollado múltiples ensayos y sondas para cuantificar el NO en soluciones biológicas, cada una de las cuales tiene ventajas y desventajas. [23–25] Muchos de estos están disponibles comercialmente para ayudar en la comprensión y utilización de sensores de NO en campos biológicos. Los primeros métodos de detección de NO datan de 1982, sin embargo, muchos eran indirectos (colorimétricos, resonancia EPR, quimioluminiscencia, bioensayos). El primer sensor electroquímico se describió en 1990, lo que permitió medir in vivo en tiempo real concentraciones relevantes de NO. En 1992 se desarrolló el primer sistema sensor comercial de NO, reportándose que en la actualidad más de 20 tipos de sensores electroquímicos de NO, siendo el límite de detección menor a 0,1 nM, y el diámetro de los mismos no supera los 100 nm.
Por otra parte, en las últimas dos décadas han surgido varios métodos de detección / cuantificación de HNO.[26–31] Puntualmente, el desarrollo del sensor específico para HNO se basa en una combinación innovadora de conocimientos de química de coordinación y especies reactivas de nitrógeno (RNOS), electroquímica y electrónica.[32–34] El sensor se sustenta en la elección de una porfirina de cobalto que por un lado permite una selectividad de reacción con el HNO (frente a otras RNOS, principalmente NO) y que debido a su geometría de interacción con el soporte del electrodo -en este caso oro-, resulta en un corrimiento de 400mv en la cupla redox de la porfirina nitrosilada (luego de atrapar al HNO) respecto de la porfirina libre, en estado de reposo. Este corrimiento -que se origina en un efecto de acoplamiento cuántico- permite mediante el diseño de un esquema de reacciones y potenciales de reposo (Esquema 1) atrapar una pequeña cantidad de HNO -proporcional a su concentración en el seno del solvente- regenerando catalíticamente el sistema, resultando en una determinación cuantitativa en tiempo real lo cual permite obtener información cinética.
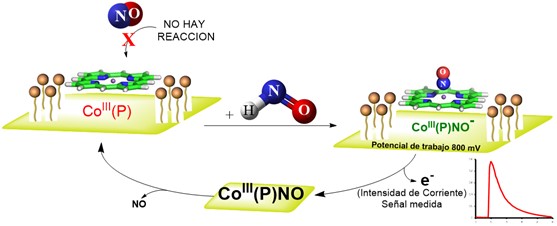
Esquema 1: Diseño conceptual para el funcionamiento de un sensor amperométrico de HNO.
La detección se basa en la circulación de corriente al oxidar el HNO sobre la porfirina de cobalto, lo que resulta en una señal de fácil manipulación, amplificada por técnicas electrónicas, que luego es digitalizada para su almacenamiento. De esta manera, permite determinar la concentración de HNO con alta precisión (nano molar) en un rango dinámico de 1nM - 100 μM. Además, la ventaja de este sensor es que es selectivo frente a otras moléculas pequeñas como RNOS, o sea ni NO, ni CO, ni O2, ni SH2 impactan en la integridad de la medición del HNO, pudiendo ser utilizado en solución acuosa, así como también en experimentos in vitro e in vivo (en sangre y/o tejidos).[26–31] El sistema se completa con el dispositivo electrónico analizador de datos y el software correspondiente (Figura 3).

Figura 3: Izq. El adquisidor de datos completo se compone del sensor específico para HNO, el dispositivo electrónico analizador de datos y el software correspondiente. Der. Diseños actuales del versátil sensor de HNO.
Interconversión NO/HNO en sistemas biológicos
A pesar de la reactividad superpuesta de ambos compuestos en medios biológicos [22, 35]con oxígeno, tioles, ácido ascórbico, metales de transición,[36, 37]hemoproteínas,[38–41] entre otros, las vías bioquímicas resultan ser muy diferentes.[14, 42] Incluso siendo el hemo ferroso de la sGCel objetivo biológico principal del NO,[43] se ha demostrado que las hemoproteínas reaccionan con HNO [44–48] y NO [49–51] tanto en el estado de oxidación Fe (III) como Fe (II), dando en el último caso un aducto estable de [HemoFe(II)]-HNO.[98] Además, se han realizado varios estudios sobre la reacción de porfirinas de Mn, Fe y Co con óxido nítrico [52] y azanona, [53–55] que muestran características interesantes sobre el mecanismo, la velocidad y la selectividad subyacentes. De todos modos, en este trabajo nos centraremos en la reactividad de ambos con moléculas pequeñas.
Formación de NO a partir de HNO
Oxígeno
La reacción del 1HNO con el O2, que se estudió por primera vez en 1993,[56, 57] es lenta debido a sus diferentes estados de spin, k ≈ (3-8) x 103 M-1s-1.[12, 58, 59] Sorprendentemente, los productos finales aún dan lugar a una profunda discusión y no han sido fehacientemente determinados. Por un lado, se ha propuesto que la reacción prosiga a través de la Reacción 1, produciendo NO y una especie radical del tipo hidroperóxido. [12, 57]
1HNO + O2 → NO● + HO2● (1)
1HNO + O2 → ONOO– (2)
Por otro, hoy en día se debate si se produce peroxinitrito (ONOO–) [60, 61] o no.[62–66] Una posible explicación es que se podrían formar diferentes isómeros protonados. Una investigación QM-MM realizada por el grupo del Dr. Estrin sugiere a la especie HN(O)(O2) como intermediario de la autooxidación de HNO.[67] Se esperaría que esta última especie actúe transfiriendo átomos de oxígeno, culminando en una oxidación por dos electrones, en lugar del mencionado mecanismo radicalario. Finalmente, se determinó una constante de velocidad de segundo orden para la reacción del HNO con oxígeno k ≈ 2 x 104 M-1s-1.[61] Definitivamente, se necesita profundizar los estudios sobre esta reacción.
Cabe mencionarse que, en el caso del óxido nítrico, este reacciona con oxigeno siguiendo una cinética de tercer orden, con una constante de velocidad de ~ 3 x 106 M-1s-1. El mecanismo de esta reacción se muestra de forma simplificada en las reacciones 3-5.[68]
2 NO● + O2 → → → 2NO2● (3)
NO2● + NO● → N2O2 (4)
N2O2 + H2O → 2NO2– + 2H++ (5)
Además, Denicola y colaboradores demostraron que la autooxidación de NO ocurre 30 veces más rápidamente dentro del interior hidrofóbico de las membranas de fosfolípidos que en un volumen igual de agua.[69] Esta aceleración podría explicarse por la solubilidad tres veces mayor del óxido nítrico y el oxígeno en estas fases hidrófobas en relación con el agua,[70] lo que da como resultado una mayor concentración local de reactivos.
Nitrosotioles
En 1998, Nawasagay colaboradores proporcionaron los únicos datos hasta el momento sobre la reacción entre el HNO y el S-nitrosoglutatión (GSNO), la cual produjo una rápida disminución de los niveles de GSNO.[71] Además, se demostró la generación de NO en estas condiciones, siendo la velocidad de producción dependiente de la cantidad de HNO inicial. En este contexto, el HNO podría reaccionar como nucleófilo y atacar el átomo de nitrógeno del GSNO, dando lugar a un intermediario que podría luego descomponerse para generar dos moléculas de NO y el tiol correspondiente (glutatión, GSH) (Reacciones 6 y 7). La propuesta de liberación de NO a partir del intermediario formado en la reacción 6es factible, ya que este intermediario es estructuralmente similar a una clase bien conocida de dadores de NO denominados "NONO-atos".[72]
GSNO + HNO → GSN(OH)NO (6)
GSN(OH)NO → GSH + 2NO (7)
Formación de HNO a partir de NO
La reducción química no enzimática, biológicamente compatible, de NO para producir HNO, ha sido explorada especialmente por nuestro grupo en los últimos cinco años.[73–78] Dicha reducción había sido descartada históricamente posiblemente debido a su potencial redox negativo E°(NO•, H+/HNO) = −0,55 V vs NHE a pH fisiológico. Sin embargo, este valor se encuentra actualmente en revisión, por ejemplo, Rocha y colaboradores recientemente estimaron dicho potencial en -0.16 V a pH 7, dejando abierta la posibilidad de una reducción de NO por especies biológicas como NADH, ácido ascórbico, vitamina E, cisteína y glutatión, cuyos potenciales de reducción en medios fisiológicos se encuentran en un rango entre -0,3 a -0,5 V.
Por otro lado, este proceso está necesariamente acoplado a otras reacciones que producen compuestos como N2O gaseoso, que impulsan la reacción, superando una barrera termodinámica desfavorable.[79]Concretamente, en el último lustro hemos demostrado que el óxido nítrico puede convertirse en HNO mediante alquilaminas,[76] alcoholes aromáticos y pseudoaromáticos (es decir, ácido ascórbico, tirosina, ácido salicílico),[74, 77] tioles,[75] y ácido sulfhídrico.[73, 78, 80]En la Tabla 1 se resumen los compuestos explorados, así como las constantes de velocidad efectiva para dichas reacciones. Cabe señalarse que las constantes de velocidad de producción de HNO podrían ser significativamente más altas, porque la keff obtenida también incluye el consumo de HNO (es decir, la reacción de HNO con NO).
En todos los casos, se determinaron las concentraciones finales de nitrito en solución y la cantidad de N2O en el espacio cabeza donde se realiza la reacción. Por un lado, los resultados presentados en la Tabla 1 muestran que en N2O y NO2– se producen en una proporción aproximada de 1: 1, como se espera que ocurra debido a la reacción entre HNO con NO (Reacción 8).Por otro lado, los rendimientos de los productos orgánicos finales son más altos que los correspondientes rendimientos de N2O,[74–76] lo que indica que estos compuestos también se producen por otras rutas que no producen HNO.
2NO + HNO → → → NO2– + N2O (8)
Table 1: keff y la relación de N2O: nitritos obtenida para las reacciones de NO con agentes reductores
| Compuesto | Grupo Funcional | keff M-1s-1 [a] | NO2–:N2O [b] | Ref. |
|---|---|---|---|---|
| Bencenotiol | SH | 110 ± 8 | 1.0 | [75] |
| Cisteina | 25 ± 6 | 1.2 | [75] | |
| BSA [c] | 0.6 | - | [81] | |
| Ácido Ascórbico | OH | 8.1 ± 0.4 | 1.2 | [74] |
| Hidroquinona | 6.0 ± 0.4 | 1.2 | [74] | |
| α-Tocoferol | 3.3 ± 0.4 | - | [77] | |
| Isopropilamina | NH2 | 0.070 ± 0.007 | 1.0 | [76] |
| Dietillamina | NH | 0.030 ± 0.005 | 1.2 | [76] |
[a] pH = 7,4, t.a., anaeróbico, en presencia de DPTA. [b] El error estimado es (± 0,1). [c] La albúmina de suero bovino (BSA) es una proteína de alto peso molecular (Mr ≈ 7x104) que tiene solo un grupo tiol libre.
Alcoholes
Hemos estudiado la reacción de NO con alcoholes aromáticos y "pseudoaromáticos", como el anión ascorbato (AscH-), fenol (PhOH), hidroquinona (HQ) y tirosina (Y). La reacción es bimolecular, siendola [HNO] linealmente dependiente de ambos reactivos [ROH] y [HNO]. Las constantes bimoleculares resultantes (keff) muestran que ambos dioles (hidroquinona y ascorbato) reaccionan a aprox. 5-10 veces más rápido que los fenoles, siendo el ascorbato el más rápido de todos.[74] Luego, confirmamos que otras vitaminas con grupos fenólicos como el α-tocoferol (la vitamina E, o medicamentos de venta libre, como el ácido acetilsalicílico (aspirina) o el acetaminofén (paracetamol) pueden promover la conversión de NO a HNO.[77]
A partir de estos resultados, propusimos que la reacción se produce a través de un ataque nucleofílico acoplado a protones (PCNA) del alcohol al NO, produciendo especies intermedias de RO-N(H)O•, que se descomponen para liberar HNO. El nitroxilo, a su vez, reacciona con el NO para dar nitritos y N2O, mientras que los radicales alcoxilo pueden reaccionar con otro radical, como en el caso de la tirosina para producir ditirosina, o con un segundo NO para producir un compuesto O-nitroso (esto ocurre con los dioles como el ascorbato o la hidroquinona).[74]
Tioles y H2S
En 2017, iniciamos un estudio sobre la reactividad delóxido nítrico con tioles, utilizando un enfoque similar al expuesto anteriormente para alcoholes. En este caso, se exploró la reactividad de NO con 1-hexanotiol (R6SH), cisteína (Cys), bencenetiol (Ph-SH) y benceneselenol (Ph-SeH). Los resultados revelaron que la producción de HNO ocurre con una velocidad que varía en el siguiente orden: SeH>Ph-SH >>Hex-SH>Cis, siendo nuevamente la reacción de primer orden en ambos reactivos.
Otra posibilidad que surge para la generación de HNO es a partir de la reacción de NO con sulfuro de dihidrógeno (H2S). El H2S es otra pequeña molécula gasotransmisora, que se ha demostrado tiene efectos cardioprotectores por sí misma.[82] En colaboración con el grupo de los Dres. Ivanovic-Burmazovicy Filipovic, y a partir de la detección de HNO in vitro e intracelular, hemos sugerido que el H2S puede convertiral NO endógeno en HNO en neuronas. Los resultados obtenidos al evaluar la reacción entre H2S y NO fueron sorprendentemente idénticos a los observados con la estimulación con HNO, mostrando una clara activación específica del canal sensorial de los quimiorreceptores TRPA1, activando la cascada HNO-TRPA1-CGRP.
Recientemente, exploramos las constantes de velocidad para la reacción entre H2S (pKa1,2 = 7.0 y 12.0) y NO a varios pH. Se pudo observar que, por un lado, existe una fuerte dependencia de la constante de reacción con el pH, siendo la velocidad máxima de reacción donde la especie predominante es HS-, y por otro lado, que la velocidad de reacción obtenida es similar utilizando NaHS o H2S, por lo que no parece estar influenciada por las impurezas típicas presentes en el NaHS (está enriquecido con polisulfuros).
Una cuestión que está actualmente en debate es la identidad de las especies intermediarias. Por un lado, Cortese-Krott y colaboradores propusieron que los principales productos intermediarios de la reacción directa son SNO–/SHNO– y polisulfuros.[83] Por otro lado, en colaboración con el grupo del Dr. Olabe, hemos presentado un punto de vista diferente sobre estas reacciones.[78] Usando la reacción de transnitrosación (RSNO + R′SH ↔ R′SNO + RSH) en la que el grupo NO se transfiere de una especie a otra, se observó que la banda de absorbancia máxima de 412 nm alcanza máximo 1 min después de la mezcla de los reactivos RSNO/HS–. Simultáneamente, se observa la aparición de NO después de la desaparición del reactivo RSNO. A partir de estos datos, y sumando a la evidencia de que {(H)SNO} tiene una vida media de 6 s, se estima que el {(H)SNO} es un primer intermediario de la reacción de transnitrosación y un precursor de SSNO–. Por lo tanto, en la reacción entre H2S y NO (la cual depende de la [HS−]), la formación del producto con absorbancia a 412 nm y la liberación retrasada de NO son consistentes con la formación de SSNO–. Estos datos también fueron respaldados por datos de espectroscopía de masas y 15N RMN. El SSNO– es una especie moderadamente estable que se descompone lentamente en soluciones acuosas en la escala de tiempo minuto-hora, dependiendo de la [O2].[78]
Aminas
De manera similar abordamos el estudio entre alquilaminas y NO. Esta reacción se ha estudiado desde principios de los años 60, pero en condiciones químicas específicas, a saber, solventes orgánicos y anhidros (como éter o THF), medios anóxicos y, en algunos casos, se requieren altas temperaturas y presiones. Nosotros demostramos que la reacción se produce y genera HNO a pH = 7. Sin embargo, los valores obtenidos para las keff son entre 20 y 250 veces menores que los obtenidos para otros compuestos a pH 7,4 (Tabla 1). Dado que se estimó que el HNO producido es cerca del 10% y tiene una velocidad de generación lenta, no se espera que esta reacción tenga implicaciones biológicas.
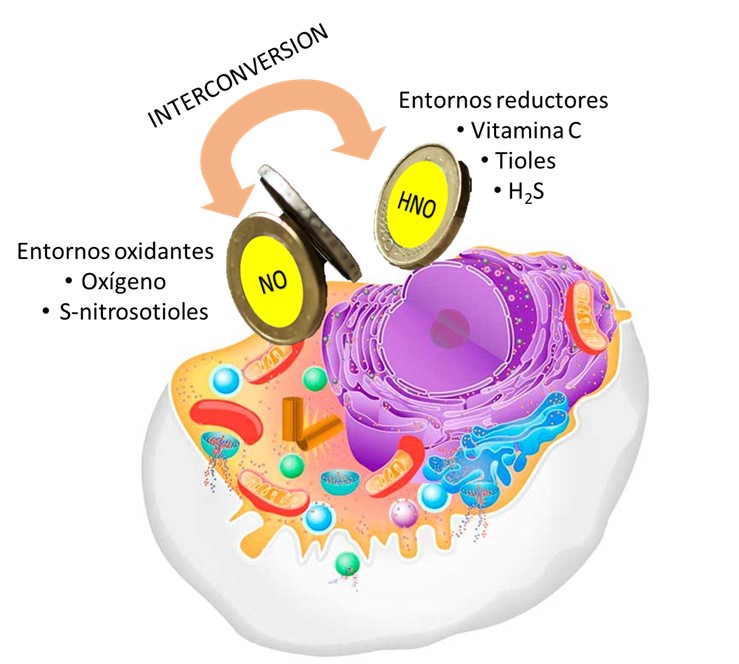
Figura 4: Interconversión NO/HNO en condiciones fisiológicas
Como se mencionó anteriormente, la conversión oxidativa de azanona en óxido nítrico por varios compuestos biológicamente relevantes es altamente probable, ya que especies como nitrosotioles,[84] hemoproteínas,[85] metaloenzimas,[86] y altas concentraciones de O2[12] están fácilmente biodisponibles. Por otro lado, en entornos reductores, el HNO se puede generar a partir del NO endógeno.[74] En estos entornos, como los que contienen altas concentraciones de ascorbato, la concentración de O2 u otras especies propensas a reducirse debe ser mínima. En consecuencia, se puede suponer que el NO y el HNO pueden interconvertirse en medios biológicos, dependiendo del estado redox del medio ambiente (Figura 4). Desde una perspectiva redox, mientras que los ambientes oxidantes promoverán la conversión del óxido nítrico a nitrito, nitrato, peroxinitrito o NO2 (entre otros), se espera que los ambientes reductores o hipóxicos produzcan HNO.
Estos resultados, junto con lo realizado por otros investigadores,[80, 87, 88] enfatizan el potencial de reacciones que involucran fuentes endógenas de NO y HNO, particularmente en relación a las diferencias y similitudes en los efectos fisiológicos de las mismas. Además, se deben considerar las fuentes bioquímicas de azanona como NO2–, hidroxilamina, cianamida y urea.[31, 42]
Perspectivas
De las discusiones anteriores, está claro que los procesos de señalización asociados con NO y HNO están coordinados, interregulados y su concentración relativa en un momento dado está correlacionada. Por lo tanto, no hay duda de que el HNO es un nuevo mensajero producido de forma endógena que media en respuestas fisiológicas específicas, muchas de las cuales aún se atribuyen a efectos directos del NO•. Además, la bioquímica del sistema NO/HNO indica que se descubrirán más acciones fisiológicas en el mediano plazo. Por ejemplo, es probable que las interacciones de ellos con moléculas ubicuas que contienen sulfidrillos (SH) o con hemoproteínas, revelen nuevos mecanismos y vías de regulación. Como congénere redox, el HNO exhibe efectos biológicos específicos y diversos. Por ejemplo, puede dirigirse a las enzimas que contienen tioles regulando la reparación del ADN, la apoptosis y la glucólisis en la progresión del tumor. Además, pronto se explorará la potencial utilidad terapéutica para los dadores de HNO en emergencias cardiovasculares en diabéticos, así como en ensayos clínicos que exploren el uso de HNO inhalado para el tratamiento de enfermedades respiratorias como la tuberculosis o el COVID-19.
Finalmente, estas especies actúan secuencial o concertadamente determinando así la regulación de funciones celulares esenciales, operan en respuesta al estrés celular o llevan a cabo procesos críticos para el desarrollo. Teniendo en cuenta que estos gasotransmisores comparten algunos objetivos de señalización, contribuyen a su biosíntesis y tienen propiedades físicas relacionadas, parece que sus similitudes y diferencias químicas son bien utilizadas por la naturaleza para generar un sistema de señalización que funciona en equilibrio para regular las intrincadas vías celulares. Ya no hay hermano menor y hermano mayor en esta historia, ambos transitan los sistemas biológicos contado su propia historia…
Agradecimientos
A las fuentes de financiamientos que hicieron posibles estas investigaciones: UBA, CONICET, ANPCyT. A la empresa nanoTeq, por la ayuda en el desarrollodel prototipo funcional del adquisidor de datos. Al Ing. Marcelo Orozco por la ayuda en el desarrollo del prototipo del sensor de HNO.
Referencias:
1. Priestley J. (1772) Observations on different kinds of air.Philosophical. Transactions of the Royal Societ 0f London 62: 147–264 DOI: 10.1098/rstl.1772.0021.
2. Arnold WP, Mittal CK, Katsuki S, and Murad F. (1977) Nitric oxide activates guanylate cyclase and increases guanosine 3’:5’-cyclic monophosphate levels in various tissue preparations. Proceedings of the. Naional. Academy of Sciiences 74: 3203–3207 DOI: 10.1073/pnas.74.8.3203.
3. Katsuki S, Arnold WP, and Murad F. (1977) Effects of sodium nitroprusside, nitroglycerin, and sodium azide on levels of cyclic nucleotides and mechanical activity of various tissues. Journal of Cyclic Nucleotide Research. 3: 239–249.
4. Adams AF, and Haslam RJ. (1978) Factors affecting the activity of guanylate cyclase in lysates of human blood platelets. Biochemical Journal 174: 23–35 DOI: 10.1042/bj1740023.
5. Ignarro LJ, Buga GM, Wood KS, Byrns RE, and Chaudhuri G. (1987) Endothelium-derived relaxing factor produced and released from artery and vein is nitric oxide. Proceedings of the. Naional. Academy of Sciences. 84: 9265–9269 DOI: 10.1073/pnas.84.24.9265.
6. Moncada S, Palmer RMJ, and Higgs EA. (1989) Biosynthesis of nitric oxide from l-arginine. Biochemical Pharmacology. 38: 1709–1715 DOI: 10.1016/0006-2952(89)90403-6.
7. Koshland D. (1992) The molecule of the year. Science (80-. ). 258: 1861–1861 DOI: 10.1126/science.1470903.
8. Ignarro LJ. (2019) Nitric oxide is not just blowing in the wind. British Journal of Pharmacology 176: 131–134 DOI: 10.1111/bph.14540.
9. Chiesa JJ, Baidanoff FM, and Golombek DA. (2018) Don’t just say no: Differential pathways and pharmacological responses to diverse nitric oxide donors. Biochemical Pharmacology. 156: 1–9 DOI: 10.1016/j.bcp.2018.08.002.
10. Harteck P. (1933) Die Darstellung von HNO bzw. [HNO] n . Berichte der Deutschen. Chemischen Gesellschaft (A B Ser. 66: 423–426 DOI: 10.1002/cber.19330660325.
11. Dalby FW. (1958) The spectrum and structure of the HNO molecule. Canadian Journal of Physics 36: 1336–1371 DOI: 10.1139/p58-138.
12. Shafirovich V, and Lymar S V. (2002) Nitroxyl and its anion in aqueous solutions: spin states, protic equilibria, and reactivities toward oxygen and nitric oxide. Proceedings of the National . Academy of Sciences U. S. A. 99: 7340–5 DOI: 10.1073/pnas.112202099.
13. DeMaster ECG, Shirota FN, Nagasawa HT, and Shirota FN. (1984) The metabolic activation of cyanamide to an inhibitor of aldehyde dehydrogenase is catalyzed by catalase. Pharmacology Biochemistry and Behaviour 18: 273–277 DOI: 10.1016/0091-3057(83)90185-5.
14. Paolocci N, Jackson MI, Lopez BE, Miranda K, Tocchetti CG, Wink DA, et al. (2007) The pharmacology of nitroxyl (HNO) and its therapeutic potential: not just the Janus face of NO. Pharmacology and Therapeutics. 113: 442–58 DOI: 10.1016/j.pharmthera.2006.11.002.
15. Tocchetti CG, Wang W, Froehlich JP, Huke S, Aon MA, Wilson GM, et al. (2007) Nitroxyl Improves Cellular Heart Function by Directly Enhancing Cardiac Sarcoplasmic Reticulum Ca 2+ Cycling. Circadian Research 100: 96–104 DOI: 10.1161/01.RES.0000253904.53601.c9.
16. Guo Y, Xu J, Wu L, Deng Y, Wang J, and An J. (2019) Advances in research on treatment of heart failure with nitrosyl hydrogen. Heart Failure Reviews 24: 941–948 DOI: 10.1007/s10741-019-09800-6.
17. Tocchetti CG, Stanley BA, Murray CI, Sivakumaran V, Donzelli S, Mancardi D, et al. (2011) Playing with Cardiac “Redox Switches”: The “HNO Way” to Modulate Cardiac Function. Antioxidant Redox Signals 14: 1687–1698 DOI: 10.1089/ars.2010.3859.
18. Hartman JC, del Rio CL, Reardon JE, Zhang K, and Sabbah HN. (2018) Intravenous Infusion of the Novel HNO Donor BMS-986231 Is Associated With Beneficial Inotropic, Lusitropic, and Vasodilatory Properties in 2 Canine Models of Heart Failure. JACC Basic to Translational Science 3: 625–638 DOI: 10.1016/j.jacbts.2018.07.003.
19. Parissis J, Bistola V, Ikonomidis I, and Triposkiadis F. (2017) Nitroxyl donors for acute heart failure: promising newcomers. European Journal of Heart Failure 19: 1333–1334 DOI: 10.1002/ejhf.793.
20. Tita C, Gilbert EM, Van Bakel AB, Grzybowski J, Haas GJ, Jarrah M, et al. (2017) A Phase 2a dose-escalation study of the safety, tolerability, pharmacokinetics and haemodynamic effects of BMS-986231 in hospitalized patients with heart failure with reduced ejection fraction. European Journal of Heart Failure. 19: 1321–1332 DOI: 10.1002/ejhf.897.
21. Bianco CL, Toscano JP, Bartberger MD, and Fukuto JM. (2017) The chemical biology of HNO signaling. Archives of Biochemistry and Biophysics. 617: 129–136 DOI: 10.1016/j.abb.2016.08.014.
22. Doctorovich F, Farmer PJ, and Marti MA. (2016) The Chemistry and Biology of Nitroxyl (HNO),. Elsevier.
23. Iverson N, Hofferber E, and Stapleton J. (2018) Nitric Oxide Sensors for Biological Applications. Chemosensors 6: 8 DOI: 10.3390/chemosensors6010008.
24. Brown MD, and Schoenfisch MH. (2019) Electrochemical Nitric Oxide Sensors: Principles of Design and Characterization. Chemical Reviews. 119: 11551–11575 DOI: 10.1021/acs.chemrev.8b00797.
25. Alday J, Mazzeo A, and Suarez S. (2020) Selective detection of gasotransmitters using fluorescent probes based on transition metal complexes. Inorganica Chimica Acta 510: 119696 DOI: 10.1016/j.ica.2020.119696.
26. Cline MR, Tu C, Silverman DN, and Toscano JP. (2011) Detection of nitroxyl (HNO) by membrane inlet mass spectrometry. Free Radical Biologyand and Medicine 50: 1274–1279 DOI: 10.1016/j.freeradbiomed.2011.02.008.
27. Reisz JA, Zink CN, and King SB. (2011) Rapid and Selective Nitroxyl (HNO) Trapping by Phosphines: Kinetics and New Aqueous Ligations for HNO Detection and Quantitation. Jounal of the American Chemical Society. 133: 11675–11685 DOI: 10.1021/ja203652z.
28. Dobmeier KP, Riccio DA, and Schoenfisch MH. (2008) Xerogel optical sensor films for quantitative detection of nitroxyl. Analytical Chemistry 80: 1247–54 DOI: 10.1021/ac702024t.
29. Rosenthal J, and Lippard SJ. (2010) Direct detection of nitroxyl in aqueous solution using a tripodal copper (II) BODIPY complex. Journal of the American Chemical Society 132: 5536–5537.
30. Zhou Y, Liu K, Li J-Y, Fang Y, Zhao T-C, and Yao C. (2011) Visualization of Nitroxyl in Living Cells by a Chelated Copper (II) Coumarin Complex. Organic Letters 13: 2357–2360.
31. Doctorovich F, Bikiel DE, Pellegrino J, Suárez SA, Larsen A, and Martí MA. (2011) Nitroxyl (azanone) trapping by metalloporphyrins. Coordination Chemistry Reviews 255 DOI: 10.1016/j.ccr.2011.04.012.
32. Suárez SA, Fonticelli MH, Rubert AA, De La Llave E, Scherlis D, Salvarezza RC, et al.(2010) A surface effect allows HNO/NO discrimination by a cobalt porphyrin bound to gold. Inorganic Chemistry 49 DOI: 10.1021/ic1007022.
33. Suárez SA, Bikiel DE, Wetzler DE, Martí MA, and Doctorovich F. (2013) Time-Resolved Electrochemical Quantification of Azanone (HNO) at Low Nanomolar Level. Analytical Chemistry 85: 10262–10269 DOI: 10.1021/ac402134b.
34. Doctorovich F, Suárez SA, Martí MA, and Battaglini F. (2018) International Patent ´´HNO Biosensor´´, WO2020/136414 A1. International patent application PCT/IB2018/0606.
35. Fukuto JM. (2019) A recent history of nitroxyl chemistry, pharmacology and therapeutic potential. British Journal of Pharmacology. 176: 135–146 DOI: 10.1111/bph.14384.
36. Van Stappen C, Goodrich LE, and Lehnert N. (2017) The Interaction of HNO With Transition Metal Centers and Its Biological Significance. Insight Into Electronic Structure From Theoretical Calculations. In The Chemistry and Biology of Nitroxyl (HNO) Elsevier. 155–192.
37. Ford PC, and Lorkovic IM. (2002) Mechanistic Aspects of the Reactions of Nitric Oxide with Transition-Metal Complexes. Chemical Reviews. 102: 993–1018 DOI: 10.1021/cr0000271.
38. Doctorovich F, Bikiel DE, Pellegrino J, Suárez SA, and Martí MA. (2012) Azanone (HNO) interaction with Hemeproteins and metalloporphyrins,.
39. Khade RL, Yang Y, Shi Y, and Zhang Y. (2016) HNO-Binding in Heme Proteins: Effects of Iron Oxidation State, Axial Ligand, and Protein Environment. Angewandte Chemie 128: 15282–15285 DOI: 10.1002/ange.201608539.
40. (2008) Globins and Other Nitric Oxide-Reactive Proteins, Part A,. Elsevier.
41. Miranda KM, Nims RW, Thomas DD, Espey MG, Citrin D, Bartberger MD, et al. (2003) Comparison of the reactivity of nitric oxide and nitroxyl with heme proteins. Journal of Inorganic Biochemistry 93: 52–60 DOI: 10.1016/S0162-0134(02)00498-1.
42. Fukuto JM, Cisneros CJ, and Kinkade RL. (2013) A comparison of the chemistry associated with the biological signaling and actions of nitroxyl (HNO) and nitric oxide (NO). Journal of Inorganic Biochemistry 118: 201–208 DOI: 10.1016/j.jinorgbio.2012.08.027.
43. Ohlstein EH, Wood KS, and Ignarro LJ. (1982) Purification and properties of heme-deficient hepatic soluble guanylate cyclase: Effects of heme and other factors on enzyme activation by NO, NO-heme, and protoporphyrin IX. Archives of Biochemistry and Biophysics 218: 187–198 DOI: 10.1016/0003-9861(82)90335-6.
44. Bazylinski DA, and Hollocher TC. (1985) Metmyoglobin and methemoglobin as efficient traps for nitrosyl hydride (nitroxyl) in neutral aqueous solution. Journal of the American Chemical Society. 107: 7982–7986 DOI: 10.1021/ja00312a031.
45. Bazylinski DA, Goretski J, and Hollocher TC. (1985) On the reaction of trioxodinitrate(II) with hemoglobin and myoglobin. Journal of the American Chemical Society 107: 7986–7989 DOI: 10.1021/ja00312a032.
46. Lin R, and Farmer PJ. (2000) The HNO Adduct of Myoglobin: Synthesis and Characterization. Journal of the American Chemical Society. 122: 2393–2394 DOI: 10.1021/ja994079n.
47. Sulc F, Immoos CE, Pervitsky D, and Farmer PJ. (2004) Efficient trapping of HNO by deoxymyoglobin. Journal of the American Chemical Society.126: 1096–101 DOI: 10.1021/ja0376184.
48. Kumar MR, Fukuto JM, Miranda KM, and Farmer PJ. (2010) Reactions of HNO with Heme Proteins: New Routes to HNO- Heme Complexes and Insight into Physiological Effects. Inorganic Chemistry 49: 6283–6292 DOI: 10.1021/ic902319d.
49. Marti MA, Capece L, Bidon‐Chanal A, Crespo A, Guallar V, Luque FJ, et al. (2008) Nitric Oxide Reactivity with Globins as Investigated Through Computer Simulation. In 477–498.
50. Milani M, Pesce A, Nardini M, Ouellet H, Ouellet Y, Dewilde S, et al. (2005) Structural bases for heme binding and diatomic ligand recognition in truncated hemoglobins. Journal of Inorganic Biochemistry. 99: 97–109 DOI: 10.1016/j.jinorgbio.2004.10.035.
51. Biochemistry THE, Nitric OF, In R, and Flow B. (2004) Serial Review : Biomedical Implications for Hemoglobin Interactions with Nitric Oxide Serial Review Editors : Mark T . Gladwin and Rakesh Patel The biochemistry of nitric oxide , nitrite , and hemoglobin : role in blood flow regulation. 36: 707–717 DOI: 10.1016/j.freeradbiomed.2003.11.032.
52. Hoshino M, Laverman L, and Ford PCPC. (1999) Nitric oxide complexes of metalloporphyrins: an overview of some mechanistic studies. Coordinated Chemistry Reviews 187: 75–102 DOI: 10.1016/S0010-8545(98)00228-8.
53. Doctorovich F, Bikiel DE, Pellegrino J, Suárez SA, and Martí MA. (2014) Reactions of HNO with Metal Porphyrins: Underscoring the Biological Relevance of HNO. Acc Chemical Research. 47: 2907–2916 DOI: 10.1021/ar500153c.
54. Conradie J, and Ghosh A. (2016) Metalloporphyrin–Nitroxyl Interactions: The Low-Energy States of Reduced Manganese, Iron, and Cobalt Porphyrin Nitrosyls. Journal of Physical Chemistry B 120: 4972–4979 DOI: 10.1021/acs.jpcb.6b04983.
55. Yang L, Fang W, and Zhang Y. (2012) Metal centre effects on HNO binding in porphyrins and the electronic origin: metal’s electronic configuration, position in the periodic table, and oxidation state. Chemical Communications. 48: 3842 DOI: 10.1039/c2cc31016c.
56. Bryukov MG, Kachanov AA, Timonnen R, Seetula J, Vandoren J, and Sarkisov OM. (1993) Kinetics of HNO reactions with O2 and HNO. Chemical Physics Letters 208: 392–398 DOI: 10.1016/0009-2614(93)87161-U.
57. Fukuto JM, Hobbs AJ, and Ignarro LJ. (1993) Conversion of Nitroxyl (HNO) to Nitric Oxide (NO) in Biological Systems: The Role of Physiological Oxidants and Relevance to the Biological Activity of HNO. Biochemical and Biophysical Research Communications. 196: 707–713 DOI: 10.1006/bbrc.1993.2307.
58. Liochev S. (2003) The mode of decomposition of Angeli’s salt (Na2N2O3) and the effects thereon of oxygen, nitrite, superoxide dismutase, and glutathione. Free Radical Biology and Medicine 34: 1399–1404 DOI: 10.1016/S0891-5849(03)00111-4.
59. Miranda KM, Paolocci N, Katori T, Thomas DD, Ford E, Bartberger MD, et al. (2003) A biochemical rationale for the discrete behavior of nitroxyl and nitric oxide in the cardiovascular system. Proceedings of the National Academy of Sciences. 100: 9196–9201 DOI: 10.1073/pnas.1430507100.
60. Zielonka J, Sikora A, Joseph J, and Kalyanaraman B. (2010) Peroxynitrite Is the Major Species Formed from Different Flux Ratios of Co-generated Nitric Oxide and Superoxide. Journal of Biological Chemistry 285: 14210–14216 DOI: 10.1074/jbc.M110.110080.
61. Smulik R, Dębski D, Zielonka J, Michałowski B, Adamus J, Marcinek A, et al. (2014) Nitroxyl (HNO) Reacts with Molecular Oxygen and Forms Peroxynitrite at Physiological pH. Journal of Biological Chemistry 289(51): 35570–35581 DOI: 10.1074/jbc.M114.597740.
62. Chazotte-Aubert L, Oikawa S, Gilibert I, Bianchini F, Kawanishi S, and Ohshima H. (1999) Cytotoxicity and Site-specific DNA Damage Induced by Nitroxyl Anion (NO − ) in the Presence of Hydrogen Peroxide. Journal of Biological Chemistry 274: 20909–20915 DOI: 10.1074/jbc.274.30.20909.
63. Wink DA, Feelisch M, Fukuto J, Chistodoulou D, Jourd’heuil D, Grisham MB, et al. (1998) The Cytotoxicity of Nitroxyl: Possible Implications for the Pathophysiological Role of NO. Archives of Biochemistry and Biophysics 351: 66–74 DOI: 10.1006/abbi.1997.0565.
64. Liochev SI, and Fridovich I. (2002) Nitroxyl (NO−): a substrate for superoxide dismutase.. Archives of Biochemistry and Biophysics 402: 166–171 DOI: 10.1016/S0003-9861(02)00074-7.
65. Katori T, Donzelli S, Tocchetti CG, Miranda KM, Cormaci G, Thomas DD, et al. (2006) Peroxynitrite and myocardial contractility: In vivo versus in vitro effects. Free Radical Biology and Medicine 41: 1606–1618 DOI: 10.1016/j.freeradbiomed.2006.08.023.
66. Jorolan JH, Buttitta LA, Cheah C, and Miranda KM. (2015) Comparison of the chemical reactivity of synthetic peroxynitrite with that of the autoxidation products of nitroxyl or its anion. Nitric Oxide 44: 39–46 DOI: 10.1016/j.niox.2014.11.002.
67. Guardia CMA, González Lebrero MC, Bari SE, and Estrin DA. (2008) QM–MM investigation of the reaction products between nitroxyl and O2 in aqueous solution. Chemical and. Physics Letters. 463: 112–116 DOI: 10.1016/j.cplett.2008.08.064.
68. Goldstein S, and Czapski G. (1996) Mechanism of the Nitrosation of Thiols and Amines by Oxygenated • NO Solutions: the Nature of the Nitrosating Intermediates. Journal of the American Chemical Society 118: 3419–3425 DOI: 10.1021/ja9536680.
69. Möller MN, Li Q, Vitturi DA, Robinson JM, Lancaster, JR, and Denicola A. (2007) Membrane “Lens” Effect: Focusing the Formation of Reactive Nitrogen Oxides from the • NO/O 2 Reaction. Chemical Research in Toxicology 20: 709–714 DOI: 10.1021/tx700010h.
70. Moller M, Botti H, Batthyany C, Rubbo H, Radi R, and Denicola A. (2005) Direct Measurement of Nitric Oxide and Oxygen Partitioning into Liposomes and Low Density Lipoprotein. Journal of Biological Chemistry 280: 8850–8854 DOI: 10.1074/jbc.M413699200.
71. Wong PS-YY, Hyun J, Fukuto JM, Shirota FN, DeMaster EG, Shoeman DW, et al. (1998) Reaction between S -Nitrosothiols and Thiols: Generation of Nitroxyl (HNO) and Subsequent Chemistry. Biochemistry 37: 5362–5371 DOI: 10.1021/bi973153g.
72. Shaikh N, Valiev M, and Lymar S V. (2014) Decomposition of amino diazeniumdiolates (NONOates): Molecular mechanisms. Journal of Inorganic Biochemistry 141: 28–35 DOI: 10.1016/j.jinorgbio.2014.08.008.
73. Eberhardt M, Dux M, Namer B, Miljkovic J, Cordasic N, Will C, et al. (2014) H2S and NO cooperatively regulate vascular tone by activating a neuroendocrine HNO–TRPA1–CGRP signalling pathway. Nature Communications 5: 4381 DOI: 10.1038/ncomms5381.
74. Suarez SA, Neuman NI, Muñoz M, Álvarez L, Bikiel DE, Brondino CD, et al.(2015) Nitric Oxide Is Reduced to HNO by Proton-Coupled Nucleophilic Attack by Ascorbate, Tyrosine, and Other Alcohols. A New Route to HNO in Biological Media? Journal of the American Chemical Society 137: 4720–4727 DOI: 10.1021/ja512343w.
75. Suarez SA, Muñoz M, Alvarez L, Venâncio MF, Rocha WR, Bikiel DE, et al.(2017) HNO Is Produced by the Reaction of NO with Thiols..Journal of the AmericanChemical Society 139: 14483–14487 DOI: 10.1021/jacs.7b06968.
76. Hamer M, Suarez SA, Muñoz M, Álvarez L, Marti M, and Doctorovich F. (2020) Reaction of Amines with NO at room temperature and atmospheric pressure: is nitroxyl a reaction intermediate? Pure Applied. Chemistry. DOI: 10.1515/pac-2020-0601.
77. Hamer M, Suarez SA, Neuman NI, Alvarez L, Muñoz M, Marti MA, et al.(2015) Discussing Endogenous NO • /HNO Interconversion Aided by Phenolic Drugs and Vitamins. Inorganic Chemistry 54: 9342–9350 DOI: 10.1021/acs.inorgchem.5b01347.
78. Marcolongo JP, Venâncio MF, Rocha WR, Doctorovich F, and Olabe JA. (2019) NO/H 2 S “Crosstalk” Reactions. The Role of Thionitrites (SNO – ) and Perthionitrites (SSNO – ). Inorganic Chemistry 58: 14981–14997 DOI: 10.1021/acs.inorgchem.9b01978.
79. Venâncio M, Doctorovich F, and Rocha W. (2017) On the Solvation and Proton Coupled Electron Transfer Reduction Potential of 2NO• to 1HNO in Aqueous Solution: A Theoretical Investigation. Journal of Physical Chemistry B. 121: 6618–6625 DOI: 10.1021/acs.jpcb.7b03552.
80. Filipovic MR, Eberhardt M, Prokopovic V, Mijuskovic A, Orescanin-Dusic Z, Reeh P, et al. (2013) Beyond H2S and NO Interplay: Hydrogen Sulfide and Nitroprusside React Directly to Give Nitroxyl (HNO). A New Pharmacological Source of HNO. Journal of Medicine Chemistry 56: 1499–1508 DOI: 10.1021/jm3012036.
81. Aravindakumar CT, Ley M De, and Ceulemans J. (2002) Kinetics of the anaerobic reaction of nitric oxide with cysteine, glutathione and cysteine-containing proteins: implications for in vivo S-nitrosation. Journal of the Chemical Society Perkin Transactions 2 663–669 DOI: 10.1039/b107273k.
82. Zhao W. (2001) The vasorelaxant effect of H2S as a novel endogenous gaseous KATP channel opener. EMBO Journal 20: 6008–6016 DOI: 10.1093/emboj/20.21.6008.
83. Cortese-Krott MM, Kuhnle GGC, Dyson A, Fernandez BO, Grman M, DuMond JF, et al. (2015) Key bioactive reaction products of the NO/H 2 S interaction are S/N-hybrid species, polysulfides, and nitroxyl. Proceedings of the National Academy of Sciences. 112: E4651–E4660 DOI: 10.1073/pnas.1509277112.
84. Smulik-Izydorczyk R, Mesjasz A, Gerbich A, Adamus J, Michalski R, and Sikora A. (2017) A kinetic study on the reactivity of azanone ( HNO ) toward its selected scavengers: Insight into its chemistry and detection. Nitric Oxide 69: 61–68 DOI: 10.1016/j.niox.2017.05.003.
85. Doyle MP, Mahapatro SN, Broene RD, and Guy JK. (1988) Oxidation and reduction of hemoproteins by trioxodinitrate (II). The role of nitrosyl hydride and nitrite. Journal of the American Chemical Society. 110: 593–599 DOI: 10.1021/ja00210a047.
86. Michael MA, Pizzella G, Yang L, Shi Y, Evangelou T, Burke DT, et al.(2014) HNO/NO Conversion Mechanisms of Cu-Based HNO Probes with Implications for Cu,Zn-SOD. Journal of. Physics and Chemistry Letters. 5: 1022–1026 DOI: 10.1021/jz5002902.
87. Heinecke J, and Ford PC. (2010) Mechanistic studies of nitrite reactions with metalloproteins and models relevant to mammalian physiology. Coordination Chemistry Reviews 254: 235–247 DOI: 10.1016/j.ccr.2009.07.021.
88. Switzer CH, Miller TW, Farmer PJ, and Fukuto JM. (2013) Synthesis and characterization of lithium oxonitrate (LiNO). Journal of Inorganic Biochemistry. 118: 128–133 DOI: 10.1016/j.jinorgbio.2012.09.022.
|
Revista QuímicaViva Número 1, año 20, Abril 2021 quimicaviva@qb.fcen.uba.ar |