Obtención de un derivado semisintético de la curcumina aislada de su fuente natural
Eugenio Torres Rodríguez, Yurién Mojena Guerra, Quirino Arias Cedeño, Robinson Hermosilla Espinosa
Centro de Estudios de Química Aplicada. Universidad de Granma. Cuba
Recibido: 17/01/2020 - Aceptado: 12/03/2020
Resumen
La curcumina es un fitoquímico aislado de rizomas de Curcuma longa L. con comprobada actividad antitumoral y quimioprotectora, sin embargo, la baja solubilidad de esta biomolécula en los fluidos biológicos ha limitado los estudios farmacológicos. La estructura química de la curcumina permite realizar diferentes tipos de reacciones, entre ellas, la O y C- alquilación. El empleo de 1,2-dibromoetano como agente alquilante en relación 1:1 respecto a la curcumina, carbonato de potasio como base y bromuro de tetrabutilamonio como catalizador de transferencia de fase, permitieron obtener un 4,4-ciclopropilderivado de la curcumina en medio acuoso con potencialidades farmacológicas. El compuesto obtenido fue debidamente caracterizado mediante métodos espectroscópicos y espectrométricos.
Palabras clave: Curcuma longa L, curcumina, 4,4-ciclopropilderivado
Summary
Curcumin is a phytochemical isolated from rhizomes of Curcuma longa L. with proven antitumor and chemoprotective activity, however, the low solubility of this biomolecule in biological fluids has limited pharmacological studies. The chemical structure of curcumin allows different types of reactions, including O and C-alkylation. The use of 1,2-dibromoethane as an alkylating agent in a 1:1 ratio with respect to curcumin, potassium carbonate as a base and tetrabutylammonium bromide as a phase transfer catalyst, allowed to obtain a 4,4-cyclopropilderivative of curcumin in aqueous medium with pharmacological potentials. The obtained compound was thoroughly characterized by spectroscopic and spectrometric methods.
Keywords: Curcuma longa L, curcumin, 4,4-cyclopropilderivative.
Introducción
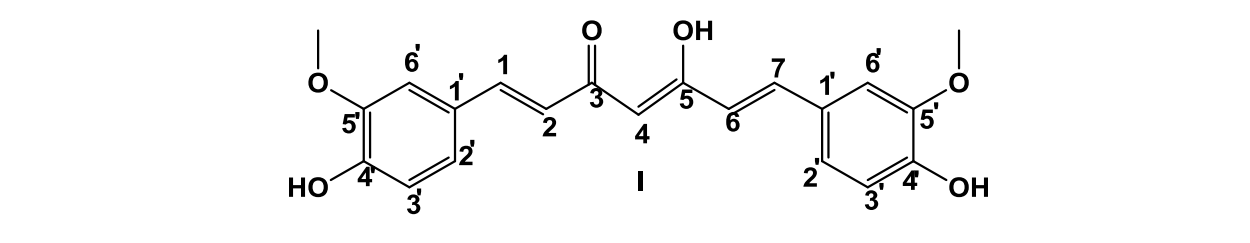
La curcumina (5-hidroxi-1,7-bis(4-hidroxi-3-metoxifenil)hepta-1,4,6-trien-3-ona) es un pigmento de color naranja aislado de rizomas de Curcuma longa L. (Figura 1),ampliamente utilizado como aditivo alimentario [1].

Figura 1: . Curcumina (A), Curcuma longa L. (B) y rizomas de la planta (C).
La curcumina se ha sometido a numerosos estudios como anticancerígeno debido a su excelente actividad antitumoral y quimioprotectora [2].Muchos de los ensayos se han visto limitados por la escasa solubilidad de la molécula en los fluidos biológicos. Intensas investigaciones se han emprendido para modificar su estructura e incrementar su absorción y potencia, manteniendo la baja toxicidad de este producto natural [3–5].
La importancia de los derivados del ciclopropano en estudios biológicos ha sido reconocida debido a su habilidad para desarrollar variedad de reacciones de apertura de anillo en presencia de electrófilos, nucleófilos y radicales[6–9].La estructura de la curcumina permite desarrollar reacciones de ciclopropanación en el átomo de carbono central(C-4) de la cadena carbonada y de esta forma introducir el potencialmente bioactivo grupo ciclopropil [3, 10, 11].
En este trabajo se reporta la obtención y caracterización de un ciclopropilderivado de la curcumina extraída de rizomas de Curcuma longa L, con potencial actividad biológica.
Materiales y métodos
El trabajo experimental se desarrolló en el laboratorio de Productos Naturales de la Universidad de Granma, Cuba; la caracterización estructural se realizó en la Universidad de Rostock, Alemania. Los reactivos y disolventes empleados en el trabajo experimental fueron de calidad “puros” o “analíticos” provenientes de las firmas Merck y Sigma-Aldrich. El curso de las reacciones se monitoreó por cromatografía de capa delgada (CCD) en cromatofolios (Al) de gel de sílice 60 F254 con espesor de capa 0,2 mm (Merck). Los espectros de resonancia magnética nuclear (RMN-1H a 300 MHz y RMN-13C a 75,46 MHz) fueron obtenidos en equipos AC 250 y ARX 30 a 20°C y se utilizaron como disolventes dimetilsufóxido deuterado (DMSO-d6) y cloroformo deuterado (CDCl3). Los espectros de masas de alta resolución (EMAR) se registraron en un espectrómetro INTECTRA GmbH, modelo AMD-402/3, mediante las técnicas de impacto ionización química (IQ) con isobutano.
La identificación de Curcuma longa L, se efectuó por especialistas del jardín botánico Copainicú. La extracción de curcumina se realizó, a partir de rizomas de Curcuma longa L. que previamente fueron sometidos a un proceso de hidrodestilación para separar los aceites esenciales, la masa vegetal se trató con metanol en un baño ultrasónico (SB-3200TD) de procedencia China, la mezcla fue sometida a ultrasonido durante dos horas. La disolución obtenida fue concentrada hasta un cuarto del volumen y tratada con acetato de etilo, obteniéndose un precipitado naranja constituido por una mezcla de curcuminoides. Mediante cromatografía de columna (tolueno-acetato de etilo 5:1) fue posible aislar la curcumina.
Métodos de síntesis:
1,7-bis(4-(2-bromoetoxi)-3-metoxifenil)-5-hidroxihepta-1,4,6-trien-3-ona (II).
La curcumina1 mmol (0,368 g) fue mezclada con K2CO3 2 mmol (0,276 g) en acetona (20 mL). La mezcla de reacción fue reflujada durante 1 h a 40 °C. Seguidamente fue añadido 1,2- dibromoetano 2 mmol (0,372 g), la mezcla resultante se reflujó durante 1 h a 40 °C. La cromatografía de capa fina permitió determinar el fin de la reacción. Luego se añadieron 10 mL de agua y 20 mL de CH2Cl2, la fase orgánica fue separada y la fase acuosa se lavó con CH2Cl2 (3 x 10 mL). La mezcla de las fases orgánicas se secó con Na2SO4 anhidro y se concentró. El producto final se purifico mediante cromatografía de columna (Éter de petróleo- acetato de etilo 15:1).
4,4-ciclopropil-bis(3-(4-(2-bromoetoxi)-3-metoxifenil)-prop-2-en-1-ona III.
1,0 mmol de bromuro de tetrabutilamonio (BTBA) fue añadido a una mezcla de heptatrienona (10 mmol) y K2CO3 (25 mmol) en agua (20 mL) a 50 °C. La mezcla de reacción fue agitada a 50 0C durante 1 h, luego se añadieron lentamente 10 mmol (1,86 g) de 1,2-dibromoetano. La mezcla resultante fue agitada durante 7 h a 50 °C. Al concluir la reacción (de acuerdo con la CCD) fueron añadidos 50 mL de CH2Cl2, la fase acuosa fue extraída con CH2Cl2 (3 x 30 mL), la fase orgánica fue secada con Na2SO4 y concentrada. Los compuestos fueron purificados mediante cromatografía de columna (Éter de petróleo - acetato de etilo).
Resultados
Aislamiento de la curcumina (I)
Se partió de 200 g de masa vegetal de Curcuma longa L. resultantes de la hidrodestilación. Se extrajo con metanol (500 mL) bajo la acción de ultrasonido (2 h), seguida de concentración y precipitación con acetato de etilo. Se obtuvo una mezcla de curcumina, desmetoxicurcumina y bisdesmetoxicurcumina, siendo la curcumina el componente mayoritario. Se logró separar la curcumina mediante una columna cromatografía, empleando como eluyente una mezcla de tolueno-acetato de etilo en relación (5:1). El producto aislado por este método fue caracterizado espectroscópicamente.
Estructura quimica:
Sólido naranja
Datos espectroscópicos:
RMN- 1H (DMSO-d6, 300 MHz): 3,83 (s, 6H, OCH3 x 2); 6,05 (s, 1H, H-4); 6,75 (d, 2H, H-2, H-6, 3J1, 2 = 15,90 Hz); 6,81(d, 1H, H-2’, 3J 2,,3,= 8,20 Hz); 7,15 (d, 1H, H-3’, 3J2,,3,= 8,20 Hz); 7,32 (s, 1H, H-6’); 7,54 (d, 2H, H-1, H-7, 3J = 15,90 Hz); 9,95 (s, 2H, OH x 2, fenólicos); 10,50 (s, 1H, OH).
RMN-13C (DMSO-d6, 75.46 MHz): 55,64 (OCH3 x 2); 100,76 (C-4); 111,28 (C-6'); 115,65 (C-3'); 121,04 (C-2'); 123,08 (C-2, C-6); 126,27 (C-1'); 140,65 (C-1, C-7); 147,93 (C-4'); 149,29 (C-5'); 183,16 (C-3, C-5).
Síntesis de 1,7-bis(4-(2-bromoetoxi)-3-metoxifenil)-5-hidroxihepta-1,4,6-trien-3-ona (II).
El compuesto sintetizado es un sólido de color naranja, se obtuvieron 0,52 g que representan un rendieminto de 89,65 %. La estructura química, los datos de resonancia magnética nuclear (RMN) y la espectrometría de masas de alta resolución (EMAR) se muestarn a continuación:
Estructura quimica:

Datos espectroscópicos:
RMN-1H (CDCl3, 500 MHz,): δ 3,67(t, 2H, H-9, 3J = 6,90 Hz); 3,95(s, 6H, H-10); 4,40(t, 2H, H-8, 3J = 6,90 Hz); 5,85(s, 1H, H-4); 6,53(d, 2H, H-2, H-6, 3J1,2 = 15,67 Hz); 6,94(d, 1H, H-2', 3J2',3' = 8,31 Hz); 7,14(d, 1H, H-3', 3J2',3' 8,31 Hz, 4J2',6' = 1,90 Hz); 7,36 (s, 1H, H-6’); 7,63(d, 2H, H-1, H-7, 3J6',7' = 15,67 Hz); 16,02(s, 1H, H-4).
RMN-13C (75.46 MHz, CDCl3), δ (ppm): 28.52(C-9); 58.13(C-10); 68.98(C-7); 101.43(C-4); 110.96(C-6'); 114.0(C-3'); 115.10(C-6); 122.28(C-2); 129.25(C-1'); 140.10(C-1); 140.18(C-7); 149.46(C-4'); 149.89(C-5'); 183.21(C-5); 183.46(C-3).
EMAR (M+H), calculada para C25H26Br2O6: 581,01, encontrada: 582.04.
Síntesis de 4,4-ciclopropil-bis(3-(4-(2-bromoetoxi)-3-metoxifenil)-prop-2-en-1-ona (III).
El compuesto sintetizado es un sólidode color amarillo, se obtuvieron 0,43 g que representan un rendimiento de 71,66 %. La estructura química, los datos de resonancia magnética nuclear (RMN) y la espectrometría de masas de alta resolución (EMAR) se muestran a continuación:
Estructura quimica:

Datos espectroscópicos:
RMN-1H (CDCl3, 500 MHz,): δ=1,52 (s, 4H, CH2 x 2); 3,67(t, 2H, H-9, 3J= 6,90 Hz); 3,95(s, 6H, H-10); 4.40(t, 2H, H-8, 3J = 6,90 Hz); 5,85(s, 1H, H-4); 6,53(d, 2H, H-2, H-6, 3J1,2 = 15,67 Hz); 6,94(d, 1H, H-2', 3J2',3' = 8,31 Hz); 7,14(d, 1H, H-3', 3J2',3' = 8,31 Hz); 7,37 (s, 1H, H-6’); 7,63(d, 2H, H-1, H-7, 3J6',7' = 15,67 Hz); 16.02(s, 1H, H-4).
MNR-13C (75.46 MHz, CDCl3), δ(ppm): 28.52(C-9); 58.13(C-10); 68.98(C-7); 101.43(C-4); 110.96(C-6'); 114.0(C-3'); 115.10(C-6); 122.28(C-2); 129.25(C-1'); 140.10(C-1); 140.18(C-7); 149.46(C-4'); 149.89(C-5'); 183.21(C-5); 183.46(C-3).
EMAR (M+H), calculada para C27H28Br2O6: 606,03; encontrada: 607,06.
Discusión
Purificación de la curcumina
El empleo de rizomas de Curcuma longa L. que previamente fueron sometidos a un proceso de hidrodestilación, facilita la extracción de la curcumina debido a que no hay interferencia del aceite esencial y de resinas, lo que hace posible la precipitación de curcuminoides. A pesar que la curcumina es el componente mayoritario de la mezcla de los curcucuminoides aislados, esta no se puede separar sin el empleo de la cromatografía de columna. La identidad y pureza de la curcumina fue demostrada mediante RMN, la pureza lograda permite que esta pueda ser empleada como materia prima en la semisíntesis de compuestos potencialmente bioactivos.
Obtención del ciclopilderivado de la curcumina
La existencia de un equilibrio ceto-enólico en la curcumina permite la alquilación del grupo metileno en la forma ceto (C-4), al ser los grupos fenólicos más ácidos que el grupo metileno es necesario protegerlos en un paso previo. El empleo de carbonato de potasio como base en relación molar 2:1 respecto a la curcumina, permite la O-alquilación selectiva con un halogenuro de alquilo, en este caso se empleó 1,2-dibromo etano en relación molar 2:1, obteniéndose el compuesto II (Figura 2).
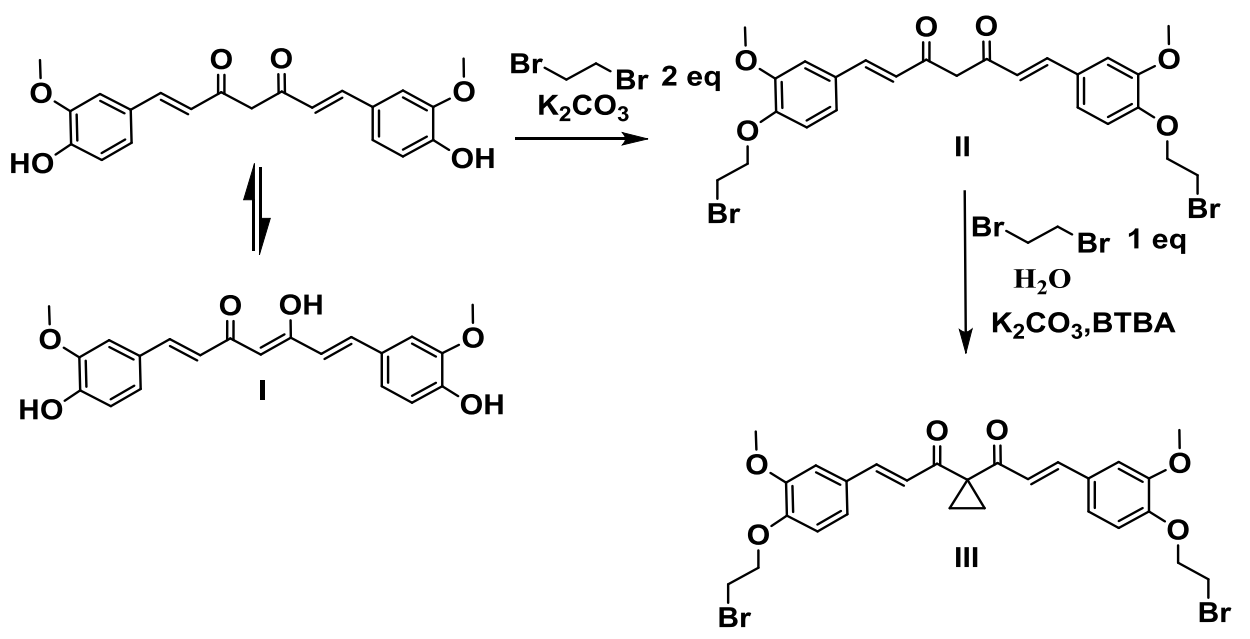
Figura 2: Esquema de reacciones.
En el espectro RMN-1H del compuesto II, además de las señales características de los curcuminoides, aparece un singuleto en 16,02 ppm del OH enólico, lo que demuestra que no se produjo reacción en el C-4, así como los multipletos en 3,67 y 4,40 ppm correspondientes a los protones metilénicos vecinos a los átomos de oxígeno y bromo respectivamente, o que demuestra la existencia de los grupos bromoetil. En el espectro RMN-13C se observan las señales correspondientes a los 25 átomos de carbono de la molécula. El espectro de masas de alta resolución muestra el pico (M+H) 581,01 que coincide con la masa calculada para esta estructura, incrementada en una unidad debido a la adición de una átomo de hidrógeno.
Partiendo del derivado O-alquilado de la curcumina (compuesto II) se procedió a la ciclopropanación. La reacción se desarrolló en medio acuoso debido que el efecto hidrofóbico puede facilitar considerablemente la reacción de alquilación[10, 12].La interacción de los reactivos y el catalizador se logró con el empleo de bromuro de tetrabutilamonio como catalizador de transferencia de fases.
Según Sasson y Bilman la catálisis por transferencia de fase para la alquilación en presencia de K2CO3 procede por un mecanismo interfacial [13]. Por otra parte Qafisheh y colaboradores reportaron un mecanismo interfacial para la reacción de ciclopropanación del malonato de dietilo empleando 1,2-dibromoetano como agente alquilante en presencia de un catalizados de transferencia de fases (CTF) que facilita la interacción en medio acuoso entre el catalizador básico (K2CO3) y el sustrato [14].La C-alquilación (ciclopropanación) de la curcumina ocurre presumiblemente por un mecanismo similar al planteado por Sasson y Qafisheh [13, 14]. En una primera etapa la base sustrae un protón del sustrato (curcumina) en la interface, posteriormente el bromuro de tetrabutilamonio como CTF, transporta el carbanión formado en la primera etapa a la fase orgánica y por último se produce la reacción de sustitución electrofílica en la fase orgánica. En la reacción de C-alquilación de la curcumina con 1,2-dibromoetano se utiliza K2CO3 como catalizados básico, en condiciones básicas la curcumina es inestable, lo que unido al mayor tiempo de reacción, provoca que el rendimiento del producto no sea superior a 71,66 %. El empleo de 1,2-dibromoetano y carbonato de potasio como catalizador básico permite una doble alquilación en C-4, generando un grupo ciclopropilo en esta posición.
En el espectro RMN-1H del compuesto III se observa un singuleto sobre 1,5 ppm con intensidad que se corresponde con 4H, asignados a los dos grupos metilenos del ciclopropano y no aparece la señal típica del OH enólico y del protón unido al C-4; evidencias que corroboran la ocurrencia de la ciclopropanación. En el espectro RMN-13C aparece la señal de un nuevo carbono cuaternario sobre 42 ppm, el C-4 de la heptadienona unido al grupo ciclopropilo y una señal sobre 17 ppm, asignada con ayuda de un el experimento DEPT a los dos grupos metilenos del ciclopropano. El espectro de masas de alta resolución muestra el pico (M+H) 607,06 que coincide con la masa calculada para esta estructura, incrementada en una unidad debido a la adición de una átomo de hidrógeno. Los datos de RMN y la espectrometría de masas permiten corroborar la estructura propuesta para el compuesto III. Debido a la mayor complejidad que le atribuye a los curcuminoides el sistema conjugado, el que a su vez agrega la posibilidad de adición Michael, la reacción de ciclopropanación se convierte en un reto. Se puede considerar que los resultados alcanzados son alentadores desde el punto de vista sintético y farmacológico, pues permiten introducir en la estructura de la curcumina el anillo ciclopropano de gran interés biológico.
Conclusiones
El empleo de rizomas de Curcuma longa L. de los que fue separado el aceite esencial por hidrodestilación, facilita la extracción de la curcumina mediante la precipitación de curcuminoides, seguida de cromatografía de columna. La introducción de un grupo ciclopropilo (ciclopropanación) en el C-4 de la curcumina no se puede realizar sin la protección previa de los grupos fenólicos mediante reacciones de O-alquilación. A partir del derivado O-alquilado de la curcumina es posible realizar la alquilación selectiva en C-4, empleando 1,2-dibrometano como agente alquilante, en relación molar 1:1 respecto a la curcumina, ocurriendo una doble alquilación en el C-4 y generándose un grupo ciclopropilo.
Declaración de conflicto de intereses
No existe conflicto de intereses entre los autores, colaboradores e instituciones involucradas.
Referencias:
1. Valdés González T, Ochoa Martínez M, Falco Manso S, García Herreiz AK, Almora Hernández E, García Cortés R, et al. (2019) Desarrollo y caracterización de un nutracéutico de Cúrcuma longa cosechada en Cuba. Revista del Archivo. del Hospital Universitario “Calixto García” 7: 84–98.
2. Panda AK, Chakraborty D, Sarkar I, Khan T, and Sa G (2017) New insights into therapeutic activity and anticancer properties of curcumin. DOI: 10.2147/JEP.S70568.
3. Sahu PK (2016) Design, structure activity relationship, cytotoxicity and evaluation of antioxidant activity of curcumin derivatives/analogues. DOI: 10.1016/j.ejmech.2016.05.037.
4. Salem M, Rohani S, and Gillies ER (2014) Curcumin, a promising anti-cancer therapeutic: A review of its chemical properties, bioactivity and approaches to cancer cell delivery. DOI: 10.1039/c3ra46396f.
5. Teiten MH, Dicato M, and Diederich M (2014) Hybrid curcumin compounds: A new strategy for cancer treatment. Molecules 19: 20839–20863 DOI: 10.3390/molecules191220839.
6. Schneider TF, Kaschel J, and Werz DB (2014) A new golden age for donor-acceptor cyclopropanes. DOI: 10.1002/anie.201309886.
7. Chanthamath S, and Iwasa S (2016) Enantioselective Cyclopropanation of a Wide Variety of Olefins Catalyzed by Ru(II)-Pheox Complexes. DOI: 10.1021/acs.accounts.6b00070.
8. Ebner C, and Carreira EM (2017) Cyclopropanation Strategies in Recent Total Syntheses. DOI: 10.1021/acs.chemrev.6b00798.
9. Asako S, Kobashi T, and Takai K (2018) Use of Cyclopropane as C1 Synthetic Unit by Directed Retro-Cyclopropanation with Ethylene Release. DOI: 10.1021/jacs.8b09297.
10. Torres-Rodríguez E, Morales-León JÁ, Guillén-González Z, Arias-Cedeño Q, Michalik* D, and Vogel C (2016) Síntesis de 4,4-ciclopropil derivados de curcuminoides en medio acuoso. Revista CENIC Ciencias Químicas 47: 43–48.
11. S PR, S B, Daisy J, and V MP (2015) Reactive Centers of Curcumin and the Possible Role of Metal Complexes of Curcumin as Antioxidants. DOI: 10.13189/ujpa.2015.030102.
12. Simon MO, and Li CJ (2012) Green chemistry oriented organic synthesis in water. DOI: 10.1039/c1cs15222j.
13. Sasson Y, and Bilman N (1989) Mechanism of solid/liquid phase-transfer catalysis in the presence of potassium carbonate: Alkylation of pyrrolidin-2-one. DOI: 10.1039/p29890002029.
14. Qafisheh N, Mukhopadhyay S, Joshi A V, Sasson Y, Chuah GK, and Jaenicke S (2007) Potassium phosphate as a high-performance solid base in phase-transfer-catalyzed alkylation reactions. DOI: 10.1021/ie060899e.
|
Revista QuímicaViva Número 2, año 19, Agosto 2020 quimicaviva@qb.fcen.uba.ar |