La materia orgánica disuelta en los ambientes dulceacuícolas: Efectos en los ecosistemas, transferencia y transformación
Roberto Daniel García
Grupo de Ecología de Sistemas Acuáticos a escala de Paisaje (GESAP), Instituto de Investigaciones en Biodiversidad y Medio Ambiente (INIBIOMA), CONICET-UNComahue. Quintral 1250, Bariloche, Argentina.
Recibido: 29/11/2018 - Aceptado: 15/02/2019
Resumen
La materia orgánica disuelta en los ambientes dulceacuícolas: Efectos en los ecosistemas, transferencia y transformación. Las aguas continentales vinculan los sistemas terrestres, la atmósfera y los océanos a través del ciclo biogeoquímico del carbono. Los arroyos, ríos y lagos son sistemas extremadamente activos para el transporte, transformación y almacenamiento de grandes cantidades de carbono de origen terrestre, que se encuentra principalmente en forma de materia orgánica disuelta (MOD).Este complejo heterogéneo de sustancias posee un rol central en los cuerpos de agua. La MOD influye en la ecología de los sistemas acuáticos ya que atenúa la radiación solar, regula el pH, interviene en el transporte de nutrientes y metales, y sustenta las tramas tróficas microbianas. La transferencia de MOD entre sistemas, su concentración y calidad, están controlados por factores climáticos, físico-químicos y biológicos. Debido a ello, su estudio permite comprender y predecir cambios ambientales naturales y antropogénicos. En este artículo se describe la importancia de la MOD en sistemas dulceacuícolas, detallando sus propiedades químicas, interacciones y transformaciones.
Palabras clave: Ambientes dulceacuícolas; aporte terrestre; degradación; cambio global; ciclo del carbono.
Dissolved organic matter in freshwater environments: Effects on ecosystems, transfer and transformation
Summary
Dissolved organic matter in freshwater environments: Effects on ecosystems, transfer and transformation. Inland waters connect terrestrial systems, atmosphere and oceans through the biogeochemical carbon cycle. The streams, rivers and lakes are extremely active systems for the transport, transformation and storage of large amounts of terrestrial origin carbon, which is found mainly in the form of dissolved organic matter (DOM). This heterogeneous complex of substances plays a key role in water bodies. DOM influences several ecological properties of aquatic ecosystems, attenuating the solar radiation, regulating the pH, mediating the transport of nutrients, metals and, ultimately supporting microbial food webs. The transference of DOM among ecosystems, its magnitude and quality are controlled by several factors including, climate, and physic-chemical and biological ones. Therefore, its study allows us to understand and predict natural and anthropogenic environmental changes. This article describes the importance of DOM in freshwater systems, detailing its chemical properties, interactions and transformations.
Keywords: Freshwater environments; terrestrial contribution; degradation; global change; carbon cycle.
Introducción
Los ambientes dulceacuícolas vinculan la vegetación, los suelos, la atmósfera y los océanos a través del ciclo biogeoquímico del carbono (C) [1-3]. A pesar de que los ambientes dulceacuícolas representan una pequeña parte de la superficie terrestre, estos sistemas juegan un importante papel en el flujo global del C [4, 5].Las estimaciones indican que los sistemas dulceacuícolas transportan, transforman o almacenan aproximadamente ~2,7 Pg de C al año (1 Pg = 1 petagramo o 109 toneladas métricas), lo que representa un~60% de la producción primaria neta de los ecosistemas terrestres [6].
Los ambientes dulceacuícolas pueden ser considerados sistemas heterotróficos, ya que su metabolismo y sus tramas tróficas se encuentran sustentadas en diferente grado por C terrestre [4].Los ríos y arroyos transportan C desde la cuenca, el cual se metaboliza y se sedimenta dentro del sistema[5]. Por su posición en el paisaje, generalmente los lagos concentran los materiales transportados por las redes fluviales. Estos sistemas son sitios extremadamente activos para el transporte, transformación y almacenamiento de grandes cantidades de C terrestre, teniendo un efecto desproporcionado en relación con su extensión espacial [6]. En los lagos y embalses se deposita más C orgánico que en los océanos [4, 7]. Debido a este gran aporte externo, la respiración de los sistemas dulceacuícolas excede a la producción primaria y, como resultado, estos sistemas liberan más dióxido de carbono (CO2) a la atmósfera del que consumen [7, 8].
En los sistemas acuáticos, los aportes de C terrestre se denominan alóctonos y se encuentran regulados por factores climáticos. Las precipitaciones vehiculizan materiales e intensifican la exportación de C terrestre hacia la red fluvial [1, 9]. El agua de las precipitaciones atraviesa diversos elementos de las cuencas (organismos, horizontes del suelo, etc.), concentrando una gran variedad de sustancias que son transportados hacia los cuerpos de agua por medio de la escorrentía [2] (Figura 1).Es por ello que las propiedades geomorfológicas (pendiente, extensión de la ribera, suelos) y biológicas (cobertura vegetal, comunidades del suelo) de la cuenca son determinantes de la cantidad y calidad del C que se exporta hacia los ambientes dulceacuícolas [10].Finalmente, los ríos, arroyos y las aguas subterráneas descargan sus aguas en los lagos, sistemas que concentrarán a través del tiempo los materiales provenientes de las cuencas [11]. La evaporación de los cuerpos de agua condensará en nubes, para luego precipitar en forma de lluvia y nieve, produciendo un nuevo arrastre de material terrestre hacia los ambientes dulceacuícolas (Figura 1).
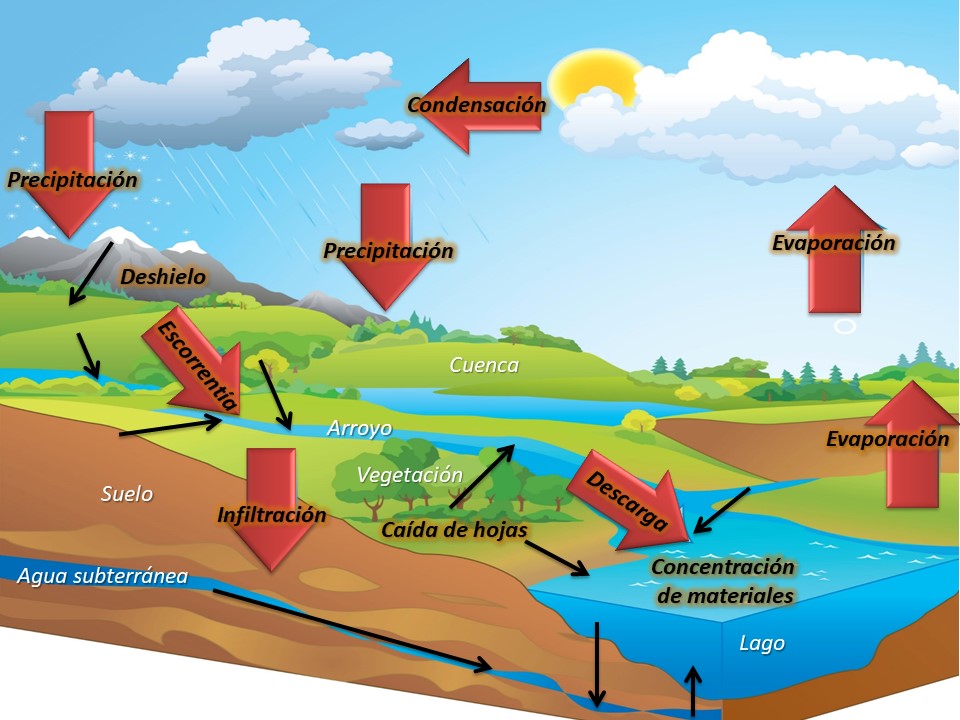
Figura 1: Esquema del ciclo del agua y del transporte de materiales hacia los ambientes acuáticos. Las flechas negras indican flujos de materiales mediados por el agua. Las flechas rojas indican procesos.
La mayor parte del C orgánico presente en los ambientes dulceacuícolas se encuentra en forma de materia orgánica disuelta (MOD), un complejo conjunto de sustancias [2]. Debido a su elevada movilidad y reactividad, la MOD tiene un rol central en el ciclo global del C y en gran medida de ella depende la circulación de la energía y los nutrientes dentro y entre ecosistemas [5, 6]. En el presente trabajo revisaremos la importancia de la MOD en los sistemas dulceacuícolas como así también su origen, transporte y transformación.
La materia orgánica disuelta en los sistemas dulceacuícolas
Los cuerpos de agua concentran un complejo heterogéneo de moléculas orgánicas de distinta composición (desde aminoácidos sencillos a polímeros complejos), que conforman lo que se denomina materia orgánica (MO) [12]. La MO se divide por convención en las fracciones particulada (MOP, >0,45 µm) y disuelta (MOD, <0,45 µm)[13].Esta categorización posee una relevancia trófica, ya que la mayoría de los consumidores secundarios (desde los protozoos hasta los peces) pueden utilizar la MOP, mientras que los microorganismos descomponedores (bacterias) hacen uso principalmente de la MOD [14](Figura 2). Las bacterias metabolizan la MOD, transformándola en biomasa y aportando CO2 a la atmósfera. Al ser consumidas, las bacterias transfieren energía y nutrientes hacia niveles superiores de la trama trófica acuática, lo que se denomina bucle microbiano [15].Si bien la producción primaria acuática realiza un importante aporte de C, la mayor parte de la energía y los nutrientes que sostienen a las tramas tróficas acuáticas proviene del subsidio de MOD del medio terrestre [4, 16] (Figura 2).
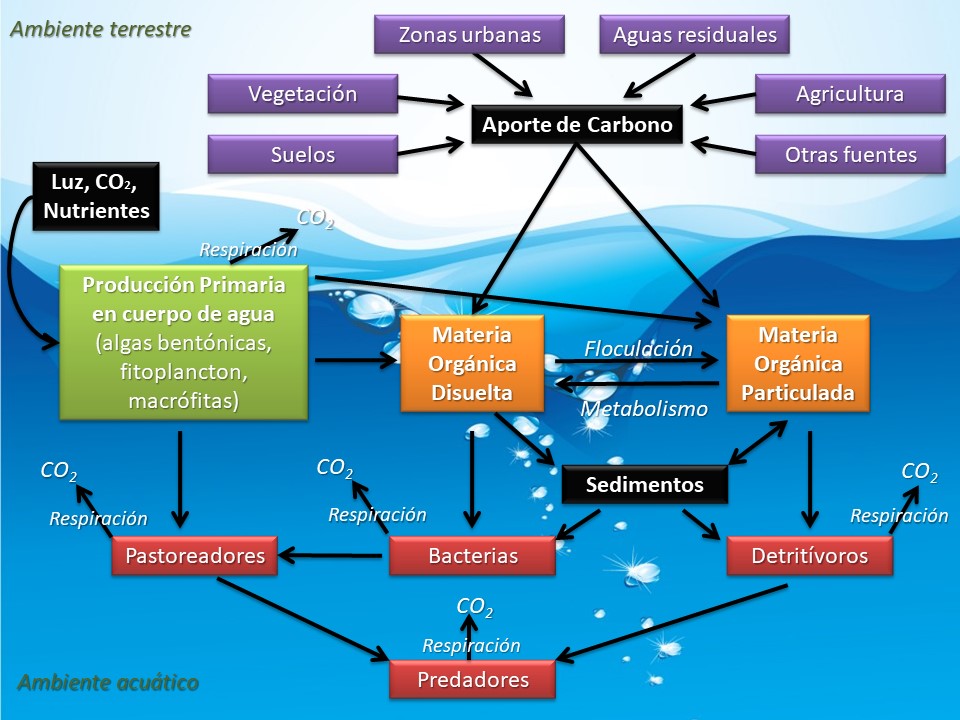
Figura 2: Esquema del ciclo del carbono orgánico en el medio acuático.
Las sustancias que componen la MOD controlan diversos aspectos de los sistemas acuáticos: regulan el pH del medio, determinan la penetración de las distintas longitudes de onda de la luz, influencian la disponibilidad de nutrientes y metales, y proveen compuestos estructurales que son utilizados directa e indirectamente por los organismos [12, 14]. Cuando se encuentra en concentraciones elevadas, la MOD constituye un problema ambiental, alterando la calidad del ecosistema acuático y del agua como recurso vital [12].
La MOD puede controlar tanto la intensidad como la calidad espectral de la luz que penetra en la columna de agua y, por lo tanto, tiene una fuerte influencia sobre la producción primaria del sistema [17]. En ambientes acuáticos muy transparentes con baja concentración de MOD, los niveles de penetración de la radiación solar pueden inhibir la fotosíntesis algal en las capas superficiales, mientras que concentraciones elevadas de MOD pueden limitar la producción primaria [18]. La MOD puede actuar como un filtro, absorbiendo la radiación ultravioleta y amortiguando los efectos nocivos de estas longitudes de onda sobre los organismos [19].
La MOD posee la capacidad de complejizarse con otros elementos, impactando su movilidad, solubilidad y utilización por los organismos [20, 21]. En particular, el ciclo del nitrógeno (N) está fuertemente ligado a la MOD, ya que las sustancias orgánicas pueden contener diferente número de átomos de N en su estructura [22]. El N es un elemento limitante para los organismos acuáticos y su disponibilidad afecta la producción primaria [23]. Entre los metales, la asociación MOD-mercurio (MOD-Hg) ha sido una de las más estudiadas debido a sus implicancias medioambientales. Dependiendo del sistema, la MOD puede inhibir o promover la formación de metilmercurio (CH3Hg+), un peligroso neurotóxico que se bioacumula y biomagnifica en las tramas tróficas acuáticas. El metilmercurio puede encontrarse en concentraciones tóxicas en peces, mamíferos marinos y moluscos de consumo humano. El consumo de animales contaminados altera el desarrollo neurológico en los embriones, fetos en gestación y niños [20, 24].
Propiedades químicas y clasificación de la MOD
La MOD está compuesta principalmente por carbono, nitrógeno, fósforo, oxígeno, hidrógeno y azufre, e incluye un amplio espectro de moléculas: sustancias simples (aminoácidos, azúcares), polímeros complejos y sustancias coloidales [25]. Este gradiente se refleja en un amplio rango de pesos moleculares, solubilidad, afinidad y propiedades ópticas de la MOD [12]. Solamente el 25% de la MOD son moléculas identificables, como hidratos de carbono, grupos amino e hidroxiácidos. El 75% restante se categoriza en grupos generales tales como sustancias húmicas (SH) y no húmicas (SNH) [26]. En los sistemas acuáticos, las SNH representan el 20% de la MOD mientras que el 80% corresponde a SH, generalmente coloreadas y derivadas de residuos de origen animal, vegetal y/o microbiano [25, 26] (Figura 3). Las SH con clasificadas según su solubilidad en: ácidos húmicos (solubles a pH <2), ácidos fúlvicos (solubles independientemente del pH) y huminas (insolubles en todo el rango de pH) [25]. Los ácidos fúlvicos son las SH mayoritarias en los ambientes acuáticos y poseen menor peso molecular (100-2.000 da) que los ácidos húmicos, los cuales pueden formar agregados coloidales de alto peso molecular (100.000 da) [13, 26].
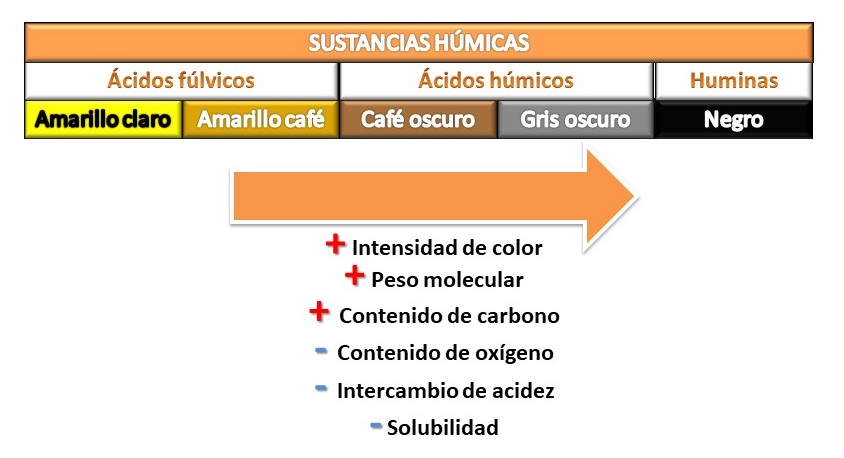
Figura 3: Composición y propiedades químicas de las sustancias húmicas.
La MOD puede caracterizarse a través de su concentración y calidad. Generalmente, se utiliza la concentración del C orgánico disuelto como estimador de la concentración de MOD, mientras que existe un amplio abanico de parámetros para definir la calidad de la MOD [27]. Existe una evolución continua en los enfoques analíticos para determinar la composición, el origen y la reactividad de la MOD debido al advenimiento de nuevas tecnologías. Sin embargo, las propiedades de absorción de la luz y de fluorescencia de la MOD han permitido un gran avance en su caracterización mediante técnicas espectrofotométricas, que brindan una rápida información acerca del tamaño molecular, aromaticidad y estado diagenético, permitiendo inferir su origen y composición [12, 13]. El reciente desarrollo de técnicas instrumentales (p.e., espectrometría de masas) ha mejorado la capacidad para caracterizar compuestos orgánicos individuales y mezclas homogéneas [27]. Sin embargo, debido a la gran complejidad de la MOD, su caracterización sigue siendo un desafío.
Origen y procesos que controlan la MOD
En ambientes dulceacuícolas, la concentración de MOD (estimada a partir de la concentración de carbono orgánico disuelto) varía aproximadamente entre 0,5 y 50,0 mg/L [28]. Este C orgánico proviene tanto de fuentes internas (autóctonas) como de fuentes externas (alóctonas) [14]. La MOD autóctona deriva de la producción primaria de las algas y macrófitas, prevaleciendo el fitoplancton en los ecosistemas lénticos y el biofilm (algas adheridas a diferentes sustratos) en los ecosistemas lóticos (Figura 2). La generación de MOD a partir de los organismos se produce por senescencia, pastoreo, lisis viral o liberación extracelular de compuestos orgánicos [26]. La MOD autóctona es particularmente susceptible a la degradación bacteriana debido a que se encuentra conformada principalmente por sustancias de fácil asimilación, como proteínas y polisacáridos [29].
La MOD alóctona proviene principalmente del ecosistema terrestre y deriva de la vegetación terrestre y de los suelos [14]. El ingreso de esta MOD a los ambientes acuáticos se encuentra ligado a las precipitaciones que movilizan materiales por escurrimiento superficial (escorrentía, por transporte de aguas superficiales conectadas) y subsuperficial (aguas subterráneas).El ingreso directo de hojarasca y detrito aporta también MOD por lixiviación [7] (Figura 1). La cantidad y calidad de MOD alóctona que ingresa a los sistemas acuáticos se encuentra influenciada por una variedad de factores, entre los que destacan el clima y las actividades antrópicas [30,31].
La MOD alóctona es dependiente de los procesos y de las características de las cuencas, como son el tipo de suelos y vegetación, el tamaño y la pendiente de la cuenca, la presencia de permafrost, entre otros [10, 32, 33]. Sin embargo, es el efecto del clima (precipitación y temperatura) el que genera la interacción entre la cuenca y los sistemas acuáticos, ya sea por arrastre de materiales durante la escorrentía o por efecto del deshielo [34, 35]. En efecto, las precipitaciones pueden incrementar la concentración de MOD de los sistemas acuáticos debido al mayor flujo de materiales [9, 36].
El cambio climático tiene grandes consecuencias para la MOD de los ecosistemas acuáticos, con efectos a corto y a largo plazo (Figura 4). El aumento de la temperatura, los cambios en las precipitaciones, etc., pueden producir grandes alteraciones en el grado de procesamiento y transferencia de los materiales terrestres hacia los cuerpos de agua [37]. Por ejemplo, el calentamiento global ha reducido la superficie de permafrost, generando un ingreso de grandes volúmenes de MO inactiva al ciclo del C, que se degrada en los suelos y cuerpos de agua liberando enormes cantidades de CO2 a la atmósfera [8, 37, 38]. En regiones donde se acumulaba una capa de nieve en invierno, las temperaturas más cálidas podrían generar una escorrentía temprana, alterando la calidad del material que es exportado desde los suelos debido al procesamiento incompleto por parte de los microorganismos [6, 37]. A su vez, la vegetación de ribera puede experimentar cambios en la composición de especies y en su relación estequiométrica (carbono: nitrógeno) debido a la variación en los patrones climáticos. Los múltiples efectos del cambio climático se traducirán en fluctuaciones de la calidad y cantidad de la MOD que es exportada desde el medio terrestre, impactando de una manera incierta sobre las redes tróficas de los sistemas acuáticos [19, 28] (Figura 4).
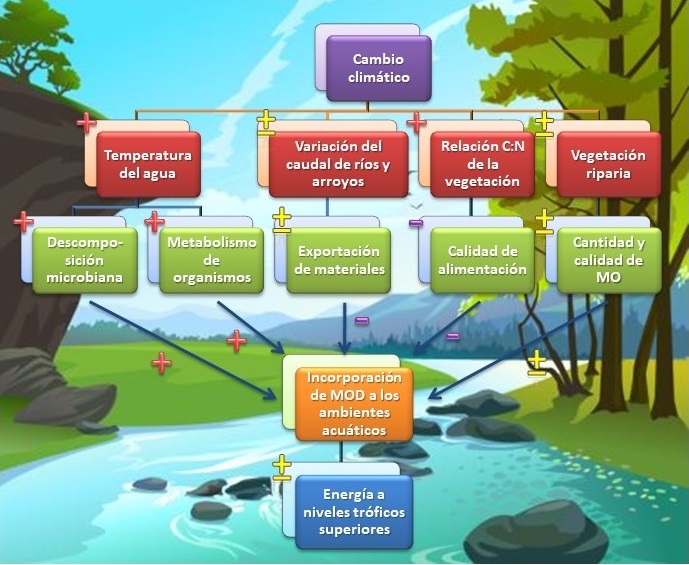
Figura 4: Impacto potencial del cambio climático sobre la materia orgánica disuelta en ambientes dulceacuícolas. +: Influencia positiva; –: Influencia negativa; ±: Incertidumbre; MO: Materia orgánica; MOD: Materia orgánica disuelta; C:N: Relación carbono:nitrógeno.
En la actualidad, la actividad antrópica es otro importante regulador de la MOD. La intensificación del impacto humano debido al crecimiento de la población, la ampliación de la frontera urbana y los cambios en la magnitud y calidad de los aportes desde el medio terrestre antropizado alteran directa e indirectamente a la MOD [30, 31]. Uno de los impactos más importantes de la actividad humana es la eutrofización, es decir, la contaminación y el enriquecimiento de C y nutrientes de los ecosistemas naturales [39]. En regiones del hemisferio norte (Norteamérica, norte y centro de Europa, y sudeste de Asia), la alteración de los ciclos hidrológicos, la urbanización y la agricultura, han conducido a un aumento sustancial de la MOD en los sistemas acuáticos, con una fuerte disminución de la claridad del agua. Este proceso, conocido como oscurecimiento de los ambientes dulceacuícolas, produce un detrimento de la calidad del agua y un incremento de los costos de potabilización de la misma [30, 38].
Transformación de la MOD
El tiempo de residencia de la MOD en los ecosistemas determina la importancia relativa de los procesos internos frente a los externos [7, 9]. En sistemas con tiempos de residencia del agua cortos, la dinámica de la MOD está determinada por factores externos como la climatología o la posición en el paisaje [9, 10]. En sistemas con tiempos de residencia más extensos, los procesos internos adquieren un papel más importante, dando lugar a distintas transformaciones de la MOD [40].
La fotodegradación y la biodegradación son reconocidos como los procesos más importantes que actúan en la transformación y mineralización de la MOD [41, 42]. La acción de la radiación solar sobre la MOD puede producir múltiples efectos, como por ejemplo la fotomineralización (que se traduce en la transferencia de C a la atmósfera en forma de CO2), la fotodegradación de la MOD (en inglés, “photobleaching”; pérdida de la capacidad de absorber fotones), la fotopolimerización (aumento de la capacidad de absorber fotones), o la formación de especies reactivas de oxígeno, como el peróxido de hidrógeno [40, 43, 44] (Figura 5). El efecto de la radiación solar depende de la composición inicial de la MOD, de su historial previo de degradación y de las condiciones de irradiación (p. e., longitudes de onda y duración de la luz) [45]. Los compuestos aromáticos provenientes del ambiente terrestre son considerados como los materiales más fotolábiles, mientras que los compuestos alifáticos son los más fotoresistentes y a su vez los más fotoproducidos [46].
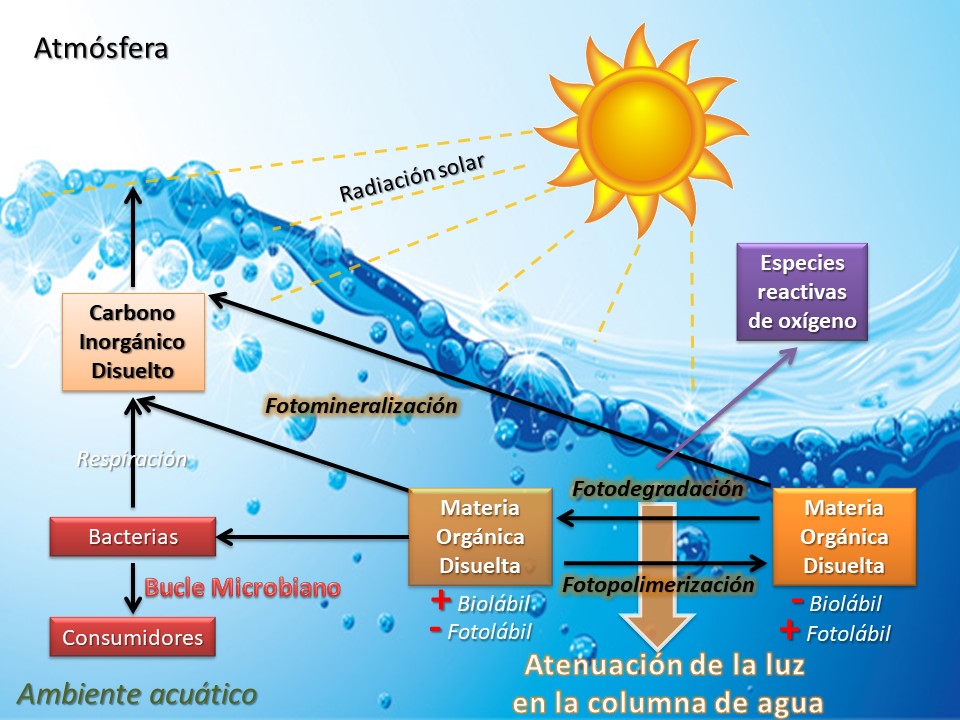
Figura 5: Efectos de la radiación solar sobre la materia orgánica disuelta (MOD) en los ambientes acuáticos y su interacción con las redes tróficas.
Por su parte, la biodegradación de la MOD es un proceso que consiste en su utilización como sustrato microbiano, cuyo metalismo produce la transformación y mineralización, liberando CO2 al sistema (Figura 5). La biolabilidad de la MOD varía según su calidad y origen [47]. Los sustratos preferenciales de las bacterias son los aminoácidos libres y los carbohidratos, pudiendo ser capaces de utilizar materiales más complejos (p. e., sustancias húmicas). En el metabolismo acuático, la MOD alóctona puede ser considerada menos biolábil que la MOD autóctona, debido a su mayor contenido de compuestos aromáticosy húmicos [46, 48].
La foto y la biodegradación son procesos que ocurren en simultáneo en los sistemas acuáticos, pudiendo actuar sinérgicamente (Figura 5). Dependiendo del origen de la MOD, la radiación solar puede disminuir, incrementar o no tener ningún efecto sobre su biodegradabilidad [40]. Algunos compuestos provenientes del ambiente terrestre (p.e., ligninas, ácidos húmicos) aumentan su biolabilidad al ser expuestos a la radiación ultravioleta, debido a su ruptura en compuestos de menor peso molecular, fácilmente utilizables por las bacterias [49, 50]. Por el contrario, fuentes más biolábiles de MOD (p.e., exudados algales), reducen su biolabilidad después de la exposición a la radiación, debido a su condensación en macromoléculas recalcitrantes que limitan el crecimiento bacteriano [48, 49]. La disponibilidad, transformación y degradación de la MOD tiene implicancias claves para el ciclo del C, nutrientes y metales, como así también para la estructuración de las comunidades y la dinámica trófica de los sistemas acuáticos.
Consideraciones finales
Los sistemas dulceacuícolas revelan información crítica sobre los procesos que ocurren en la biosfera a través de las fluctuaciones en sus características físico-químicas y biológicas [7, 28]. En particular, la MOD evidencia señales de procesos y/o disturbios pasados y presentes en sus cuencas que permiten inferir el impacto futuro de cambios ambientales que operan actualmente [51].El cambio impulsado por el clima está generando respuestas complejas en los ecosistemas, que varían dependiendo de la distribución geográfica. El mayor ingreso de MOD desde las cuencas hacia los ríos y lagos ha sido extensamente registrado en América del Norte y Europa, y ha causado gran preocupación en la comunidad científica. Sin embargo, los efectos sobre otras regiones todavía se encuentran bajo estudio [7].
La dinámica de la MOD también puede ser usada como herramienta para predecir los impactos antrópicos [51].Los vertidos de aguas residuales, la actividad agrícola, la destrucción de hábitats naturales, entre otras prácticas, modifican los ciclos biogeoquímicos y sus efectos se traducen en el deterioro de la calidad del agua y en la perdida de servicios ecosistémicos [52].Si queremos mitigar las implicancias ambientales, sociales y económicas que esto puede acarrear, será fundamental conocer cómo funcionan los ciclos biogeoquímicos dentro y entre sistemas, cómo se ven influenciados por las perturbaciones, y por qué estos ciclos funcionan como lo hacen.
Agradecimientos
Agradezco a M Reissig, MC Diéguez, PE García y a un revisor anónimo por sus valiosos aportes que han mejorado notablemente la escritura del manuscrito.
Referencias:
1. Lohse KA, Brooks PD, McIntosh JC, Meixner T, Huxman TE (2009) Interactions between biogeochemistry and hydrologic systems. Annual Review of Environment and Resources 34: 65–96.DOI:10.1146/annurev.environ.33.031207.111141
2. Aufdenkampe AK, Mayorga E, Raymond PA, Melack JM, Doney SC, Alin SR, et al. (2011) Riverine coupling of biogeochemical cycles between land, oceans, and atmosphere. Frontiers in Ecology and the Environment 9(1): 53–60. DOI:10.1890/100014.
3. Xenopoulos MA, Downing JA, Kumar MD, Menden‐Deuer S, Voss M (2017) Headwaters to oceans: Ecological and biogeochemical contrasts across the aquatic continuum. Limnology and Oceanography 62(S1): S3–S14. DOI:10.1002/lno.10721.
4. Cole JJ, Prairie YT, Caraco NF, McDowell WH, Tranvik LJ, Striegl RG, et al. (2007) Plumbing the global carbon cycle: integrating inland waters into the terrestrial carbon budget. Ecosystems 10(1): 172–185. DOI:10.1007/s10021-006-9013-8.
5. Battin TJ, Kaplan LA, Findlay S, Hopkinson CS, Marti E, Packman AI, et al. (2008) Biophysical controls on organic carbon fluxes in fluvial networks. Nature Geoscience 1(2): 95–100. DOI:10.1038/ngeo101.
6. Tranvik LJ, Downing JA, Cotner JB, Loiselle SA, Striegl RG, Ballatore TJ, et al. (2009) Lakes and reservoirs as regulators of carbon cycling and climate. Limnology and Oceanography 54(6part2): 2298–2314.DOI:10.4319/lo.2009.54.6_part_2.2298.
7. Ward ND, Bianchi TS, Medeiros PM, Seidel M, Richey JE, Keil RG, et al. (2017) Where carbon goes when water flows: carbon cycling across the aquatic continuum. Frontiers in Marine Science 4: artículo 7. DOI:10.3389/fmars.2017.00007.
8. Raymond PA, Hartmann J, Lauerwald R, Sobek S, McDonald C, Hoover M, et al. (2013) Global carbon dioxide emissions from inland waters. Nature 503(7476): 355–359. DOI:10.1038/nature12760.
9. Garcia RD, Reissig M, Queimaliños CP, Garcia PE, Diéguez MC (2015) Climate-driven terrestrial inputs in ultraoligotrophic mountain streams of Andean Patagonia revealed through chromophoric and fluorescent dissolved organic matter. Science of The Total Environment 521-522: 280–292.DOI:10.1016/j.scitotenv.2015.03.102.
10. Garcia PE, Diéguez MC, Queimaliños CP (2015) Landscape integration of North Patagonian mountain lakes: a first approach using characterization of dissolved organic matter. Lakes & Reservoirs: Research & Management 20(1): 19–32. DOI:10.1111/lre.12083.
11. Garcia RD, Gerea M, Soto Cárdenas S, Garcia PE, Pérez G, Reissig M, Queimaliños CP, Diéguez MC (2015c) Integrando los cuerpos de agua al paisaje del Parque: la trama invisible de las cuencas. Macroscopía 5: 3–8.
12. Aiken GR (2014) Fluorescence and dissolved organic matter: a chemist's perspective. En: Coble PG, Lead J, Baker A, Reynolds D., Spencer RGM (eds.), Aquatic Organic Matter Fluorescence, New York :Cambridge University Press
13. Leenheer JA, Croué JP (2003) Peer reviewed: characterizing aquatic dissolved organic matter. Environmental Science & Technology 37(1): 18A–26A.
14. Wetzel RG (2003) Dissolved organic carbon: Detrital energetics, metabolic regulators, and drivers of ecosystem stability of aquatic ecosystems. En: Findlay SEG, Sinsabaugh RL (eds.), Aquatic Ecosystems: Interactivity of Dissolved Organic Matter. San Diego: Academic Press. Estados Unidos.
15. Guillemette F, Del Giorgio PA (2012) Simultaneous consumption and production of fluorescent dissolved organic matter by lake bacterioplankton. Environmental Microbiology 14: 1432–1443. DOI:10.1111/j.1462-2920.2012.02728.x.
16. Tranvik LJ, Cole JJ, Prairie YT (2018) The study of carbon in inland waters—from isolated ecosystems to players in the global carbon cycle. Limnology and Oceanography Letters 3(3): 41–48. DOI:10.1002/lol2.10068.
17. Morris DP, Zagarese H, Williamson CE, Balseiro EG, Hargreaves BR, Modenutti B, et al. (1995) The attenuation of solar UV radiation in lakes and the role of dissolved organic carbon. Limnology and Oceanography 40: 1381–1391. DOI:10.4319/lo.1995.40.8.1381.
18. Gerea M, Pérez GL, Unrein F, Soto Cárdenas CE, Morris D, Queimaliños CP (2017) CDOM and the underwater light climate in two shallow North Patagonian lakes: evaluating the effects on nano and microphytoplankton community structure. Aquatic Sciences 79(2): 231–248. DOI:10.1007/s00027-016-0493-0.
19. Häder DP, Williamson CE, Wangberg SA, Rautio M, Rose KC, Gao K, et al. (2015) Effects of UV radiation on aquatic ecosystems and interactions with other environmental factors. Photochemical & Photobiological Sciences 14(1): 108–126.DOI:10.1039/C4PP90035A.
20. Ravichandran M (2004) Interactions between mercury and dissolved organic matter— a review. Chemosphere 55(3): 319–331.DOI:10.1016/j.chemosphere.2003.11.011.
21. Soto Cárdenas CE, Diéguez MC, Queimaliños CP, Rizzo A, Fajon V, Kotnik J, et al.(2018a) Mercury in a stream-lake network of Andean Patagonia (Southern Volcanic Zone): Partitioning and interaction with dissolved organic matter. Chemosphere 197: 262-270. DOI:10.1016/j.chemosphere.2018.01.048.
22. Bronk DA, See JH, Bradley P, Killberg L (2007) DON as a source of bioavailable nitrogen for phytoplankton. Biogeosciences 4(3): 283–296.DOI:hal-00297614.
23. Kissman CE, Williamson CE, Rose KC, Saros JE (2013) Response of phytoplankton in an alpine lake to inputs of dissolved organic matter through nutrient enrichment and trophic forcing. Limnology and Oceanography 58(3): 867–880. DOI:10.4319/lo.2013.58.3.0867.
24. Soto Cárdenas CE, Gerea M, Queimaliños CP, Ribeiro Guevara S, Diéguez MC (2018b) Inorganic mercury (Hg2+) accumulation in autotrophic and mixotrophic planktonic protists: Implications for Hg trophodynamics in ultraoligotrophic Andean Patagonian lakes. Chemosphere 199: 223–231.DOI:10.1016/j.chemosphere.2018.02.035.
25. Hessen DO, Tranvik LJ (1998) Aquatic Humic Substances: Ecology and Biogeochemistry. Berlin: Springer-Verlag.
26. Steimberg C (2013) Ecology of Humic Substances in Freshwaters: Determinants from Geochemistry to Ecological Niches. Berlin:Springer Science & Business Media.
27. Minor EC, Swenson MM, Mattson BM, Oyler AR (2014) Structural characterization of dissolved organic matter: a review of current techniques for isolation and analysis. Environmental Science: Processes & Impacts 16(9): 2064–2079. DOI:10.1039/C4EM00062E.
28. Creed IF, McKnight DM, Pellerin BA, Green MB, Bergamaschi BA, Aiken GR, et al. (2015) The river as a chemostat: fresh perspectives on dissolved organic matter flowing down the river continuum. Canadian Journal of Fisheries and Aquatic Sciences 72(8): 1272–1285. DOI:10.1139/cjfas-2014-0400.
29. Benner R (2003) Molecular indicators of the bioavailability of dissolved organic matter En: Findlay SEG, Sinsabaugh RL (eds.), Aquatic Ecosystems: Interactivity of Dissolved Organic Matter. San Diego:Academic Press.
30. Williams CJ, Frost PC, Morales‐Williams AM, Larson JH, Richardson WB, Chiandet AS, et al. (2016) Human activities cause distinct dissolved organic matter composition across freshwater ecosystems. Global Change Biology 22(2): 613–626. DOI:10.1111/gcb.13094.
31. Creed IF, Bergström AK, Trick CG, Grimm NB, Hessen DO, Karlsson J, et al. (2018) Global change‐driven effects on dissolved organic matter composition: Implications for food webs of northern lakes. Global Change Biology 24: 1–23. DOI:10.1111/gcb.14129.
32. Aitkenhead-Peterson J, McDowell W, Neff J, Stuart E, Robert L (2003) Sources, production, and regulation of allochthonous dissolved organic matter inputs to surface waters En: Findlay SEG, Sinsabaugh RL (eds.). Aquatic Ecosystems: Interactivity of Dissolved Organic Matter San Diego:Academic Press.
33. Garcia RD, Messeta ML, Feijoó C, Garcia PE (en prensa) Assessment of variations in dissolved organic matter in contrasting streams in the Pampas and Patagonian regions (Argentina).Marine & Freshwater Research. DOI:10.1071/MF18156.
34. Finlay JC, Neff JC, Zimov S, Davydova A, Davydova S (2006) Snowmelt dominance of dissolved organic carbon in high-latitude watersheds: Implications for characterization and flux of river DOC. Geophysical Research Letters 33(10):L10401. DOI:10.1029/2006GL025754.
35. Garcia RD (2016) Caracterización de la materia orgánica alóctona y la dinámica de su ingreso en un lago profundo Norpatagónico a través de arroyos tributarios. Tesis de Doctorado, Universidad del Comahue, Argentina.
36. Messetta ML, Hegoburu C, Casas-Ruiz JP, Butturini A, Feijoó C (2018) Characterization and qualitative changes in DOM chemical characteristics related to hydrologic conditions in a Pampean stream. Hydrobiologia 808(1): 201–217. DOI:10.1007/s10750-017-3422-x.
37. Erickson III DJ, Sulzberger B, Zepp RG, Austin AT (2015) Effects of stratospheric ozone depletion, solar UV radiation, and climate change on biogeochemical cycling: interactions and feedbacks. Photochemical & Photobiological Sciences 14(1): 127–148. DOI:10.1039/ C4PP90036G.
38. Fasching C, Behounek B, Singer GA, Battin TJ (2014) Microbial degradation of terrigenous dissolved organic matter and potential consequences for carbon cycling in brown-water streams. Scientific Reports 4, N° artículo 4981. DOI:10.1038/srep04981.
39. Carpenter SR, Stanley EH, Vander Zanden MJ (2011) State of the world's freshwater ecosystems: physical, chemical, and biological changes. Annual review of Environment and Resources 36: 75–99. DOI:10.1146/annurev-environ-021810-094524.
40. Reche I (2003) Sensibilidad de los ecosistemas acuáticos a la radiación ultravioleta: el papel de la materia orgánica disuelta. Ecosistemas 12(1): 1–11.
41. Chen M, Jaffé R (2014) Photo- and bio-reactivity patterns of dissolved organic matter from biomass and soil leachates and surface waters in a subtropical wetland. Water Research 61: 181–190.DOI:10.1016/j.watres.2014.03.075.
42. Hansen AM, Kraus TE, Pellerin BA, Fleck JA, Downing BD, Bergamaschi BA (2016) Optical properties of dissolved organic matter (DOM): Effects of biological and photolytic degradation. Limnology and Oceanography 61(3): 1015–1032. DOI:10.1002/lno.10270.
43. Moran MA, Sheldon WM, Zepp RG (2000) Carbon loss and optical property changes during long-term photochemical and biological degradation of estuarine dissolved organic matter. Limnology and Oceanography 45(6): 1254–1264. DOI:10.4319/lo.2000.45.6.1254.
44. Garcia PE, Queimaliños CP, Diéguez MC (2018) Natural levels and photo-production rates of hydrogen peroxide (H2O2) in Andean Patagonian aquatic systems: Influence of the dissolved organic matter pool. Chemosphere. DOI:10.1016/j.chemosphere.2018.10.179.
45. Garcia RD, Diéguez MC, Gerea M, Garcia PE, Reissig M (2018) Characterisation and reactivity continuum of dissolved organic matter in forested headwater catchments of Andean Patagonia. Freshwater Biology 63(9): 1049–1062. DOI:10.1111/fwb.13114.
46. Helms JR, Mao J, Stubbins A, Schmidt-Rohr K, Spencer RG, Hernes PJ, et al. (2014) Loss of optical and molecular indicators of terrigenous dissolved organic matter during long-term photobleaching. Aquatic Sciences 76(3): 353–373. DOI:10.1007/s00027-014-0340-0.
47. Benner R, Kaiser K (2011) Biological and photochemical transformations of amino acids and lignin phenols in riverine dissolved organic matter. Biogeochemistry 102(1-3): 209–222. DOI:10.1007/s10533-010-9435-4.
48. Catalán N, Obrador B, Felip M, Pretus JL (2013) Higher reactivity of allochthonous vs. autochthonous DOC sources in a shallow lake. Aquatic Sciences 75(4): 581–593. DOI:10.1007/s00027-013-0302-y.
49. Fasching C, Battin TJ (2012) Exposure of dissolved organic matter to UV-radiation increases bacterial growth efficiency in a clear-water Alpine stream and its adjacent groundwater. Aquatic Sciences 74(1), 143–153. DOI:10.1007/s00027-011-0205-8.
50. Fellman JB, Petrone KC, Grierson PF (2013) Leaf litter age, chemical quality, and photodegradation control the fate of leachate dissolved organic matter in a dryland river. Journal of Arid Environments 89: 30–37.DOI:10.1016/j.jaridenv.2012.10.011.
51. Williamson CE, Saros JE, Vincent WF, Smol JP (2009) Lakes and reservoirs as sentinels, integrators, and regulators of climate change. Limnology and Oceanography 54(6part2): 2273–2282.DOI:10.4319/lo.2009.54.6_part_2.2273.
52. Cirrelli AF (2012) El agua: Un recurso esencial. Química Viva 11 (3): 147–170.
|
Revista QuímicaViva Número 1, año 18, Abril 2019 quimicaviva@qb.fcen.uba.ar |