El espermatozoide: algo más que un paquete de lujo para entregar DNA
Maite Yael Cambiasso1, Camila Galotto1, Melisa Celeste Sánchez1, Vanina Fontana2,3, Lucrecia Piñeiro1, Marina Romanato1 y Juan Carlos Calvo1,2
1Instituto de Biología y Medicina Experimental (IBYME), CONICET, 2Departamento de Química Biológica, Facultad de Ciencias Exactas y Naturales, Universidad de Buenos Aires, 3IQUIBICEN, CONICET, Buenos Aires, Argentina.
Resumen
Durante la formación del espermatozoide, en la última etapa de la espermatogénesis, llamada espermiogénesis, hay un recambio de histonas por protaminas (P1 y P2). Estas proteínas básicas empaquetan la cromatina modificando los nucleosomas por estructuras de toroides. Esto significa una condensación mucho mayor que la de una célula somática, haciendo esta cromatina transcripcionalmente inactiva, pero mucho más resistente a daños físicos y por especies reactivas de oxígeno. Luego de la penetración del espermatozoide al ovocito, el primer paso hacia la formación del pronúcleo masculino es la descondensación de esta cromatina. Este proceso se lleva a cabo con la acción del glutatión que reduce los puentes disulfuro intra e inter protaminas, como también de una molécula con alta carga negativa que permite el remplazo de las protaminas por las histonas ovocitarias. Hemos estudiado este proceso y demostrado que esa molécula es el heparán sulfato ovocitario. También estudiamos el papel de otro glicosaminoglicano con cierta capacidad descondensante, el dermatán sulfato, en espermatozoides de donantes y pacientes, en particular con respecto a la proporción de protaminas presentes en esos núcleos, demostrando una relación P1/P2 disminuida y con posibilidad de impactar en la descondensación diferencial usando dermatán sulfato o heparina (como equivalente molecular del heparán sulfato, por similitud de estructura, carga y potencia descondensante).
Palabras clave: espermatozoide; cromatina; descondensación; protaminas; glicosaminoglicanos
Summary
During the formation of the sperm, in the last stage of the spermatogenesis, called spermiogenesis, there is a replacement of histones by protamines (P1 and P2). These basic proteins package chromatin by modifying the nucleosomes by toroid structures. This means a much larger condensation than a somatic cell, making this chromatin transcriptionally inactive, but much more resistant to physical damage and reactive oxygen species. After the penetration of the sperm to the oocyte, the first step towards the formation of the male pronucleus is the decondensation of this chromatin. This process is carried out with the action of glutathione that reduces disulfide bridges intra and inter protamines, as well as a molecule with high negative charge that allows the replacement of protamines by oocyte histones. We have studied this process and demonstrated that this molecule is the oocyte heparan sulfate. We also studied the role of another glycosaminoglycan with a certain decondensing capacity, dermatan sulfate, in sperm of donors and patients, in particular with respect to the proportion of protamines present in those nuclei, demonstrating a decreased P1/P2 relationship and with the possibility of a differential decondensation using dermatan sulfate or heparin (as the molecular equivalent of heparan sulfate, by similarity of structure, negative charge and decondensing power).
Keywords: spermatozoa; chromatin; decondensation; protamines; glycosaminoglycans
Introducción
En el camino de la evolución, la separación de los sexos permitió una reproducción más eficiente desde el punto de vista de herencia genética, al combinar los caracteres hereditarios del varón y la mujer en un núcleo nuevo generado a partir del proceso de fecundación entre un espermatozoide y un ovocito. Esta fecundación permite que, al ingresar la totalidad del espermatozoide al interior (ooplasma) del ovocito, una vez desparecidas sus membranas, el material genético pueda combinarse con la contraparte femenina y así organizar el núcleo del embrión [1].
Pero, desde el punto de vista molecular, este proceso (singamia) no es tan simple dada la compleja condensación de la cromatina espermática (de 6 a 8 veces más compacta que la cromatina de cualquier célula somática), ocurrida durante la última fase de la espermatogénesis: espermiogénesis (Fig. 1) [2]. En esta etapa, las histonas que comúnmente organizan la cromatina en unidades nucleosomales, son remplazadas por otras proteínas básicas, más pequeñas, llamadas protaminas. Estas protaminas condensan la cromatina en forma de toroide, a diferencia del solenoide generado por la interacción con las histonas, confiriendo más resistencia frente a daños por especies reactivas de oxígeno, a expensas de hacer a esta cromatina transcripcionalmente inactiva [3]. Aproximadamente, dependiendo de la especie, entre un 85 y 90% de las histonas [4] son remplazadas por protaminas lo que deja a esta cromatina en un estado condensado que presenta zonas nucleosomales (solenoides) con toroides donde se encuentran las protaminas (Fig. 2).
La condensación diferencial hace suponer que la descondensación no ocurra en todo el cromosoma de igual manera, sino que, dependiendo de la presencia de histonas o protaminas, pueda haber zonas que descondensen antes que otras.
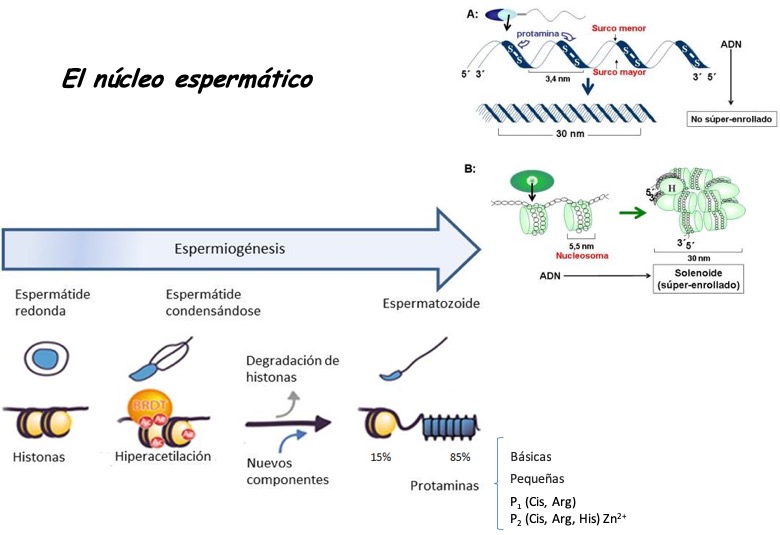
Figura 1: Condensación de la cromatina espermática. Representación gráfica de las etapas involucradas indicando la presencia de protaminas y el remplazo de las histonas por estas proteínas.
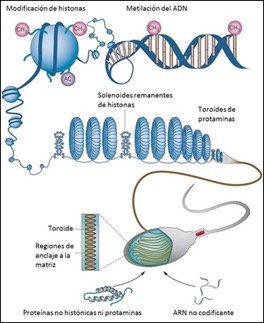
Figura 2: Ubicación de las protaminas en la cromatina espermática. En el esquema se indica su ubicación junto con los nucleosomas remanentes.
Las protaminas
Las protaminas [5] comprenden una familia de proteínas pequeñas (aproximadamente entre 50 y 110 aminoácidos) y ricas en arginina, sintetizadas en la etapa final de espermátidas, encontradas en muchos animales y plantas, que se unen al DNA, condensando el genoma de esas células a un estado genéticamente inactivo. La comparación de secuencias sugiere que han evolucionado desde histonas especializadas hasta protaminas, pasando por un estado de proteínas símil protaminas. Los elementos estructurales que están presentes en todas las protaminas maduras, comprenden dominios ricos en arginina que serían responsables de la unión al DNA, con múltiples sitios de fosforilación potencial. Encontramos dos protaminas, presentes diferencialmente en las distintas especies: P1 y P2. De estas, P1 (Fig. 3) se encuentra empaquetando el DNA espermático en todos los mamíferos, mientras que P2 (Fig. 4) está presente en los espermatozoides de primates, algunos roedores y un grupo de mamíferos placentarios [6, 7]. P2 se sintetiza a partir de un precursor que sufre procesamiento proteolítico luego de unirse al DNA y que, además, tiene la capacidad de unir Zn2+, aunque no se conoce bien la función de este último [7]. Si bien, P1 y P2 pueden ser fosforiladas inmediatamente a su síntesis, luego de unirse al ácido nucleico la mayoría de los grupos fosfato son eliminados y los residuos cisteína son oxidados, permitiendo la formación de enlaces disulfuro que une a las protaminas entre sí, como también formar puentes disulfuro intramoleculares [8, 9]. Se ha demostrado que ambas, P1 y P2, son esenciales para la función espermática normal, encontrándose en una relación 1:1 en humanos y 2:1 en ratones, siendo P1 la única protamina presente en espermatozoides de rata [10].
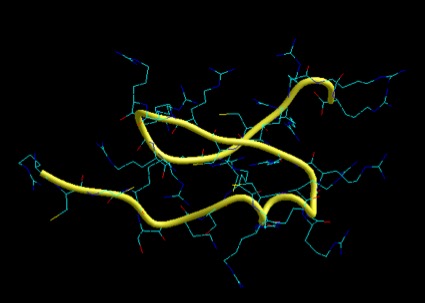
Figura 3: Modelado por similitud de la protamina P1. Se toma como molde el dominio de reconocimiento de heparina en una isoforma alternativa del VEGF-A (el VEGF55) [11]
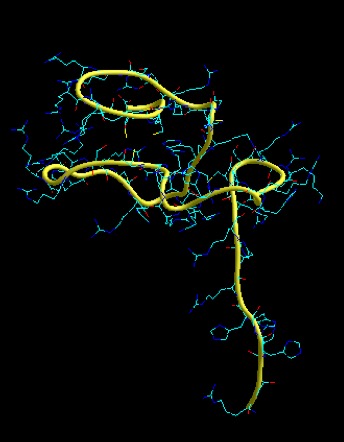
Figura 4: Modelado por similitud de la protamina P2. Se utiliza como molde el“RINGdomain” de la “synaptotagmin-likeprotein 4” [12].
El proceso de descondensación
El primer paso hacia la formación del pronúcleo masculino consiste en la descondensación de la cromatina espermática [13] (Fig. 5).
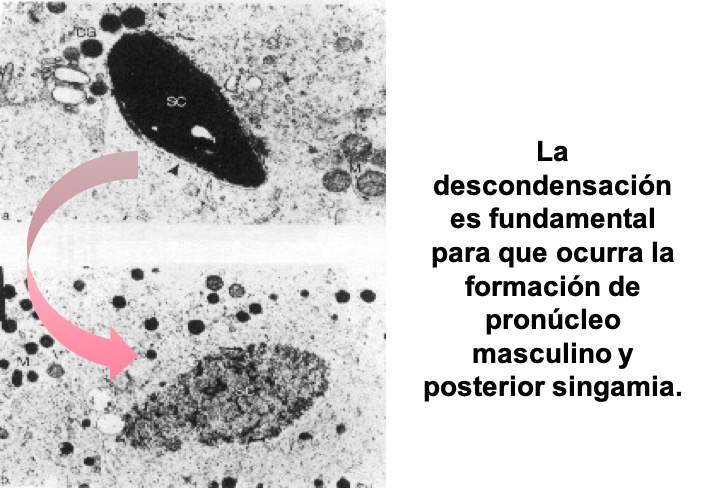
Figura 5: Microfotografía electrónica del estado de un núcleo. Con su cromatina condensada (imagen superior) o descondensada (imagen inferior).
Debido a la interacción entre las protaminas y el DNA, fundamentalmente a través de las cargas negativas en el ácido nucleico y las positivas de las protaminas, como también entre las bases nitrogenadas del DNA y los aminoácidos de las proteínas, es lógico pensar en la existencia de alguna molécula cargada negativamente que “compita” con el DNA por estas protaminas. A esta competición se le suma una reducción en los puentes disulfuro entre protaminas e intraprotaminas para hacer más lábil a la estructura tan compacta. En este proceso, la reducción de los puentes disulfuro está a cargo del glutatión (GSH)ovocitario [14, 15]. Según nuestros resultados experimentales, la reducción sería sinérgica con la remoción de las protaminas, al menos en el modelomurino. En otras especies animales, la nucleoplasmina parece ser la molécula que interviene en el intercambio protaminas:histonas [16]. Sin embargo, en mamíferos y roedores, no pareciera ser esta la molécula involucrada [17].
En ensayos in vitro, esta descondensación puede obtenerse utilizando heparina o un detergente como el SDS, en conjunto con GSH. Pero ninguno de estos agentes se encuentra fisiológicamente dentro del ovocito, por lo que no podrían ser las moléculas relevantes en dicho proceso.
Papel de los glicosaminoglicanos en la descondensación de la cromatina.
Teniendo en cuenta los resultados in vitro con moléculas cargadas negativamente, los candidatos más lógicos por presencia local (fluido folicular) y carga son los glicosaminoglicanos (GAGs) [18, 19]. Entre ellos, salvo el ácido hialurónico, la mayoría posee una importante carga negativa producto de la presencia de ácido urónico y la sulfatación de los azúcares. Todos están constituidos por repeticiones disacarídicas con mayor o menor sulfatación y de longitudes muy variables. Esto llevó a probar la descondensación de la cromatina espermática en presencia de GSH y uno o varios de estos GAGs: ácido hialurónico, condroitín sulfato, heparán sulfato, dermatán sulfato o heparina con diversas modificaciones estructurales (acetilaciones, desulfataciones, etc.) (Fig. 6).
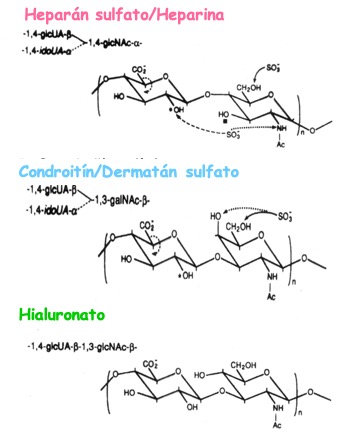
Figura 6: Estructura de los diversos glicosaminoglicanos que fueron utilizados para analizar la descondensación de la cromatina espermática.
El resultado de la descondensación puede seguirse en el tiempo, observando al microscopio óptico con contraste de fase la presencia de, por lo menos, tres formas espermáticas: con la cabeza condensada (S: sin descondensar), es decir pequeña y refringente; con la cabeza medianamente descondensada (M), es decir más redondeada, grande y con poca o casi nada de refringencia o, groseramente descondensada (G), es decir sin refringencia, muy grande y, a veces, muy poco visible al microscopio salvo por la presencia del flagelo que permite observar una especie de “fantasma” de cabeza en el extremo (Fig. 7).
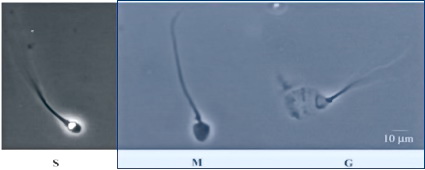
Figura 7: Distintas formas de los espermatozoides según el estado de descondensación de la cromatina. S (sin descondensar), M (medianamente descondensada), G (groseramente descondensada). Metodología microscopía óptica con contraste de fase
Como criterio de descondensación, se considera la suma porcentual de formas M+G habiendo contado, al menos, unos 200 espermatozoides.
La mezcla descondensante consiste en GSH 10 mM y alguno de los GAGs en concentración 46 µM. Normalmente, se evalúa la descondensación a los 15, 30 y 60 minutos, a 37oC.
¿Quién es el GAG candidato para la descondensación?
El análisis de la descondensación, luego de 60 minutos, en presencia de los diversos GAGs indicó que, para espermatozoides humanos, los candidatos eran el heparán sulfato (HS) y su análogo estructural, la heparina (Hep) [20]. Dado que la heparina es un producto exclusivo de mastocitos, la molécula de elección resultó el HS. De los otros GAGs, solamente el dermatán sulfato (DS) mostró una cierta capacidad descondensante, aunque mucho menor que la del HS (Fig. 8).
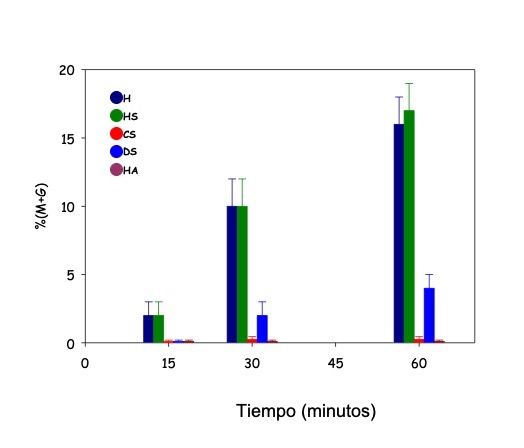
Figura 8: Descondensación obtenida en la cromatina de espermatozoides humanos, en presencia de diversos GAGs. Heparina (H), Heparán sulfato (HS) y, en menor medida, Dermatán sulfato (DS) fueron capaces de descondensar el DNA. El resto de los GAGs: ácido hialurónico (HA) y condroitín sulfato (CS) no presentaron actividad descondensante.
Analizando el sistema con espermatozoides murinos, el resultado fue similar, aunque el DS mostró una mejor capacidad descondensante comparada con los humanos y, además, un efecto sinérgico cuando se utilizaba una mezcla de HS y DS en concentraciones subóptimas para ambas por separado, evento no observado en la cromatina humana [21] (Fig. 9).
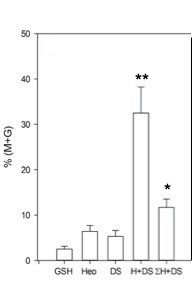
Figura 9: Descondensación de la cromatina espermática murina. En presencia de Heparina (Hep/H), Dermatán sulfato (DS), la combinación de ambos y la sumatoria algebraica de los efectos independientes. El tiempo de descondensación es de 15 minutos. (*) p< 0.05 vs H±DS, (**) p< 0.01 vs GSH/Hep/DS
Dado que la posible explicación para la actividad descondensante parecía radicar en la carga de estas moléculas, se estudió el efecto con moléculas químicamente modificadas.
Los resultados permitieron definir que no parecía ser simplemente la carga neta sino la distribución espacial de la misma la que podría dar cuenta de la efectividad de estos GAGs [20] (Fig. 10).
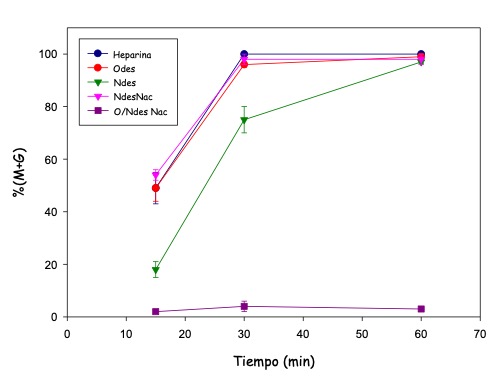
Figura 10: Descondensación obtenida en presencia de heparinas modificadas para cambiar la carga total o su distribución. Odes: O desulfatada, N des: N desulfatada, NdesNac: N desulfatada N acetilada, O/NdesNac: O/N desulfatada N acetilada. La desulfatación elimina carga negativa y la acetilación elimina carga positiva del grupo amino-azúcar.
Con esto en consideración, se hizo un modelo de distribución de carga (utilizando el programa Hyperchem 8.0, HyperCube) comparando el heparán sulfato con el dermatán sulfato, dos únicos GAGs (además de la heparina) con capacidad descondensante.
El resultado indicó que el dermatán sulfato muestra una distribución homogénea de cargas similar a la observada en la doble hélice de DNA (Fig. 11), mientras que para el heparán sulfato la distribución resulta mucho más dirigida en forma de X (Fig. 12). Esto permitiría suponer que la capacidad diferencial de descondensación que muestran ambas moléculas es resultado de esta distribución de cargas y que, tal vez, la combinación de ambos GAGs en la mezcla descondensante permitiría diferenciar muestras de espermatozoides con una cantidad y/o relación diferente entre P1 y P2, resultando en una compactación global diferente [22]. Podría especularse con que el DS descondense zonas más próximas a los nucleosomas, mientras que el HS/Hepdescondense zonas más alejadas.
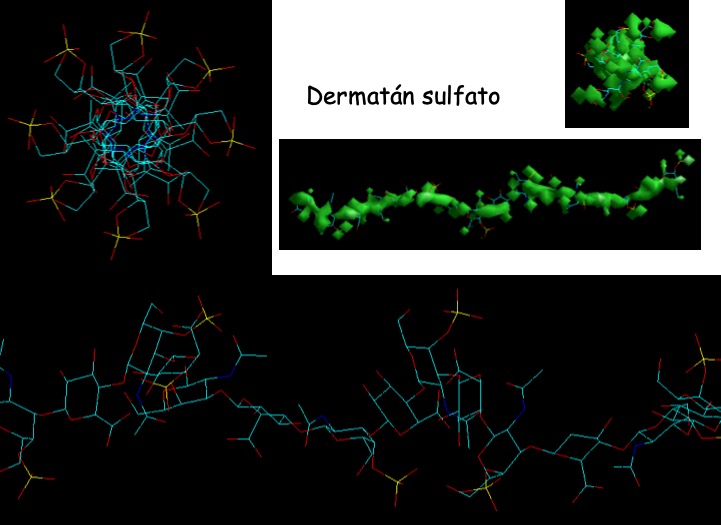
Figura 11: Distribución de cargas negativas en la molécula del dermatán sulfato. En verde se muestra la superficie cargada de la molécula y, hacia la izquierda y arriba, la orientación de las cargas negativas, similar a lo que se observa en una doble hélice de DNA.
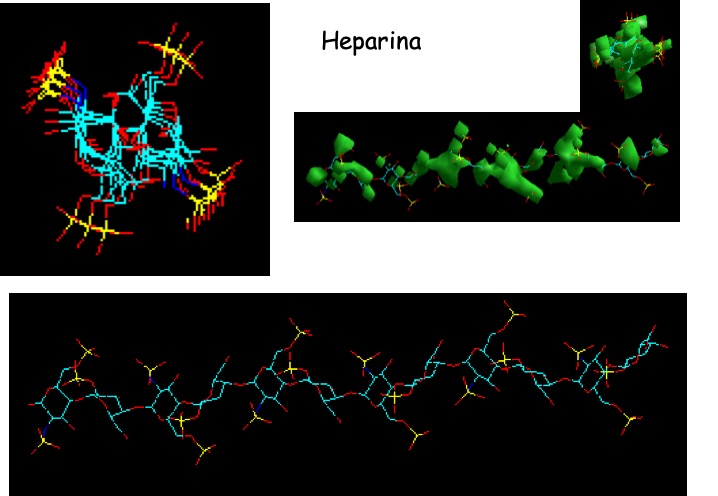
Figura 12: Distribución de cargas negativas en la molécula de heparina/heparán sulfato. En verde se muestra la superficie cargada de la molécula y, hacia la izquierda y arriba, la orientación de las cargas negativas, de manera mucho más localizada que lo observado para dermatán sulfato.
Debido a la similitud de acción con respecto a la descondensación, para los experimentos se utilizó heparina (por su menor costo y mayor accesibilidad) y solamente heparán sulfato cuando fue necesario.
El heparán sulfato, presente en el ovocito.
Para corroborar esta posibilidad de que el heparán sulfato fuese la molécula descondensante, estudiamos la presencia de este en el ooplasma utilizando un anticuerpo específico contra el glicosaminoglicano.
Pudimos observar su presencia en ovocitos murinos y humanos, en distintas etapas de su maduración [23, 24] (Figs. 13, 14, 15).
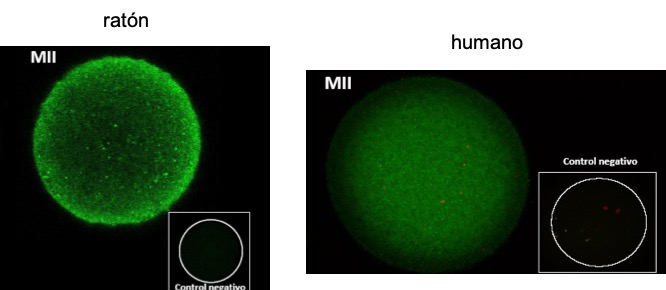
Figura 13: Heparán sulfato en el interior de ovocitos en metafase II.
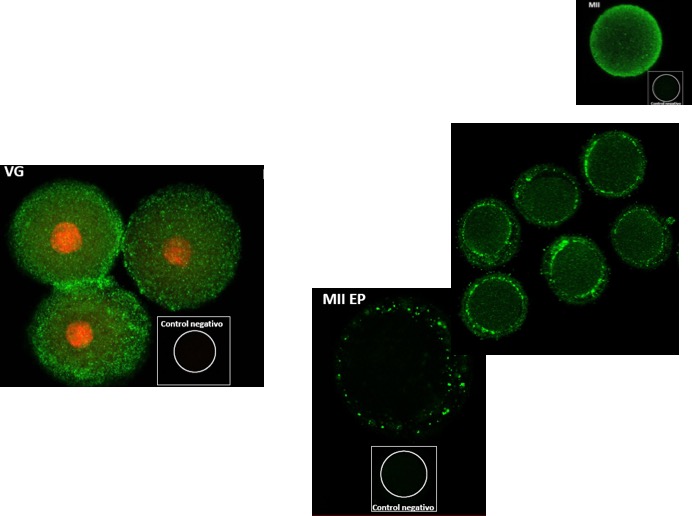
Figura 14: Ovocitos murinos. En estadio de vesícula germinal (VG), metafase II (MII) y, en este estadio discriminando el espacio perivitelino (EP) o el conjunto de espacio perivitelino y ooplasma.
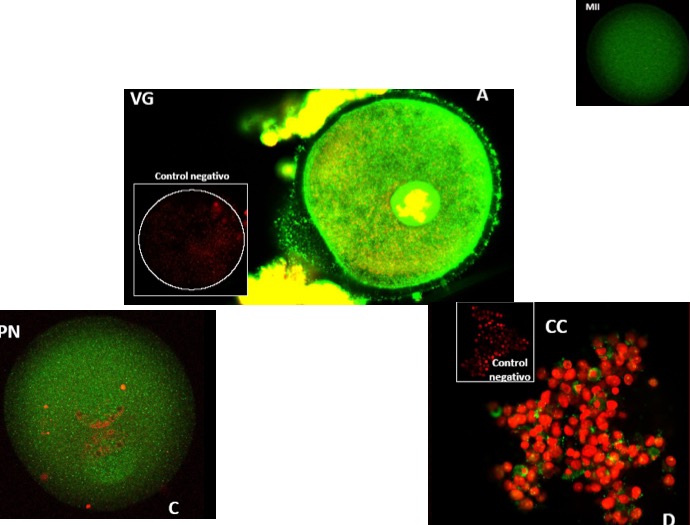
Figura 15: Heparán sulfato en ovocitos humanos y células de la granulosa. La imagen A muestra un ovocito en estadio de vesícula germinal, la imagen C en condición de pronúcleo (ovocito arrestado espontáneamente) y, la imagen D, en las células del cúmulo.
Más aún, utilizando ovocitos tanto murinos como humanos que fueron aplastados para liberar su contenido, se demostró que el heparán sulfato era necesario mediante el uso de heparinasa, enzima específica que degrada este glicosaminoglicano [25].
Cociente de velocidades de descondensación.
El análisis de la descondensación de muestras de espermatozoides de donantes voluntarios sanos (normozoospérmicos y, preferentemente, de fecundidad comprobada) a diversos tiempos (15, 30 y 60 minutos), permitió definir un cociente entre lo observado a los 30 y 60 minutos como índice de velocidad de descondensación [V60/V30= %(M+G)60/%(M+G)30]. Este valor de corte sería de utilidad, en su traslado a la clínica de fecundidad, para comparar con las muestras de pacientes que consultan por problemas de fertilidad y cuya causa, principalmente, se deba a factores masculinos.
De acuerdo con lo que se observa en la figura 16, los donantes mostraron un perfil muy similar de descondensación en presencia de heparina, con un valor promedio de 1.05 ± 0.20 y permitiendo calcular un punto de corte en 1.45 (Media ± 2 DEM) (V60/V30), siendo el correspondiente a la descondensación en presencia de DS de 1.30 ± 0.27 y resultando en un valor de corte de 1.84 (Media ± 2 DEM).
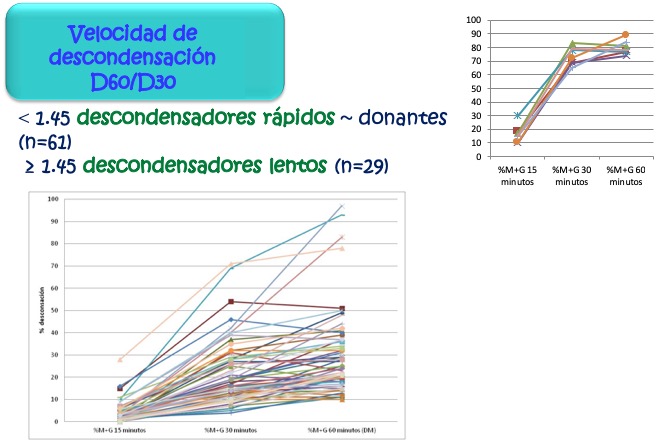
Figura 16: Comportamiento de los donantes respecto a la descondensación de la cromatina espermática en presencia de GSH y heparina Puede verse que la mayoría presenta una descondensación máxima a los 30 minutos, mientras que algunos ese máximo lo tienen a los 60 minutos.
Extracción de protaminas y cuantificación.
Con el objetivo de poder correlacionar la presencia y relación de protaminas presentes en la cromatina de espermatozoides obtenidos de donantes o pacientes que concurren a consultar por problemas de fecundidad, se aislaron las protaminas a partir de muestras de semen y se analizaron por electroforesis en géles ácidos con urea. Dada la carga positiva neta de estas proteínas, la corrida electroforética se realiza en ácido acético con urea y las mismas migran hacia el polo negativo (Figs. 17, 18).
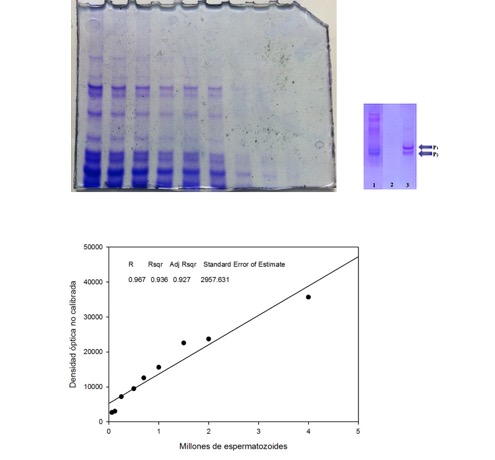
Figura 17: Posición de las protaminas. En un gel ácido de poliacrilamida se muestran diluciones sucesivas de un extracto obtenido a partir de donantes (Panel superior). El panel inferior muestra la calibración en función de la cantidad de espermatozoides sembrados, para fijar la cantidad adecuada a partir de la cual extraer las protaminas.
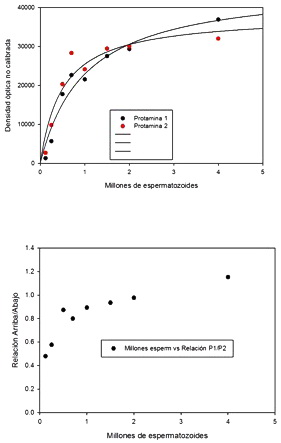
Figura 18: Relación de densidad óptica obtenida a partir de los geles ácidos. De aquí se determina que una cantidad entre 1 – 2 millones de espermatozoides es la indicada para obtener la relación esperada 1:1 para muestras humanas.
Relación de protaminas en muestras de pacientes.
Cuando se realizó la descondensación, extracción de protaminas y su análisis electroforético, a partir de muestras de pacientes que recurren a clínicas de reproducción asistida, pudo observarse una relación P1/P2 alterada, aunque no se detectó una cantidad total significativamente diferente de la de los donantes (Fig. 19).
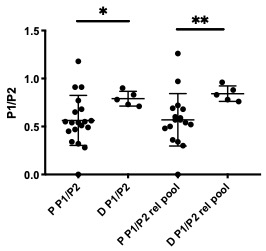
Figura 19: Relación entre las protaminas P1 y P2 para muestras de pacientes y donantes normozoospérmicos. La diferencia entre ambos grupos es significativa (* p= 0.0282 y **p= 0.0082 para la relación relativa a un pool de protaminas constituido por proteínas extraídas de 8 donantes).
Comparación en las velocidades de descondensación en presencia de heparina o dermatán sulfato, para muestras de pacientes y donantes.
Una vez determinado que en las muestras proveniente de los pacientes se encontró una relación P1/P2 disminuida con respecto a los controles, se analizó la relación de velocidades de descondensación tal como se indicara previamente, utilizando tanto heparina como dermatán sulfato como agentes descondensantes, además de GSH. Pudo observarse que la relación de descondensación entre 60 y 30 minutos, fue significativamente diferente para los pacientes, cuando se comparó el efecto de heparina y dermatán sulfato (Fig. 20). Para los donantes, esa relación no fue significativamente diferente al comparar ambos glicosaminoglicanos. Esta observación permitiría suponer que en los pacientes, con una relación menor de protaminas P1/P2, la utilización de uno u otro glicosaminoglicano en la descondensación podría servir como una herramienta que permitiese demostrar una condensación diferencial de la cromatina.
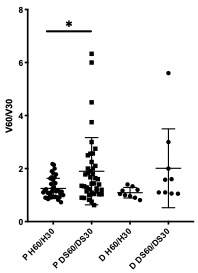
Figura 20: Velocidad de descondensación. Determinada como la relación de descondensación a 30 y 60 minutos, en presencia de heparina o dermatán sulfato, tanto en muestras obtenidas de pacientes o donantes normozoospérmicos. * p= 0.0168
Perspectivas futuras
Dada la importancia de una buena relación entre el contenido de protaminas para una actividad fecundante eficiente, desde el punto de vista del espermatozoide, parece razonable estudiar un poco más en detalle el impacto de esta relación en el proceso de descondensación cromatínico, como también en otros aspectos que tienen un peso relevante en el resultado de una fecundación, como por ejemplo motilidad, hipermotilidad, exocitosisacrosomal. No menos importante resulta profundizar en el posible papel del heparán sulfato presente en la superficie del espermatozoide, en los diversos puntos de encuentro de este con: epitelio endometrial, epitelio oviductal, células de la granulosa, oolema.
Asimismo, y por razones de espacio, no se mencionó la importancia de la epigenéticaen cromatina espermática en todo este proceso. Situaciones ambientales (agroquímicos y otros productos), como también hábitos alimentarios (dieta con exceso de azúcares o grasas) o situaciones de abuso de sustancias tales como alcoholismo, pueden incidir en la cromatina espermática modificando la metilación/acetilación de histonas remanentes, de protaminas, metilación de bases en el DNA, con una posible translación a la salud embrionaria. Todo esto está en estudio en nuestro laboratorio [26, 27].
Referencias:
1. Chan RC, Severson AF, Meyer BJ (2004)Condensin restructures chromosomes in preparation for meiotic divisions. The Journal of Cell Biology 167: 613–625.
2. Griswold MD (2016) Spermatogenesis: The Commitment to Meiosis Physiological Reviews 96: 1–17
3. Brewer L, Corzett M, Balhorn RJ (2002) Condensation of DNA by spermatid basic nuclear proteins. Biological Chemistry 277:38895-38900
4. Champroux A, Cocquet J, Henry-Berger J, Drevet JR, Kocer A (2018) A Decade of Exploring the Mammalian Sperm Epigenome: Paternal Epigenetic and Transgenerational Inheritance Frontiers in Cell and Developmental Biology 6: 1-50
5. Balhorn R (2007) The protamine family of sperm nuclear proteins Genome Biology 8: 227
6. Balhorn R (1989) Mammalian protamines: structure and molecular interactions. In: Adolph KW, editor. Molecular Biology of Chromosome Function pp. 366–395 New York: Springer-Verlag
7. Lee CH, Cho YH (1999) Aspects of mammalian spermatogenesis: electrophoretical analysis of protamines in mammalian species Molecuar Cell 9: 556–559
8. Calvin HI, Bedford JM (1971) Formation of disulphide bonds in the nucleus and accessory structures of mammalian spermatozoa during maturation in the epididymis Journal of Reproduction and Fertility 13 (Supp): 65–75.
9. D’Occhio MJ, Hengstberger KJ, Johnston SD (2007) Biology of sperm chromatin structure and relationship to male fertility and embryonic survival Animal Reproduduction Science 101: 1– 17
10. Corzett M, Mazrimas J,Balhorn R (2002) Protamine 1: Protamine 2 stoichiometry in the sperm of eutherian mammals Molecular Reproduction and Development 61: 519–527
11. Zhao W, McCallum SA, Xiao Z, Zhang F, Linhardt RJ (2012)Binding affinities of vascular endothelial growth factor (VEGF) for heparin-derived oligosaccharides Biosciences Report 32: 71–81
12. Tarantini F, LaVallee T, Jackson A, Gamble S, MoutaCarreira C, Garfinkel S, Burgess WH, Maciag T (1998) The Extravesicular Domain of Synaptotagmin-1 Is Released with the Latent Fibroblast Growth Factor-1 Homodimer in Response to Heat Shock. Journal of Biological Chemistry 273: 22209-22216
13. Perreault SD, Wolff RA, Zirkin BR (1984) The role of disulfide bond reduction during mammalian sperm nuclear decondensation in vivo Developmental Biology 101: 160–167
14. Zirkin BR, Soucek DA, Chang TJK, Perreault SD (1985)In vitro and in vivo studies of mammalian sperm nuclear decondensation Gamete Researh 11: 349–365
15. Onikubo T,Nicklay JJ, Xing L, Warren C, Anson B, Wang WL, Burgos ES, Ruff SE, Shabanowitz J, Cheng RH, Hunt DF, Shechter D (2015). Developmentally Regulated Post-translational Modification of Nucleoplasmin Controls Histone Sequestration and Deposition Cell Reports 10: 1735–1748
16. Burns KH, Viveiros MM, Ren Y, Wang P, DeMayo FJ, Frail DE, Eppig JJ, Matzuk MM (2003) Roles of NPM2 in chromatin and nucleolar organization in oocytes and embryos Science 300: 633–636
17. Delgado NM, Reyes R, Huacuja L, Merchant H, Rosado A (1982)Heparin binding sites in the human spermatozoa membrane. Archives of Andrology 8: 87–95
18. Carrell DT, Liu L (2002) Heparin binding sites are present at a higher concentration on sperm of subfertile men than donors of known fertility. Archives of Andrology 48: 147–154
19. Romanato M, Cameo MS, Bertolesi G, Baldini C, Calvo JC, Calvo L (2003) Heparan sulphate: a putative decondensing agent for human spermatozoa in vivo. Human Reproduction 18: 1868–1873
20. Sanchez MC, Sedo CA, Julianelli VL, Romanato M, Calvo L, Calvo JC, Fontana VA (2013)Dermatan sulfate synergizes with heparin in murine sperm chromatin decondensation. Systems Biology in Reproductivity Medicine 59: 82–90
21. Perreault SD, Naish SJ,Zirkin BR (1987) The timing of hamster sperm nuclear decondensation and male pronucleus formation is related to sperm nuclear disulfide bond content. Biology of Reproduction 36: 239–244
22. Romanato M, Regueira E, Cameo MS, Baldini C, Calvo L, Calvo JC (2005) Further evidence on the role of heparan sulfate as protamine acceptor during the decondensation of human spermatozoa. Human Reproduction 20: 2784–2789
23. Julianelli V, Farrando B, Alvarez Sedó C, Calvo L, Romanato M, Calvo JC (2012) Heparin enhances protamine disulfide bond reduction during in vitro decondensation of human spermatozoa Human Reproduction 27: 1930–1938
24. Romanato M, Julianelli V, Zappi M, Calvo L, Calvo JC (2008) The presence of heparan sulfate in the mammalian oocyte provides a clue to human sperm nuclear decondensation in vivo. Human Reproduction 23: 1145–1150
25. Sánchez MC, Alvarez Sedó C, Chaufan GR, Romanato M, Da Cuña R, Lo Nostro F, Calvo JC, Fontana V (2017) In vitro effects of endosulfan-based insecticides on mammalian sperm Toxicolology Research (Camb)7:117-126
26. Sánchez MC, Fontana VA, Galotto C, Cambiasso MY, Sobarzo CMA, Calvo L, Calvo JC, Cebral E (2018) Murine sperm capacitation, oocyte penetration and decondensation following moderate alcohol intake. Reproduction 155:529-541
|
Revista QuímicaViva Número 3, año 17, Diciembre 2018 quimicaviva@qb.fcen.uba.ar |