Contenido de polifenoles y actividad antioxidante de la Uva de Mar (Coccoloba uvifera)
Rafael MJ. Mex-Álvarez, Patricia M. Garma-Quen, María G. Maldonado-Velázquez, Francisco J. Aguirre-Crespo, Francisca M. Pantoja-Bolio y Yolanda G. Núñez-Pinto
Facultad de Ciencias Químico Biológicas, Universidad Autónoma de Campeche. México
Recibido: 25/05/2017 - Aceptado: 16/01/2018
Resumen
Coccoloba uvifera, conocida comúnmente como uva de mar, es una planta perteneciente a la familia Polygonaceae que es conocida por sus propiedades medicinales y la producción de compuestos fenólicos; estos metabolitos secundarios son de interés farmacológico e industrial porque poseen actividad antioxidante por distintos y variados mecanismos como la neutralización de especies reactivas de oxígenos, reducción de radicales libres y de iones metálicos. El propósito de este trabajo de investigación fue determinar el contenido de compuestos fenólicos (fenoles totales, taninos y flavonoides) en tres partes vegetales (hoja, cáscara-pulpa, semilla) de C. uvifera, además de su actividad antioxidante. Los ejemplares de la planta se colectaron en la costa del municipio de Champotón (Estado de Campeche, México) y se extrajo por maceración empleando dos disolventes (metanol y acetona); se determinó la cantidad de fenoles totales, taninos totales, taninos condensados y flavonoides totales en cada uno de los extractos obtenidos y su actividad antioxidante por los métodos de inhibición del DPPH, reducción del H2O2 y poder reductor de iones férrico (FRAP). Se encontró un mayor contenido de polifenoles en los extractos de la semilla que se correlaciona bien con su actividad antioxidante. Todos los extractos mostraron actividad antioxidante en todos los métodos, pero tuvieron un mejor FRAP comparado con la capacidad de reducir al H2O2. Los resultados obtenidos demuestran que la semilla de C. uvifera es una fuente importante de compuestos fenólicos.
Palabras clave: actividad reductora, radicales libres, taninos
Summary
Polyphenol content and antioxidant activity of Coccoloba uvifera
Coccoloba uvifera, commonly known as sea grape, is a plant belonging to the family Polygonaceae that is known for its medicinal properties and the production of phenolic compounds; these secondary metabolites are of pharmacological and industrial interest because they possess antioxidant activity by different and varied mechanisms such as the neutralization of reactive species of oxygen, scavenging of free radicals and metal ions. The purpose of this research was to determine the content of phenolic compounds (total phenolic compounds, tannins and flavonoids) in three plant parts (leaf, husk-pulp, seed) of C. uvifera, in addition to its antioxidant activity. The specimens of the plant were collected on the coast of the municipality of Champoton (Campeche State, Mexico) and extracted by maceration using two solvents (methanol and acetone); the amount of total phenolic compounds, total tannins and total flavonoid content and condensed tannins and in each of the extracts obtained and their antioxidant activity were determined by the methods of DPPH radical scavenging, Hydrogen Peroxide Radical Scavenging and Ferric Reducing Antioxidant Power (FRAP). It was found a higher content of polyphenols in the seed extracts than in the other extracts, which correlates well with their antioxidant activity. All extracts showed antioxidant activity in all methods, but had a better FRAP compared to the ability to reduce H2O2. The results obtained demonstrate that the C. uvifera seed is an important source of phenolic compounds.
Keywords: reducing activity, free radicals, tannins
Introducción
El género Coccoloba pertenece a la familia Polygonaceae y contiene cerca de 400 especies de plantas herbáceas y arbóreas distribuidas desde el sur de los Estados Unidos y México hasta América del Sur, incluido el Caribe [1-3]. Las especies del género se emplean en etnomedicina para el tratamiento de insomnio, estrés, pérdida de memoria; los extractos de raíces y hojas se consumen como tintura o en infusiones; además se usan como cicatrizantes o para el tratamiento de enfermedades infecciosas.Actualmente existen pocos estudios científicos sobre las especies del género Coccoloba, en la literatura científica se encuentran reportes de su actividad citotóxica, hipoglucemiante y antimicrobiana [1,4-7]. En este género destaca Coccoloba uvifera, conocida comúnmente como uva de mar que es una planta tropical que crece en suelos arenosos y rocosos de las costas de América e islas del Caribe y la cual se usa como ornato en parques y avenidas, además su fruto es comestible y en medicina tradicional se emplea para el tratamiento de lesiones en la piel y la mucosa oral por sus propiedades cicatrizantes [1-3,8].
Entre los metabolitos reportados para el género Coccoloba destacan los polifenoles, estos metabolitos secundarios presentan una gran diversidad de actividades biológicas derivada de su propiedad antioxidante; los compuestos polifenólicos se dividen en grupos de acuerdo a su estructura química destacando los flavonoides y taninos porque estos metabolitos presentan actividades biológicas de interés al contrarrestar los efectos nocivos del estrés oxidativo [8-10]. La generación de especies reactivas de oxígeno y su falta de control genera el estrés oxidativo que daña a biomoléculas (lípidos, proteínas y ácidos nucleicos) y está implicado en el desarrollo de distintas patologías como el cáncer, Alzheimer, Parkinson, aterosclerosis, accidentes cerebrovasculares y envejecimiento prematuro; además de complicar enfermedades cardiovasculares y la diabetes [8-10]. Los polifenoles por sus propiedades antioxidantes son capaces de inhibir los fenómenos oxidativos que dañan a las biomoléculas y pueden contribuir a la salud humana y animal al suministrarse en la dieta [8-12]. Por lo anterior, el objetivo del presente trabajo fue cuantificar el contenido de polifenoles y evaluar la actividad antioxidante de extractos metanólicos y acetónicos de la hoja, pulpa y semilla de la uva de mar que crece en el municipio de Champotón del Estado de Campeche (México) para conocer su potencial farmacológico y contribuir al conocimiento químico de una especie poco estudiada en la actualidad.
Materiales y métodos
Material biológico y químico.
La muestra de Uva de mar (Coccoloba uvifera) se recolectó en la Ciudad de Champotón en el Estado de Campeche México durante el mes de octubre del 2016 y se transportó al laboratorio para eliminar cualquier impureza mecánica; la planta fue identificada en el Herbario del Centro de Investigaciones Históricas y Sociales de la Universidad Autónoma de Campeche. La cáscara y la pulpa de los frutos de la uva de mar se separaron de las semillas antes del secado. Las muestras vegetales (hojas, cáscara-pulpa y semilla) se secaron en estufa a 50ºC; posteriormente se realizó la extracción del material biológico por maceración con dos disolventes diferentes (metanol y propanona) durante 48 horas a temperatura ambiente. Los extractos se concentraron a seco en un rotaevaporador equipado con baño María a 40ºC y se determinó la cantidad de extracto obtenido por gravimetría. Los extractos secos se suspendieron en etanol absoluto ajustándose las concentraciones de los extractos a 1000 ppm (1000mg de extracto vegetal crudo/1L de disolvente); los extractos resuspendidos se conservaron en refrigeración a 4º C.Todos los reactivos químicos empleados en este trabajo fueron grado analítico y se adquirieron de la compañía Sigma-Aldrich Company.
Cuantificación de compuestos polifenólicos totales [12].
Se empleó el método de Folin-Ciocalteu para la determinación de polifenoles totales, se adicionó 100μL del extracto a 1000μL de agua en un tubo de ensayo y luego se añadió 100μL del reactivo de Folin-Ciocalteu, se dejó reaccionar durante 30 minutos y posteriormente se adicionó 500μL de Na2CO3 20%, se incubó a temperatura ambiente durante 90 minutos. Finalmente se leyó en un espectrofotómetro a 760 nm. Se realizó una curva de calibración con ácido gálico para determinar la concentración de polifenoles presentes en cada extracto.
Cuantificación de taninos totales [13].
Se preparó el reactivo de gelatina para la precipitación de taninos mezclando en un matraz volumétrico 5 mL de la solución de gelatina al 10% y 10 mL de solución de NaCl 10% en HCl 1%; se agitó bien la mezcla y se aforó a 50 mL con agua destilada, se dejó en reposo la mezcla por 30 minutos para dejar sedimentar los sólidos insolubles, posteriormente se filtró la mezcla y la solución filtrada se empleó como reactivo para el análisis de taninos totales. Se mezcló 500μL del extracto con 500μL del reactivo de gelatina y se incubó por 30 minutos a baño maría a 37ºC, posteriormente se centrifugó a 5000 rpm durante 10 minutos y se tomaron 500μL del sobrenadante para la determinación de fenoles totales por el método de Folin-Ciocalteu (100μL del reactivo de Folin-Ciocalteu sin adición de agua destilada y 500μL de Na2CO3 20%).
Cuantificación de taninos condensados [14].
Se mezcló 100mL del extracto con 2mL del reactivo de vainillina HCl (que se prepara al mezclar cantidades iguales de HCl 10% y vainillina 1% en metanol), se deja reaccionar y se mide la absorbancia después de 20 minutos a 500 nm. Se realizó una curva de calibración empleando catequina como estándar y los resultados se expresan como equivalente de catequina en mg por gramo de extracto.
Cuantificación de flavonoides totales [12].
Se determinó por el método colorimétrico del cloruro de aluminio. Se transfirió a un tubo de ensayo 1,0 mL de agua destilada y se añadieron 100μL de extracto y 100μL de NaNO2 5%, se mezcló y se dejó reaccionar 5 minutos, luego se añadió 100μL de AlCl3 10%, se homogenizó y se dejó reaccionar otros 5 minutos, finalmente se añadieron 100μL de NaOH 1,0 M y se leyó la absorbancia a 510 nm. Para calcular la concentración de los flavonoides se realizó una curva de calibración empleando quercitina como estándar. La concentración se expresa como mg equivalentes de quercitina/ gramo de extracto.
Actividad neutralizante de radicales libres (Método del DPPH) [14]
Se mezclaron 2,0 mL de una solución de DPPH (2,2-difenil-1-picrilhidrazilo. 150μM en metanol) y 100μL de extracto en tubos de ensayo, luego se incubó la mezcla de reacción en un lugar oscuro y a temperatura ambiente durante 30 minutos. Posterior al período de incubación se verificó que los tubos contuvieran radical DPPH (presencia de color morado) y se leyeron las soluciones en un espectrofotómetro a 520 nm ajustando a cero de absorbancia con metanol; también se leyó la absorbancia de la mezcla de 2,0 mL de la solución de DPPH con 100μL de metanol. Se empleó ácido gálico, disuelto en etanol, como solución estándar.
Actividad reductora de peróxido de hidrógeno [15,16]
Se empleó el método de la peroxidasa para determinar la concentración de peróxido de hidrógeno remanente; se mezcló en un tubo de ensayo 500μL del extracto con 500μL de una solución de H2O2 700μM, se dejó incubar 30 minutos a 37ºC en baño maría; terminado el tiempo de reacción se transfirieron 100μL de la mezcla a un tubo de ensayo que contenía el reactivo generador de color [Fenol 12mM, 4-aminoantipirina 0,5mM, peroxidasa de rábano picante 1,0 U/mL en solución buffer de fosfato (PBS) 84 mM pH=7,0], se mezcló y se dejó en incubación a 37ºC por 30 minutos, se midió la absorbancia a 504nm ajustando a cero de absorbancia con PBS; se corrigió la interferencia en la lectura usando todos los reactivos pero reemplazando el fenol por PBS, la absorbancia obtenida se restó a la absorbancia original.
Poder antioxidante reductor de ion férrico (FRAP) [17].
Se emplearon diferentes concentraciones de los extractos (de 50 a 200 ppm). Se mezclaron 100 μL del extracto con 2,5 mL de solución tampón de fosfatos (0,2M, pH=6.6) y se adicionó 2,5 mL de solución de ferricianuro de potasio [K3Fe (CN)6] al 1%; se incubó la mezcla a 50ºC por 20 minutos; luego se adicionaron 2,5 mL de ácido tricloroacético al 10% y se centrifugaron a 3000 rpm durante 10 min. Se tomaron 2,5 mL del sobrenadante y se adicionaron 2,5 mL de agua destilada y 500 μL de cloruro férrico al 1%. Finalmente se midió la absorbancia de cada mezcla en un espectrofotómetro a 700 nm.
Análisis estadístico [18].
Todos los ensayos se realizaron por triplicados y se expresan como la media ± desviación estándar. El análisis estadístico se realizó con la ayuda del programa computacional SPSS 22.0, se realizó un análisis de varianza (ANOVA) y pruebas de comparación de medias de Tukey con un nivel de significancia del 95% (p≤0,05) para establecer diferencias estadísticas entre las diferentes muestras por su contenido de polifenoles o su actividad antioxidantes, el análisis de correlación se realizó mediante la prueba de Pearson.
Resultados
En total se obtuvieron seis extractos de Coccoloba uvifera, porque se emplearon dos disolventes y tres partes vegetales (Tabla I), los frutos se separaron en la cáscara y pulpa que se secaron juntos y se obtuvo un extracto de este material biológico, también se extrajo la semilla y la hoja.
Tabla I: Claves asignadas a cada extracto de las partes vegetales de Coccoloba uvifera estudiadas, obtenidas por maceración.
| Clave | Parte Vegetal | Disolvente empleado |
|---|---|---|
| UHM | Hoja | Metanol |
| UHA | Hoja | Acetona |
| UCM | Cáscara y pulpa | Metanol |
| UCA | Cáscara y pulpa | Acetona |
| USM | Semilla | Metanol |
| USA | Semilla | Acetona |
El contenido de compuestos fenólicos de los seis extractos estudiados de C. uvifera se reporta en la Tabla 2, los extractos de la semilla de C. uvifera tanto metanólico como acetónico mostraron la mayor cantidad de compuestos fenólicos (688,74 y 600,86 mg de ácido gálico/ g de extracto, respectivamente). En general el metanol y la acetona extrajeron cantidades similares de polifenoles, a excepción de los extractos obtenidos de la hoja donde la acetona extrajo una mayor cantidad de flavonoides (148,02 mg de quercitina/g de extracto) y el metanol una mayor cantidad de taninos (161,11mg de catequina/ g de extracto).
Tabla II: Concentración de Compuestos fenólicos en los extractos de Coccoloba uvifera
| Extracto | Fenoles totales | Taninos totales | Taninos condensados | Flavonoides |
|---|---|---|---|---|
| UHM | 239,61±4,76a | 161,11±2,84a | 7,82±0,59a | 71,24±1,06a |
| UHA | 224,45±6,63b | 27,95±7,31b | 9,33±0,84a | 148,02±1,34b |
| UCM | 102,56±1,65c | 53,14±3,18c | 1,5±0,10b | 29,59±0,30c |
| UCA | 186,21±7,82d | 57,22±3,29d | 4,17±0,26c | 46,63±0,58d |
| USM | 688,74±8,16e | 477,52±7,48e | 61,37±0,49d | 59,8±0,59e |
| USA | 600,86±5,78f | 427,19±3,93f | 37,56±0,62e | 71,54±1,12a |
Resultados expresados como el promedio ± una desviación estándar (X±S, n=3) letras diferentes en la misma columna indican diferencias significativas; los valores representan mg de la sustancia de referencia/ g de extracto: ácido gálico para fenoles totales y taninos totales, catequina para taninos condensados y quercetina para flavonoides.
Los resultados de la actividad antioxidante se reportan en la Tabla 3, se puede observar que todos los extractos mostraron una capacidad de neutralizar el radical libre DPPH, reducir al peróxido de hidrógeno y a los iones férricos. Todos los resultados se reportan en función de la equivalencia de la actividad de ácido gálico empleado como estándar o sustancia de referencia. Los extractos obtenidos de la semilla mostraron una mayor actividad, particularmente los obtenidos con metanol como disolvente. En general, todos los extractos redujeron significativamente a los iones férricos y al DPPH más eficientemente que al peróxido de hidrógeno; en este último bioensayo se tuvo la menor actividad antioxidante de los extractos.
Tabla III: Actividad antioxidante de los extractos de Coccoloba uvifera.
| Extracto | Inhibición del DPPH | Reducción del H2O2 | FRAP |
|---|---|---|---|
| UHM | 136,47±2,78a | 124,35±3,75a | 274,66±12,29a |
| UHA | 93,41±5,91b | 89,51±7,28b | 202,83±15,16b |
| UCM | 55,61±1,85c | 35,94±1,53c | 85,25±2,25c |
| UCA | 110,38±3,31d | 43,01±2,87d | 177,12±3,97d |
| USM | 515,28±4,58e | 331,71±11,14e | 595,27±5,96e |
| USA | 242,06±8,25f | 194,41±8,91f | 323,83±4,59f |
Resultados expresados como equivalentes de ácido gálico contenidos en el extracto, se reporta el promedio ± una desviación estándar (X±S, n=3) letras diferentes en la misma columna indican diferencias significativas.
La actividad antioxidante de los extractos de C. uvifera evaluados se explica principalmente por el contenido de taninos, como se puede apreciar en las Figuras 1, 2, 3 y 4; porque en casi todos los extractos son los polifenoles mayoritarios en comparación con los flavonoides. La mayor correlación entre el contenido de taninos y la bioactividad se observó en la reducción del peróxido de hidrógeno, mientras que en la reducción del radical DPPH tuvo los menores valores del coeficiente de correlación.
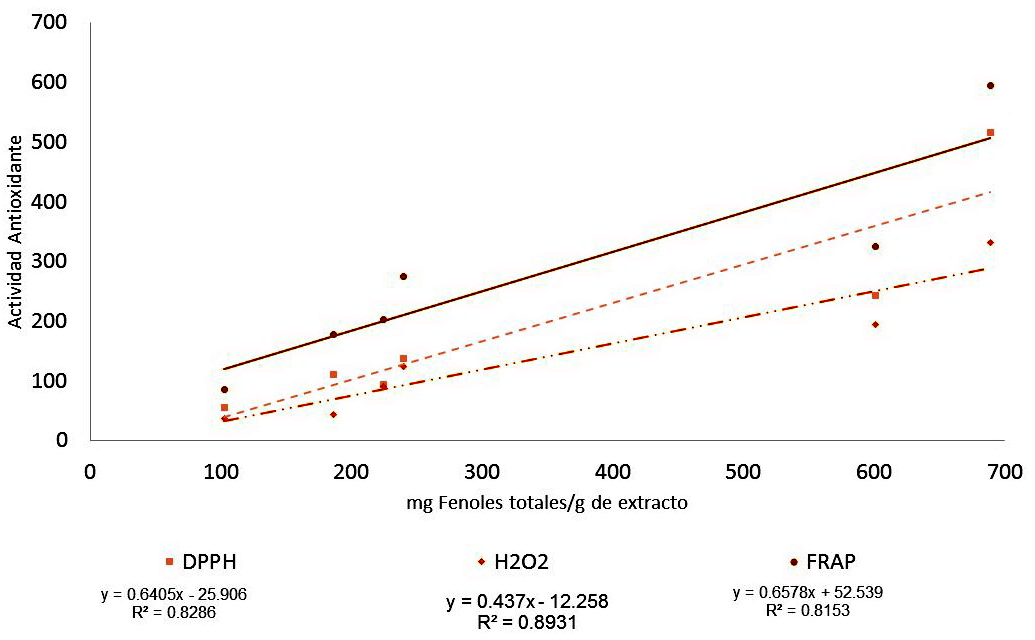
Figura 1: Correlación entre la cantidad de compuestos fenólicos totales y la actividad antioxidante de los extractos de Coccoloba uvifera
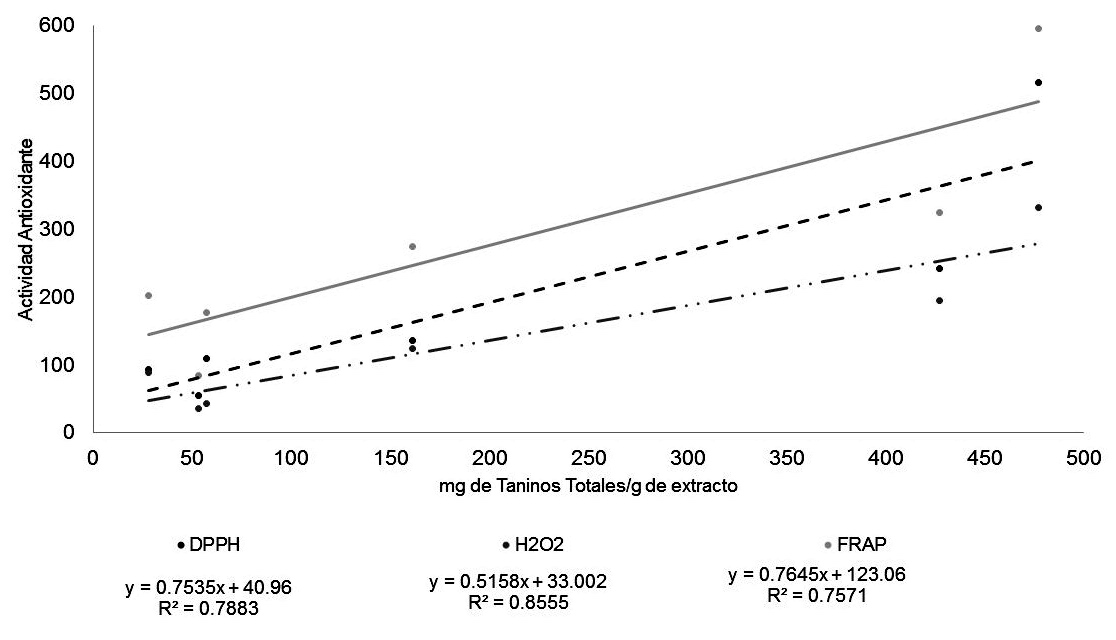
Figura 2: Correlación entre la cantidad de Taninos totales y la actividad antioxidante de los extractos de Coccoloba uvifera
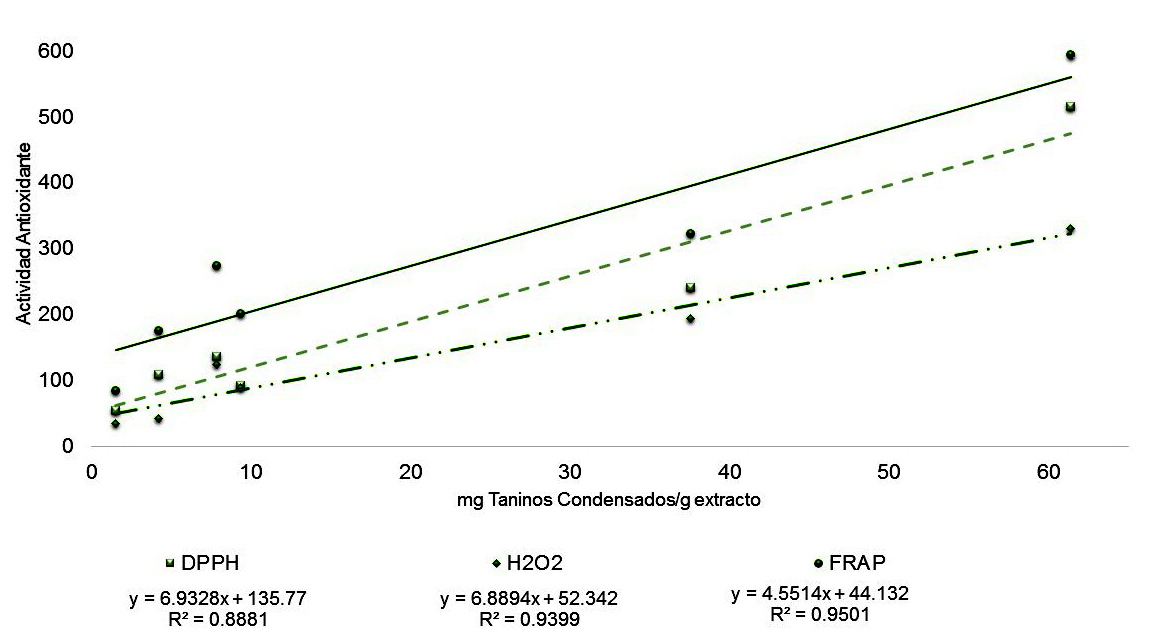
Figura 3: Correlación entre la cantidad de Taninos Condensados y la actividad antioxidante de los extractos de Coccoloba uvifera
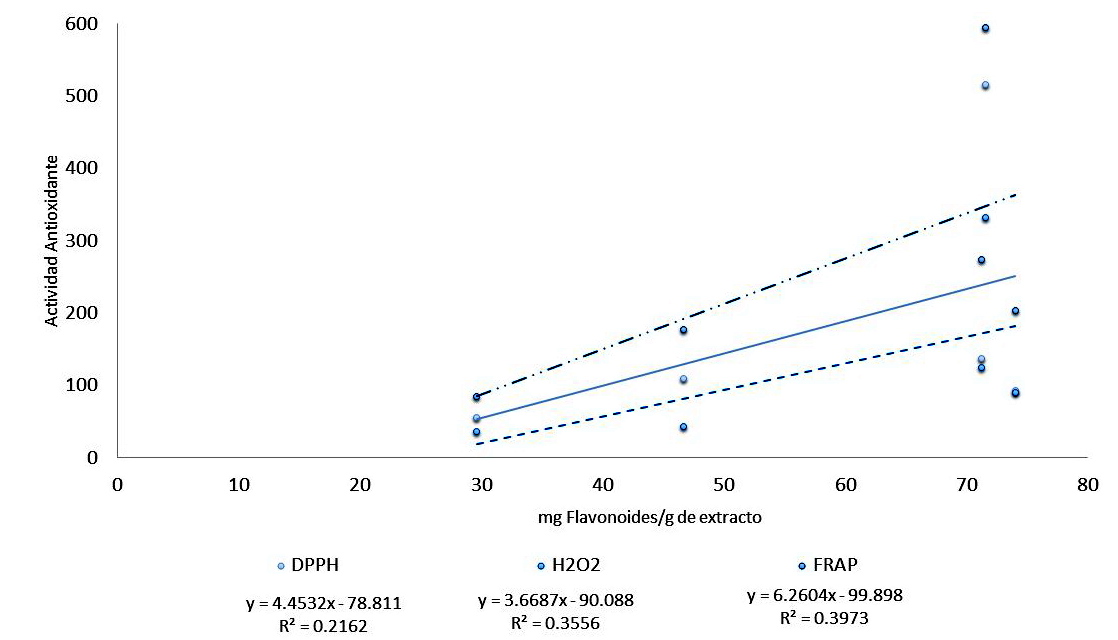
Figura 4: Correlación entre la cantidad de Flavonoides y la actividad antioxidante de los extractos de Coccoloba uvifera
Discusión
Según la Organización Mundial de la Salud aproximadamente el 80% de la población mundial usa la medicina alternativa, especialmente la medicina herbolaria para el tratamiento de sus afecciones [19]; este hecho se debe a que las plantas son fuente de metabolitos secundarios de interés biológico, farmacológico e industrial porque contienen una gran diversidad de estructuras químicas y actividad biológica [19-21]. Con el aumento en el estrés oxidativo por diversos factores como la contaminación, mala alimentación y el aumento en el consumo de sustancias tóxicas como el alcohol y cigarro se ha incrementado el número de pacientes que padecen enfermedades relacionadas con el estrés oxidativo como el cáncer, la enfermedad de Parkinson, el asma, enfermedades cardiovasculares y la diabetes [20-22]. Los compuestos polifenólicos sintetizados por las plantas tienen una actividad antioxidante elevada y por ello sirven para la prevención y el tratamiento de diversas enfermedades relacionadas con el estrés oxidativo [21,22]; estos compuestos generalmente son inocuos para el ser humano y pueden emplearse en la alimentación y por sus efectos benéficos para la salud humana y animal caracterizan a las plantas que las contienen como alimentos funcionales o para detectar fuentes vegetales potencialmente útiles como suplementos alimenticios [20,23,24]. La cantidad de los compuestos fenólicos producidos por una determinada especie están determinados por distintos factores entre los que destacan la genética, las condiciones ambientales y la fenología de la plantas que causan variaciones intraespecíficas; pero también hay variación dentro de un mismo individuo por factores genéticos, ontogénicos, bióticos y abióticos; hay factores como la sequía, la poda, la defoliación y el ataque de plagas que causan daños fisiológicos y pueden influir en la cantidad de polifenoles presentes en la planta [21,23].
Los dos grupos principales de polifenoles son los taninos y los flavonoides; los taninos son compuestos fenólicos complejos que están ampliamente distribuidos en las plantas, químicamente se distinguen dos tipos de taninos (los hidrolizables y los condensados), estos compuestos fenólicos presentan actividades antioxidantes pero altas concentraciones de taninos pueden disminuir el valor nutricional de los productos alimentarios porque los taninos forman complejos con proteínas [19,22]. Los flavonoides son una extensa familia de compuestos polifenólicos que poseen diversas bioactividades entre las que destacan la diminución de lipoproteínas sanguíneas, disminución de la glucemia y mejoramiento de las funciones inmunológicas [19]. Debido a la gran variedad de las estructuras químicas de los polifenoles la composición de éstos en un extracto vegetal dependerá del disolvente empleado [19,24,25]; además, la distribución de los metabolitos polifenólicos no es uniforme en los diferentes órganos vegetales y la variación también depende de las diferentes poblaciones de la planta [22]. Los flavonoides poseen diferentes grados de polaridad dependiendo de su estructura química; existen flavonoides que están unidos químicamente con estructuras glicosídicas que los hacen más solubles en disolventes polares y menos solubles en compuestos orgánicos; sin embargo, las agliconas de los flavonoides altamente hidroxiladas son solubles en alcoholes (etanol, metanol y butanol) mientras que los pocos hidroxilados se disuelven mejor en acetato de etilo y acetona [22]. Algunos autores señalan que disolventes de alta polaridad como el agua y el etanol presentan un mejor rendimiento en la obtención de polifenoles en comparación con la acetona y el dietiléter [26]; otros indican que la acetona y el acetato de etilo son buenos disolventes para extraer la mayoría de taninos y otros polifenoles vegetales [24,25] por eso es conveniente emplear diversos disolventes para la extracción de los compuestos polifenólicos, los más usados son el agua, el metanol, el etanol, la acetona y el acetato de etilo; cada uno posee un poder extractor distinto tanto en la cantidad como en la composición de sustancias fenólicas obtenidas [27-30]. En el presente trabajo se estudiaron dos disolventes y tres partes vegetales de C. uvifera y se obtuvieron cantidades similares a las reportadas para las especies del género Coccoloba, particularmente con los estudios realizados en la misma especie [4,8,10], las semillas presentaron la mayor cantidad de compuestos fenólicos y el extracto metanólico en comparación con el extracto acetónico; en oposición, el extracto acetónico de la cáscara y la pulpa contenía mayor cantidad de polifenoles que el extracto metanólico, asimismo el extracto acetónico de la hoja presentó una mayor cantidad de flavonoides respecto al extracto metanólico.
Para evaluar la actividad antioxidante de un extracto vegetal se recomiendan que se ensayen diferentes métodos porque la diversidad y complejidad de los extractos de plantas es muy grande; se prefieren métodos sencillos, económicos y de fácil acceso y con alta reproducibilidad, entre ellos destaca el método del DPPH que mide la capacidad de los extractos para reducir al radical libre por donación de átomos de hidrógeno, este ensayo es una técnica de decoloración porque el radical DPPH es de color violeta y al reducirse se torna amarillo [21,31]. Uno de los principales problemas que existe en el análisis de los datos de la actividad antioxidante de los extractos de las plantas es la expresión de los resultados, porque se reportan de diversas maneras, por ello en este trabajo se prefirió expresar la actividad antioxidante de los extractos con la actividad antioxidante equivalente de la sustancias empleada como referencia (ácido gálico) aprovechando la capacidad de este polifenol de inhibir al DPPH, reducir al peróxido de hidrógeno y al ión férrico. Los fenoles han recibido mucha atención como antioxidantes por su capacidad de reducir radicales libres y de quelar metales; los compuestos polifenólicos son donadores de hidrógeno y por su propiedad redox son sustancias reductoras [32]; el ensayo del FRAP sirve para determinar la eficacia de los compuestos antioxidantes para reducir el ion férrico a ferroso; esto sirve para suprimir la formación de radicales y prevenir el daño oxidativo; el poder reductor indica que hay compuestos en los extractos que son donadores de electrones y que pueden actuar como antioxidantes primarios y secundarios; la capacidad de reducir el hierro férrico se puede atribuir a la donación de hidrógenos de los compuestos fenólicos que se relaciona con la presencia de agentes reductores.
Igualmente, debido a que los polifenoles son buenos donadores de electrones pueden acelerar la descomposición del peróxido de hidrógeno a agua previniendo el daño tisular por especies reactivas de oxígeno. El peróxido de hidrógeno no es muy reactivo por sí solo pero puede ser tóxico para las células porque produce radicales hidroxilo que son muy dañinos, por esto es importante remover el peróxido en los sistemas celulares o de los alimentos [33,34]. En general, todos los extractos estudiados mostraron una actividad antioxidante significativa que se relaciona bien con el contenido de polifenoles, esto concuerda con estudios previos que reportan una correlación positiva entre la cantidad de polifenoles presentes en materiales vegetales y su actividad antioxidante medidas por distintos métodos como la neutralización del radical DPPH y la reducción de iones metálicos (FRAP) y especies reactivas de oxígeno (peróxido de hidrógeno) [20, 25,33]. Por ello, los extractosde la semilla de uva de mar mostraron el mayor contenido de polifenoles y la mayor actividad antioxidante; en general, los extractos de las partes vegetales de la uva de mar mostraron una mejor capacidad de reducir al ion férrico que al peróxido de hidrógeno. Los taninos totales y los taninos condensados fueron los metabolitos secundarios que mejor explican la actividad antioxidante de los extractos de C. uvifera; la mejor correlación se obtuvo con el ensayo de reducción de peróxido de hidrógeno.
Referencias:
1. Melo E de (2004) As espécies de Coccoloba P. Browne (Polygonaceae) da Amazônia brasileira. Acta Amazonica 34: 525–551.
2. Vargas-Simón G, Pire R (2010) Efecto de dos condiciones de almacenamiento en la germinación de semillas de uva de playa (Coccoloba uvifera (L.) Jacq.). Revista de la Facultad de Agronomía LUZ 27: 559-573.
3. Madriz R, Ramírez N (1996) Biología reproductiva de Coccoloba uvifera (Polygonaceae) una especie poligamo-dioica. Revista de Biología Tropical 44: 105-115.
4. Barros IB de, Fidelis QC, Souza Daniel JF de, Pereira Pinto J, GarciaLonni AAS; Silva Ribeiro G, Braz-Filho R, Resende de Aráujo N, Trevian Ferreira D (2010) Toxicity, antioxidantactivity and phytochemical characterization of Coccoloba mollis roots and leaves. Semina: Ciências Exatas e Tecnológicas 31: 101-106.
5. Tsuboy MS, Marcarini JC, Luiz RC, Barros IB, Ferreira DT, Ribeiro LR, Mantovani MS (2010) In Vitro evaluation of the genotoxic activity and apoptosis induction of the extracts of roots and leaves from the medicinal plant Coccoloba mollis (Polygonaceae). Journal of Medicinal Food 13: 503-508.
6. Tsuboy MS, MarcariniI JC, Ferreira TD, AnastácioFerraz ER, DrumondChequer FM, Palma de Oliveira D, Ribeiro LR, Mantovani MS (2010) Evaluation of extracts from Coccoloba mollis using the Salmonella/ microsome system and in vivo tests. Genetics and Molecular Biology 33: 542-548.
7. Barros Cota B, Braga de Oliveira A, Souza-Filho JD, Castro Braga F (2003) Antimicrobial activity and constituents of Coccoloba acrostichoides. Fitoterapia 74: 729–731.
8. Lawson-Evi P, Bakoma B, TitrikouAfi H, Eklu-Gadegbéku K, Aklikokou K, Gbeassor M (2015) Phytochemical screening, antioxidant and hypoglycemic activity of Coccoloba uvifera leaves and Waltheria indica roots extracts. International Journal of Pharmacy and Pharmaceutical Sciences 7: 279-283.
9. Bezerra de Barros I, Souza Daniel de JF, Pereira Pinto J, Rezende MI, BrazFilho R, Trevisan Ferreira D (2011) Phytochemical and antifungal activity of anthraquinones and root and leaf extracts of Coccoloba mollis on phytopathogens. Brazilian Archives of Biology an Technology 54: 535-541.
10. Segura Campos MR, Ruiz Ruiz J, Chel-Guarrero L, Bentacur Ancona D (2014) Coccoloba uvifera(L.) (Polygonaceae) Fruit: Phytochemical Screening and Potential Antioxidant Activity. Journal of Chemistry 2015: 1-9.
11. Peñarrieta JM, Alvarado JA, Bergenståhl B, Åkesson B (2007) Spectrophotometric methods for the measurement of total phenolic compounds and total flavonoids in foods. Revista Boliviana de Química 24: 5-9.
12. Hajimahmoodi M, Moghaddam G, Ranjbar AM, Khazani H, Sadeghi N, Reza Oveisi M, Jannat B (2013) Total phenolic, flavonoids, tannin content and antioxidant power of some iranian pomegranate flower cultivars (Punicagranatum L.). American Journal of Plant Sciences 4: 1815-1820. DOI: 10.4236/ajps.2013.49223
13. Velásquez Valderrama AM (2004) Extracción de taninos presentes en el banano verde. Revista Lasallista de Investigación 1: 17-22.
14. Sáenz-Esqueda MA, Rosales-Castro M, Rocha-Guzmán NE, Gallegos-Infante JA, González-Laredo RF (2010) Contenido fenólico y acción antioxidante de extractos de acículas de Pinuscooperi, P. durangensis, P. engelmaniiy P. teocote. Madera y Bosques 16: 37-48.
15. Fernando CD, Soysa P (2015) Optimized enzymatic colorimetric assay for determination of hydrogen peroxide (H2O2) scavenging activity of plant extracts. MethodsX 2: 283-91.
16. Zhou B, Wang J, Guo Z, Tan H, Zhu X (2006) A simple colorimetric method for determination of hydrogen peroxide in plant tissues. Plant Growth Regulation 49:113–118.
17. Daniel A, Workneh M (2017) Determination of total phenolic content and antioxidant activities of five different brands of Ethiopian coffee. International Journal of Food and Nutrition Research 1: 1-10.
18. Alves Pontis J, Mendonça Alves LA, Reis da Silva SJ, Flach A (2014) Color, phenolic and flavonoid content, and antioxidant activity of honey from Roraima, Brazil. Food Science and Technology 34: 69-73.
19. Sultana M, Kumar Verma P, Raina R, Prawez S, Dar MA (2012) Quantitative analysis of total phenolic, flavonoids and tannin contents in acetone and n-hexane extracts of Ageratum conyzoides. International Journal of ChemTech Research 4: 996-999.
20. Fattahi S, Zabihi E, Abedian Z, Pourbagher R, Motevalizadeh Ardekani A, Mostafazadeh A, Akhavan-NiakiH (2014). Total phenolic and flavonoid contents of aqueous extract of stinging nettle and In Vitro antiproliferative effect on hela and BT-474 Cell Lines. International Journal of Molecular and Cellular Medicine 3: 102–107.
21. Chandra Shekhar T, Anju G (2014) Antioxidant activity by DPPH radical scavenging method of Ageratum conyzoides Linn. Leaves. American Journal of Ethnomedicine 1: 244-249.
22. Pérez-Nájera VC, Lugo-Cervantes EC, Gutiérrez-Lomelí M, Del-Toro-Sánchez CL (2013) Extracción de compuestos fenólicos de la cáscara de lima (Citrus limetta Risso) y determinación de su actividad antioxidante. Revista de Ciencias Biológicas y de la Salud 15: 18-22.
23. Pérez-Pérez E, Ettiene G, Marín M, Casassa-Padron A, Silva N, Raga J, González C, Sandoval L, Medina D (2014) Determinación de fenoles y flavonoides totales en hojas de guayabo (Psidium guajava L.). Revista de la Facultad de Agronomía LUZ 31: 60-77.
24. Sungl SH, Hoon Kim K, Tae Jeon B, Hee Cheong S, Hyun Park J, Hyun Kim D, Kweon HJ, Moon SH (2012) Antibacterial and antioxidant activities of tannins extracted from agricultural by-products. Journal of Medicinal Plants Research 6: 3072-3079.
25. Pinheiro do Prado AC, MonaliseAragão AF, Roseane Block JM (2009) Phenolic compounds and antioxidant activity of Pecan [Carya illinoinensis (Wangenh.) C. Koch] kernel cake extracts. Grasas y aceites 60: 458-467.
26. Mladenović KG, Muruzović MŽ, Stefanović OD, Vasić SM, Čomić LR (2016) Antimicrobial, antioxidant and antibiofilm activity of extracts of Melilotus officinalis (L.) Pall. The Journal of Animal & Plant Sciences 26: 1436-1444.
27. Restrepo-Sánchez DC, Narváez-Cuenca CE, Restrepo-Sánchez LP (2009). Extracción de compuestos con actividad antioxidante de frutos de guayaba cultivada en Vélez-Santander, Colombia. Química Nova 32: 1517-1522.
28. Chavan UD, Amarowicz R (2013) Effect of various solvent systems on extraction of phenolics, tannins and sugars from beach pea (Lathyrus maritimus L.) International Food Research Journal 20: 1139-1144.
29. Paladino SC, Zuritz CA (2011) Extracto de semillas de vid (Vitis vinifera L.) con actividad antioxidante: eficiencia de diferentes solventes en el proceso de extracción. Revista de la Facultad de Ciencias Agrarias 187-199.
30. Padmalochana K, Dhana Rajan MS (2014) Antimicrobial activity of aqueous, ethanol and acetone extracts of Sesbania grandiflora leaves and its phytochemical characterization. International Journal of Pharma Sciences and Research 5: 957-962.
31. NazariFormagio AS, Ferreira Volobuff CR, Santiago M, Lima Cardoso CA, Vieira M, Valdevina Pereira Z (2014) Evaluation of antioxidant activity, total flavonoids, tannins and phenolic compounds in Psychotria leaf extracts. Antioxidants 3: 745-757.
32. Pal R, Girhepunje K, Upadhayay A, Thirumoorthy N (2012). Antioxidant and free radical scavenging activity of ethanolic extract of the root of Morinda citrifolia (Rubiaceae). African Journal of Pharmacy and Pharmacology 6: 278-282.
33. Wettasinghe M, Shahidi F (1999) Antioxidant and free radical-scavenging properties of ethanolic extracts of defatted borage (Boragoocinalis L.) seeds. Food Chemistry 67: 399-414.
34. Keser S, Celik S, Turkoglu S, Yilmaz Ö, Turkoglu I (2012) Hydrogen peroxide radical scavenging and total antioxidant activity of hawthorn. Chemistry Journal 2: 9-12.
35. Moniruzzaman M, Yung An C, Visweswara Rao P, Islam Hawlader MN, BintiMohdAzlan SA, AmrahSulaiman S, Hua Gan S (2014) Identification of phenolic acids and flavonoids in monofloral honey from Bangladesh by high performance liquid chromatography: Determination of antioxidant capacity. BioMed Research International 2014: 1-11.
|
Revista QuímicaViva Número 2, año 14, Agosto 2015 quimicaviva@qb.fcen.uba.ar |