Los insecticidas organofosforados metilazinfos y clorpirifos y el carbamato carbaril producen un incremento de los niveles de espermidina en las gónadas del gasterópodo de agua dulce Planorbarius corneus
Luis Claudio Cacciatore, Noemi Rosario Verrengia Guerrero, Adriana Cristina Cochón*
Universidad de Buenos Aires, Facultad de Ciencias Exactas y Naturales, Departamento de Química Biológica, Buenos Aires, Argentina.
Recibido: 28/06/2017 - Aceptado: 13/07/2017
Resumen
La inhibición de la actividad acetilcolinesterasa es el parámetro biomarcador por excelencia de exposición y/o efecto a agentes anticolinesterásicos. No obstante, estos pesticidas también ejercen sus efectos sobre otros blancos moleculares secundarios mucho menos estudiados. Las poliaminas putrescina, espermidina y espermina son cationes orgánicos presentes en todas las células vivas con funciones esenciales para el crecimiento y la diferenciación celular. Los objetivos del presente trabajo fueron determinar las proporciones relativas de las poliaminas mencionadas en diversos tejidos y regiones anatómicas del gasterópodo de agua dulce Planorbarius corneus y evaluar los efectos producidos en las mismas luego de la exposición a tres agentes anticolinesterásicos de uso frecuente en Argentina. Los caracoles fueron expuestos por 48 h a concentraciones subletales del carbamato carbaril (2,1 mg L-1) y de los pesticidas organofosforados metil azinfos (2,6 mg L-1), clorpirifos (7,5 μg L-1), y una mezcla binaria de ambos (1,3 mg L-1 de metil azinfos + 3,75 μg L-1 de clorpirifos). Los niveles de poliaminas fueron determinados en los tejidos blandos totales, la glándula digestiva, la hemolinfa y las gónadas por HPLC fase reversa con derivatización pre-columna con cloruro de dansilo. P. corneus contiene putrescina, espermidina y espermina con una proporción relativa de 1:0,24:0,005, 1:0,51:0,003, 1:0,15:0,001 y 1:0,22:0,004 en tejidos blandos totales, glándula digestiva, hemolinfa y gónadas, respectivamente. En las tres primeras matrices, no se observaron modificaciones en los niveles de poliaminas con respecto a los controles. En cambio, en las gónadas se observó un incremento significativo del contenido de espermidina que osciló entre el 57% y 68%, según el insecticida utilizado, sin que se alteraran los niveles de putrescina y espermina. Todos los tratamientos ensayados produjeron en las gónadas aumentos similares en las relaciones espermidina/putrescina y espermidina/espermina siendo en promedio del 46% y 31%, respectivamente. Estos resultados muestran que el metabolismo de poliaminas podría ser un blanco secundario de acción tóxica de los agentes anticolinesterásicos en las gónadas de los gasterópodos de agua dulce y podría brindar información complementaria para la evaluación del impacto de pesticidas en sistemas acuáticos.
Palabras clave: insecticidas anticolinesterásicos, gasterópodos, poliaminas
The organophosphorus insecticides azinphos-methyl and chlorpyrifos and the carbamate carbaryl produce an increase in spermidine levels in the gonads of the freshwater gastropod Planorbarius corneus
Summary
The inhibition of acetylcholinesterase activity is widely used as a biomarker of exposure and/or effect to anticholinesterase agents. However, these pesticides also exert their effects on other much less studied secondary molecular targets. The polyamines putrescine, spermidine and spermine are organic cations present in all living cells and essential for cell growth and differentiation. The objectives of the present study were to determine the relative proportions of the mentioned polyamines in various tissues and anatomical regions of the freshwater gastropod Planorbarius corneus, and to evaluate the effects of exposure to three anticholinesterase agents commonly used in Argentina on polyamine levels. The snails were exposed for 48 h to sublethal concentrations of the carbamate carbaryl (2.1 mg L-1) and to the organophosphorus pesticides methyl azinphos (2.6 mg L-1), chlorpyrifos (7.5 μg L-1), and a binary mixture of both (1.3 mg L-1 of methyl azinphos + 3.75 μg L-1 of chlorpyrifos). Polyamine levels were determined in total soft tissues, digestive gland, hemolymph and gonads by reversed phase HPLC with pre-column derivatization with dansyl chloride. P. corneus contains putrescine, spermidine and spermine with a relative ratio of 1: 0.24: 0.005, 1: 0.51: 0.003, 1: 0.15: 0.001 and 1: 0.22: 0.004 in total soft tissues, digestive gland, hemolymph and gonads, respectively. In the first three matrices, no changes in polyamine levels were observed with respect to the controls. In contrast, in the gonads, a significant increase in spermidine content was observed (57% to 68%, according to the insecticide used). The levels of putrescine and spermine in this tissue were not altered. All tested treatments produced in the gonads similar increases in spermidine/putrescine and spermidine/spermine ratios, averaging 46% and 31%, respectively. These results show that the metabolism of polyamines could be a secondary target of toxic action of the anticholinesterase agents in the gonads of the freshwater gastropods and could provide complementary information for the evaluation of the impact of pesticides in aquatic systems.
Keywords: anticholinesterase insecticides, gastropods, polyamines
Introducción
Los insecticidas organofosforados (OPs) tales como el metil azinfos (MAZ) y el clorpirifos (CPF) y el carbamato carbaril (CB), ejercen su toxicidad por inhibición de la actividad de la enzima acetilcolinesterasa (AChE), causando neurotoxicidad. Pero, mientras los OPs son capaces de fosforilar un residuo serina en el sitio activo de la AChE de manera irreversible, la carbamilación del mismo residuo es menos estable [1,2]. Tanto el MAZ como el CPF deben ser activados metabólicamente a las formas oxónicas para ejercer su acción anticolinesterásica. En cambio, la mayoría de los carbamatos como el CB no necesitan ser activados metabólicamente para ejercer su acción anticolinesterásica [3].
Estos pesticidas alcanzan los cursos de agua por escorrentía superficial y subsuperficial o por deriva aérea luego de ser aplicados a los cultivos y algunas veces por aplicación directa al agua superficial para control de mosquitos [4].
En general, los pesticidas se encuentran en los ambientes acuáticos formando parte de mezclas complejas. En particular, Loewy y col. [4] informaron, en el Valle del Río Neuquén, la coexistencia de MAZ, CPF y CB en el agua de drenaje procedente de zonas de riego de cultivos de manzana. Durante los períodos de aplicación de octubre a marzo correspondientes a las campañas 2008/09 y 2009/10, las mayores frecuencias de detección en agua (superficial y subsuperficial) se encontraron para el MAZ y el CPF (> 70%), seguido del CB (>40%).
Algunas especies del Filum Mollusca han sido recomendadas como modelos biológicos experimentales adecuados para evaluar los impactos subletales de los contaminantes solos o en mezclas en los ecosistemas acuáticos [5,6]. El gasterópodo Planorbarius corneus es un caracol hermafrodita que habita en lagunas y estanques temporarios y corrientes de agua dulce. Esta especie pertenece a la familia Planorbidae, la mayor familia de gasterópodos pulmonados los cuales presentan una amplia distribución mundial [7]. P. corneus ha sido usado como un modelo experimental en estudios de toxicidad [8-14].
Tradicionalmente, la inhibición de la actividad AChE ha sido y es el parámetro biomarcador por excelencia de exposición y/o efecto a insecticidas OPs y carbamatos. En este sentido, Cacciatore y col. [13] observaron que la exposición de P. corneus a concentraciones ambientalmente relevantes en el ecosistema acuático de MAZ y CPF produjeron inhibiciones significativas de la actividad AChE en los tejidos blandos y la hemolinfa, siendo el CPF un inhibidor de la actividad AChE mucho más potente que el MAZ. Además, dependiendo de la concentración, las mezclas de MAZ y CPF produjeron efectos aditivos o sinérgicos sobre la inhibición de la AChE [13].
La mayoría de los pesticidas OPs y carbamatos son capaces de interactuar con otros blancos no-colinesterasa, también referidos como blancos secundarios [15, 16]. Estos blancos alternativos son capaces de modular la toxicidad aguda y crónica de los insecticidas anticolinesterásicos; por lo tanto, su estudio se vuelve de fundamental importancia [17]. Además, el camino molecular desde la exposición hasta la muerte por efecto de los OPs y carbamatos no ha sido bien establecido [18]. Por ejemplo, se ha visto en peces y en invertebrados acuáticos que la falta de correlación entre la inhibición de la AChE y la mortalidad refuerza la hipótesis de que blancos no-colinérgicos de OPs y carbamatos deben ser incluidos en el análisis [19, 20].
Las poliaminas putrescina (Put), espermidina (Spd) y espermina (Spm) son cationes orgánicos presentes en todas las células vivas y son esenciales para el crecimiento celular y la diferenciación. Debido a que las poliaminas se encuentran completamente protonadas en condiciones fisiológicas, ellas pueden interactuar con ácidos nucleicos, ATP y con distintas proteínas y fosfolípidos. El contenido de poliaminas en las células está regulado por su biosíntesis, degradación, absorción y excreción; y tanto en células procariontes como eucariontes, los niveles de estos policationes se incrementan durante la respuesta celular a estímulos proliferativos [21].
Estudios recientes han mostrado que los insecticidas OPs afectan el metabolismo de las poliaminas en embriones del anfibio Rhinella arenarum [22, 23]. Por otro lado, casi no se ha investigado el metabolismo de poliaminas en gasterópodos acuáticos y menos aún los efectos que pueden ejercer sobre dicho metabolismo los insecticidas OPs. Por ello, los objetivos del presente trabajo fueron: (1) Determinar los niveles de las poliaminas Put, Spd y Spm en los tejidos blandos y en diferentes regiones anatómicas del gasterópodo de agua dulce P. corneus y (2) Evaluar si la exposición por 48 horas a concentraciones subletales de MAZ, CPF, CB y una mezcla de MAZ + CPF modifican los niveles de poliaminas en las regiones anatómicas estudiadas.
Materiales y métodos
Reactivos
Los reactivos cloruro de dansilo, prolina, putrescina (Put), espermidina (Spd), espermina (Spm), metil azinfos Pestanal® (MAZ, CAS N° 86-50-0, pureza > 98%), clorpirifos Pestanal® (CPF, CAS N° 2921-88-2, 99,9% de pureza) y carbaril (CB, CAS N° 63-25-2, 99% de pureza) se compraron a Sigma Aldrich de Argentina S.A. El acetonitrilo, calidad HPLC, se adquirió a Sintorgan S.A. (Buenos Aires, Argentina). Los otros reactivos utilizados en el trabajo fueron de grado analítico, marca Carlo Erba, Mallinckrodt o Merck.
Organismos seleccionados y tratamientos
Los caracoles adultos de P. corneus se adquirieron a Discus Morón S.R.L., Buenos Aires, Argentina. Posteriormente, los caracoles fueron cultivados en condiciones estándar, en peceras de vidrio (17 a 20 L) provistas de aireación, a una temperatura de 22 ± 2 °C y con un fotoperíodo artificial de 14-10 horas de luz/oscuridad. Los animales se alimentaron con hojas de lechuga ad libitum (Fried et al., 1992). En todos los experimentos, se emplearon organismos adultos de tamaño similar (10 ± 2 mm de diámetro de concha y 300 ± 36 mg de peso húmedo).
Para los cultivos se utilizó agua de red, declorada por al menos 24 h, con las siguientes propiedades físico-químicas: dureza total = 67 ± 3 mg CaCO3 L-1, alcalinidad = 29 ± 2 mg CaCO3 L-1, pH = 7,0 ± 0,2 y conductividad = 250 ± 17 µS cm-1. Para los bioensayos el agua declorada fue filtrada por una columna de carbón, a fin de eliminar la materia orgánica que pudiera estar disuelta.
Los bioensayos se realizaron exponiendo a los caracoles durante 48 hs a los siguientes medios: 1) solución de 7,5 µg CPF L-1; 2) solución de 2,6 mg MAZ L-1; 3) a una mezcla binaria de ambos OPs (3,75 µg L-1 de CPF + 1,3 mg L-1 de MAZ), y 4) solución de 2,1 CB mg L-1. Paralelamente, se efectuaron controles en agua declorada. Durante los tratamientos, los animales no fueron alimentados. No se observó mortalidad en los animales controles ni en cualquiera de los tratamientos. Las soluciones acuosas conteniendo los pesticidas MAZ, CPF y CB se prepararon disolviendo los mismos en acetona y se diluyeron con la cantidad necesaria de agua declorada. La concentración de los pesticidas se determinó por HPLC con detector UV [24]. Los valores de concentración medidos se encontraron siempre dentro del rango del 95%-102% con relación a los valores nominales.
Para evitar la degradación de los pesticidas durante toda la exposición de los bioensayos, el medio se renovó cada 24 h. La constancia de la concentración de cada uno de los pesticidas durante el período de tiempo de 24 h se evaluó en estudios de estabilidad realizados en nuestro laboratorio. La concentración promedio de los pesticidas, a las 24 h, permaneció en todos los casos dentro del rango del 82-98% de la concentración inicial.
Determinación de los niveles de poliaminas
Los niveles de poliaminas se determinaron en homogenatos de organismos enteros, glándula digestiva, gónadas y hemolinfa de P. corneus utilizando HPLC en fase reversa como describen Cochón y col. [25]. Se optimizó este método, originalmente descripto en ratas, en el invertebrado P. corneus.
Para ello, cada caracol o un pool de las distintas regiones anatómicas representado por 3 a 5 caracoles se homogeneizaron en agua destilada y luego se precipitaron las proteínas con ácido perclórico 0,2 N en frío durante 30 min. Luego de centrifugar por 20 min a 7.000 x g, una alícuota del sobrenadante se utilizó para dansilar las poliaminas presentes. Las cuantificaciones de las poliaminas dansiladas se realizaron por HPLC en un equipo Spectra-Physics Analytical, Inc., Fremont, California, equipado con una bomba de gradiente modelo Spectra SERIES P200 y un detector de fluorescencia Spectra SYSTEM FL2000. Se utilizó una columna de fase reversa C18, de 5 µm, con dimensiones de 25 cm por 4,6 mm. Las poliaminas eluyeron dentro de los 40 min con un gradiente desde 40% de acetonitrilo en agua hasta el 100% de acetonitrilo, con un flujo de 1 ml min-1. Se realizó una curva de calibración utilizando soluciones patrones de Put, Spd y Spm tratadas de igual forma que las muestras. La detección de las poliaminas se fijó a 342 nm (excitación) y 512 nm (emisión) y los resultados se expresaron como nmoles de poliamina g -1 tejido húmedo.
Análisis estadístico
Los resultados se expresaron como el promedio ± D.E. (desviación estándar). Los distintos tratamientos se analizaron utilizando ANOVA de un factor y las comparaciones entre grupos se realizaron utilizando la prueba de Tukey-HSD. Se utilizó un nivel de significancia de 0,05. Previamente al ANOVA, los datos fueron evaluados para normalidad y homogeneidad de la varianza usando las pruebas de Shapiro-Wilk y de Levene, respectivamente, con el software OriginPro 7.5 (OriginLab, Northampton, MA).
Resultados
Los tiempos de retención de las poliaminas dansiladas fueron de 19, 24 y 28 min para Put, Spd y Spm, respectivamente. Las curvas de calibración fueron para Put y = 40,69 x (nmoles ml-1) + 38,35, R2 = 0,9994, para Spm y = 64,25 x (nmoles ml-1) + 21,36, R2 = 0,9978, y para Spd y = 82,01 x (nmoles ml-1) + 66,20, R2 = 0,9979.
La Figura 1 muestra la proporción relativa de Put, Spd y Spm en tejidos blandos totales, glándula digestiva, hemolinfa y gónadas, respectivamente. Put fue la poliamina mayoritaria en todos los tejidos, seguida por Spd; mientras que los niveles de Spm fueron muy bajos en todos los casos.
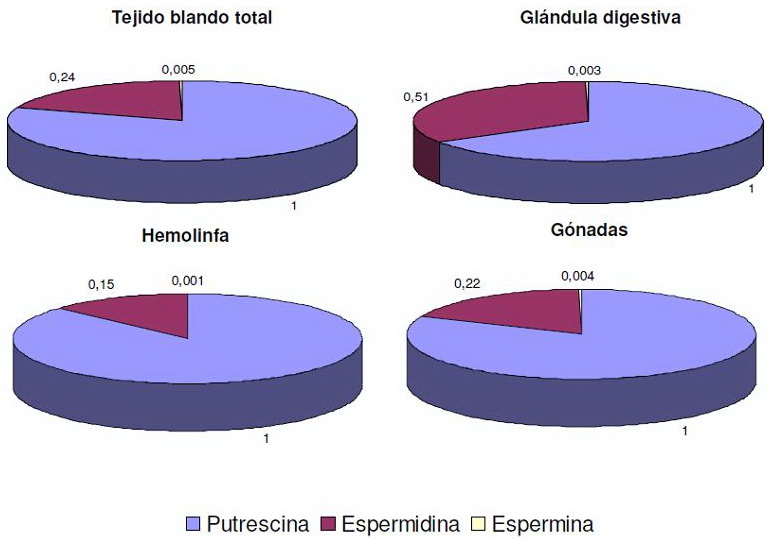
Figura 1: Proporciones relativas de las poliaminas putrescina, espermidina y espermina en tejido blando total y en distintas regiones anatómicas de Planorbarius corneus. En todos los casos, se asignó el valor de 1 a los niveles de putrescina
La Tabla I muestra el contenido de Put, Spd y Spm en los tejidos blandos totales, glándula digestiva, hemolinfa y gónadas de P. corneus en el grupo control y en los caracoles expuestos por 48 h a concentraciones subletales de los pesticidas OPs CPF (7,5 µg L-1), MAZ (2,6 mg L-1), una mezcla binaria de ambos (3,75 µg L-1 de CPF + 1,3 mg L-1 de MAZ) y del carbamato CB (2,1 mg L-1). En tejidos blandos totales, glándula digestiva y hemolinfa, los pesticidas no modificaron los niveles de poliaminas con respecto a los controles (p>0,05). En cambio, en las gónadas se produjo un incremento significativo del contenido de Spd que osciló entre el 57% y 68%, según el insecticida utilizado (p<0,05), sin alterar los niveles de Put y Spm. Todos los tratamientos ensayados produjeron en las gónadas aumentos similares en las relaciones Spd/Put y Spd/Spm siendo en promedio del 46% y 31%, respectivamente (p<,05).
Tabla I: Niveles de Poliaminas en Tejido blando total y distintas regiones anatómicas de Planorbarius corneus controles y expuestos a agentes anticolinesterásicos.
| Tejido Blando Total | |||
| Put | Spd | Spm | |
| (nmoles g-1 tejido blando total) | |||
| Controles | 2852±271 | 686±75 | 13±8 |
| CPF | 2732±245 | 641±49 | 12±4 |
| MAZ | 2806±281 | 724±88 | 16±6 |
| CPF+MAZ | 2417±589 | 655±219 | 12±7 |
| CB | 2973±301 | 765±122 | 16±6 |
| Glándula digestiva | |||
| Put | Spd | Spm | |
| (nmoles g-1 Glándula digestiva) | |||
| Controles | 3954±460 | 2012±486 | 13±7 |
| CPF | 4187±558 | 2060±502 | 11±4 |
| MAZ | 4126±391 | 1862±338 | 18±6 |
| CPF+MAZ | 4050±914 | 2076±647 | 20±6 |
| CB | 3917±280 | 1878±326 | 15±4 |
| Hemolinfa | |||
| Put | Spd | Spm | |
| (nmoles ml-1 hemolinfa) | |||
| Controles | 1480±385 | 225±68 | Detectable (N.C.) |
| CPF | 1320±447 | 218±63 | Detectable (N.C.) |
| MAZ | 1389±376 | 269±83 | Detectable (N.C.) |
| CPF+MAZ | 1473±500 | 262±50 | Detectable (N.C.) |
| CB | 1324±320 | 250±37 | Detectable (N.C.) |
| Gónadas | |||
| Put | Spd | Spm | |
| (nmoles g-1 Gónadas) | |||
| Controles | 3006±333 | 675±180 | 11±4 |
| CPF | 3112±424 | 1063±76* | 13±3 |
| MAZ | 3178±343 | 1108±125* | 12±5 |
| CPF+MAZ | 3060±281 | 1079±99* | 15±4 |
| CB | 3164±103 | 1132±98* | 15±3 |
Los caracoles fueron expuestos por 48 h a 7,5 µg L-1 clorpirifos (CPF), 2,6 mg L-1 metilazinfos (MAZ), una mezcla de 3,75 µg L-1 de CPF + 1,3 mg L-1 de MAZ o 2,1 mg L-1 carbaryl (CB).
Los asteriscos (*) significan diferencias estadísticamente significativas con respecto a los controles (p<0,05). N.C.: no cuantificable.
Discusión
En general se considera que las poliaminas Put y Spd predominan en las células procariontes, las cuales crecen rápidamente, mientras que la Spd y Spm predominan en las células eucariontes, las cuales proliferan relativamente de manera más lenta [21]. Si bien estos predominios en las relaciones de las poliaminas parecieran ser así en muchas especies, no se pueden hacer generalizaciones. En realidad, existen muy pocas investigaciones que hayan estudiado los niveles de poliaminas en especies de invertebrados. La presente investigación demuestra que en los tejidos blandos totales y en todos los tejidos y regiones anatómicas estudiadas de P. corneus hay un predominio neto de Put y Spd. Un antecedente similar al observado en P. corneus se encuentra en Biomphalaria glabrata, donde existe también un predominio neto de Put y Spd [26]. Ambos caracoles, pertenecientes a la misma familia, presentaron en las regiones anatómicas concentraciones de Put y Spd muy similares a las presentadas en el presente trabajo. Por otro lado, en P. corneus se encontraron concentraciones muy bajas de Spm mientras que en B. glabrata ésta no pudo ser detectada utilizando la misma técnica instrumental.
En los tejidos blandos totales de P. corneus no se verificaron alteraciones en los niveles de poliaminas por exposición aguda a los OPs MAZ, CPF, una mezcla de MAZ+CPF, ni al carbamato CB. Coincidiendo con estos resultados, tampoco se vieron alterados los niveles de las poliaminas en tejido blando total de B. glabrata por exposición al herbicida paraquat y al OP MAZ [26, 27]. Por el contrario, a diferencia de lo observado en tejido blando total, al analizar distintas regiones anatómicas por separado (glándula digestiva, hemolinfa, gónadas) se pudo determinar que la exposición a los OPs y al CB alteró el metabolismo de las poliaminas en las gónadas de P. corneus, evidenciándose aumentos significativos del contenido de Spd entre 57 y 68%. Todos los tratamientos ensayados produjeron en las gónadas aumentos similares en las relaciones espermidina/putrescina y espermidina/espermina siendo en promedio del 46% y 31%, respectivamente. Otros autores [28] también pudieron determinar, a través de estudios metabolómicos, la existencia de alteraciones de los niveles de Put y Spd en el sistema nervioso central del gasterópodo de agua dulce Lymnaea stagnalis expuesto a un extracto de agua superficial obtenida de un área agrícola de Holanda y al insecticida imidacloprid.
Se ha demostrado que Spd, al igual que otras poliaminas, juega un rol indispensable para lograr una reproducción exitosa, actuando en diversas etapas del proceso reproductivo [29]. Por ello, la modificación de los niveles de Spd en las gónadas de P. corneus podría estar relacionada con una alteración en los procesos reproductivos. En este sentido, se ha demostrado que, dependiendo de las concentraciones y el tiempo de exposición, el OP MAZ inducía alteraciones en la reproducción del gasterópodo B. glabrata, representadas por una disminución en el número de masas de huevos y, en algunos casos, por un menor número o aun la ausencia total de eclosión de los huevos [30]. Efectos adversos sobre la reproducción se observaron también en P. corneus por exposición aguda a concentraciones ambientalmente relevantes de CPF [31].
En conjunto, nuestros resultados y los de otros autores muestran que el metabolismo de poliaminas podría ser un blanco secundario de acción tóxica de algunas familias de pesticidas en los gasterópodos de agua dulce y podría brindar información complementaria para la evaluación de su impacto en sistemas acuáticos. Además, cuando el tamaño del organismo así lo permita, los análisis de las posibles alteraciones de los niveles de poliaminas deberían ser realizados de forma tejido-específica ya que la respuesta podría ser altamente dependiente del tejido.
Agradecimientos
Se agradece el financiamiento recibido de la Universidad de Buenos Aires (20020110100070).
Referencias:
1. Sogorb MA, Vilanova E (2002) Enzymes involved in the detoxification of organophosphorus, carbamate and pyrethroid insecticides through hydrolysis. Toxicology Letters 128: 215-228.
2. Van Dyk JS, Pletschke B (2011). Review on the use of enzymes for the detection of organochlorine, organophosphate and carbamate pesticides in the environment. Chemosphere 82: 291-307.
3. Gupta RC (2006) Classification and Uses of Organophosphates and Carbamates en Gupta, R. C.(Ed), Toxicology of Organophosphate and Carbamate Compounds pp 5-24. Burlington, MA: Elsevier Academic Press
4. Loewy RM, Monza LB, Kiers VE, Savini MC (2011) Pesticide distribution in an agricultural environment in Argentina. Journal of Environmental Science Health B. 46: 662-670.
5. Rittschof D, McClellan-Green P (2005) Molluscs as multidisciplinary models in environment toxicology. Marine Pollution Bulletin 50: 369-373.
6. Tallarico L D F (2015) Freshwater gastropods as a tool for ecotoxicology assessments in Latin America. American Malacological Bulletin 33: 330-336.
7. Jopp F (2006) Comparative studies on the dispersal of the Great Ramshorn (Planorbarius corneus L.): A modelling approach. Limnologica 36: 17-25.
8. Pavlica M, Klobučar GIV, Vetma N, Erben R, Papeš D (2000) Detection of micronuclei in haemocytes of zebra mussel and great ramshorn snail exposed to pentachlorophenol. Mutation Research 465: 145-150.
9. Otludil B, Cengiz E I,Yildirim M Z,Ünver Ö, Ünlϋ E (2004) The effects of endosulfan on the great ramshorn snail Planorbarius corneus (Gastropoda, Pulmonata): a histopathological study. Chemosphere 56: 707-716.
10. Clarke N, Routledge EJ, Garner A, Casey D, Benstead R, Walker D, Watermann B, Gnass K, Thomsen A, Jobling S (2009) Exposure to treated sewage effluent disrupts reproduction and development in the seasonally breeding Ramshorn snail (subclass: Pulmonata, Planorbarius corneus). Environmental Science Technology 43: 2092-2098.
11. Benstead RS, Baynes A, Casey D, Routledge E J, Jobling S (2011) 17 β-Oestradiol may prolong reproduction in seasonally breeding freshwater gastropod mollusks. Aquatic Toxicology 101: 326–334.
12. Cacciatore LC, Kristoff G, Verrengia Guerrero NR, Cochón AC (2012) Binary mixtures of azinphos-methyl oxon and chlorpyrifos oxon produce in vitro synergistic cholinesterase inhibition in Planorbarius corneus Chemosphere 88: 450-458.
13. Cacciatore LC, Verrengia Guerrero NR, Cochón AC (2013) Cholinesterase and carboxylesterase inhibition in Planorbarius corneus exposed to binary mixtures of azinphos-methyl and chlorpyrifos. Aquatic Toxicology 128-129: 124-134.
14. Cacciatore LC, Nemirovsky SI, Verrengia Guerrero NR, Cochón AC (2015) Azinphos-methyl and chlorpyrifos, alone or in a binary mixture, produce oxidative stress and lipid peroxidation in the freshwater gastropod. Planorbarius corneus Aquatic Toxicology 167: 12-19.
15. Pope CN (1999) Organophosphorus pesticides: do they have all the same mechanism of toxicity? Journal of Toxicology and Environmetal Health, Part B 2: 161-181.
16. Jett DA, Lein PJ (2006) Noncholinesterase mechanisms of central and peripheral neurotoxicity: muscarinic receptors and other targets en: Gupta, R.C. (Ed.). Toxicology of organophosphate and carbamate compounds pp.233-245. Amsterdam: Academic Press Elsevier Inc.
17. Ferrari A, Pechen de D’Angelo AM, Venturino A (2009) Primary and secondary targets of action-response to anticholinesterase pesticide exposure in fish: Trends in underlying molecular mechanisms en: Kanzantzakis, C.M. (Ed.) Progress in Pesticide Research pp. 220-253. New York: Nova Science Publishers, Inc.
18. Peña Llopis S, Ferrando MD, Peña JB (2002) Impaired glutathione redox status is associated with decreased survival in two organophosphate poisoned marine bivalves. Chemosphere 47: 485-497.
19. Ferrari A, Venturino A, Pechen de D’ Angelo AM (2004) Time course of brain cholinesterase inhibition and recovery following acute and subacute azinphosmethyl, parathion and carbaryl exposure in the goldfish (Carassius auratus). Ecotoxicology and Environmetal Safety 57: 420–425.
20. Kristoff G, Verrengia Guerrero NR, Pechen de D’Angelo AM, Cochón AC (2006) Inhibition of cholinesterase activity by azinphos-methyl in two freshwater invertebrates: Biomphalaria glabrata and Lumbriculus variegatus. Toxicology 222: 185-194.
21. Igarashi K, Kashiwagi K (2010) Modulation of cellular function by polyamines. The International Journal of Biochemistry and Cell Biology 42: 39-51.
22. Lascano CI, Ferrari A, Gauna LE, Cocca C, Cochón AC, Verrengia Guerrero, NR, Venturino A (2011). Organophosphorus insecticides affect normal polyamine metabolism in amphibian embryogenesis. Pesticide Biochemistry and Physiology 101: 240-247.
23. Sotomayor V, Lascano C, Pechén de D'Angelo AM, Venturino A (2012) Developmental and polyamine metabolism alterations in Rhinella arenarum embryos exposed to the organophosphate chlorpyrifos. Environmental Toxicology and Chemistry 31: 2052-2058.
24. Cacciatore LC (2013) Evaluación de la toxicidad de insecticidas anticolinesterásicos, solos o en mezclas binarias, en el invertebrado de agua dulce Planorbarius corneus. Estudio de parámetros biomarcadores de exposición y efecto. Tesis doctoral. Facultad de Ciencias Exactas y Naturales, Universidad de Buenos Aires, Buenos Aires, Argentina.
25. Cochón AC, González N, San Martín de Viale LC (2002) Effects of the porphyrinogenic compounds hexachlorobenzene and 3,5 diethoxycarbonyl-1,4-dihydrocollidine on polyamine metabolism. Toxicology 176: 209-219.
26. Cochón AC, Della Penna AB, Kristoff G, Piol MN, San Martín de Viale LC, Verrengia Guerrero NR (2007) Differential effects of paraquat on oxidative stress parameters and polyamine levels in two freshwater invertebrates. Ecotoxicology and Environmental Safety 68: 286-292.
27. Kristoff G (2010) Estudio comparativo de biomarcadores en los invertebrados acuaticos Biomphalaria glabrata y Lumbriculus variegatus expuestos a pesticidas de relevancia ambiental. Tesis doctoral. Facultad de Ciencias Exactas y Naturales, Universidad de Buenos Aires, Buenos Aires, Argentina.
28. Tufi S, Wassenaar PN, Osorio V, de Boer J, Leonards PE, Lamoree MH (2016) Pesticide mixture toxicity in surface water extracts in snails (Lymnaea stagnalis) by an in vitro acetylcholinesterase inhibition assay and metabolomics. Environmental Science and Technology 50: 3937-3944.
29. Bauer MA, Carmona-Gutiérrez D, Ruckenstuhl C, Reisenbichler A, Megalou EV, Eisenberg T, Magnes C, Jungwirth H, Sinner FM, Pieber TR, Fröhlich KU, Kroemer G, Tavernarakis N, Madeo F (2013). Spermidine promotes mating and fertilization efficiency in model organisms. Cell Cycle 12: 346-352.
30. Kristoff G, Cacciatore LC, Guerrero NR, Cochón AC (2011) Effects of the organophosphate insecticide azinphos-methyl on the reproduction and cholinesterase activity of Biomphalaria glabrata. Chemosphere 84, 585-591.
31. Rivadeneira PR, Agrelo M, Kristoff G (2015) Acute Exposure of the Freshwater Snail Planorbarius corneus to an Environmental Concentration of Chlorpyrifos: Recovery Studies of Enzyme Activities in Gonads and Effects on Reproduction en: Mayes, C. (Ed.) Chlorpyrifos: Toxicological Properties, Uses and Effects on Human Health and the Environment pp. 27-38. New York: Nova Science Publishers, Inc.
|
Revista QuímicaViva Número 2, año 16, Agosto 2017 quimicaviva@qb.fcen.uba.ar |