Breve historia del VIP, un péptido que hace honor a su sigla
Claudia Pérez Leirós y Rosanna Ramhorst
Laboratorio de Inmunofarmacología. Departamento de Química Biológica. FCEyN. IQUIBICEN, UBA-CONICET.
Resumen
El VIP, péptido intestinal vasoactivo, fue aislado como una hormona intestinal, luego descripto como neurotransmisor en el sistema nervioso central y periférico, en los ‘80 redescubierto como inmunomodulador y, más recientemente, retomado su papel durante la gestación. Pertenece a la familia de secretina, glucagón y otros péptidos endógenos que tienen efectos por unión a receptores de 7 dominios transmembrana acoplados a proteínas G (GPCR) del grupo B. En esta perspectiva se refieren los aspectos más destacados de su actividad biológica y los alcances de este péptido endógeno como molécula candidata en Farmacología, todo matizado con reflexiones del Profesor Sami Said, quien junto con el Profesor Viktor Mutt iniciaron hace unos 50 años los experimentos que permitieron su aislamiento y caracterización.
Palabras clave: VIP – péptido intestinal vasoactivo – neurotransmisión – inmunomodulación - embarazo
Brief story of VIP, a peptide that honors its acronym
Summary
VIP, the vasoactive intestinal peptide, was isolated as a gut hormone, then described as a neurotransmitter of the central and peripheral nervous system, in the ´80s re-discovered as an immune peptide and lately recovered with a its role in pregnancy. It belongs to the family of secretin, glucagon and related peptides that activate group B GPCR (G protein coupled receptors). In this review the most relevant aspects of this pleiotropic peptide are summarized as well as its potential as a lead molecule in Pharmacology, everything trimmed with Profesor Said’s reflections who, together with Professor Viktor Mutt, started the experiments that led to its isolation and characterization 50 years ago.
Keywords: VIP – vasoactive intestinal peptide – neurotransmission – immunomodulation - pregnancy
Camino al VIP
‘En 1960, como médico especialista en pulmón en el Medical College de Virginia, en EEUU, comencé a preguntarme por qué las enfermedades pulmonares graves como la embolia pulmonar masiva o el Sindrome de Distres Respiratorio Agudo se asociaban frecuentemente con hipotensión y shock. Y me plantee varias explicaciones de las cuales una, que no había atraído mucha atención, suponía que el pulmón al sufrir una injuria frente a este trauma liberaba a la circulación una o más sustancias vasodilatadoras’. Así comienza Sami Saidsu encantadora perspectiva sobre el descubrimiento del péptido intestinal vasoactivo, que también es la historia de su bautismo con el nombre ‘VIP’, una sigla tan reconocida como lo justa que es esta denominación para una molécula endógena con múltiples efectos y funciones en el organismo, como se descubriría años más tarde[1] (* ver nota al pie).
Como en muchos de los hallazgos científicos, en la historia del VIP también ocurrió que una hipótesis que convencía a unos pocos se retoma con solidez intelectual y renovada metodología y se demuestra su validez para satisfacción de propios y ajenos, para el avance de la ciencia y sus aplicaciones y, por qué no, también para el deleite de los lectores de la historia de los descubrimientos.
Y sigue Said, ‘los experimentos preliminares para verificar esta hipótesis, realizados con tejido pulmonar de animales de laboratorio, confirmaron que cuando esos extractos se administraban a otros animales causaban hipotensión, y que ésta no era atribuible a sustancias conocidas como la histamina, las prostaglandinas o las calicreinas, […] dejando abierta la posibilidad de la presencia en el pulmón de otros compuestos, peptídicos, con acción vasodilatadora’.
Con esa idea en mente, Said decidió usar la oportunidad de un año sabático para ir al Instituto Karolinska en Estocolmo, Suecia, donde lo presentaron con el Profesor Viktor Mutt, conocido como el mejor bioquímico de péptidos del Instituto. Si bien pudieron confirmar una fuerte actividad vasodilatadora en los extractos peptídicos del pulmón, el aislamiento del componente activo de ese extracto se dificultaba demasiado por la escasa cantidad de tejido fresco disponible. Y ahí nuevamente el genio y la casualidad, esa combinación que no asegura descubrimientos pero que, a veces, se ofrece a los espíritus empeñados y sagaces, encontró otra pista en el camino. En el Instituto había poca disponibilidad de tejido pulmonar pero sobraban extractos de intestino delgado, incluso en varios estadios de purificación, ya que se usaban en los experimentos que Viktor Mutt llevaba adelante para caracterizar otros péptidos intestinales como secretina y colecistokinina.
Con el diario del lunes -diría uno ahora-, sin duda fue una decisión acertada. Lo que pensó Sami Said en ese momento, según relata en su perspectiva, fue ‘[…] cuánto más aprovechable sería todo esto si el péptido que estamos buscando estuviera en el intestino y no en el pulmón. Y de repente esa idea se volvió razonable porque me acordé que el intestino delgado y el pulmón tienen un origen embrionario común, el intestino anterior'.
Así, lograron aislar del intestino delgado cantidades suficientes del péptido -que hasta ese momento no tenía nombre- y probaron en distintos sistemas in vitro e in vivo su potente efecto vasodilatador. Said lo nombró como lo conocemos hoy, VIP, nombre quele cabía muy bien proviniendo del intestino y al no saber, en ese momento, que su distribución era tan amplia, en casi todos los tejidos, demostrado más tarde. Y como él mismo admite, también influyó en esa denominación la presunción de que la sigla VIP iba a ser fácil de recordar. El nombre, igual que para nombrar a las ‘personas muy importantes’, algo que ciertamente el VIP no es, sin embargo da pie para honrar esa sigla y sí aludir -de nuevo leyendo el diario de un lunes de marzo de 2017-, a un perfil de actividad amplísimo, que excede al intestino y el pulmón, y abarca sistemas y funciones tan diversas como la función nerviosa (es un neuropéptido), la función inmunitaria (como inmunopéptido), la función salival y del páncreas exocrino (como péptido pro-secretorio), la capacidad de crecimiento celular (es un factor de crecimiento), el embarazo, y siguen las firmas (revisado recientemente en [2-4]).
El péptido fue identificado como un miembro de la familia de secretina, muy cerca de la cual había estado siempre en los procedimientos de extracción, pero mientras secretina era eluida en las columnas de intercambio iónico, el VIP por su alta carga permanecía unido a la carboximetil celulosa. Efectivamente, el protocolo del laboratorio en el Karolinskaindicaba lavar la columna con HCl de alta molaridad y descartar los lavados de modo de ‘limpiar’ la columna para usos subsecuentes, lo que llevó a una simpática humorada del investigador con su mentor ‘estuvimos tirando a la basura todo este tiempo el péptido más importante del intestino!’.
Sami Said volvió a Estados Unidos, el VIP fue purificado, se desarrolló un kit para medir sus niveles en fluidos humanos, se informó la secuencia de aminoácidos, se pudo sintetizar y se lo identificó en la misma familia de péptidos de secretina, glucagón y otros péptidos que se unen a receptores de 7 dominios transmembrana acoplados a proteínas G (GPCR por su sigla en inglés) de tipo II o B. Se vio, además, que la mayor homología estructural del VIP en esta familia era con PACAP (cerca del 70%), una molécula con muy alta eficacia para aumentar la actividad de adenililciclasa, a la que le debe su nombre (Péptido activador de adenililciclasapituitara).
La temprana disponibilidad de un kit para medir los niveles de VIP en muestras de pacientes permitió asociarlo con tumores del sistema nervioso, como el neuroblastoma, y esto llevó a hipotetizar que podría estar expresado en condiciones normales en neuronas y en distintas áreas del cerebro, lo cual se verificó en los años siguientes. La expresión de VIP fue demostrada en corteza cerebral, hipocampo, amígdala e hipotálamo, y tras varios estudios funcionales ‘redescubierto’ como neurotransmisor. Es más, con sus densos plexos y nervios, se puede decir que fue particularmente afortunada la decisión de extraerlo del intestino delgado donde se encuentra en tan alta proporción, razonó Said en su perspectiva.
¿Qué es y cómo es el VIP?
VIP se define en casi todos los trabajos como un péptido pleiotrópico, justamente por esta característica de generar efectos a niveles tan disímiles como glandular, vascular, nervioso, metabólico, inmunitario y de crecimiento. VIP estimula la secreción de electrolitos y proteínas en glándulas exocrinas, la secreción de prolactina en la hipófisis (endocrina) y de catecolaminas por lamédula adrenal[2-4]. Es un factor de sobrevivencia neuronal, regula el metabolismo de glucógeno en la corteza, participa en el control de los ritmos circadianos actuando sobre el reloj biológico en el núcleo supraquiasmático del hipotálamo y hay evidencias de su papel en el desarrollo del sistema nervioso central: su déficit está asociado a defectos estructurales,disrupción de ritmos biológicos y trastornos cognitivos, entre otros [2-7].Su perfil como neurotransmisor fue ampliamente descripto y revisado no solo en ese rol sino también en desórdenes neuroinflamatorios por el Profesor James Waschek de la Universidad de California en Los Angeles[5].
Y cuando ya tenía su lugar indiscutido en el sistema nervioso se descubrió que VIP también regula la respuesta inmunitaria hacia un perfil anti-inflamatorio y tolerogénico, demostrado en distintos diseños in vitro y modelos animales de inflamación crónica y autoinmunidad[8,9]. Más aún, en enfermedades inflamatorias crónicas con alta prevalencia y deshabilitantes como la artritis reumatoidea, el grupo de la Profesora Rosa Gomariz de la Universidad Complutense de Madrid propuso que sus niveles plasmáticos pueden ser usados como un biomarcador con valor clínico en el curso de la enfermedad [10].
Sobre la base de un espectro tan amplio de actividad biológica, se sostiene al VIP como candidato a fármaco para diversas enfermedades y desórdenes de salud en humanos incluyendo diabetes, asma, impotencia, enfermedades inflamatorias y autoinmunes. Para esto se realizaron análisis de la relación estructura-actividad que dieron lugar a numerosos congéneres sintéticos disponibles comercialmente para estudios básicos, y una formulación tópica para el tratamiento de la hipertensión pulmonar aprobada por la FDA.
En cuanto a su estructura, el VIP tiene una secuencia de 28 aminoácidos altamente conservada, idéntica en humanos, bovinos, porcinos, perro, cabra, rata, ratón y conejo, mientras que en especies donde se desvía de esta secuencia como pollo o cobayo, ésta solo difiere en 4 aminoácidos (revisado en [2]). La secuencia del VIP en humanos, según el código de una letra para cada aminoácido, se muestra en la figura 1.
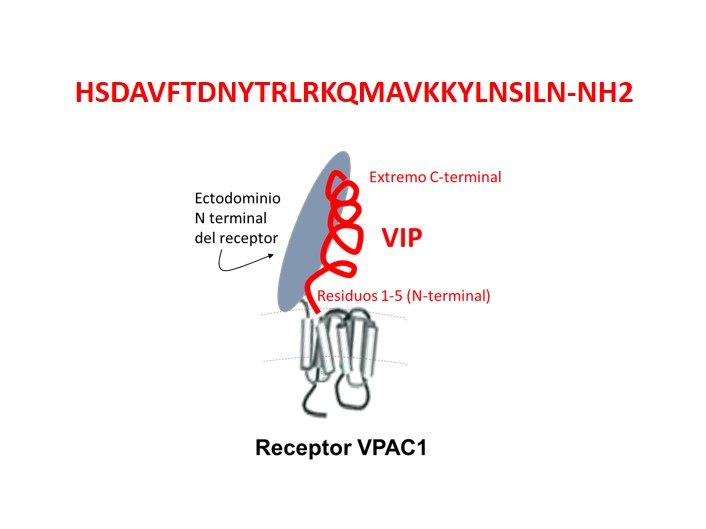
Figura 1: Secuencia de aminoácidos del VIP (arriba) y modelo propuesto para su unión al receptor VPAC1 (abajo) según estudios de modelado molecular. VIP se muestra como una hélice alfa en rojo con su estructura y dominio C-terminal (residuos 6-28) unidos en forma paralela a láminas beta plegadas en la estructura del ectodominio N terminal del receptor VPAC1 esquematizado con un ovalo gris. Esquema modificado con información revisada por [2,3].
VIP se une con alta afinidad a receptores VPAC1, VPAC2 y con menor afinidad al PAC1, todos del grupo B de GPCR y activa la señalización intracelular a través de AMPc, entre otras vías [2,3]. Por estudios bioquímicos y de modelado in silico se pudo demostrar que el péptido se une al primer dominio extracelular, que en los receptores del grupo B es particularmente extensopermitiendo unir a los péptidos de la familia como se describió inicialmente para el factor liberador de corticotrofina o CRF. Estudios de cristalografía de Rayos X, RMN, fotoafinidad y modelado molecular indican que la conformación en alfa-hélice del VIP se une por su estructura central y región C-terminal (residuos 6-28) al extremo N-terminal del receptor VPAC1 en una disposición alineada con las láminas beta de este ectodominio y dejando la región N terminal (residuos 1-5) del péptido en contacto con el core del receptor [2-4].
‘Campo VIP’ (nuevas evidencias y potencial del VIP en medicina traslacional)
El estudio del VIP, sus múltiples efectos y potenciales aplicaciones ha seguido su rumbo firme y, en ese sentido, observaciones hechas muchos años atrás son permanentemente retomadas con otras metodologías, nuevos diseños y renovados ‘votos de investigación’, dando lugar a hipótesis atractivas.
Una de estas ‘puntas’ ha sido el estudio del VIP durante la gestación, ya no en cuanto a su papel como factor trófico en el desarrollo embrionario, sino porla posible contribución a la gestación desde el lado materno. Trabajos de distintos laboratorios con líneas celulares trofoblásticas y placenta humanas [11,12] mostraron la actividad del péptido al unirse a receptores VPAC y sus vías de señalización intracelular; al mismo tiempo, en embarazo en mujeres y en modelos de gestación en animales se midieron sus niveles plasmáticos y se vio que, especialmente en rata y ratón, un aumento de VIP sérico materno precede al VIP embrionario [13-15]. En este marco pudimos aportar información original acerca de su papel como inmunomodulador en la interfase materno-placentaria, ya actuando sobre células de la respuesta innata como monocitos, macrófagos y neutrófilos; o en la respuesta adaptativa, induciendo un perfil tolerogénico demostrado en diseños in vitro con células humanas y en modelos animales [17-21].
En 2010, el Profesor Gil Mor de la Universidad de Yale en New Haven, Estados Unidos, propuso una nueva visión acerca del control de la respuesta inmunológica durante la gestación [22]. A la mirada clásica según la cual la gestación es un estado de inmunosupresión, el Dr. Mor ha contrapuesto la idea de que la gestación es un estado de inmuno-cooperación materno-placentaria con un equilibrio dinámico signado por el mantenimiento de la homeostasis inmunológica. Según este esquema (figura 2), al comenzar el segundo trimestre se da un cambio de perfil de respuesta eminentemente pro-inflamatoria a uno anti-inflamatorio que acompaña a la madre y el feto hasta pocos días antes del parto y asegura el adecuado crecimiento fetal.
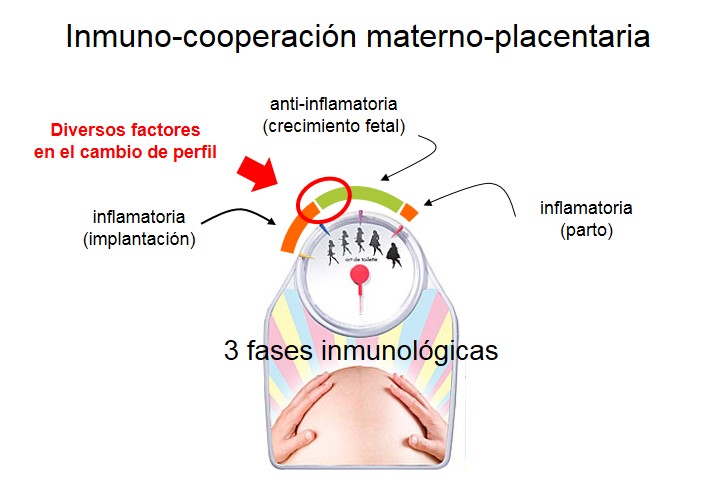
Figura 2: Desde el punto de vista inmunológico el curso del embarazo en mujeres transcurre en 3 etapas. Se distinguen 3 fases inmunológicas: la primera en la prevalece un perfil, pro-inflamatorioabarca desde la implantación hasta iniciado el segundo trimestre. La segunda es la más extensa y predomina un perfil anti-inflamatorio, y la tercera es la más corta con un perfil pro-inflamatorio en que se prepara el útero para el momento del parto. El óvalo y la flecha roja señalan el cambio de perfil inmunológico,caracterizado por numerosos factores y procesos que intervienen para favorecer mecanismos anti-inflamatorios y tolerogénicos.
Se pudo comprobar que en el pasaje de un perfil al otro intervienen numerosos mediadores y tipos celulares, muchos de ellos en circuitos redundantes, que aseguran este correcto ‘switch’. Y hay mucho interés en conocer más acerca de estos factores ya que su modulación podría servir en el tratamiento, o para el diagnóstico, de complicaciones del embarazo que cursan con disfunción placentaria, trastornos vasculares y aumento de la respuesta inflamatoria. En este sentido, trabajos recientes del laboratorio nuestro sostienen la hipótesis que el VIP, sintetizado por células trofoblásticas entre otras células de la interfase, tiene un papel clave en ese cambio de perfil, modulando el estado de activación de monocitos y macrófagos reclutados en alta proporción durante toda la gestación a la interfase[17-19]. De la misma manera, demostramos en colaboración con la Dra. AnalíaTrevani de la Academia Nacional de Medicina, IMEX-CONICET y la Facultad de Medicina de la UBA, que las células trofoblásticas desactivan a los neutrófilos para la formación de redes extracelulares y favorecen su apoptosis a través de mecanismos mediados por el VIP [20]. Más aún, pudimos demostrar que el VIP actúa en circuitos autocrinos para regular funciones de las células trofoblásticas como la invasividad o su capacidad migratoria, necesarias para la placentación. Al mismo tiempo, el VIP de esas células actuaría paracrinamente para regular la función de las células fagocíticas, favoreciendo una adecuada eliminación de desechos celulares que podrían resultar deletéreos para la salud de la madre y el crecimiento fetal [17, 21]. Un resumen de los mecanismos propuestos se esquematiza en la figura 3:
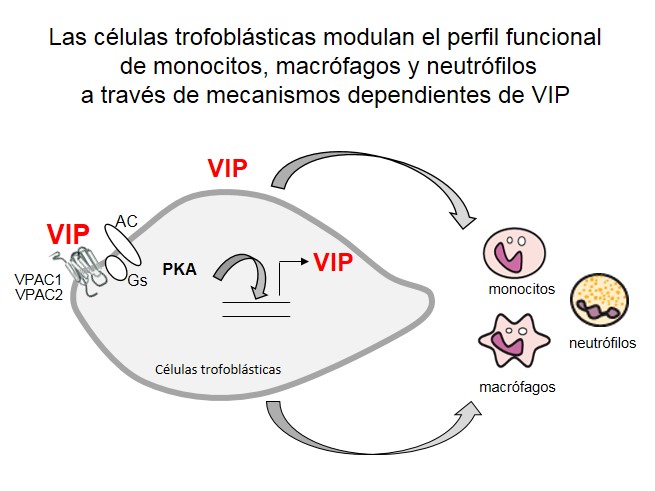
Figura 3: Mecanismos de interacción de células trofoblásticas y células inmunes con la participación del VIP. Las células trofoblásticas se diferencian a un perfil con capacidad de migrar e invadir. Se propone que el VIP, actuando sobre las células trofoblásticas libera diversos factores, incluido VIP endógeno, que en circuitos autocrinos y paracrinos modula la función de células vecinas. PKA: proteína kinasa A; AC: adenililcliclasa; Gs: proteína G estimulatoria
Consideraciones finales
Afortunadamente, todo indica que queda mucho por descubrir acerca del VIP como péptido endógeno y muchas estrategias para avanzar en sus posibles aplicaciones a la medicina y a la farmacología.Un progreso considerable, por ejemplo, se ha informado en el campo de VIP y cáncer. En particular, su efecto como factor de crecimiento por transactivación de receptores de la familia del factor de crecimiento epidérmico. Los receptores VPAC1 y VPAC2 se sobre expresan en tumores comunes en humanos como neuroblastoma, cáncer de próstata, pulmón y mama, incluso se intenta usarlos como un medio para localizar el tumor in vivo y evaluar su tamaño[23].
Su perfil de actividad tan variado en cuanto a tipos celulares y sistemas sobre los que actúa, como su estructura lábil a la ruptura por proteasas, siguen desafiando a investigadores en las áreas de Bioquímica y Farmacología Molecular para obtener congéneres con mayor eficacia y selectividad y que a su vez ofrezcan un mejor perfil de seguridad.En otra línea, numerosos grupos de investigación continúan analizando el potencial de esta molécula endógena para predecir o establecer nuevos parámetros de diagnóstico y seguimiento de enfermedades con un fuerte componente inflamatorio.
(*) Nota de las autoras: la traducción de las palabras del Profesor Said en su perspectiva fueron hechas con el mayor empeño en ser fieles a las frases escritas y -aunque sin haberlo conocido personalmente- con la admiración hacia el maestro que describieron muchos colegas cuando falleció en 2013, unos meses antes del XI Simposio Internacional de VIP, PACAP y péptidos relacionados realizado en Pecs, Hungría.
Agradecimientos
Como Directoras del Laboratorio de Inmunofarmacología estamos agradecidas por el trabajo dedicado de los investigadores, becarios doctorales y estudiantes que desde 2007 trabajan en los efectos del VIP en el embarazo. Especialmente agradecemos su compromiso con la investigación, con la ciencia de calidad, como también el buen humor y compañerismo con que comparten unos metros cuadrados de laboratorios, unos metros lineales de mesadas, todos los equipos y reactivos.
Agradecemos a todos nuestros colaboradores, argentinos y extranjeros, y en particular a tres de ellos JW, RG y GM aludidos aquí por ser fundantes en el tema del VIP y de la gestación.
Nuestro reconocimiento a la Facultad de Ciencias Exactas y Naturales de la UBA y a nuestro Departamento de QuímicaBiológica e IQUIBICEN por darnos un lugar para aportar conocimiento y experiencia. Al CONICET y a la UBA por sostener nuestra tarea de investigación como investigadoras y docentes, como también a través de becas y subsidios y al FONCyT por el financiamiento de los proyectos.
Referencias:
1. Said S (2007)The discovery of VIP: Initially looked for in the lung, isolated from intestine, and identified as a neuropeptide Peptides 28: 1620–1621.
2. Harmar AJ, Fahrenkrug J, Gozes I, Laburthe M, May V, Pisegna JR, Vaudry D, Vaudry H, Waschek JA, Said S (2012). Pharmacology and functions of receptors for vasoactive intestinal peptide and pituitary adenylatecyclase-activating polypeptide: IUPHAR Review 1 Br J Pharmacol 166: 4-17
3. Couvineau A, Laburthe M (2012) VPAC receptors: Structure, molecular pharmacology and interaction with accessory proteins Br J Pharmacol 166: 42-50.
4. Dickson L, Finlayson K (2009)VPAC and PAC receptors: From ligands to function. Pharmacol Ther 121: 294-316.
5. Waschek JA (2013). VIP and PACAP:neuropeptide modulatorsof CNS inflammation,injury, and repair Br J Pharmacol 169: 512–523.
6. Colwell CS1, Michel S, Itri J, Rodriguez W, Tam J, Lelievre V, Hu Z, Liu X, Waschek JA (2003) Disrupted circadian rhythms in VIP- and PHI-deficient mice Am J Physiol Regul Integr Comp Physiol 285:R939-49
7. Maduna T, Lelievre V (2016) Neuropeptides shaping the central nervous system development: Spatiotemporal actions of VIP and PACAP through complementary signaling pathways J Neurosci 94:1472-1487.
8. Abad C, Gomariz RP, Waschek JA (2006) Neuropeptide mimetics and antagonists in the treatment of inflammatory disease: focus on VIP and PACAP Curr Top Med Chem 6:151-63
9. Delgado M, Ganea D (2013)Vasoactive intestinal peptide: a neuropeptide with pleiotropic immune functions Amino Acids 45: 25-39.
10. González-Álvaro I, Ortiz AM, Seoane IV, García-Vicuña R, Martínez C, Gomariz RP (2015) Biomarkers predicting a need for intensive treatment in patients with early arthritis Curr Pharm Des 2015;21(2):170-81
11. Deutsch PJ, Sun Y, Kroog GS (1990). Vasoactive Intestinal Peptide Increases Intracellular CAMP andGonadotropin-a Gene Activity in JEG-3 Syncytial Trophoblasts J Biol Chem 265: 10274-10281
12. Marzioni D, Fiore G, Giordano A, Nabissi M, Florio P, Verdenelli F, Petraglia F, Castellucci M (2005). Placental Expression of Substance P and Vasoactive Intestinal Peptide: Evidence for a Local Effect on Hormone Release J Clin Endocrinol Metab 90:2378–2383
13. Ottesen B, Ulrichsen H, Fahrenkrug J, Larsen JJ, Wagner G, Schierup L, Søndergaard F(1982) Vasoactive intestinal polypeptide and the female genital tract: relationship to reproductive phase and delivery Am J Obstet Gynecol 143:414-420
14. Spong CY, Lee SJ, Mccune SK, Gibney G, Abebe DT, Alvero R, Brenneman DE, Hill JM (1999). Maternal Regulation of Embryonic Growth: The Role ofVasoactive Intestinal Peptide Endocrinology 140: 917-924
15. Hill JM, McCune SK, Alvero R, Glazner GW, Henins KA, Stanziale SF, Keimowitz JR, Brenneman DE (1996). Maternal Vasoactive Intestinal Peptide and the Regulation of Embryonic Growth in the Rodent J Clin Invest 97:202–208
16. Vota D, Paparini D, Hauk V, Toro A, Merech F, Varone C, Ramhorst R, Pérez Leirós C (2016).Vasoactive Intestinal Peptide modulates trophoblast-derived cell line function and interaction with phagocytic cells through autocrine pathways Sci Rep 6:26364. doi: 10.1038/srep26364
17. Paparini D, Grasso E, Calo G, Vota D, Hauk V, Ramhorst R, Perez Leirós C(2015). Trophoblast cells primed with vasoactive intestinal peptide enhance monocyte migration and apoptotic cell clearance through αvβ3 integrin portal formation in a model of maternal-placental interaction Mol Hum Reprod 21:930-41
18. Calo G, Sabbione F, Vota D, Paparini D, Ramhorst R, Trevani A, Pérez Leirós C (2017) Trophoblast cells inhibit neutrophil extracellular trap formation and enhance apoptosis through vasoactive intestinal peptide-mediated pathways Hum Reprod 32:55-64
19. Hauk V, Azzam S, Calo G, Gallino L, Paparini D, Franchi A, Ramhorst R, Pérez Leirós C (2014). Vasoactive intestinal peptide induces an immunosuppressant microenvironment in the maternal-fetal interface of non-obese diabetic mice and improves early pregnancy outcome Am J Reprod Immunol 71:120-30.
20. Gallino L, Calo G, Hauk V, Fraccaroli L, Grasso E, Vermeulen M, Perez Leirós C, Ramhorst R (2016) VIP treatment prevents embryo resorption by modulating efferocytosis and activation profile of maternal macrophages in the CBAxDBA resorption prone model Sci Rep 6:18633. doi: 10.1038/srep18633
21. Vota D, Aguero M, Grasso E, Hauk V, Gallino L, Soczewski E, Pérez Leirós C, Ramhorst R (2017) Progesterone and VIP cross-talk enhances phagocytosis and anti-inflammatory profile in trophoblast-derived cells Mol Cell Endocrinol 443: 146-154
22. Mor G, Cardenas I (2010) The immune system in pregnancy: A unique complexity Am J Reprod Immunol 63:425-433.
23. Moody TW, Nuche-Berenguer B, Jensen RT (2016). Vasoactive intestinal peptide/pituitary adenylatecyclase activating polypeptide, and their receptors and cancer Curr Opin Endocrinol Diabetes Obes 23:38-47.
|
Revista QuímicaViva Número 2, año 14, Agosto 2015 quimicaviva@qb.fcen.uba.ar |