Evaluación de la electrocoagulación en el tratamiento de agua potable
Jesús Rafael Perozo Cuicas1, Rebeca Lisbeth Abreu Cuadra 2
1Departamento de Energética y 2Departamento de Química Universidad Nacional Experimental “Francisco de Miranda” Falcón. Venezuela
jrpcuicas@gmail.com , rebekabreu@gmail.com
Recibido: 27/02/2017 - Aceptado: 04/04/2017
Resumen
Con el incremento de la cantidad de contaminantes presentes en el agua se hace necesaria la implementación de nuevas alternativas que presenten una solución eficiente, económica y accesible para las plantas de potabilización y la comunidad en general. La presente investigación propuso la evaluación de las variables necesarias para el proceso de electrocoagulación en el tratamiento de aguas crudas, mediante el establecimiento de una celda electrolítica con diferentes configuraciones ánodo- cátodo evaluando así los porcentajes de remoción para así determinar la eficiencia del proceso. Se realizaron estudios a escala de laboratorio usando una celda electrolítica de capacidad de 1L, con electrodos de hierro, aluminio y acero inoxidable donde se producen hidróxidos de hierro y aluminio los cuales actúan como coagulantes. Se determinaron los porcentajes de remoción de color, turbidez y sólidos totales, para una configuración aluminio - acero inoxidable y para la segunda configuración hierro - acero inoxidable. Se aplicó un diseño 2K con una sola réplica y un análisis multivariado de varianza usando el software estadístico Insfostat/Profesional. Los resultados mostraron que las eficiencias en remoción de turbidez y color utilizando ánodo de aluminio fueron de un 40% a un 80% bajo las mejores condiciones de voltaje aplicado, separación entre los electrodos y tiempo de tratamiento. Sin embargo, los porcentajes con ánodo de hierro oscilan en un rango de 10% a 50% en las mejores condiciones del sistema estudiado. El análisis de varianza determino que existe una diferencia significativa al modificar el metal anódico. Los resultados mostraron que hay una buena correlación entre los hidróxidos de metales formados en la coagulación electroquímica y la reducción de los dos principales contaminantes evaluados del agua cruda como lo son la turbidez y el color.
Palabras clave: electrocoagulación, tratamiento de agua, celda electrolítica.
Evaluation of electrocoagulation in drinking water treatment
Summary
Due to the increase of the amount of contamination in water, it is necessary to implement new alternatives to provide an efficient, economic and accessible solution for the drinking water plants and the community in general. This research had as its aim to evaluate the necessary variables for the electro- coagulation process in the treatment of no treated waters through the establishment of an electrolytic cell with different anode- cathode settings which evaluate the percentages of stirring to determine the effectiveness and efficiency of the process. Two laboratory studies were carried out by using an electrolytic cell of 1L of capacity, iron electrodes, aluminum and stainless steel electrodes which produce iron and aluminum hydroxides which behave as coagulants. The percentages of color removal, turbidity and total solids were determined for the aluminum - stainless steel configuration and for the second iron - stainless steel configuration. We applied a 2K design with a single replicate and a multivariate analysis of variance using the statistical software Insfostat/Profesional. The results showed that the turbidity and color removal efficiencies using aluminum anode were 40% to 80% under the best conditions of applied voltage, separation between the electrodes and treatment time, however, the percentages with anode of Iron oscillate in a range of 10% to 50% under the best conditions of the studied system. The analysis of variance determined that there is a significant difference when the anodic metal is modified. The results showed that there is a good correlation between the hydroxides of metals formed in the electrochemical coagulation and reduction of the two main pollutants evaluated from raw water such as turbidity and color.
Keywords: electro-coagulation, treatment water, electrolytic cell.
Introducción
Los recursos de agua dulce del planeta constituyen solo una pequeña porción del ciclo hidrológico y están alimentados por la precipitación en forma de lluvia y nieve [1]. La demanda de agua dulce y energía continuará creciendo significativamente en las próximas décadas para satisfacer las necesidades de poblaciones y economías en crecimiento, aumentando la presión existente sobre los recursos naturales no renovables y los ecosistemas. Se prevé que la demanda mundial de agua (en términos de extracción de agua) aumentará cerca de un 55 % para el año 2050. Como resultado, la disponibilidad de agua dulce estará bajo mayor presión durante este período, y las previsiones apuntan a que más de un 40 % de la población mundial vivirá en zonas con severos problemas hídricos para el 2050 [2]. En muchos países, particularmente en zonas áridas, las aguas freáticas son de vital importancia para el sustento y la salud de la mayoría de la población, pues proporcionan casi toda el agua necesaria para uso doméstico, agrícola e industrial [3].
El término de calidad de agua es relativo y solo tiene importancia universal si está relacionado con el uso del recurso. Para decidir si un agua califica para un propósito particular, su calidad debe especificarse en función del uso que se le va dar. Bajo estas condiciones, se dice que un agua está contaminada cuando sufre cambios que afecta su uso real o potencial [4].
Los tratamientos de agua para adaptarla a distintos usos con fines específicos juegan un papel muy importante en la actualidad. Son necesarias tecnologías cada vez más confiables, selectivas, eficientes y económicas para que el acceso a la misma sea mayor. Mientras que la cantidad total de agua permanece constante, su demanda es creciente día a día. Este aumento en la demanda, no solo es en cantidad sino también en calidad y la contaminación que las personas producimos en el agua de superficie o subterránea, aumenta en forma alarmante el problema de disponibilidad [5]. La finalidad de las operaciones de tratamiento y potabilización es obtener aguas con las características adecuadas al uso que se les dé, por lo que la combinación y naturaleza exacta de los procesos varía en función tanto de las propiedades de las aguas de partida como de su destino final [6].
En el tratamiento de aguas, La electrocoagulación (EC) es una tecnología de tratamiento que ha empezado a tomar auge en las últimas décadas, aunque su desarrollo se llevó a cabo a principios del siglo pasado y fue patentada en los Estados Unidos en 1909. En su forma más sencilla un reactor de electrocoagulación es una celda electrolítica constituida por un ánodo y un cátodo, conectando los electrodos a una fuente de poder externa [7]. La EC se convierte en un proceso electroquímico que puede tener resultados exitosos en su aplicación optimizando los factores que lo conforman, alcanzando el reto de proteger, conservar y recuperar el recurso hídrico. La electroquímica ofrece una serie de beneficios que en muchos casos se pueden capitalizar para lograr procesos verdes. En ellos, la cantidad de desechos emitidos al medio ambiente se minimiza a través del diseño de pasos en donde la cantidad de subproductos sea la mínima, así como el consumo de materias primas y de energéticos [8].
El proceso de EC se lleva a cabo en tres etapas:
- Inicialmente se forma el coagulante por oxidación electrolítica del metal en el ánodo.
- Se desestabilizan los contaminantes y emulsiones.
- Finalmente, se producen flóculos por agrupación de partículas del contamínate o adsorción en el flóculo de compuestos químicos presentes en la solución [9].
La tecnología de electrocoagulación es considerada normalmente como una técnica beneficiosa para el ambiente. Este proceso también es aplicado para la síntesis de diferentes compuestos orgánicos e inorgánicos, recuperación de suelos contaminados, desalación de disoluciones, regeneración de oxidantes, reductores, bases y ácidos por su gran economía y variedad [10]. En esta técnica, el empleo de electrones como reactivo es útil no solo para suprimir el uso de reductores y oxidantes cuyos productos de oxidación o reducción suelen ser contaminantes, sino que también reduce el número de etapas en la síntesis de diferentes compuestos disminuyendo de esta forma la contaminación originada por el proceso químico. “Si se centra en su aspecto ambiental, las posibilidades de aplicación de la tecnología electroquímica son muy variadas” [11].
Según algunos autores, las principales ventajas de la EC sobre el método de coagulación química que se reportan son las siguientes: la EC requiere equipos relativamente simples, es fácil de utilizar y su operación es flexible [12-13]. Los procesos electroquímicos tienen ventajas en la compatibilidad con el ambiente, una mayor eficiencia termodinámica, mejor selectividad y versatilidad, adicionalmente tienen menores costos por unidad de carga y requieren mantenimientos más sencillos [8].
La electrocoagulación ocurre cuando los iones metálicos formados por oxidación en el ánodo reaccionan con OH- producidos en el cátodo por reducción del H2O a H2. Los hidróxidos formados (rigurosamente, un óxido hidratado generalmente de hierro o aluminio trivalentes) actúan como agentes floculantes y adsorbentes del contaminante, por lo que en EC son frecuentemente utilizados electrodos de hierro o de aluminio. Los iones de aluminio hidrolizado pueden formar largas cadenas de Al-O-Al-OH las cuales pueden adsorber químicamente una gran cantidad de contaminantes [14]. Para el caso en el cual el hierro actúa como ánodo, se han propuesto dos mecanismos que explican la formación in situ de dos posibles coagulante. Estos pueden ser hidróxido ferroso Fe(OH)2 o férrico Fe(OH)3 [15]. Como consecuencia de la electrólisis se forma también O2 en el ánodo, lo que sumado al H2 producen finas burbujas que arrastran a los hidróxidos metálicos con el contaminante hacia la superficie del líquido, donde se concentran y pueden ser colectados y removidos fácilmente mediante una cámara de flotación y un colector de espumas [16]. Durante la formación de los hidróxidos metálicos, la generación de los iones está acompañada de la concentración electroforética de partículas alrededor del electrodo, las cuales neutralizan su carga coagulando. La corriente aplicada obliga a los iones OH- a migrar hacia el ánodo, por lo que el pH en la capa límite es más alto que en el resto de la solución, lo que favorece la formación de hidróxidos del metal del electrodo [13].
Los principales factores que influyen en la eficiencia del proceso de electrocoagulación según algunos autores son: pH, tiempo de residencia, conductividad, material de los electrodos, separación entre electrodos e intensidad de corriente [12, 13, 16, 17]. El material de los electrodos varía de acuerdo al tipo de sistema utilizado, estos pueden ser de hierro, de aluminio, cobre, acero o aleaciones de aluminio y magnesio. Los electrodos son de sacrificio, según la Ley de Faraday, debido a que en el proceso electrolítico migran hacia el seno del agua residual los iones que desestabilizan los coloides. La eficiencia de los electrodos depende de la concentración, tipo de contaminante y la velocidad de agitación. [18]
En el estado Falcón – Venezuela, la empresa encargada de la potabilización del agua es Hidrofalcón, organización que desde su fundación presta un servicio hidrosanitario a través de su línea de negocio que abarca desde la captación del agua cruda de los embalses, la potabilización, la distribución del agua potable y su comercialización, hasta la recolección y saneamiento de las aguas servidas en el estado [19]. Esta empresa realiza una considerable inversión anual de dinero en el uso de coagulantes en el proceso de floculación como el sulfato de aluminio y policloruro de aluminio para el procesamiento del agua. En algunas regiones de nuestro estado, se encuentran innumerables comunidades que utilizan el agua procedente de acuíferos o pozos para el consumo humano, sin ser éstas sometidas a ningún tratamiento de potabilización o desinfección, hecho que afecta con mayor impacto la salud e higiene de los niños y adulto mayores de dichas comunidades, así como también, el desarrollo productivo y social de las mismas.
En el presente estudio, se planteó la evaluación de la electrocoagulación química en el tratamiento del agua cruda de la planta de potabilización “Ing. Luís Martín Martínez” a escala de laboratorio. En su desarrollo, se establecieron los parámetros fisicoquímicos más determinantes para la calidad en las aguas crudas de dicho embalse que fueron objeto de análisis y pruebas que hicieron optimizar el proceso desarrollado.
Materiales y métodos
Se realizaron 6 muestreos de 18.5 L de agua cruda en la toma muestra de entrada a la planta de potabilización y se delimitaron los parámetros fisicoquímicos de mayor importancia mediante datos proporcionados por la empresa Hidrofalcón. La determinación de las propiedades fisicoquímicas de interés se efectuó siguiendo la metodología analítica descritas en el Standard Methods [20]: color (Espectrofotométrica SM-2120-C), turbidez (Nefelométrico SM-2130-B), sólidos totales (Gravimétrico SM-2540-B).
Se implementó una celda electrolítica a escala de laboratorio tipo batch con capacidad de un litro (1 L) conectada a una fuente de poder y se realizaron mediciones de pH al inicio de cada experimento. El esquema se muestra en la Figura 1.
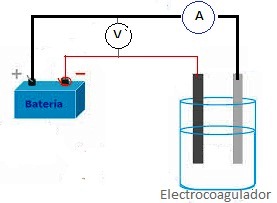
Figura 1: Esquema del circuito eléctrico y celda electrolítica a escala de laboratorio.
Las variables o factores evaluados en la electrocoagulación fueron potencial aplicado, arreglo de los electrodos, separación de placas y tiempo de electrolisis, todos con dos niveles. La investigación se condujo mediante un diseño al azar con arreglo factorial fraccionado 24, es decir, 4 factores que tienen dos niveles cada uno, es un diseño que permite elegir adecuadamente una parte o fracción de los tratamientos de un diseño factorial completo con el fin de estudiar el efecto de los factores utilizando menos corridas experimentales. Los experimentos se desarrollaran de forma aleatoria para evitar el efecto de las variables no controladas evitando sesgar los resultados [21]. La información básica se resume en la siguiente tabla:
Tabla 1. Información de las variables del diseño de experimento.
| Factores | Nivel bajo | Nivel alto | Unidades |
| Potencial | 2 | 4 | V |
| Arreglo de electrodos | Aluminio – acero inoxidable | Hierro– acero inoxidable | - |
| Separación de placas | 1 | 2 | cm |
| Tiempo | 1 | 10 | min |
En el análisis de los datos experimentales se empleó Microsoft Office Excel y los resultados de las remociones de color y turbidez se compararon mediante un análisis multivariado de varianza usando el software estadístico Insfostat/Profesional. La geometría de los electrodos utilizados para cada prueba se presenta a continuación:
Tabla 2. Condiciones de los electrodos establecidas para los análisis de agua cruda.
| Tipo de placa o eléctrodo | Espesor | Largo Ancho | Peso | |
| Aluminio | 3 mm | 11.9 cm | 4 cm | 36.6480 g |
| Hierro | 3 mm | 11.7 cm | 3.2 cm | 96.8984 g |
| Acero Inoxidable | 1 mm | 11.7 cm | 3.1 cm | 12.5395 g |
Resultados y discusiones
Los resultados obtenidos en la remoción de las propiedades fisicoquímicas turbidez, color y sólidos totales aplicando la técnica de electrocoagulación se resumen en la Tabla 3.
En el ánodo de aluminio a un voltaje inicial de 2V se apreció una remoción de las variables de respuestas turbidez y color desde el primer minuto de comenzada la electrolisis de 74,9% y 69,7% respectivamente, sin embargo, a medida que transcurrió el tiempo el sistema tiende a estabilizarse obteniendo un promedio de remoción de turbidez de 73,9% y color de 73,2 % entre 1 y 10 minutos a una separación de 1 cm entre placas. Al aplicar un voltaje mayor en la celda (4V) el mejor porcentaje de remoción obtenido para turbidez fue de 24,5% y para el color 57,3% en un tiempo de exposición de 1 minuto.
Tabla 3. Eficiencia en remoción en turbidez, color y solidos totales (ST).
| Ánodo | Distancia Entre Placas (cm.) | Voltaje Aplicado(V) | pH | Tiempo de Exposición (min.) | % Rem1. Turbidez | % Rem. Color | % Rem. ST |
| Al | 1 | 2 | 7-8 | 1 | 74,9 | 69,7 | 12,50 |
| 10,00 | 72,8 | 76,6 | |||||
| 4 | 7-8 | 1 | 24,5 | 57,3 | 17,32 | ||
| 10,00 | 22,9 | 46,9 | |||||
| 2 | 2 | 7-8 | 1 | 34,0 | 38,6 | 16,88 | |
| 10,00 | 43,4 | 45,9 | |||||
| 4 | 7-8 | 1 | 43,7 | 48,0 | 11,18 | ||
| 10,00 | 45,5 | 44,4 | |||||
| Fe | 1 | 2 | 7-8 | 1 | 6,0 | 17,0 | 21,24 |
| 10,00 | 4,8 | 12,2 | |||||
| 4 | 7-8 | 1 | 12,3 | 10,7 | 5,98 | ||
| 10,00 | 22,0 | 5,8 | |||||
| 2 | 2 | 7-8 | 1 | 16,5 | 50,4 | 6,15 | |
| 10,00 | 24,2 | 49,4 | |||||
| 4 | 7-8 | 1 | 35,5 | 39,9 | 11,27 | ||
| 10,00 | 23,3 | 31,55 |
1:Remoción
En cuanto el electrodo de hierro los resultados arrojaron remociones de turbidez y color menores en comparación con el ánodo de aluminio, resultando la mayor remoción en turbidez de 35,5% con un voltaje aplicado de 4V, separación de 2 cm y tiempo de 1 minuto. En el caso del color la mayor remoción registrada fue de 50,4% con un voltaje aplicado de 2V, separación de 2 cm y tiempo de 1 minuto.
Por otra parte, los sólidos totales presentaron un comportamiento muy cercano entre ellos como se muestra en la Tabla 3, lo que indica que el agua proveniente del proceso electrolítico no aporta gran cantidad de los mismos.
Se efectuaron experimentos adicionales tomando tiempos de EC aplicados a la muestra de agua cruda de 1 min, 5 min, 10 min, 20 min, para evaluar el tiempo de electrolisis. Sin embargo, al obtener los resultados se tomaron 1 min y 10 min como los tiempos óptimos, al observar que las variables de respuestas tienden a estabilizarse después de los 10 minutos de exposición al proceso electrolítico.
Se realizó un análisis de varianza multivariado para el estudio de los efectos sobre la variables turbidez y color, con el software estadístico InfoStat. Obteniéndose el análisis de varianza que se muestra en la Tabla 4.
Tabla 4. Análisis de la Varianza multivariado
| Cuadro de Análisis de la Varianza (Lawley-Hotelling) | |||||
| F.V. | Estadístico | F | gl(num) | gl(den) | p |
|---|---|---|---|---|---|
| Ánodo | 1,17 | 5,85 | 2 | 10 | 0,0207 |
| Distancia | 0,06 | 0,29 | 2 | 10 | 0,7553 |
| Voltaje | 0,12 | 0,59 | 2 | 10 | 0,5705 |
| Tiempo | 0,02 | 0,11 | 2 | 10 | 0,8970 |
| Test: Hotelling Alfa: 0,05 Error: Matriz de covarianzas común gl: 11 |
|||||
| Ánodo | % Rem1. Turbidez | % Rem. Color | n | |
|---|---|---|---|---|
| Al | 45,20 | 53,41 | 8 | A |
| Fe | 18,06 | 27,13 | 8 | B |
| Letras distintas indican diferencias significativas (p<=0,05) | ||||
| Distancia | % Rem. Turbidez | % Rem. Color | n | |
|---|---|---|---|---|
| 1,00 | 30,01 | 37,02 | 8 | A |
| 2,00 | 33,25 | 43,53 | 8 | A |
| Letras distintas indican diferencias significativas (p<=0,05) | ||||
| Voltaje | % Rem. Turbidez | % Rem. Color | n | |
|---|---|---|---|---|
| 2,00 | 34,57 | 44,96 | 8 | A |
| 4,00 | 28,69 | 35,58 | 8 | A |
| Letras distintas indican diferencias significativas (p<=0,05) | ||||
| Tiempo | % Rem. Turbidez | % Rem. Color | n | |
|---|---|---|---|---|
| 1,00 | 30,90 | 41,45 | 8 | A |
| 10,00 | 32,35 | 39,10 | 8 | A |
| Letras distintas indican diferencias significativas (p<=0,05) | ||||
1:Remoción
El análisis de reducción de datos arrojó que existe una diferencia significativa con un valor p<0.05 para el uso del material anódico, los electrodos de aluminio con una media de 45,20% en la remoción de turbidez y 53,41% en la remoción de color, con respecto al de hierro con 18,06% y 27,13% en la remoción de turbidez y color respectivamente. Muchos autores han determinado la eficiencia del uso de electrodos de hierro en el tratamiento de aguas residuales [13, 17, 23] y el uso de electrodos de hierro en la reducción de la dureza del agua [24], sin embargo, en la disminución de la turbidez y color del agua cruda los electrodos de hierro resultaron menos eficientes. Se evidenció que los electrodos de hierro producen una mayor turbidez y coloración en el agua cruda durante el tratamiento y aumenta a medida que transcurre el tiempo. La generación de iones está acompañada por la concentración electroforética de partículas alrededor del electrodo, las cuales neutralizan su carga coagulando. La corriente aplicada induce a los iones OH- a migrar hacia el ánodo, por lo que el pH cerca de éste es más alto que en el resto de la solución, lo que favorece la formación de hidróxido férrico. El Fe(OH)3 forma un coloide color café rojizo y, dependiendo del pH y de la disponibilidad de iones ferrosos, puede reaccionar con el O2 disuelto para dar Fe3O4 [12].
La Figura 2 muestra un grafico de barra con los porcentajes de remoción y desviación estandar para la turbidez y color comparando el material anodico utilizado, encontrándose que la mayor remoción se obtuvo con el ánodo de aluminio.
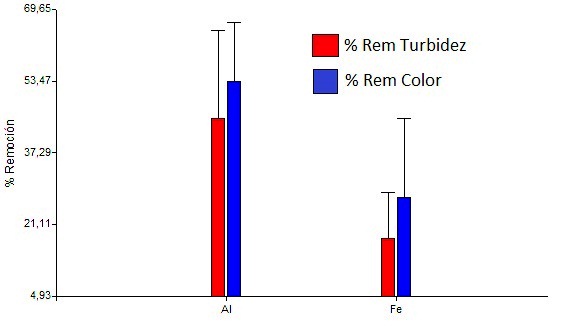
Figura 2: Porcentajes de remoción de turbidez y color utilizando ánodos de aluminio y hierro.
En la Tabla 4 los resultados estadísticos establecieron que no existen diferencias significativas en la variable de respuesta cuando se cambió la distancia de separación entre las dos placas. Se ha observado que cuando en el reactor se usan solo dos placas, una como ánodo y otra como cátodo, no se presenta buena disolución de iones metálicos. Para mejorar esta disolución se debe aumentar el área superficial de los electrodos, lo cual se logra aumentando el número de placas [13]. Otra investigación estableció una relación entre el área superficial del electrodo y la distancia entre las placas, mientras mayor es el área del electrodo aumenta el área de interfaz de transferencia electrónica y por lo tanto la distancia de separación entre los electrodos no tiene mucha influencia [22].
La variación del potencial aplicado no reportó una diferencia significativa de acuerdo al análisis estadístico, ocurriendo mayor remoción de contaminantes a 2V. A medida que se aumenta el potencial se favorece la reducción del agua originando burbujas de H2 (g) en el cátodo disminuyendo el área efectiva de oxidación, con base en consideraciones termodinámicas, en el proceso de electrólisis del agua a temperatura ambiente se requiere de un diferencial de potencial de 1.23V para cualquier valor de pH [8]. En cuanto al cambio del factor tiempo de electrólisis, ocurrió una producción de agente coagulante desde al primer minuto de iniciado el tratamiento para los dos materiales anódicos evaluados, sin embargo, las letras iguales del análisis estadístico revelan que no existió diferencia significativa en las pruebas desarrolladas con los tiempo de 1 y 10 minutos. Los electrodos de hierro requieren de un 50% mayor de tiempo en comparación con el ánodo de aluminio para alcanzar una remoción eficiente [22].
Se realizó un análisis estadístico de varianza para observar el comportamiento de los tratamientos con las interacciones de los factores ánodo, voltaje y separación entre las placas, sin evaluar el efecto del tiempo de electrólisis.
El análisis estadístico confirma que el tratamiento con mayor eficiencia en remoción de la turbiedad y el color se alcanzó en el primer tratamiento con las interacciones ánodo de aluminio, a un voltaje de 2V y con la menor separación de placas. Los resultados se visualizan en la Figura 3.
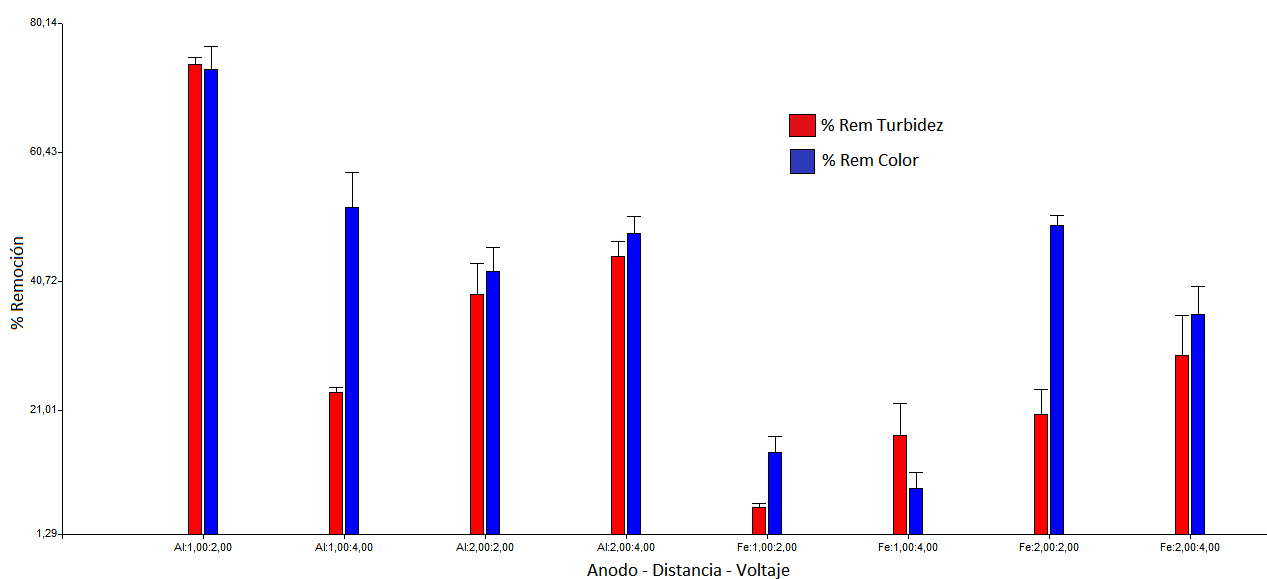
Figura 3: Porcentaje de remoción de turbidez y color en función de las interacciones de los factores.
El comportamiento estadístico explica las condiciones óptimas para el tratamiento del agua cruda evidenciándose una mayor remoción que favorece la propiedad turbidez con respecto al color en las condiciones de ánodo de aluminio, una distancia de 1 cm, un potencial de 2 V en un tiempo muy rápido de 10 min. En el grafico se demuestra que los electrodos de hierro son los menos eficientes pero mantienen un comportamiento más estable en la remoción en comparación al electrodo de aluminio.
Los resultados de esta investigación en cuanto a los electrodos se asemejan a los obtenidos [16] quienes comprobaron que los mejores electrodos de trabajo son los de aluminio, ya que con su empleo se logra una mayor remoción de color y se remueven más sólidos con un menor consumo de energía que cuando se emplean los electrodos de hierro. De igual manera, desde el punto de vista económico también resultan los mejores, al garantizar valores técnicamente factibles para un costo de operación más bajo.
Conclusiones
La electrocoagulación es un sistema de tratamiento eficiente y con perspectivas interesantes para la eliminación de diferentes tipos de contaminantes en el agua. Sin embargo, hay que tomar en cuenta que es susceptible a diferentes parámetros de operación que pueden modificar su eficiencia y variar los costos de operación.
El ánodo y el cátodo que presentaron mayores porcentajes de remoción de color y turbidez tenían la configuración aluminio-acero inoxidable.
Debido a la electrólisis del agua se produce un desprendimiento de oxígeno e hidrógeno gaseoso en los electrodos, los cuales al ascender a la superficie provocan fenómenos como la separación rápida de coloides del electrodo y la formación de una nata en la superficie fácilmente extraíble por medios mecánicos entre otros.
La remoción general alcanzada de color y turbidez en el agua cruda estudiada es muy significativa, confirmando el poder de la corriente eléctrica en desestabilizar el equilibrio eléctrico que presentan, provocando la precipitación de sus componentes.
Por último cabe destacar que, sin duda alguna la necesidad de proveer agua de calidad para satisfacer el incremento acelerado de la demanda mundial y la crisis por el recurso hídrico, crean un desafío que requiere atención urgente. La electrocoagulación, como tecnología de alto rigor científico, tiene un significativo valor como parte de la solución global a este problema.
Referencias:
1. Sahuquillo A (2009) La importancia de las Aguas Subterráneas Revista de la Real Académica de Ciencias Exactas Físicas y Naturales de España. 103: 97-114.
2. Connor R (2014) Agua y energía. Informe de las Naciones Unidas Sobre el desarrollo de los recursos hídricos en el mundo. División de ciencias del agua. www.unesco.org/water/wwap.
3. Secretaria de la Convención Ramsar (2010) El manejo de las aguas subterráneas: para el uso racional de los humedales Cuarta edición. Gland, Suiza.
4. Centro Panamericano de Ingeniería Sanitaria y Ciencias del Ambiente (2004) Tratamiento de agua para consumo humano Plantas de filtración rápida. Manual I: Teoría. Tomo 1,Lima
5. Organización Mundial de la Salud (2007) Guidelines for Drinking-Water Quality Health criteria and other supporting information. Segunda edición, Ginebra.
6. Arrellano J (2002) Introducción a la ingeniería ambiental Primera edición. Alfaomega, México DF.
7. Arias W, Lovera D, García I (2011) Diseño y construcción de un reactor electrolítico multielectródico para laboratorio Revista del Instituto de Investigaciones de la Facultad de Geología, Mina, Metalúrgica y Ciencias Geográficas de la Universidad Mayor de San Marcos 14: 53- 57.
8. Vantes N (2002) Electroquímica y electrocatálisis. Materiales: aspectos fundamentales y aplicaciones Buenos Aires: e-libro.net. Primera edición Volumen Ib.
9. Arango A (2005) La electrocoagulación: una alternativa para el tratamiento de aguas residuales Revista Lasallista de Investigación de Colombia 2:49-56.
10. Mollah M (2001) Electrocoagulation (EC) science and aplications Journal of Hazardous Materials 84: 29-41.
11. Dávila J, Marriaga N, Machuca F (2008) Remoción de solidos totales de vinaza por electrocoagulación-electroflotación Revista de la Facultad de Mina de la Universidad Nacional de Colombia 158: 41-47.
12. Martín D, Rivera H, Piña M, Pérez C (2008) Incidencia del gradiente de velocidad en la eficiencia de la electrocoagulación para remover arsénico en un reactor a flujo pistón” Revista de Ciencia y Tecnología de América de la Asociación Interciencia 33: 496–502.
13. Restrepo A, Arango A, Garcés G (2006) La Electrocoagulación: retos y oportunidades en el tratamiento de aguas Revista Lasallista de Investigación de Colombia 1:58-77.
14. Piña M, Martin A (2011) Revisión de las variables de diseño y condiciones de operación de la electrocoagulación Revista Mexica de Ingeniería Química 10(2): 257-271.
15. Chen G (2004) Electrochemical technologies in wastewater treatment Separation and Purication Technology Research 38:11–41.
16. Ojeda E, Hing R, González Y (2012) Estudio comparativo del uso de electrodos de hierro y aluminio en el proceso de electrocoagulación de la vinaza Revista del Centro Nacional de Investigaciones Científicas en Ciencias Químicas de Cuba 43:1-13.
17. Mameri N, Lounici A, Belhocine D, Grib H, Piron D, Yahiat Y (2001) Defluoridation of Sahara water by small plant electrocoagulation using bipolar aluminium electrodes Separation and Purification Technology Research 24: 113–119.
18. Lavorante M, Alvarez H, Chantrill C, Fasoli H (2011) Aplicaciones ambientales de la electrocoagulación a escala piloto Revista Científica Ciencia de la Universidad Nacional de Catamarca de Argentina 6(21): 39-47.
19. http://www.hidrofalcon.com/noticias/index.php?option=com_content&view=article&id=45&Itemid=2, accesado 15/06/2015
20. American Public Health Association, American Water Works Association, Water Environment Federation (2005) Standard methods for the examination of water and wastewater, 21th Edition, American Public Health Association 1015 fifteenth street, N.W. Washington, D.C. USA.
21. Montgomery D (2004) Diseño y análisis de experimentos: Limusa, S.A. Segunda edición: México DF
22. Kobya M, Taner O, Bayramoglu M (2003) Treatment of textile wastewaters by electrocoagulation utilizing iron and aluminum electrodes Journal of Hazardous Materials 100:163-178.
23. Quintana D, Gortáres P, Estrada M, Villa M (2010) Tecnologías electroquímicas como alternativas en el tratamiento de aguas contaminadas: adsorción por carbón activado Revista Ide@s del Consejo de Ciencia y Tecnologia del Estado de Guanajuato 60: 570-581.
24. Malakootian M, Mansoorian H, Moosazedeh M (2010) Perfomance evaluation of electrocoagulation process using iron-rod electrodes for removing harsness from drinking water. Desalination Research 255: 67 – 71.
|
Revista QuímicaViva Número 1, año 16, Abril 2017 quimicaviva@qb.fcen.uba.ar |