El ácido fusárico, micotoxina producida por Fusarium spp., afecta negativamente el crecimiento de Pseudomonas protegens Pf-5 mediante el secuestro de hierro y la producción de especies reactivas de oxígeno.
Evangelina M. Bernar1¤ y Jimena A. Ruiz1,2
1 Departamento de Química Biológica. Facultad de Ciencias Exactas y Naturales. Universidad de Buenos Aires. Buenos Aires. Argentina.
2 Instituto de Investigaciones en Biociencias Agrícolas y Ambientales. Consejo Nacional de Investigaciones Científicas y Técnicas. Facultad de Agronomía. Universidad de Buenos Aires. Buenos Aires. Argentina.
¤ Dirección actual: Departamento de Química Biológica e Instituto de Bioquímica y Biofísica, Facultad de Farmacia y Bioquímica, Universidad de Buenos Aires, Ciudad Autónoma de Buenos Aires, Argentina.
embernar@qb.ffyb.uba.ar (EMB) - jruiz@agro.uba.ar (JAR)
Recibido: 17/10/2016 - Aceptado: 03/11/2016
Resumen
El ácido fusárico es un metabolito producido por diversas especies de hongos fitopatógenos del género Fusarium. Existen diversos trabajos que demuestran que este compuesto es tóxico para células vegetales y de mamíferos. P. protegens Pf-5 es una bacteria conocida por sus propiedades de supresión de diversos fitopatógenos del suelo, entre ellos Fusarium spp., sin embargo existe inconsistencia en cuanto a la eficacia de biocontrol de estos fitopatógenos. Teniendo en cuenta la toxicidad del ácido fusárico en células vegetales y de mamíferos, el objetivo de este trabajo fue evaluar la toxicidad y estudiar los efectos del ácido fusárico en distintas características relacionadas con el biocontrol en P. protegens Pf-5.
Los resultados obtenidos demuestran que el ácido fusárico afecta negativamente el crecimiento, pero incrementa la formación de biopelículas. Por otro lado, cuando P. protegens Pf-5 se cultivó en presencia de ácido fusárico, se observó un notable incremento en la producción del sideróforo pioverdina, asi como un aumento en la producción de biosurfactantes y en la cantidad de especies reactivas de oxígeno. Mediante titulación espectrofotométrica se pudo determinar que el ácido fusárico es capaz de quelar hierro.
De acuerdo con los datos obtenidos en este trabajo, el ácido fusárico es tóxico para P. protegens Pf-5, lo cual incidiría negativamente en la eficacia de biocontrol de enfermedades de marchitamiento causadas por Fusarium spp. productores de ácido fusárico. Entre los mecanismos de toxicidad se encontrarian el secuestro de hierro y el estrés oxidativo.
Palabras clave: ácido fusárico, Pseudomonas protegens, sideróforos
Fusaric acid, mycotoxin produced by Fusarium spp., negatively affects growth of Pseudomonas protegens Pf-5 by means of iron sequestration and production of reactive oxygen species.
Summary
Fusaric acid is a metabolite produced by several phytopathogenic fungi of the genus Fusarium. Several works have demonstrated that this compound is toxic for plant and mammalian cells. P. protegens Pf-5 is very well known because of its ability to suppress several soil-borne phytopathogens, including Fusarium spp., however biocontrol efficiency is not consistent. Taking into account the toxicity of fusaric acid for plant and mammalian cells, the main aim of this work was to evaluate the toxicity and to study the effects of fusaric acid in different physiological traits related to biocontrol in P. protegens Pf-5.
The results demonstrate that fusaric acid negatively affects growth, but increases bacterial biofilm formation. When P. protegens Pf-5 was grown in the presence of fusaric acid, a notable increase in the production of the siderophore pyoverdine, as well as an increment in biosurfactant production and reactive oxygen species were observed. Spectrophotometric titrations revealed that fusaric acid chelates iron.
According to the data obtained in this study, fusaric acid is toxic to P. protegens Pf-5, which would negatively affect biocontrol efficiency of wilt plant diseases caused by Fusarium spp, able to produce fusaric acid. Chelation of iron and oxidative stress would be some of the mechanisms of fusaric acid toxicity in P. protegens Pf-5.
Keywords: fusaric acid, Pseudomonas protegens, siderophores
Introducción
El ácido fusárico (AF, ácido 5-butilpiridin-2-carboxílico) [1] es un metabolito fúngico producido por varias especies de Fusarium spp., que contribuye a las enfermedades de marchitamiento y pudrición en diversos cultivos [1-3], entre los cuales se incluyen miembros de las familias Gramineae, Leguminosae, Alliaceae y Solanaceae. Estas enfermedades causan importantes pérdidas económicas a nivel mundial [4-9]. Actualmente, la aplicación de fungicidas sintéticos es la estrategia más utilizada para el control de las enfermedades producidas por especies de Fusarium. Sin embargo, debido a los efectos nocivos de los fungicidas en el medio ambiente y a la aparición de cepas de hongos resistentes, el uso de rizobacterias como agentes de biocontrol se presenta como una alternativa promisoria.
Varios estudios han demostrado que las Pseudomonas spp. fluorescentes pueden colonizar raíces infectadas con Fusarium oxysporum [10], el productor principal de ácido fusárico, y suprimir las enfermedades causadas por estos hongos [11-13]. Sin embargo, diversos factores, entre los cuales podemos mencionar las propiedades físico-químicas del suelo y las interacciones que tienen lugar en la rizósfera entre plantas, hongos y bacterias, modulan la eficacia de biocontrol de patógenos de suelo [14]. Para ilustrar este aspecto, podemos citar trabajos que demostraron que el AF limita la producción del metabolito anti-fúngico fenazina-1-carboxamida en P. chlororaphis [15,16] y reprime la expresión de genes involucrados en la síntesis del antibiótico 2,4-diacetilfloroglucinol (DAPG) en P. fluorescens, tanto in vitro como in vivo [12,17]. Estos resultados sugirieron que el AF disminuye la capacidad de estas cepas de Pseudomonas para competir con los patógenos de suelo. Por otro lado, el AF es tóxico para células vegetales y de mamíferos [2,3,18], y varios mecanismos -aún no del todo esclarecidos- contribuirían a la toxicidad de este compuesto.
A excepción del efecto del AF en la producción de antibióticos importantes para el biocontrol, se ha estudiado muy poco acerca de la influencia de este metabolito fúngico en Pseudomonas spp. fluorescentes. Por este motivo, el objetivo del presente trabajo fue analizar los efectos del AF en el crecimiento, la formación de biopelículas, la producción de surfactantes, la producción de pioverdinas y de especies reactivas de oxígeno en la cepa Pseudomonas protegens Pf-5, la cual es bien conocida por sus propiedades de supresión del crecimiento de diversos patógenos de suelo.
Materiales y métodos
Condiciones de cultivo
P. protegens Pf-5 [19] se cultivó con agitación a 30ºC en medio LB o medio mínimo E2 [20] suplementado con 1 mM MgSO4, 0,1% (vol/vol) de solución de microelementos [20] y glucosa a una concentración final de 0,6% (m/vol). El medio sólido se preparó agregando 1,5% (m/vol) de agar. En caso necesario los cultivos se suplementaron con AF (Sigma, St. Louis, Mo.) a partir de una solución madre con una concentración de 280 mM, la cual se preparó disolviendo el compuesto en 18% (vol/vol) de metanol y ajustando el pH a 6,5 con 2 N NaOH.
Para evaluar el efecto del AF en el crecimiento, las células de un cultivo crecido durante toda la noche en medio E2 suplementado con glucosa, se inocularon en medio fresco (con o sin AF). La densidad óptica inicial de la suspensión bacteriana a 600 nm (DO600) se ajustó a 0,05. Los cultivos se crecieron en frascos Erlenmeyer a 30°C con agitación constante a 180 rpm.
Ensayos de cuantificación de bacterias adheridas (formación de biopelículas)
Se realizó un cultivo de P. protegens Pf-5 durante toda la noche en medio E2 suplementado con glucosa. Se utilizó una alícuota de este cultivo para inocular placas de poliestireno de 96 pocillos que contenían 150 µl de medio fresco con o sin AF, de manera de obtener una DO600 inicial de 0,05. Las placas se incubaron durante 24 h a 30ºC en cámara húmeda. Después de la incubación, se midió la DO600 de la suspensión de bacterias no adheridas (planctónicas), se eliminó todo el contenido de la placa y la misma se lavó con agua para eliminar todas las bacterias no adheridas a la superficie de poliestireno. La biomasa de las bacterias adheridas (biopelícula) se cuantificó mediante su tinción con cristal violeta y posterior determinación de la absorbancia a 595 nm (A595), de acuerdo al protocol de Merritt et al. [21]. Los valores obtenidos se normalizaron a la biomasa (DO600) de las bacterias no adheridas. Este ensayo se repitió tres veces utilizando tres cultivos independientes en cada repetición y diez réplicas para cada cultivo.
Determinación de la producción de surfactantes
Se utilizaron cultivos crecidos en medio E2 suplementado con glucosa en ausencia o presencia de 2 y 4 mM de AF, los cuales ser incubaron durante 14 h a 30°C. Se centrifugó una alícuota de 5 mL de cada cultivo a 13.000 rpm para obtener el sobrenadante y se midió la tensión superficial de cada sobrenadante usando un tensiómetro de Du Noüy. Cada determinación se realizó por triplicado a partir de tres cultivos independientes.
Cuantificación de especies reactivas de oxígeno (ERO)
Las bacterias se cultivaron durante 14 h en medio mínimo E2 suplementado con glucosa, en ausencia o presencia de 2 y 4 mM de AF. A fin de realizar un control positivo de estrés oxidativo, se incubó una suspensión de P. protegens Pf-5 con una DO600 igual a 0,5 con 3 mM de H2O2 durante 1 h. Posteriormente, los cultivos se centrifugaron a baja velocidad y el pellet (botón de células) obtenido se resuspendió en NaCl 0,09% (m/vol). Una alícuota de esta suspensión se mezcló con la sonda diacetato de 2’,7’-diclorodihidrofluoresceína (DCFH-DA) a una concentración final de 50 mM. La mezcla se incubó a 30°C durante una hora y se centrifugó a baja velocidad para retirar la sonda no internalizada. Finalmente, el pellet se resuspendió en NaCl 0,09%. Se determinó la cantidad de células positivas (que presentaron fluorescencia) por citometría de flujo usando un equipo FACS Ariall BD Cell Sorter (BD Bioscience) con un filtro FIT-C (Blue Diodo 488). El análisis de los datos se realizó usando el software Flow Explorer 4.2. Cada determinación se realizó por triplicado a partir de tres cultivos independientes.
Determinación de la producción de pioverdinas
La producción de pioverdinas se cuantificó utilizando los sobrenadantes de cultivos crecidos en medio mínimo E2 suplementado con glucosa en ausencia o presencia de 2 y 4 mM de AF, por un período de tiempo de 35 hs. Luego de separar las células del medio por centrifugación (13.000 rpm), se colocaron 150 μl del sobrenadante en una placa de microtitulación de 96 pocillos con fondo plano y se determinó la producción de pioverdinas por medición de la fluorescencia emitida a 520 nm luego de la excitación con una longitud de onda de 420 nm. Las determinaciones se realizaron por triplicado a partir de tres cultivos independientes. Los valores de fluorescencia obtenidos se normalizaron a la biomasa (DO600) de los cultivos y se expresaron como unidades relativas de fluorescencia (URF).
Determinación de la formación de quelatos por titulación espectrofotométrica
El AF se diluyó en agua Milli-Q a una concentración final de 0,14 mM. El espectro de absorción UV del AF solo o el AF incubado con concentraciones crecientes de Fe2+ y Fe3+ se analizó por espectrofotometría (Ultrospec 2100 pro, GE Healthcare) en el intervalo de longitud de onda entre 200 y 300 nm. Se prepararon soluciones frescas de los cationes correspondientes a una concentración de 0,01M en 0,01 N HCl, las cuales se mezclaron con AF y se incubaron durante 2 min para luego proceder a su medición. El AF mostró un máximo de absorción a 270 nm (A270), y la intensidad se vio afectada por la unión al hierro. La intensidad de absorción medida a 270 nm se utilizó por lo tanto, para calcular la constante de afinidad (K0.5) del AF para los iones férrico y ferroso. La K0.5 se corresponde con la concentración del catión que causa un cambio en la absorción a 270 nm igual a la mitad de la máxima intensidad. Para obtener el valor de K0.5 los datos se ajustaron al programa SigmaPlot (Jandel Scientific), utilizando la siguiente ecuación: ΔA270/A270 = (ΔA270/A270max)x[M]/(K0.5+[M]), donde ΔA270 es el cambio observado luego del agregado del catión correspondiente, A270 es la absorción inicial del AF en ausencia de hierro, ΔA270/A270max corresponde al cambio de absorción máxima producido por el hierro, y [M] es la concentración de Fe2+ o Fe3+ utilizada. Todas las mediciones se realizaron un mínimo de tres veces.
Resultados
El AF afecta negativamente la viabilidad celular y el crecimiento
Para evaluar el efecto del AF sobre el crecimiento de P. protegens Pf-5, se comenzó por determinar la concentración inhibitoria mínima (CIM) de AF para esta bacteria. P. protegens Pf-5 se cultivó en medio E2 suplementado con glucosa, al cual se le agregaron concentraciones crecientes de AF (2 a 12 mM). Bajo estas condiciones, se observó que el crecimiento bacteriano fue completamente inhibido al utilizar concentraciones de AF superiores a 7 mM. A partir de este resultado, se decidió trabajar con dos concentraciones sub-inhibitorias de AF, 2 mM y 4 mM a fin de evaluar los efectos de esta micotoxina sobre características fisiológicas de P. protegens Pf-5 relacionadas con la supervivencia en la rizósfera y el control biológico.
Al analizar el efecto del AF sobre el crecimiento bacteriano, se observó que el agregado de este compuesto a una concentración de 2 mM no afectaba significativamente la velocidad de crecimiento durante la fase exponencial (µ 2mM AF= 2,0 h-1, µ sin AF=2,2 h-1). Sin embargo, luego de 14 hs de cultivo, tiempo en el cual se alcanzaba la fase estacionaria de crecimiento, la densidad óptica del cultivo disminuyó significativamente (p< 0,05), sugiriendo una posible lisis celular. Si bien el cultivo crecido en ausencia de AF también mostró una disminución de la densidad óptica, dicha disminución no fue tan pronunciada como la observada al agregar AF. Por otra parte, cuando el medio de cultivo se suplementó con 4 mM de AF, los valores de densidad óptica obtenidos fueron significativamente menores (p<0,05) a los observados para los cultivos crecidos en ausencia de AF, tanto durante la fase exponencial como durante la fase estacionaria. La velocidad de crecimiento del cultivo crecido con 4 mM de AF resultó mucho menor que la del cultivo crecido sin el agregado de este compuesto (µ 4mM AF= 1,2 h-1, µ sin AF=2,2 h-1) (Figura 1). A fin de evaluar si la disminución de la densidad óptica durante la fase estacionaria se correspondía con un menor número de células viables (UFC/ml), se realizaron recuentos en placa a distintos tiempos, los cuales confirmaron que en presencia de AF el número de UFC/ml era significativamente menor (luego de 29 hs de cultivo se obtuvo un valor de 8,17 x 1012 ± 5,86 x 1011 UFC/ml para el cultivo crecido sin AF; 2,97 x 1010 ± 3,51 x 109 UFC/ml para el cultivo crecido con 2 mM de AF y 2,67 x 109 ± 5,77 x 108 UFC/ml para el cultivo crecido con 4 mM de AF).
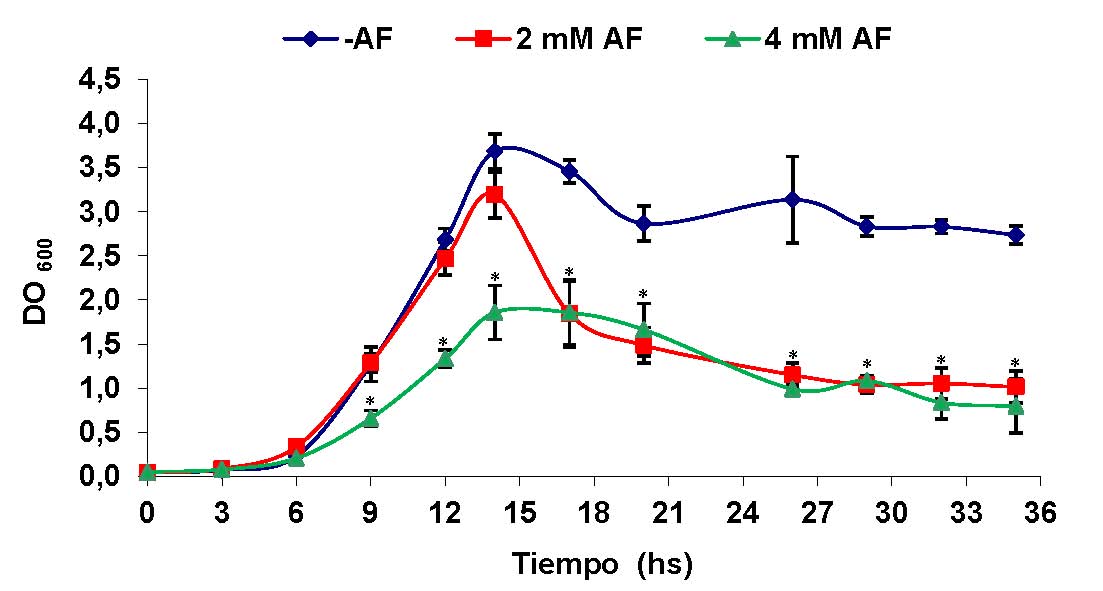
Figura 1: Efecto del AF en el crecimiento de P. protegens Pf-5 en medio mínimo E2 suplementado con glucosa. El crecimiento bacteriano se monitoreó cada tres horas por medición de la absorbancia a 600 nm (DO600). Los valores representan el promedio entre las densidades ópticas de tres cultivos independientes ± el desvío estándar (D.S). Los datos fueron analizados usando como prueba estadística ANOVA de un factor. Los asteriscos sobre las barras de error indican que existen diferencias significativas respecto del control sin AF.
El AF produce un incremento en la formación de biopelículas
La capacidad de las bacterias para adherirse a una superficie y formar biopelículas es importante para su supervivencia en una gran variedad de ambientes y esta estructura organizada es la que predomina cuando las bacterias colonizan la superficie de la raíz [22-24]. Teniendo esto en cuenta, se evaluó el efecto del AF sobre la capacidad de formación de biopelículas en P. protegens Pf-5. Los resultados mostraron que la formación de biopelículas se incrementó significativamente (p<0,05) en presencia de concentraciones sub-inhibitorias de AF, observándose un mayor incremento en presencia de 4 mM de AF (Figura 2).
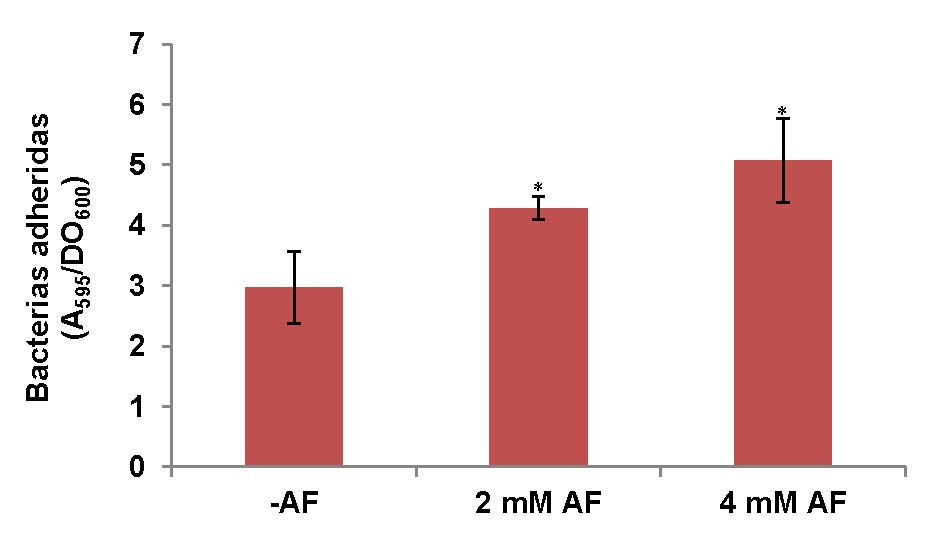
Figura 2: Efecto del AF en la formación de biopelículas en cultivos de P. protegens Pf-5. La capacidad de formación de biopelículas se evaluó luego de 24 hs de incubación a 30°C en medio mínimo suplementado con glucosa, con o sin el agregado de AF. Las bacterias se incubaron sin agitación en placas de poliestireno de 96 pocillos. Los valores representan el promedio entre la proporción de bacterias adheridas (A595/DO600) de tres cultivos independientes ± D.S. Los datos fueron analizados usando como prueba estadística ANOVA de un factor. Los asteriscos sobre las barras de error indican que existen diferencias significativas respecto del control sin AF.
El AF incrementa la producción de surfactantes
Debido a que algunos surfactantes producidos por Pseudomonas del grupo fluorescente tienen un papel importante en la formación de biopelículas bacterianas [25,26], se estudió si la producción de los mismos se veía afectada en presencia de AF. La producción de estos compuestos se evaluó a través de la medición de la tensión superficial (λ) de los sobrenadantes obtenidos a partir de cultivos crecidos en medio E2 suplementado con glucosa. Los resultados, que se muestran en la Tabla 1, se expresaron como el porcentaje de diminución de λ, considerando como 0% la tensión superficial del medio sin inocular y sin AF (Control 1).
En primer lugar, se determinó la tensión superficial de los sobrenadantes de cultivos crecidos en ausencia de AF (Control 2). Bajo estas condiciones, se observó una disminución de la tensión superficial, lo cual indica que P. protegens Pf-5 produce surfactantes cuando se cultiva en medio E2 suplementado con glucosa (producción basal de surfactantes). También se determinó si el AF tiene propiedades surfactantes per se. Para esto se agregó al medio de cultivo sin inocular, AF a dos concentraciones finales: 2 y 4 mM (Controles 3a y 3b, respectivamente). El agregado de AF al medio de cultivo produjo una disminución en la tensión superficial, que fue menor a la observada para el Control 2. Posteriormente, se midió la tensión superficial de los sobrenadantes de cultivos crecidos en presencia de 2 y 4 mM de AF (Tratamiento A y B, respectivamente). En este caso, se observó un porcentaje de disminución de λ superior al observado para los controles 2 y 3. Para descartar que este último resultado se debiera a un efecto aditivo entre el AF adicionado y los surfactantes producidos por P. protegens, se realizó un control adicional (Control 4). Para esto se agregó al sobrenadante del cultivo crecido en ausencia de micotoxina, AF a una concentración final de 2 y 4 mM (controles 4a y 4b, respectivamente). Bajo estas condiciones, se observó un porcentaje de disminución de λ mayor al observado en el control 2. Sin embargo, esta disminución fue significativamente menor (p<0,05) a la observada en los tratamientos A y B, por lo que inferimos que en presencia de concentraciones sub-inhibitorias de AF hay un aumento en la producción de surfactantes.
Tabla I: Efectos del AF sobre la producción de surfactantes
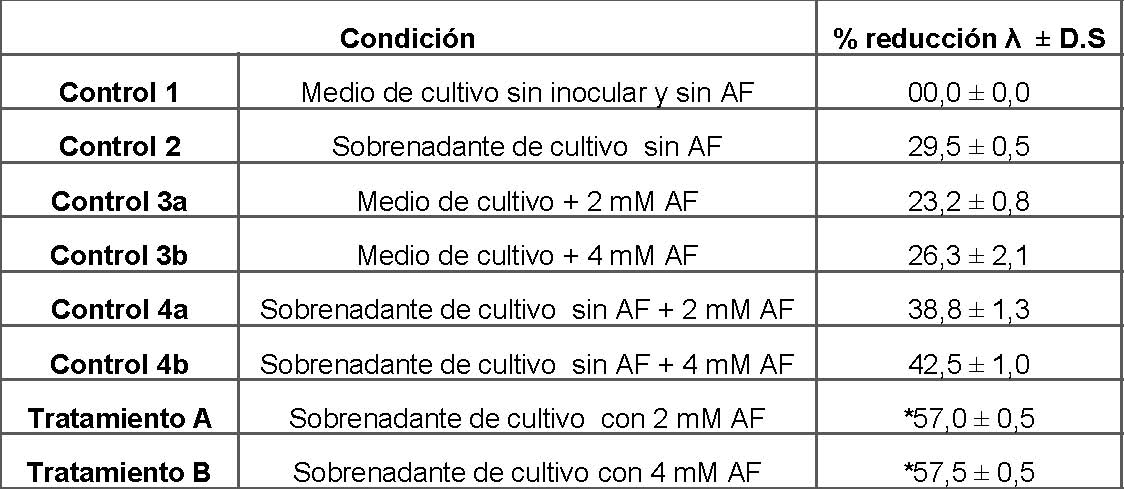
P. protegens Pf-5 se cultivó en presencia y ausencia de AF durante 14 h a 30°C con agitación. Se centrifugó una alícuota de 5 ml de cada cultivo para obtener el sobrenadante, al cual se le midió la tensión superficial utilizando el tensiómetro de Du Noüy. Los valores representan la media de los porcentajes de reducción de la tensión superficial (λ) de tres cultivos independientes ± D.S. Los datos fueron analizados usando como prueba estadística ANOVA de un factor. Los asteriscos indican que existen diferencias significativas respecto de los controles analizados.
El AF produce un incremento en la producción de especies reactivas de oxigeno (ERO)
Compuestos cíclicos como el AF y el paraquat (dicloruro de 1,1'-dimetil-4,4'-bipiridilo) pueden generar O2- (anión superóxido) y causar estrés oxidativo. El daño celular por estrés oxidativo puede provocar la muerte celular debido a la destrucción de las macromoléculas [27,28]
Con el fin de determinar si el AF incrementaba la producción de ERO, se realizaron cultivos de P. protegens Pf-5 en medio mínimo E2 suplementado con glucosa en ausencia y presencia de 2 y 4 mM de AF. Al mismo tiempo, se realizó un control positivo de estrés oxidativo, incubando una suspensión de P. protegens Pf-5 con 3 mM de H2O2 durante 1 h. La producción de ERO se determinó utilizando la sonda DCFH-DA (diacetato de 2’,7’-diclorodihidrofluoresceína). Hempel y colaboradores [29] demostraron que el DCFH-DA es capaz de sensar indirectamente O2-, ya que el anión superóxido es reducido a peróxido de hidrogeno mediante la acción de la superóxido dismutasa en el interior celular. El DCFH-DA solo se activa dentro de la célula, ya que al atravesar la membrana celular este compuesto es hidrolizado por esterasas pasando a su forma no fluorescente DCFH (2’,7’-diclorodihidrofluoresceína). Finalmente, el DCFH sufre una reacción de oxidación con los radicales de oxígeno pasando a su forma fluorescente DCF. La intensidad de fluorescencia obtenida es proporcional a los niveles de ERO intracelulares. El porcentaje de células ERO positivas (células que presentan fluorescencia) fue analizado por citometría de flujo.
Como puede observarse en la Figura 3 A y B, el tamaño (FSC) y la complejidad celular (SSC) (referido a la complejidad del núcleo y la granulosidad celular) de P. protegens Pf-5 no se modificaron cuando las bacterias se incubaron con 3 mM de H2O2 (Figura 3A) o bien cuando se cultivaron en presencia de concentraciones sub-inhibitorias de AF (Figura 3B). Cuando las células se incubaron con H2O2 el porcentaje de células reactivas a la sonda fue del 2,4%, superior al obtenido para el control sin AF (Figura 3B). Cuando las bacterias se cultivaron en presencia de 4 mM de AF (Figura 3C, recuadros 5 y 6 y Figura 3D) se observó un aumento significativo (p<0,05) en el porcentaje de células ERO positivas, respecto al control sin AF (Figura 3C recuadros 1 y 2 y Figura 3D). Como puede observarse en el histograma 6 de la Figura 3C, en presencia de 4 mM de AF se observó la aparición de una nueva población de células con una intensidad de fluorescencia mayor que la población de células observada en los cultivos que fueron incubados sin AF (Figura 3C, recuadros 1 y 2 y Figura 3D) o con 2 mM de AF (Figura 3C, recuadros 3 y 4 y Figura 3D).
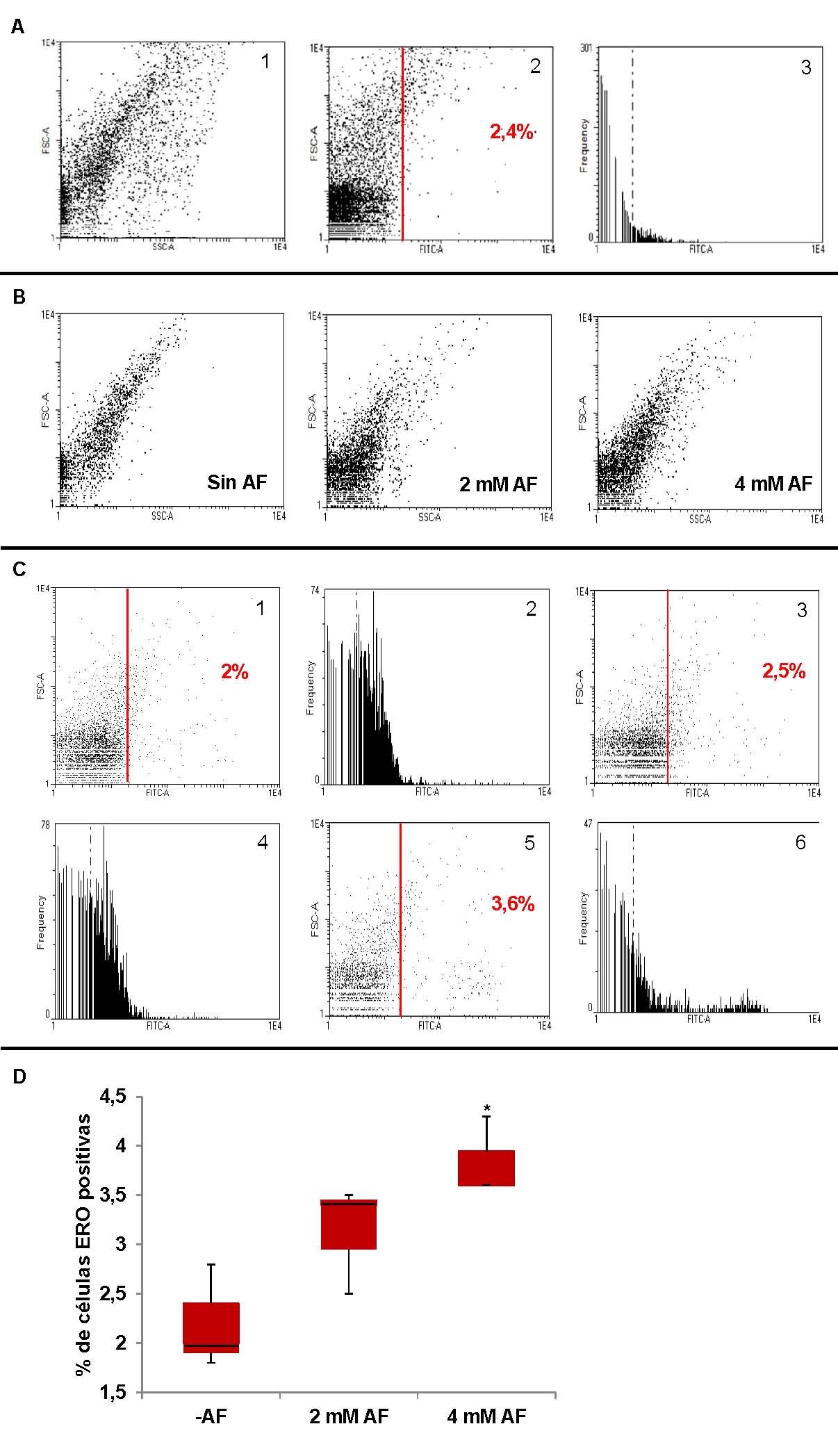
Figura 3: Efecto del AF en la producción de especies reactivas de oxígeno (ERO) en cultivos de P. protegens Pf-5. Una alícuota del pellet celular resuspendido en solución fisiológica se mezcló con la sonda DCFH-DA. La cantidad de células ERO positivas (células que presentan fluorescencia) se midió por citometría de flujo usando un equipo FACS Ariall BD CellSorter con un filtro FIT-C. A. Como control positivo de estrés oxidativo se incubó una suspensión de P. protegens Pf-5 con 3 mM de H2O2 durante 1 h. 1. Gráfico de puntos de FSC (Forward scattering) vs SSC (Side scattering), el cual representa el tamaño celular y el contenido de gránulos, respectivamente. 2. Gráfico de puntos FSC vs FITC-A, el cual representa el tamaño celular y el número de células que emiten fluorescencia, respectivamente. En color rojo se indica el porcentaje de células ERO positivas. 3. Histogram Frequency vs FITC-A, que representa el número de células y la intensidad de fluorescencia emitida, respectivamente. B, C y D. Se utilizaron cultivos crecidos durante 14 hs en medio mínimo con o sin AF. B. Gráficos de puntos de FSC vs SSC. C. Gráficos de puntos FSC vs FITC-A (1, 3 y 5) e histogramas Frequency vs FITC-A (2, 4 y 6). Se expone una de las muestras más representativas de cada condición. 1 y 2: cultivo incubado sin AF; 3 y 4: cultivo incubado con 2 mM de AF; 5 y 6: cultivo incubado con 4 mM de AF. En color rojo se indica el porcentaje de células ERO positivas. FITC: isotiocianato de fluoresceína. D. Comparación del porcentaje de células ERO positivas en ausencia y presencia de AF. Los valores representan la media entre los porcentajes de células ERO positivas (células que presentan fluorescencia) de tres cultivos independientes ± D.S. Los datos fueron analizados usando la prueba estadística de Kruskal-wallis.
El AF promueve la producción de pioverdina
En condiciones de escasez de hierro, P. protegens Pf-5 produce dos tipos de sideróforos, denóminados pioverdina y enanto-pioquelina [30,31] que tienen una alta afinidad por este elemento. La producción de sideróforos es una estrategia fundamental para la supervivencia de las bacterias en la rizósfera, además de representar un mecanismo importante en el control de fitopatógenos por parte de Pseudomonas del grupo fluorescente [32,33].
Basados en la importancia de estos compuestos, se evaluó el efecto de concentraciones sub-inhibitorias (2 y 4 mM) de AF sobre la producción de pioverdinas durante el crecimiento en medio mínimo suplementado con glucosa, observándose un aumento en la producción de estos sideróforos (Figura 4A) en presencia de ambas concentraciones de AF, luego de la entrada en la fase estacionaria de crecimiento (Figura 1). Asimismo, como se puede observar en la Figura 4A, el incremento en la producción de pioverdinas fue mayor a mayor concentración de AF agregada al medio de cultivo. La Figura 4B muestra la emisión de fluorescencia del sobrenadante de los cultivos, usando un transiluminador de luz ultravioleta (UV), luego de 16 hs de crecimiento.
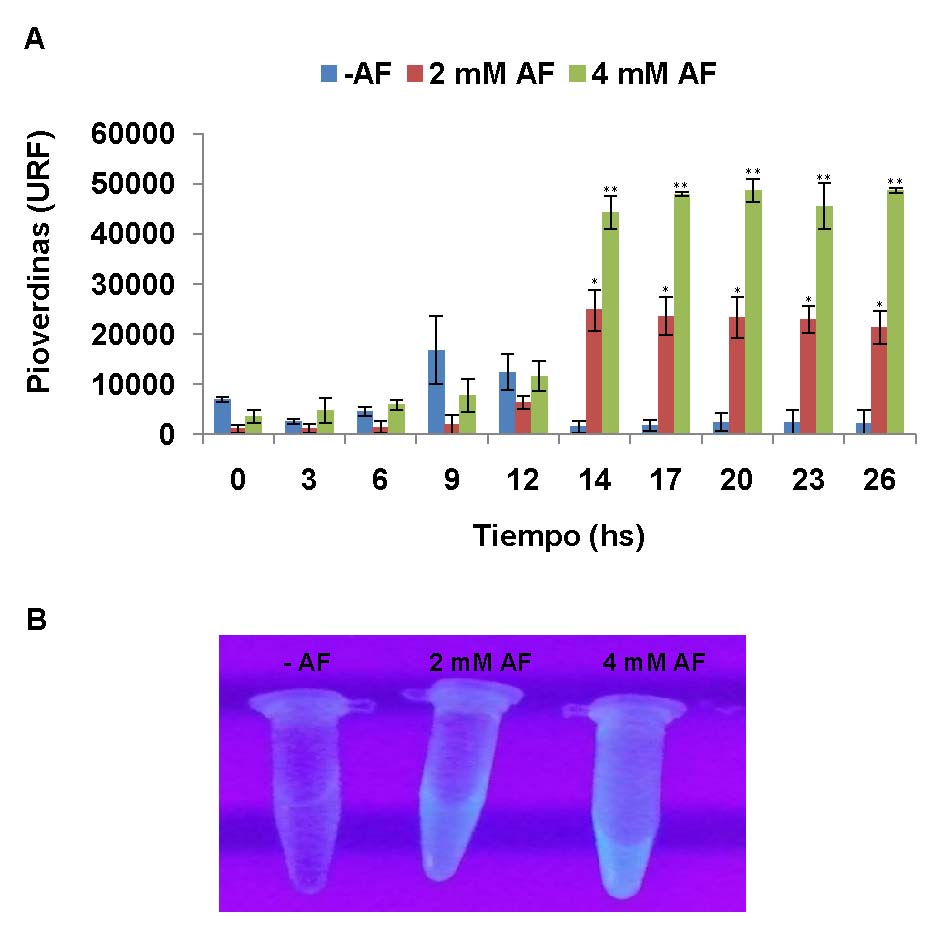
Figura 4: Efecto del AF en la producción de pioverdinas en cultivos de P. protegens Pf-5. A. La producción de pioverdinas se cuantificó cada tres horas en el sobrenadante de cultivos crecidos en medio mínimo suplementados con glucosa con o sin el agregado de AF, a través de la medición de la fluorescencia emitida a 520 nm luego de la excitación a 420 nm. La intensidad de fluorescencia obtenida en cada caso se normalizó a la DO600 de los cultivos y se expresa como unidades relativas de fluorescencia (URF). Se muestra el promedio de las mediciones de tres cultivos independientes ± D.S. Los datos fueron analizados usando como prueba estadística ANOVA de un factor. Los asteriscos sobre las barras de error indican que existen diferencias significativas respecto del control sin AF. B. Emisión de fluorescencia de los sobrenadantes de los cultivos de P. protegens Pf-5 crecidos en medio mínimo durante 16 hs, con o sin el agregado de AF, al exponer los tubos a la luz ultravioleta (UV).
Por otra parte, dado que la producción de pioverdinas se induce en condiciones de baja disponibilidad de hierro en el medio, se decidió evaluar el efecto de distintas concentraciones de hierro (10 y 100 µM de sulfato de hierro) en la producción de pioverdinas en presencia y ausencia de AF (Figura 5). Cuando el medio de cultivo se suplementó con 10 µM de sulfato de hierro (concentración que aporta la solución de trazas del medio de crecimiento) y AF, se observó un incremento significativo en la producción de pioverdinas en presencia de ambas concentraciones de AF, respecto del control sin AF. Sin embargo, cuando las bacterias se cultivaron en condiciones de exceso de hierro (100 µM de Fe2+) y AF, no se observaron diferencias significativas en la producción de estos sideróforos entre los cultivos crecidos en ausencia y presencia de AF. Este último resultado demostró que cuando el medio contiene altas concentraciones de hierro, la presencia de AF no afecta la producción de pioverdinas.
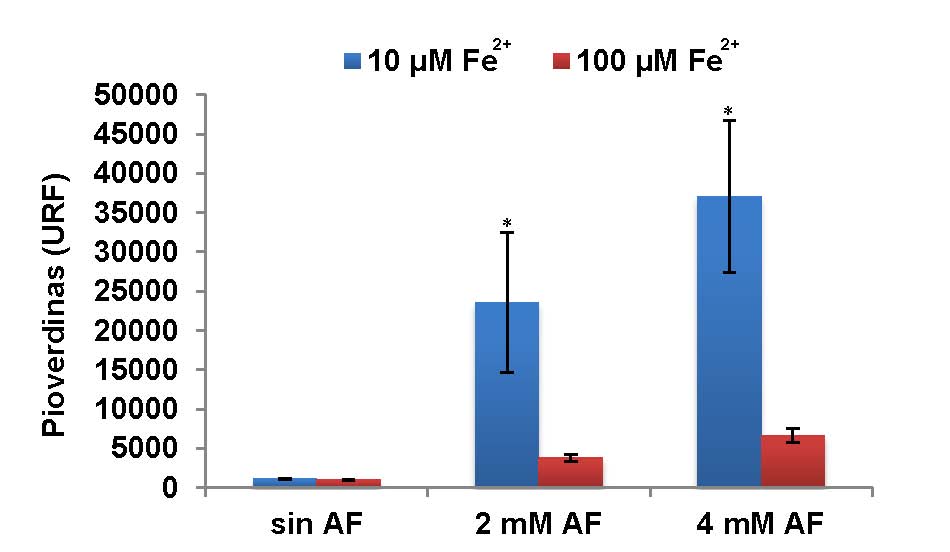
Figura 5: Efecto de la concentración de Fe2+ en la producción de pioverdinas en cultivos de P. protegens Pf-5 crecidos en presencia y ausencia de AF. El medio de cultivo se suplementó con 10 y 100 µM de FeSO4.7H2O. La producción de pioverdinas se cuantificó después de 16 hs de cultivo por medición de la fluorescencia emitida a 520 nm luego de la excitación a 420 nm. La intensidad de fluorescencia obtenida en cada caso se normalizó a la DO600 de los cultivos y se expresa como unidades relativas de fluorescencia (URF). Los valores representan el promedio entre las URF de tres cultivos independientes ± D.S. Los datos fueron analizados usando como prueba estadística ANOVA de un factor. Los asteriscos sobre las barras de error indican que existen diferencias significativas respecto del control sin AF.
El AF es capaz de quelar hierro
El resultado anterior demostró que el AF incrementa la producción de pioverdinas. Teniendo en cuenta que las pioverdinas se sintetizan y secretan cuando el hierro no se encuentra disponible para el microorganismo [30], se decidió evaluar la capacidad del AF de unirse y formar quelatos con los cationes Fe2+ y Fe3+ mediante titulación espectrofotométrica [32,35]. El AF fue capaz de unirse y formar quelatos estables con el ion férrico y ferroso, obteniéndose una constante de afinidad (K0.5)=55 µM para Fe2+ y 10 µM para el Fe3+. Este resultado demuestra que el AF posee la propiedad de quelar el hierro, haciéndolo no disponible para la célula, siendo el ión ferroso el que posee mayor afinidad.
Discución
El objetivo de este trabajo fue realizar un estudio que comprendiera el análisis de los efectos de la micotoxina denominada ácido fusárico (AF) sobre distintas características de P. protegens Pf-5, de manera de obtener un conocimiento más abarcador de la interacción Pseudomonas-Fusarium. Cuando se analizó el efecto del AF en el crecimiento bacteriano en medio mínimo (Figura 1), se observó una significativa disminución en la velocidad de crecimiento durante la fase exponencial en los cultivos crecidos con el agregado de 4 mM AF, pero no en los cultivos crecidos en presencia de 2 mM AF. Sin embargo, la viabilidad celular disminuyó significativamente luego de la entrada de las células en la fase estacionaria de crecimiento en presencia de ambas concentraciones de AF. Estos resultados demuestran que, aunque P. protegens Pf-5 es capaz de crecer en presencia de concentraciones de AF ≥ 7mM, esta micotoxina genera una disminución significativa en su tasa de crecimiento y en la viabilidad celular. Trabajos realizados con rizobacterias Gram positivas con propiedades biocontroladoras pertenecientes a los géneros Bacillus y Paenibacillus indican que son mucho más susceptibles que P. protegens Pf-5 al AF [36,37].
Dado que el AF está involucrado en la patogenia de enfermedades de marchitamiento de un gran número de especies vegetales [38], existen varios trabajos que han estudiado su efecto en este tipo de células, encontrándose que el AF inhibe la respiración celular [39], afecta la permeabilidad y el potencial de membrana [38,40,41] e incrementa el nivel de especies reactivas de oxígeno (ERO) [42]. En coincidencia con este último resultado, en este trabajo observamos un incremento significativo en la producción de ERO al cultivar a P. protegens Pf-5 en aerobiosis en presencia de 4 mM de AF (Figura 3). El incremento en los niveles de ERO puede ocasionar inactivación enzimática, daños en el DNA y peroxidación de lípidos [43], lo cual explicaría la marcada disminución en la densidad celular observada al cultivar las células bacterianas en presencia de la micotoxina (Figura 1).
Por otro lado, en presencia de AF se observó un incremento en la formación de biopelículas (Figura 2) y en la producción de surfactantes (Tabla 1). En P. chlororaphis se reportó que el AF disminuye la producción de acil-homoserin-lactonas (AHLs) [16], moléculas señal involucradas en la comunicación célula-célula (quorum sensing) en bacterias Gram negativas. Las señales que llevan a la producción de biopelículas en Pseudomonas spp. son muy complejas y responden a la presencia de AHLs, por este motivo una alteración en la producción de estas moléculas en respuesta al AF podría ser en parte responsable del efecto del AF sobre la formación de biopelículas. Las AHLs producidas por P. protegens Pf-5 aún no han sido caracterizadas. Si bien hemos intentado, mediante el uso de cepas biosensoras de AHLs de distinto número de carbonos, detectar la producción de AHLs en esta bacteria, no hemos obtenido resultados positivos con ninguno de los biosensores utilizados (datos no mostrados). Asimismo, tal como ocurre con la resistencia a los antibióticos [44], es posible que la estructura multicelular de las biopelículas bacterianas tenga la finalidad de incrementar la resistencia a la micotoxina. En cuanto a la producción de biosurfactantes, Bruijn y colaboradores demostraron que los biosurfactantes producidos por una cepa de P. fluorescens son necesarios para la unión de las células a distintas superficies y que mutantes incapaces de producirlos mostraban una marcada incapacidad de formación de biopelículas [25,26]. En concordancia con lo anterior, nuestros resultados demuestran que el AF además de incrementar la formación de biopelículas, aumenta la producción de surfactantes en cultivos de P. protegens Pf-5.
Una de las respuestas de P. protegens Pf-5 ante la presencia de AF fue un marcado incremento en la producción de pioverdinas. Dicho incremento fue además dependiente de la concentración de AF agregada (Figura 4). Mediante experimentos de microarrays se ha demostrado que la expresión de varios genes involucrados en la biosintesis de pioverdina y el transporte de hierro se incrementa en presencia de AF en P. chlororaphis [16]. Un trabajo más reciente en el cual se analizó el transcriptoma de P. protegens Pf-5 en respuesta a la limitación de hierro, también reveló que la expresión de los genes involucrados en la biosíntesis de pioverdina y enanto-pioquelina (otro sideróforo producido por P. protegens), aumentaba marcadamente en estas condiciones [44]. Además, en células eucariotas el AF inhibe el crecimiento y el ácido picolínico, un compuesto estructuralmente similar al AF, impide la incorporación de hierro en las células [18]. Dado que las pioverdinas son sintetizadas en condiciones en las cuales el hierro se encuentra escasamente disponible para las bacterias [30], los antecedentes previos y los resultados obtenidos en este trabajo nos sugirieron que el AF se uniría al hierro, haciendo que este compuesto esté inaccesible para las células. A fin de confirmar esta hipótesis realizamos análisis por espectrofotometría que confirmaron que el AF es capaz de quelar tanto el catión férrico como el ferroso, siendo el Fe3+ el que posee mayor afinidad por el AF. Dado que el hierro es un elemento presente en varias proteínas y coenzimas fundamentales para el crecimiento, su limitación como resultado del secuestro mediado por el AF podría provocar una disminución en la velocidad de crecimiento y la viabilidad celular, tal como se observó en la Figura 1.
Un resumen de los resultados obtenidos en este trabajo se encuentra diagramado en la Figura 6. Los mismos aportan los primeros conocimientos de los efectos del AF sobre características de P. protegens Pf-5 relacionadas con su capacidad de supervivencia, colonización y competencia en la rizósfera, los cuales podrían ser aplicados en la mejora de esta cepa para ser usada como un inoculante en suelos contaminados con Fusarium spp. productores de AF. Se ha demostrado que el AF afecta negativamente el crecimiento y la viabilidad, lo cual podría ser explicado en parte por el incremento en la producción de ERO y el secuestro de hierro por el AF. Asimismo, las propiedades anfipáticas del AF y su capacidad de quelar metales, también podrían provocar una disminución en la estabilidad de las membranas celulares como ocurre en células vegetales, y de esta manera contribuir a la muerte celular [38,40]. Además, se observó que el AF incrementa la producción de surfactantes y la formación de biopelículas bacterianas. Estos efectos podrían llegar a estar relacionados. Suponemos que la inducción de la formación de biopelículas por parte del AF se debería a su efecto tóxico y que dicha estructura multicelular proporcionaría a las bacterias una mayor capacidad de tolerancia a este compuesto. Sin embargo, esta hipótesis debería ser probada. Finalmente, observamos que el AF es capaz de quelar Fe2+ y Fe3+, lo cual provocaría una disminución del hierro disponible para las células bacterianas, induciendo la expresión de pioverdinas y en última instancia afectando el crecimiento y la viabilidad. Varios estudios han demostrado la importancia de los sideróforos en la supresión de enfermedades vegetales causadas por Fusarium spp. productores de AF [46-48]. Los resultados obtenidos en este trabajo proporcionan una explicación para dicho efecto, ya que la capacidad de secretar pioverdinas parece ser una estrategia adaptativa para incrementar la supervivencia en presencia de este quelante de hierro. Esto último, remarca la importancia de utilizar cepas que produzcan niveles elevados de sideróforos en suelos contaminados con productores de AF y al mismo tiempo pone de relevancia la importancia de la fertilización de los suelos con hierro para el biocontrol de las enfermedades provocadas por Fusarium.
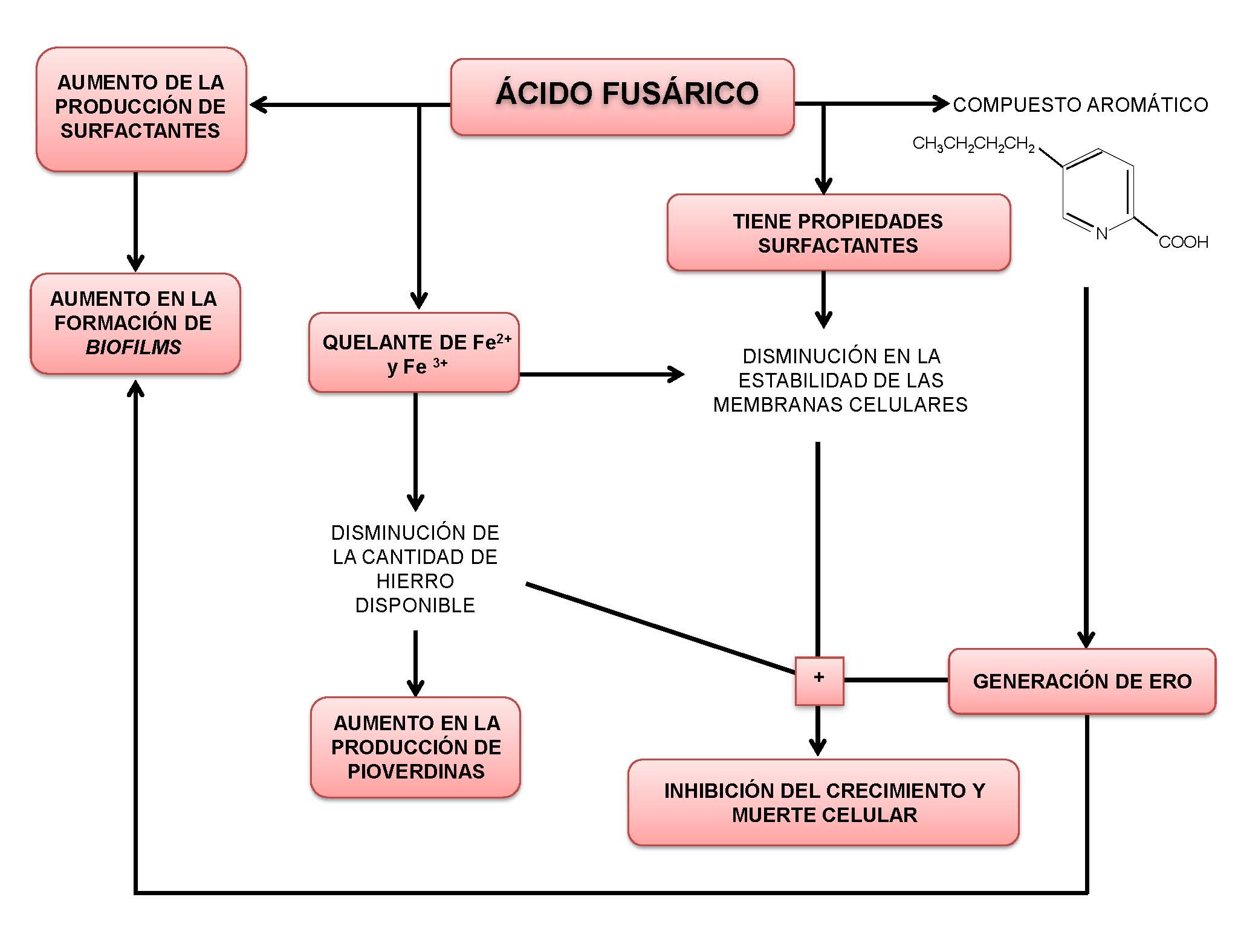
Figura 6: Esquema de los efectos del ácido fusárico en P. protegens Pf-5. En recuadros: resultados de los experimentos realizados. Sin recuadrar: posible explicación que conduzca al efecto observado en los experimentos realizados. Los signos más (+) reflejan la suma de los efectos.
Agradecimientos
Agradecemos a Claudio Valverde por facilitarnos la cepa P. protegens Pf-5.
Referencias:
1. Capasso R, Evidente A, Cutignano M, Vurro M, Zonno MC, Bottalico A (1996) Fusaric acid and 9,10-dehydrofusaric acids and their methyl esters from Fusarium nygamai. Phytochemistry 41: 1035-1039.
2. Gapillout I, Milat ML, Blein JP (1996) Effects of fusaric acid on cells from tomato cultivars resistant or susceptible to Fusarium oxysporum f. sp. lycopersici. European Journal Plant Patholology 102: 127-132.
3. Mégnégneau B, Branchard M (1988) Toxicity of fusaric acid observed on callus cultures of various Cucumis melo genotypes. Plant Physiology and Biochemistry 26: 585-588.
4. Lori GA, Sisterna MN, Haidukowski M, Rizzo I (2003) Fusarium graminearum and deoxynivalenol contamination in the durum wheat area of Argentina. Microbiological Research 158: 29-35.
5. Di Pietro A, Madrid MP, Caracuel Z, Delgado-Jarana J, Roncero MIG (2003) Fusarium oxysporum: exploring the molecular arsenal of a vascular wilt pathogen. Molecular Plant Pathology 4: 315-325.
6. Pioli RN, Mozzoni L, Morandi EN (2004) First report about pathogenic association between F. graminearum and soybean. Plant Disease Note 88: 220.
7. Reynoso MM, Chulse SN, Zeller KA, Torres AM, Leslie JL (2009) Genetic structure of Fusarium verticilliodies populations isolated from maize in Argentina. European Journal of Plant Pathology 123: 207-215.
8. Stenglein SA (2009) Fusarium poae: A pathogen that needs more attention. Journal of Plant Pathology 91: 25-36.
9. Stenglein SA, Barreto D, Nicholson P, Chandler E, Brambilla V, Piris EM, Saliva V, Mitdieri M, Salerno GL (2009) First report of Fusarium poae on tomato in Argentina. Plant Pathology 58: 401.
10. de Weert S, Kuiper I, Lagendijk EL, Lamers GE, Lugtenberg BJ (2004) Role of chemotaxis toward fusaric acid in colonization of hyphae of Fusarium oxysporum f. sp. radicis-lycopersici by Pseudomonas fluorescens WCS365. Molecular Plant-Microbe Interactions 17: 1185-1191.
11. Chin-A-Woeng TFC, Bloemberg GV, Bij AJvd, Drift KMGMvd, Schripsema J, Kroon B, Scheffer RJ, Keel C, Bakker PAHM, Tichy H-V, de Bruijn FJ, Thomas-Oates JE, Lugtenberg BJ (1998) Biocontrol by Phenazine-1-carboxamide-Producing Pseudomonas chlororaphis PCL1391 of Tomato Root Rot Caused by Fusarium oxysporum f. sp. radicis-lycopersici. Molecular Plant-Microbe Interactions 11: 1069-1077.
12. Duffy BK, Keel C, Défago G (2004) Potential role of pathogen signaling in multitrophic plant-microbe interactions involved in disease protection. Applied and Environmental Microbiology 70: 1836-1842.
13. Saikia R, Varghese S, Singh BP, Arora DK (2009) Influence of mineral amendment on disease suppressive activity of Pseudomonas fluorescens to Fusarium wilt of chickpea. Microbiological Research 164: 365-373.
14. Haas D, Defago G (2005) Biological control of soil-borne pathogens by fluorescent pseudomonads. Nature Reviews Microbiology 3: 307-319.
15. van Rij ET, Wesselink M, Chin A, Woeng TF, Bloemberg GV, Lugtenberg BJ (2004) Influence of environmental conditions on the production of phenazine-1-carboxamide by Pseudomonas chlororaphis PCL1391. Molecular Plant-Microbe Interactions 17: 557-566.
16. van Rij ET, Girard G, Lugtenberg BJ, Bloemberg GV (2005) Influence of fusaric acid on phenazine-1-carboxamide synthesis and gene expression of Pseudomonas chlororaphis strain PCL1391. Microbiology 151: 2805-2814.
17. Notz R, Maurhofer M, Dubach H, Haas D, Defago G (2002) Fusaric acid-producing strains of Fusarium oxysporum alter 2,4-diacetylphloroglucinol biosynthetic gene expression in Pseudomonas fluorescens CHA0 in vitro and in the rhizosphere of wheat. Applied and Environmental Microbiology 68: 2229-2235.
18. Ramautar A (2003) An investigation into the apoptotic inducing effect of fusaric acid on human lymphocytes and its role in cell growth inhibition [Master Thesis]. Durban: University of Natal.
19. Howell C, Stipanovic R (1979) Control of Rhizoctonia solani in cotton seedlings with Pseudomonas fluorescens and with an antibiotic produced by the bacterium. Phytopathology 69: 480-482.
20. Lageveen R, Huisman GW, Preusting H, Ketelaar P, Eggink G, Witholt B (1988) Formation of polyesters by Pseudomonas oleovorans: Effect of substrates on formation and composition of poly-(R)-3-hydroxyalkanoates and poly-(R)-3-hydroxyalkenoates. Applied and Environmental Microbiology 54: 2924-2932.
21. Merritt JH, Kadouri D, E., O´Toole GA (2005) Growing and analyzing static biofilms. Current Protocols in Microbiology: Unit IB.1.1-1B.1.17.
22. de Weger LA, van der Vlugt CIM, Wijfjes AH, Bakker PA, Schippers B, Lugtenberg BJ (1987) Flagella of plant-growth-stimulating Pseudomonas fluorescens strain are required for colonization of potato root. Journal of Bacteriology 169: 2769-2775.
23. Lugtenberg BJ, Dekkers L, Bloemberg GV (2001) Molecular determinants of rhizosphere colonization by Pseudomonas. Annual Review of Phytopathology 39: 461-490.
24. Rudrappa T, Biedrzycki ML, Bais HP (2008) Causes and consequences of plant-associated biofilms. FEMS Microbiology Letters 64: 153-166.
25. de Bruijn I, de Kock MJD, de Waard P, van Beek TA, Raaijmakers JM (2007) Massetolide A Biosynthesis in Pseudomonas fluorescens. Journal of Bacteriology 190: 2777-2789.
26. de Bruijn I, Raaijmakers JM (2008) Regulation of Cyclic Lipopeptide Biosynthesis in Pseudomonas fluorescens by the ClpP Protease. Journal of Bacteriology 191: 1910-1923.
27. Cabiscol E, Tamarit J, Ros J (2000) Oxidative stress in bacteria and protein damage by reactive oxygen species. International Microbiology 3: 3-8.
28. Touati D (2000) Iron and Oxidative Stress in Bacteria. Archives of Biochemistry and Biophysics 373: 1-6.
29. Hempel SL, Buetner GR, O’ Malley YQ, Wessel DA, Flaherty DM (1999). Dihydrofluorescein diacetate is superior for detecting intracellular oxidants: comparison with 2’,7’ - dichlorodihydrofluorescein diacetate, 5(and 6)-carboxy-2’,7’-dichlorodihydrofluorescein diacetate, anddihydrorhodamine 123. Free Radical Biology and Medicine 27: 146-159.
30. Meyer JM, Abdallah MA (1978) The fluorescent pigment of Pseudomonas fluorescens: biosynthesis, purification and physicochemical properties. Journal of General Microbiology 107: 319-328.
31. Youard ZA, Mislin GLA, Majcherczyk PA, Schalk IJ, Reimmann C (2007) Pseudomonas fluorescens CHA0 produces enantio-pyochelin, the optical antipode of the Pseudomonas aeruginosa siderophore pyochelin. The Journal of Biological Chemistry 282: 35546-35553.
32. Hill-Cottingham DG (1955) Spectrophotometric determination of iron chelates. Part I. Analyst 80: 906-908.
33. Hill-Cottingham DG (1957) Spectrophotometic determination of iron chelates. PartII. Analyst 82: 524-525.
34. Hill-Cottingham DG (1957) A spectrophotometric method of analysis of chelate solutions and its application to the study of iron chelates in soils and plants. Soil Science 84: 43-49.
35. Malini S (1996) Heavy metal chelates of fusaric acid: in vitro spectrophotometry. Journal of Phytopathology 57: 221-231.
36. Bacon CW, Hinton DM, Hinton A (2006) Growth-inhibiting effects of concentrations of fusaric acid on the growth of Bacillus mojavensis and other biocontrol Bacillus species. Journal of Applied Microbiology 100: 185-194.
37. Landa B, B., Cachinero-Díaz JM, Lemanceau P, Jímenez-Díaz RM, Alabouvette C (2002) Effect of fusaric acid and phytoanticipins on growth of rhizobacteria and Fusarium oxysporum. Canadian Journal of Microbiology 48: 971-985.
38. Gaumann E (1958) The mechanism of fusaric acid injury. Phytopathology 48: 670.
39. Marrè MT, Vergani P, Albergoni FG (1993) Relationship between fusaric acid uptake and its binding to cell structures by leaves of Egeria densa and its toxic effects on membrane permeability and respiration. Physiological and Molecular Plant Pathology 42: 141-157.
40. Pavlovkin J, Mistrík I, Prokop M (2004) Some aspects of the phytotoxic action of fusaric acid on primary Ricinus roots. Plant Soil and Environment 50: 397-401.
41. Koehler K, Bentrup F (1983) The effect of fusaric acid upon electrical membrane properties and ATP level in photoautotropic cell suspension cultures of Chenopodium rubrum. Z Pflanzenphysiologie 102: 355-361.
42. Kuzniak E (2001) Effects of fusaric acid on reactive oxygen species and antioxidants in tomato cell cultures. Journal of Phytopathology 149: 575-582.
43. Gutierrez PL (2000) The metabolic of Quinone-containing alkylating agents: free radical production and measurement. Frontiers in Bioscience 5: 629-638.
44. Stewart PS, Costerton JW (2001) Antibiotic resistance of bacteria in biofilms. Lancet 358: 135-138.
45. Lim CL, Hassan KA, Tetu SC, Loper JE, Paulsen IT (2012) The effect of iron limitation on the transcriptome and proteome of Pseudomonas fluorescens Pf-5. PLoS One 7: e39139.
46. Elad Y, Baker R (1985) Influence of trace amounts of cations and siderophore-producing Pseudomonas on chlamydospore germination of Fusarium oxysporum. Ecology and Epidemiology 75: 1047-1052.
47. Elad Y, Baker R (1985) The role of competition for iron and carbon in suppression of chlamidospore germination of Fusarium spp. by Pseudomonas spp. Ecology and Epidemiology 75: 1053-1059.
48. Sneh B, Dupler M, Elad Y, Baker R (1984) Chlamydospore germination of Fusarium oxyporum f. sp. cucumerinum as affected by fluorescent and lytic bacteria from a Fusarium-suppressive soil. Ecology and Epidemiology 74: 1115-1124.
|
Revista QuímicaViva Número 3, año 15, Diciembre 2016 quimicaviva@qb.fcen.uba.ar |