Actividad experimental para introducir el concepto de azeotropía
Santiago Veiga
Cátedra de Fisicoquímica, D.E.T.E.M.A, Facultad de Química, Udelar, Montevideo, Uruguay
Polo Educativo Tecnológico UTU- Sede Latu, Montevideo, Uruguay.
Recibido: 30/09/2016 - Aceptado: 07/11/2016
Resumen
La dificultad de separar la mezcla etanol-agua por destilación radica en su comportamiento termodinámico, pues forma una mezcla azeotrópica. Éste es un fenómeno interesante al que se le da poca importancia en el laboratorio de química a nivel universitario. Esta actividad consiste en estudiar el proceso de destilación y algunas de sus modificaciones como son: a) la realización de destilaciones simples de mezclas 10 y 50% en peso de etanol registrando la temperatura y determinando la composición del destilado, b) incorporación del proceso de destilación fraccionada a presión atmosférica para las mezclas obtenidas por destilación simple y c) modificación en la composición del azeótropo al realizar la destilación fraccionada a presión reducida (300 mmHg).
Palabras clave: mezclas etanol-agua, destilación, azeótropo, presión reducida
Experimental activity to introduce the azeotropic concept
Summary
The difficulty of separating the ethanol-water mixture by distillation is its thermodynamic behavior, since they form an azeotropic mixture. This is an interesting phenomenon that is given little importance in the chemistry laboratory at university level. This activity involves studying the distillation process and some of its modifications such as: a) performing simple distillations of 10 and 50% (w/w) ethanol solutions recording the temperature and determining the composition of the distillate, b) integration of fractional distillation at atmospheric pressure to mixtures obtained by simple distillation c) change in the composition of the azeotrope by performing fractional distillation at reduced pressure (300 mmHg).
Keywords: ethanol-water mixtures, distillation, azeotrope, reduced pressure
Introducción
La destilación es la técnica de separación más ampliamente utilizada en la industria de procesos químicos. Durante este proceso en el laboratorio la mayoría de los estudiantes parecen esperar que los componentes de una mezcla líquida se vaporicen una después de la otra, en concordancia con sus puntos de ebullición. Esta concepción de componentes independientes surge de la enseñanza de la química a nivel pre-universitaria donde las propiedades de las mezclas apenas se tratan y donde la destilación ha sido presentada explícitamente como un método de separación basado en las diferencias de puntos de ebullición de los componentes. La destilación se basa en la diferencia entre los puntos de ebullición de los componentes involucrados. Esta separación depende, de que cuando un líquido es vaporizado parcialmente, las composiciones de vapor y líquido difieran. La fase vapor generalmente se enriquece en el componente más volátil respecto a la fase líquida y mediante la separación continua de estas fases y la repetición de la vaporización es posible lograr la separación deseada.
A bajas presiones y temperaturas moderadas, alejado del punto crítico, el equilibrio líquido-vapor para una mezcla multicomponente puede ser expresado como [1]:
yi . P = xi . γi . Pisat i= 1,2….n (Ecuación 1)
Donde yi y xi son las composiciones del vapor y el líquido en equilibrio del componente i respectivamente, P es la presión del sistema, γi es el coeficiente de actividad del componente i en la fase líquida y Pisat es la presión de vapor saturado del componente i. El coeficiente de actividad γi es una medida de la no-idealidad de la mezcla y es función de la temperatura y la composición. Cuando γi=1 la mezcla puede denominarse ideal y la ecuación anterior se simplifica para obtener la ley de Raoult.
yi . P = xi . Pisat i= 1,2….n (Ecuación 2)
Mezclas no-ideales exhiben desviaciones positivas ( γi > 1) o negativas ( γi < 1) de la ley de Raoult. Si estas desviaciones son muy grandes la presión de vapor exhibe un punto extremo (máximo o mínimo) a temperatura constante o exhibe el mismo comportamiento en la temperatura de ebullición a presión constante y la mezcla se denomina azeotrópica. En este punto la composición de la fase líquida y de la fase vapor en equilibrio son iguales (x = y).
El estudiante puede observar que al alcanzar la composición azeotrópica, durante el proceso de destilación, la temperatura y la presión se mantienen constantes. Por este motivo en algunos casos un azeótropo puede ser confundido con un componente puro, sin embargo puede distinguirse fácilmente modificando la composición o la presión del sistema.
Para describir adecuadamente un azeótropo (del griego: a-no, zeo-hervir, tropos-cambio) hace falta conocer el punto de ebullición a una presión dada, por lo general la atmosférica y la composición. Si el azeótropo se compone de una sola fase, propiedades como la densidad o el índice de refracción pueden ser utilizadas para determinar la composición a partir de una curva de calibración preparada a partir de una serie de disoluciones conocidas.
El fenómeno de azeotropía fue identificado por primera vez por Wade y Merriman cuando determinadas mezclas exhibían un máximo o mínimo en la temperatura de ebullición a presión constante [2].
En resumen, la formación de un azeótropo depende de dos factores: de la diferencia de la temperatura de ebullición de los componentes puros y del grado de no idealidad, por lo tanto cuanto más cercana es la temperatura de ebullición de los componentes puros y cuanto más alejada del comportamiento ideal se encuentre la mezcla, mayor es la probabilidad de formarse un azeótropo [3-4]
En el caso de la mezcla etanol-agua se encuentra un azeótropo en 89,4 % mol de etanol a 78,2°C a 1 atm. Esta temperatura es la mínima a la cual la solución etanol-agua puede entrar en ebullición, por lo tanto el etanol solo puede ser purificado hasta aproximadamente 95% en volumen conocido como etanol rectificado [5]. Una vez que se alcanza esa composición los coeficientes de actividad del agua y del etanol son iguales, entonces la concentración del vapor es igual a la del líquido y por lo tanto destilaciones posteriores no son efectivas. Cuando para un determinado proceso se requieren composiciones de alcohol mayores, por ejemplo, cuando se usa como aditivo para las naftas, debe utilizarse algún otro método para aumentar esa concentración, entre las más desarrolladas se encuentran la destilación azeotrópica con benceno o ciclohexano [6], adsorción física con tamices moleculares [7] y a través de membranas de pervaporación [8]. Otra posible alternativa para obtener etanol anhidro es a partir de la destilación a vacío, debido a que el azeótropo desaparece a una presión por debajo de los 11,5 kPa (aproximadamente 80 mmHg) [9]. Igualmente este proceso no es económicamente viable debido a que requiere una gran cantidad de etapas y un alto reflujo y esto tiene involucrado un elevado consumo energético, pero si puede ser útil su análisis a nivel de laboratorio para comprender su fundamento.
Materiales y métodos
Para la preparación de las disoluciones, para construir la curva de calibración, se utilizó etanol absoluto anhidro y agua destilada. Las disoluciones fueron preparadas en peso utilizando una balanza analítica. El equipo de destilación simple consta de un balón de destilación de 500 mL que se ubica dentro de una manta calefactora, un cabezal de destilación, un refrigerante funcionando a contracorriente y sensores de temperatura ubicados en el balón de destilación y en la entrada del refrigerante donde condensa el vapor. El cabezal se encuentra aislado del exterior recubriéndolo con algodón.

Figura 1: Equipo para destilación fraccionada a) presión atmosférica y b) presión reducida
Para la destilación fraccionada se utiliza un equipo como el que se observa en la Figura 1 a). Este consta de una columna Vigreux de 1,1 m de largo por 3 cm de diámetro también aislada, con un refrigerante colocado en la parte superior, sensores de temperatura en el balón y en el tope de la columna (conectados a una interfaz Pasco®) y una llave por donde se retira parte del vapor condensado. Para trabajar a presión reducida se tapa el refrigerante superior y se conecta una bomba de vacío y un sensor de presión absoluta (Figura 1 b). Para calcular las composiciones de todas las muestras se elaboró una curva de calibración a partir de la medida del índice de refracción con un refractómetro de Abbé para distintas composiciones de mezcla etanol-agua. Todas las experiencias fueron realizadas en un laboratorio termostatizado a 20°C por lo tanto el índice de refracción de los datos de la curva de calibración y de todas las muestras obtenidas están referidas a esa temperatura teniendo en cuenta que esta propiedad se ve influenciada por una variación de la temperatura.
Resultados y discución
A partir de la Figura 2 a) se observa que el mejor ajuste de los datos experimentales se obtiene para un polinomio de cuarto grado. Para evitar el problema de resolver una ecuación de cuarto grado y con el inconveniente agregado que un índice de refracción hallado pueda corresponder a 2 valores de fracción molar, se procedió a hacer una dilución de todas las muestras obtenidas con el fin de simplificar la resolución numérica. En esas condiciones la curva utilizada es la Figura 2 b). Para esto en todos los casos se obtuvo 1 mL de la muestra y se agregaron 3 mL de agua destilada utilizando una pipeta automática. Se prepararon mezclas de 10% y 50% en peso de etanol. La mezcla de 10% en peso en etanol puede representar la mezcla obtenida luego del proceso de fermentación para acercar la actividad a una mezcla obtenida en la industria. A partir del diagrama de equilibrio líquido-vapor adaptado de [10] (Figura 3), pueden obtenerse las temperaturas de ebullición de las mezclas de partida y las composiciones de destilado esperadas.
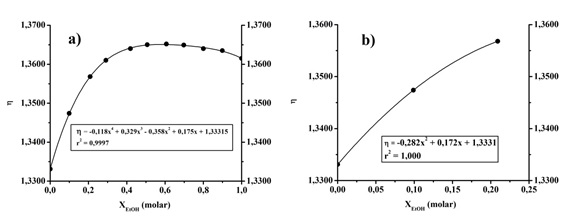
Figura 2: Curva de calibración para disoluciones etanol-agua
Se realizaron destilaciones simples recogiendo 1 mL de destilado a intervalos regulares de 3 minutos y se registró la variación de temperatura del balón y en la entrada del refrigerante donde condensa el vapor.
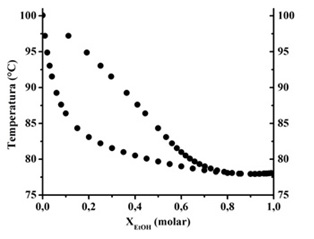
Figura 3: Diagrama de equilibrio líquido-vapor para el sistema etanol-agua. Adaptado de [10].
A partir de la Figura 4 puede observarse que la temperatura de ebullición de la mezcla en el balón y a la entrada del refrigerante prácticamente coincide. Esto es coherente ya que todo el cabezal de destilación se encuentra aislado. Igualmente debe remarcarse la idea de que la temperatura del vapor a la entrada del refrigerante es la que se utiliza como un posible cambio en los matraces recolectores o en la finalización de la destilación.
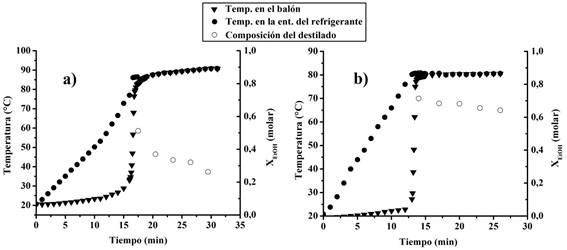
Figura 4: Destilación simple de la mezcla a) 10% p/p de etanol y b) 50 % p/p de etanol
Como puede observarse en ambas destilaciones al avanzar la destilación la composición del destilado se enriquece en el componente menos volátil, por lo tanto la composición más rica en etanol corresponde a la primera gota de destilado obtenido. En este punto también puede analizarse el rendimiento de una destilación. Al obtener más masa de destilado su composición en etanol va a disminuir. En algunos procesos se va a requerir un destilado más puro que va en contraposición con la cantidad que puede obtenerse. Para aumentar esa composición puede anteponerse al refrigerante una columna de fraccionamiento. En ésta el vapor que se genera a partir de la mezcla en ebullición sufre una serie de condensaciones y evaporaciones a lo largo de la columna con lo cual se va enriqueciendo en el componente más volátil. En general cuanto más larga sea la columna y mayor la superficie de contacto dentro de la columna más efectiva será la separación de los componentes aunque también depende de otros factores [11].
La experiencia no es estrictamente una destilación fraccionada ya que se trabaja a reflujo total (todo el vapor que llega al tope de la columna es condensado y vuelve al balón). Lo que se obtiene es una pequeña cantidad de ese vapor que se lo hace condensar luego de alcanzar el estado estacionario. El mismo se verifica tomando varias muestras en distintos tiempos.
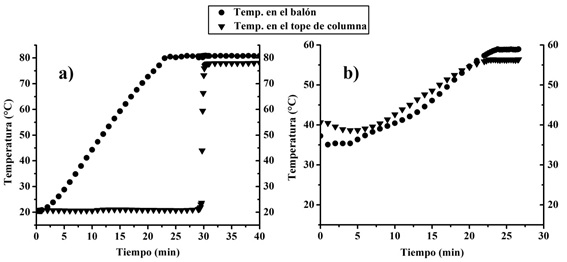
Figura 5: Perfil de temperatura en destilación fraccionada a: a) presión atmosférica y b) presión reducida
A partir de los 30 minutos se tomaron las medidas luego de termostatizar el vapor condensado. A partir de la Figura 5 a) puede observarse que la temperatura en el tope de la columna es 78,1 °C y la composición determinada del vapor condensado es 0,892 molar en etanol, por lo tanto se podría afirmar que se alcanzó la composición azeotrópica. Esto quiere decir que por más que se destile una composición inicial mayor en etanol que esta última se va a obtener la composición azeotrópica. Utilizando esta misma mezcla de 50% en peso de etanol se realizó una destilación a vacío. Para eso se cerró el refrigerante superior y se conectó una bomba de vacío. Se lleva el sistema hasta una presión de 300mmHg y se repite la toma de muestra a través de una septa de goma utilizando una jeringa luego de alcanzar el estado estacionario.
Diferencias en el perfil típico de temperaturas para la Figura 5 b) se atribuye a la manipulación de la bomba de vacío para mantener la presión constante. La composición azeotrópica en esas condiciones es 0,920 molar en etanol a 56,4°C. Este valor se encuentra razonablemente cerca de los informados en bibliografía (Tabla I) donde se reportan datos estimados de la composición del azeótropo a presiones por debajo de la atmosférica.
| Datos bibliográficos | ||||||||
| P (mmHg) | Taz (°C) | XEtOH (molar) | [12] | [13] | [9] | |||
| Taz (°C) | XEtOH (molar) | Taz (°C) | XEtOH (molar) | Taz (°C) | XEtOH (molar) | |||
| 761 | 78,1 | 0,892 | 78,2 | 0,894 | 78,18 | 0,904 | - | - |
| 300 | 56,4 | 0,920 | - | - | 56,51 | 0,924 | 56,5 | 0,925 |
Conclusión
Se diseñó una actividad que permite comprender un proceso muy utilizado a nivel de laboratorio e industrial como ser la destilación utilizando solventes relativamente inocuos y poder comparar el desempeño de una destilación simple, fraccionada y la máxima composición de etanol que puede obtenerse por este método (composición azeotrópica). También se plantea una alternativa para aumentar la composición en etanol obtenida que es disminuyendo la presión del sistema modificando la composición del azeótropo.
Agradecimientos
A los Dres. Alejandro Amaya y Juan Bussi, al Lic. Germán Morales, al I.Q. Jorge De Vivo, al I.Q. Aníbal Bruzzone y al Polo Tecnológico Educativo del LATU por permitir el uso de sus instalaciones para desarrollar esta actividad.
Referencias:
1. Treybal RE (1980) Mass-transfer operations: third edition, New York, U.S.A., McGraw-Hill.
2. Wade JD, Merriman RW (1911) Influence of water on the boiling point of ethyl alcohol at pressures above and below the atmospheric pressure. Journal of the Chemical Society, Transactions, 99, 997-1011.
3. Horsley LH (1973) Azeotropic Data – III, Advances in Chemistry Series 116, Washington DC, USA, R.F. Gould.
4. King CJ (1980) Separation Processes: second edition, New York, U.S.A. Mc-Graw Hill.
5. Chao H, Xingang L, Xhimin X, Peng B (2007) Design and Operation of Batch Extractive Distillation with Two Reboilesr. Chinese Journal of Chemical Engineering, 15(2), 286-290.
6. Chianese A, Zinnamosca F (1990) Ethanol dehydration by azeotropic distillation with a mixed-solvent entrainer. The Chemical Engineering Journal, 43, 59-65.
7. Purbasari A, Istirokhatun T, Devi AM, Mahsunnah L, Susanto H (2013) Preparation and Characterization of Zeolite Membrane for Bioethanol Purification. Bulletin of Chemical Reaction Engineering & Catalysis, 8(1), 47-53.
8. Gao C, Zhang M, Ding J, Pan F, Jiang Z, Li Y, Zhao J (2014) Pervaporation dehydration of ethanol by hyaluronic acid/sodium alginate two-active-layer composite membranes. Carbohydrate Polymers 99, 158– 165.
9. Njenga HN (2004) Estimation of azeotropic compositions of the ethanol water system below 760 mmHg pressure. International Journal of BioChemiPhysics, 13(2), 43-46.
10. http://vle-cal.com accesado 26/05/2016.
11. Snyder HR, Shriner RL (1940) An Efficient Fractional Distillation Column. An Experiment Suitable for Use in Beginning Organic Laboratory Work. Journal of chemical education, 17 (12), 588-590.
12. Gmehling J, Menke J, Krafczyk J, Fischer K (1994) Azeotropic Data, Part I and Part II. VCH-Publishers, Weinheim, New York, U.S.A.
13. Pérez Ones O, Díaz J, Zumalacárregui L, Gozá León O (2010) Evaluación de propiedades físicas de mezclas etanol-agua. Revista Facultad de Ingeniería Universidad de Antioquia, 52, 62-74.
|
Revista QuímicaViva Número 3, año 15, Diciembre 2016 quimicaviva@qb.fcen.uba.ar |