Actividad antibacteriana in vitro de nuevas chalconas halogenadas
Marian Blanco Ponce1, Ariamna Dip Gandarilla1, Eugenio Torres Rodríguez1, Dilver Peña Fuentes1, Christian Vogel2, Mijail Bullaín Galardis3, Leobel Fajardo Cedeño4
1Centro de Estudios de Química Aplicada. Universidad de Granma. Bayamo. Cuba
2Instituto de Química. Universidad de Rostock. Alemania.
3Centro de Estudios de Biotecnología Vegetal. Universidad de Granma. Bayamo. Cuba.
44Empresa Laboratorio Farmacéutico Oriente, MEDILIP. Bayamo. Granma. Cuba
Recibido: 06/06/2016 - Aceptado: 26/07/2016
Resumen
Las chalconas, importantes precursores de la biosíntesis de flavonoides e isoflavonoides, son muy conocidas por su potencial actividad antimicrobiana, antinflamatoria, antiespasmódica, antioxidante, entre otras. En este trabajo se reporta la síntesis de cuatro nuevas chalconas halogenadas con rendimientos entre 34 y 63 %. Todos los compuestos fueron caracterizados mediante espectroscopia infrarrojo, resonancia magnética nuclear (RMN-1H y 13C), análisis elemental cuantitativo y espectrometría de masas de alta resolución. Se evaluó la actividad antibacteriana in vitro de las chalconas sintetizadas a través del método de difusión en agar por diseminación superficial en disco de Bauer-Kirby y se determinó la concentración inhibitoria mínima de los compuestos mediante el método de microdilución en caldo. Uno de los compuestos obtenidos, la 1,5-bis-(5-cloro-2-hidroxifenil)pent-1,4-dien-3-ona, mostró halos de inhibición (19 mm) y concentración inhibitoria mínima (4 µg/mL) comparables con antibióticos comerciales frente a cepas de bacterias Gram positivas y Gram negativas.
Palabras clave: síntesis, chalconas halogenadas, actividad antibacteriana, concentración inhibitoria mínima.
In vitro antibacterial activity of new halogenated chalcones
Summary
Chalcones, important precursors for the biosynthesis of flavonoids and isoflavonoids, are known for their potential antimicrobial, anti-inflammatory, anti-spasmodic, anti-oxidant activities, among others. In this paper we report the synthesis of four new halogenated chalcones derivatives in 34–63% yields. All compounds were characterized by infrared spectroscopy, nuclear magnetic resonance (1H- and 13C-NMR), elementary analysis and high resolution mass spectra. The antibacterial activity of synthesized chalcones was evaluated in vitro by the agar diffusion method of Bauer-Kirby. The minimal inhibitory concentration of compounds was determined by making serial micro dilutions. One of the synthesized compounds, the 1,5-bis-(5-chloro-2-hydroxiphenyl)pent-1,4-dien-3-one showed diameters of zones of inhibition (19 mm) and a minimal inhibitory concentration (4 µg/mL) similar with commercial available antibiotics for Gram-positive and Gram-negative bacteria.
Keywords: synthesis, halogenated chalcones, antibacterial activity, minimum inhibitory concentration.
Introducción
Las chalconas son metabolitos secundarios que se encuentran de forma natural en muchas plantas, fundamentalmente en helechos, coníferas y vegetales de forma general [1-3]. Estos compuestos son importantes precursores en la biosíntesis de flavonoides e isoflovonoides y son considerados como un subgrupo de esta familia. Su estructura se caracteriza por la presencia de un anillo aromático en el extremo de una cadena de 3 átomos de carbono con insaturaciones α,β (1,3-difenil-2-propen-1-ona) [4]. Otros autores consideran las chalconas como derivados de los curcuminoides [5].
Las chalconas son estructuras que han ganado el interés de muchos investigadores debido a su probada actividad biológica. Se reportan diversas propiedades farmacológicas para este tipo de estructuras, demostrándose su actividad antiviral y anticancerígena [3,6-7], antimicrobiana [7-8], antioxidante [3,7], antinflamatoria [6,9], antitumoral [3], antiulcerosa [10] y antiespasmódica [11-12]. Por ello se considera que estos compuestos presentan importantes potencialidades terapéuticas.
Debido a la creciente resistencia de los microorganismos frente a los antibióticos comerciales, la obtención de nuevas sustancias con actividad antimicrobiana continúa siendo objeto de numerosas investigaciones en la actualidad [4,13]. La obtención de análogos de chalconas con potencialidades bioactivas pudiera ser una alternativa en la búsqueda de nuevos antibióticos.
Algunos estudios manifiestan que el grupo carbonilo α,β-insaturado del núcleo de las chalconas junto con el grupo hidroxilo (OH) presente en el anillo aromático, son los factores más importantes que determinan su bioactividad [7,13]. Otros autores han propuesto que la posición de los grupos OH y metoxi (OCH3), la introducción de halógenos, así como la cantidad de sustituyentes que presentan los anillos aromáticos son también factores que influyen en el aumento de las potencialidades farmacológicas de esta familia de compuestos [14-17].
Los halógenos, de forma general, confieren estabilidad a los fármacos e impiden el fracaso de los mismos en los estudios farmacocinéticos y farmacodinámicos. Los compuestos halogenados atraviesan la membrana celular con mayor facilidad debido a la polaridad conferida por este tipo de átomos. Generalmente los organismos superiores no producen sustancias halogenadas, lo que convierte a estas estructuras en fármacos potenciales [18].
En este trabajo se describen las síntesis de nuevas chalconas halogenadas, aplicando modificaciones de la reacción de condensación aldólica clásica, [19-21] y la evaluación de la actividad antibacteriana in vitro de los compuestos obtenidos.
Materiales y métodos
El trabajo de síntesis se realizó en el laboratorio de Química Orgánica del Centro de Estudios de Química Aplicada (CEQA) de la Universidad de Granma, Cuba y en el Instituto de Química de la Universidad de Rostock, Alemania.
Los reactivos y disolventes empleados en el trabajo experimental fueron de calidad analítica provenientes de las firmas Merck y Sigma-Aldrich.
Las temperaturas de fusión se determinaron en microplatina de calentamiento BHMK 05 tipo Boetius. Los espectros IR se registraron en espectrofotómetros FTIR Phillips PU-9624 y FTIR Nicolet 205. Los espectros RMN-1H (300 MHz) y RMN-13C (75, 62 MHz), fueron obtenidos en equipos AC 250 y ARX 300. AVANCE 500 a 20 °C. Las señales en los espectros 1H y 13C se asignaron con ayuda de experimentos COSY, DEPT y HSQC. Como disolvente se utilizó dimetilsulfóxido deuterado (DMSO-d6). Los espectros de masas de alta resolución (EMAR) se registraron en un espectrómetro INTECTRA GmbH, modelo AMD-402/3, mediante las técnicas de ionización por electro spray (ESI). El análisis elemental cuantitativo se realizó en equipos de las firmas CARLO ERBA CHNS-O EA-1108 y Leco CHNS-932.
Síntesis de chalconas arilhalogenadas
La síntesis de chalconas arilhalogenadas se realizó haciendo algunas modificaciones al método propuesto por Sardjiman y colaboradores [22].
Método de síntesis A (Para la obtención de las chalconas 1, 2 y 3)
Se mezclaron 10 mmoles del aldehído correspondiente y 10 mL de etanol al 65 %, la mezcla se enfrió en baño de hielo a 0 ºC y se añadieron 5 mL de NaOH al 50 % bajo agitación. Luego se gotearon 0,18 mL de acetona (5 mmoles), la mezcla se agitó durante 1 h a la misma temperatura y posteriormente por 2 h a temperatura ambiente. Cuando la cromatografía de capa delgada (CCD) indicó el fin de la reacción, se añadió agua (50 mL) y la disolución roja se neutralizó con 50 mL de HCl al 10 %. El sólido formado se filtró, se lavó con agua y se recristalizó en etanol.
Método de síntesis B (Para la obtención de la chalcona 4)
Inicialmente se obtuvo la monochalcona 4-(4-hidroxi-3-yodo-5-metoxifenil)-3-buten-2-ona según el procedimiento reportado por Ryu y colaboradores. Los datos analíticos concuerdan con los reportados por estos autores [23].
10 mmoles de 4-(4-hidroxi-3-yodo-5-metoxifenil)-3-buten-2-ona y 5 mmoles de 5-iodovainillina se disolvieron en 4 mL de DMF. Posteriormente se añadió 0.1 mL de tetrahidroquinolina, la mezcla de reacción se agitó a 40 ºC durante 1 h y luego a 85 ºC durante 4 h. Después de enfriar a 25 ºC, fueron añadidos 100 mL de CHCl3 y la mezcla fue lavada tres veces con 20 mL agua. La fase orgánica se secó con Na2SO4 anhidro y se concentró en vacío. El producto se purificó a través de recristalización en ácido acético.
Evaluación de la actividad antibacteriana de los análogos de chalconas
Se utilizó el método de difusión en agar por diseminación superficial en disco de Bauer-Kirby [24], con algunas modificaciones [25]. Los inóculos se prepararon a partir de colonias crecidas durante 24 h y se ajustaron con el patrón 0.5 de McFarland. La siembra se realizó sobre agar Mueller-Hinton (BioCen, Cuba) con hisopos estériles. Con cada uno de los compuestos se preparó una disolución estándar de 20 mg/mL, utilizando DMSO como disolvente. Se adicionaron 5 µL de esta disolución a discos de papel de filtro (Whatman, Inglaterra) de 6 mm de diámetro previamente esterilizados, quedando aproximadamente 100 µg/disco. Luego, las placas de Petri se incubaron a (37 ± 0.1) ºC durante 24 horas en una incubadora (Boxun BG-80, China). Los halos de inhibición del crecimiento del microorganismo alrededor de los discos se midieron en milímetros. Cada tratamiento tuvo tres repeticiones. Se utilizaron como controles negativos, discos de papel de filtro de 6 mm de diámetro cargados con 5 µL de DMSO, y como controles positivos, discos de los antibióticos comerciales Amoxicilina (30 µg/disco) para cepas Gram negativas y Gentamicina (30 µg/disco) para cepas Gram positivas, (Sensi–DiscTM, Francia). Los resultados se declararon como el promedio del diámetro de los halos de inhibición para cada tratamiento.
Cepas bacterianas evaluadas
Se utilizó una batería constituida por dos cepas de referencia internacional, depositadas en el American Type Culture Collection (ATCC) y tres cepas salvajes aisladas en el Centro de Higiene y Epidemiología del municipio Manzanillo, provincia Granma, Cuba.
- Bacillus subtilis subsp spizizenii (ATCC 6633)
- Staphylococcus aureus sp. (salvaje)
- Pseudomonas aeruginosa (salvaje)
- Salmonella typhimurium (ATCC 14028)
- Escherichia coli sp. (salvaje)
Determinación de la Concentración Inhibitoria Mínima (CIM) de los análogos de chalconas
Para determinar la concentración inhibitoria mínima (CIM) se empleó el método de microdilución en caldo [26]. Para cada uno de los compuestos se elaboró una disolución estándar partiendo de 20 mg del sólido, que fueron disueltos en 1 mL de dimetilsulfóxido (DMSO) para una concentración final de 20 mg/mL. Se prepararon cuatro disoluciones de trabajo a partir de las disoluciones estándar mediante una dilución 1:5 para obtener una concentración final de 4 mg/mL. Se añadieron 100 µL de caldo Mueller-Hinton (BioCen, Cuba) en los pocillos de una placa de cultivo de 96 pocillos (Corning). Luego se mezclaron en la primera hilera de pocillos 100 µL de la solución de trabajo y se realizaron diluciones seriadas dobles hasta la hilera 10. Se adicionaron 100 µL del inóculo en todos los pocillos excepto en la última hilera, que constituyó el control de esterilidad. De esta forma se obtuvo un rango de concentración entre 1000 – 2 µg/mL para las fracciones, así como un control de crecimiento y un control de esterilidad sin los compuestos. Las placas de cultivos se incubaron a (37 ± 0,1) °C por un período de 24 horas en una incubadora (Boxun BG-80, China). La concentración inhibitoria mínima se determinó como la concentración mínima del extracto que inhibió completamente el crecimiento bacteriano a simple vista. El ensayo se realizó por triplicado para cada una de las bacterias.
Resultados y discusión
Siguiendo el método de síntesis A se obtuvieron tres nuevas chalconas arilhalogenadas (Fig. 1) con rendimientos de aproximadamente un 60 % (Tabla I).
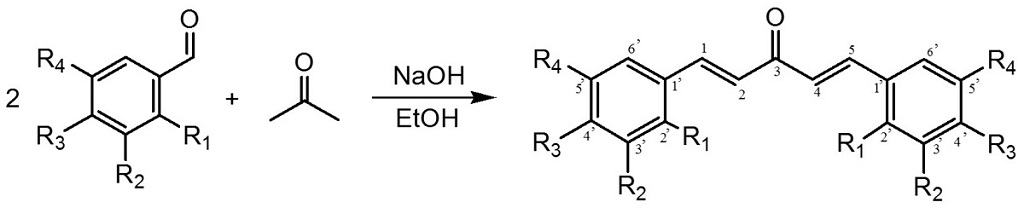
Figura 1: Esquema de síntesis de chalconas halogenadas a través del método A.
Siguiendo el método de síntesis B se obtuvo una nueva chalcona arilhalogenada (Fig. 2) con un rendimiento de 35 % (Tabla I).
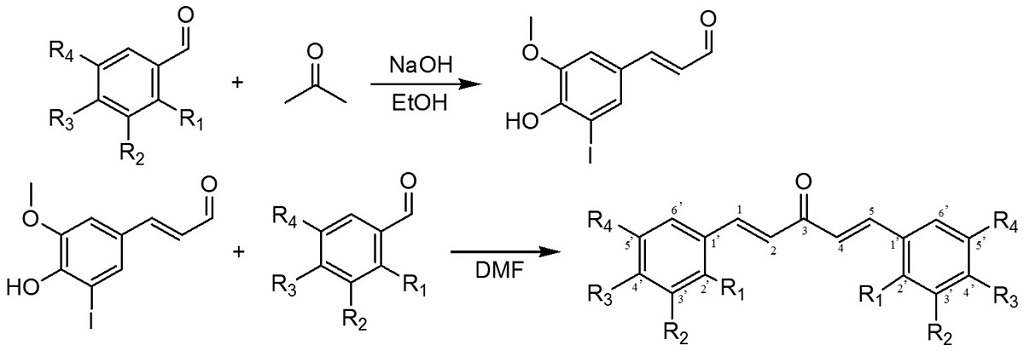
Figura 2: Esquema de síntesis de chalconas halogenadas a través del método B.
En la tabla I se muestran los sustituyentes de los anillos y los rendimientos alcanzados durante la síntesis de las chalconas halogenadas.
Tabla I. Análogos de chalconas arilhalogenadas obtenidos.
| Compuestos | R1 | R2 | R3 | R4 | Rdto (%) | Método |
| 1 | OH | H | H | Br | 63 | A |
| 2 | OH | H | H | Cl | 59 | A |
| 3 | OH | H | H | I | 60 | A |
| 4 | H | I | OH | OCH3 | 34 | B |
El aldehído usado para obtener el compuestos 4 presenta características más ácidas que los usados para sintetizar las chalconas 1, 2 y 3. De ahí que fuera necesario utilizar un medio fuertemente básico en el cual los productos (chalconas) son inestables [27-28]. Por otro lado, la presencia del grupo metoxi en el aldehído pudiera hacerlo susceptible a las condiciones ácidas aplicadas en el método A, dificultando la obtención de la chalcona 4 por esta vía. Por ello se decidió emplear una vía de síntesis con condiciones moderadas (método B), con la cual se logró obtener el deseado compuesto 4 con un rendimientos de 34 % (Tabla I). Ambos métodos de síntesis pueden ser usados, según la estructura de los aldehídos, para la obtención de análogos halogenados de las chalconas.
Las chalconas obtenidas como producto final son sólidos cristalinos en forma de agujas, con colores entre amarillo y verde, característica esperada por la alta conjugación que presentan estas estructuras y por la presencia de grupos cromóforos como el carbonilo e hidroxilo.
Los espectros RMN-1H mostraron señales intensas debido a la simetría de los compuestos y las mismas corresponden con las estructuras propuestas. No se detectaron las típicas señales de los protones aldehídos reaccionantes, al mismo tiempo que entre los 7,38 y 7,87 ppm aparecen las señales correspondientes a los protones vinilo (CH=CH) de la pentadienona, con 3J1,2 ≈ 3J4,5 ≈ 16,05 Hz. El resto de las señales corresponden a los diferentes protones que aparecen de la estructura. El espectro RMN-13C muestra las señales de todos los átomos de carbono presentes en cada una de las estructuras.
Por otro lado, el espectro infrarrojo muestra fuertes señales alrededor de los 1620 y 3050 cm-1 correspondientes al grupo carbonilo de la pentadienona y al hidroxilo sustituido en el anillo bencénico, respectivamente. En el espectro de masas de alta resolución (EMAR) se observa coincidencia entre la masa calculada y la experimental. El análisis elemental cuantitativo muestra correspondencia entre las determinaciones de las cantidades de carbono e hidrógeno tanto calculadas como experimentales. Todo lo anterior confirma la identidad de las estructuras propuestas.
Datos de la caracterización estructural
1,5-bis-(5-bromo-2-hidroxifenil)penta-1,4-dien-3-ona (1)
Sólido verde, recristaliza en etanol (2,65 g; 63 %; método A), Tf: 180–182 ºC; Rf= 0,68 [Éter de Petróleo (EP) -Acetato de etilo (AcOEt) 1:1].
IR (KBr): 1626,2 (CO); 3054,5 (OH).
RMN-1H (DMSO-d6, 300 MHz):
δ = 6,91 (d, 2H, H-3', 3J3',4' = 8,10 Hz);
7,38 (d, 2H, H-2, H-4, 3J1,2= 3J4,5 = 16,05 Hz);
7,43 (dd, 2H, H-4', 3J3',4' = 8,10 Hz, 4J4',6' = 2.4 Hz);
7,87 (d, 2H, H-1, H-5, 3J1,2 = 3J4,5 = 16,05 Hz);
7,90 (d, 2H, H-6', 4J4',6' = 2,4 Hz);
10,58 (s, 2H, OH x 2).RMN-13C (DMSO-d6, 75,46 MHz):
δ = 110,63 (C-5');
118,40 (C-3');
123,73 (C-6');
126,60 (C-2, C-4);
130,02 (C-4');
130,69 (C-1, C-5);
133,91 (C-1');
156,39 (C-2'); 188,60 (C-3).Espectrometría de masa de alta resolución (EMAR):
M (C17H12Br2O3) calculada: 421,92;
experimental (M+3H)+: 424,91;
(M+Na)+: 446,90Análisis elemental (%):
calculado C: 48,15; H: 2,85;
experimental C:48,20; H:3,11
1,5-bis-(5-cloro-2-hidroxifenil)pent-1,4-dien-3-ona (2)
Sólido verde, recristaliza en etanol 1,97 g; 59 %; método A), Tf: 176–178 0C; Rf = 0,66 (EP-AcOEt 1:1).
IR (KBr): 1634,2 (CO); 3106 (OH).
RMN-1H (DMSO-d6, 300 MHz):
δ = 6,96 (d, 2H, H-3', 3J3',4' = 8,60 Hz);
7,31 (dd, 2H, H-4', 3J3',4' = 8,60 Hz, 4J4',6' = 2,60 Hz);
7,38 (d, 2H, H-2, H-4, 3J1,2 = 3J4,5 = 16,20 Hz);
7,88 (d, 2H, H-1, H-5, 3J1,2 = 3J4,5 = 16,20 Hz);
7,79 (d, 2H, H-6', 4J4',6' = 2,60 Hz);
10,59 (s, 2H, OH x 2).RMN-13C (DMSO-d6, 75,46 MHz):
δ = 110,63 (C-5');
117,92 (C-3');
123,11 (C-6');
126,62 (C-2, C-4);
127,81 (C-4');
131,08 (C-1, C-5);
136,57 (C-1');
155,90 (C-2');
188,63 (C-3).EMAR:
M (C17H12Cl2O3) calculada: 334,02;
experimental (M+H)+: 335,02;
(M+Na)+: 357,00Análisis elemental (%):
calculado C: 60.92; H: 3,61;
experimental C: 60,95; H: 3,68
1,5-bis-(5-iodo-2-hidroxifenil)pent-1,4-dien-3-ona (3)
Sólido amarillo, recristaliza en etanol; (3,1 g; 60 %; método A), Tf: 190–1910C; Rf = 0,67 (EP-AcOEt 1:1).
IR (KBr): 1633,4 (CO); 3101 (OH).
RMN- 1H (DMSO-d6, 300 MHz):
δ = 6,79 (d, 2H, H-3', 3J3',4' = 8,69 Hz);
7,34 (d, 2H, H-2, H-4, 3J1,2 = 3J4,5 = 16,05 Hz);
7,54 (dd, 2H, H-4', 3J3',4' = 8,69 Hz, 4J4',6'=2,10 Hz);
7,83 (d, 1H, H-1, H-5, 3J1,2 = 3J4,5 = 16,05 Hz);
8,01 (d, 2H, H-6', 4J4',6' = 2.10 Hz);
10,56 (s, 2H, OH).RMN-13C (DMSO-d6, 62,89 MHz):
δ = 81,59 (C-5');
118,79 (C-3');
124,26 (C-6');
126,40 (C-2, C-4);
136,32 (C-4');
136,48 (C-1, C-5);
139,67 (C-1');
156,87 (C-2');
188,49 (C-3).EMAR:
M (C17H12I2O3) calculada: 517,89;
experimental (M+H)+: 518,89;
(M+Na)+: 540,87Análisis elemental (%):
calculado C: 39,41; H: 2,33;
experimental C: 39,46; H: 2,58
1,5-bis(4-hidroxi-3-iodo-5-metoxifenil)pent-1,4-dien-3-ona (4)
Cristales verdes, recristaliza en ácido acético (1,92 g; 34 %; método B); Tf: 186–187 0C; Rf = 0,38 (EP-AcOEt 1:2).
IR (KBr): 1662,4 (CO); 3085,3 (OH).
RMN-1H (DMSO-d6, 300 MHz):
δ = 3,92 (s, 6H, OCH3 x 2);
7,23 (d, 2H, H-2, H-4, 3J1,2 = 3J4,5 = 16,05 Hz);
7,43 (d, 2H, H-6', 4J2',6' = 1,70 Hz);
7,65 (d, 2H, H-1, H-5, 3J1,2 = 3J4,5 = 16,05 Hz);
7,44 (d, 2H, H-2', 4J2',6' = 1,70 Hz);
10,16 (s, 2H, OH x 2).RMN-13C (DMSO-d6, 75,46 MHz):
δ = 56,27 (OCH3 x 2);
84,62 (C-3');
111,08 (C-6');
124,02 (C-2');
128,21 (C-2, C-4); 131,64 (C-1');
141,47 (C-1, C-5); 147,19 (C-4');
148,62 (C-5');
187,98 (C-3).EMAR:
M (C19H16I2O5) calculada: 577,91;
experimental (M+): 577,91;
(M+Na)+: 600,89Análisis elemental (%):
calculado C: 39,47; H: 2,79;
experimental C: 39,58; H: 3,03
Actividad antibacteriana
Teniendo en cuenta las posibles potencialidades bioactivas de las chalconas sintetizadas, fue evaluada la actividad antibacteriana (Tabla II).
Tabla II. Resultados de la evaluación de la actividad antibacteriana de los análogos de chalconas.
| Halos de inhibición (mm) frente a cepas bacterianas | |||||
| Sustancias evaluadas | Bacillus subtilis subsp. spizizenii ATCC (6633) (Gram positiva) | Staphylococcus aureus (Salvaje) (Gram positiva) | Pseudomonas aeruginosa (Salvaje) (Gram negativa) | Salmonella typhimurium ATCC (14028) (Gram negativa) | Escherichia coli (Salvaje) (Gram negativa) |
| 1 | 11,0 ± 0,6 | 12,7 ± 0,6 | 11,0 ± 1,0 | - | - |
| 2 | 18,0 ± 1,0 | 19,7 ± 0,6 | 19,0 ± 1,0 | - | - |
| 3 | - | - | - | - | - |
| 4 | 10,0 ± 1,0 | - | - | - | - |
| Gentamicina | - | 21,0 ± 1,0 | 19,0 ± 1,0 | 19,0 ± 1,0 | 20,0 ± 1,0 |
| Amoxicilina | 18,0 ± 0,6 | 31,0 ± 1,0 | ND | 18,0 ± 0,6 | |
| DMSO | - | - | - | - | - |
ND: No determinada, (-): Resultado negativo en la inhibición del crecimiento bacteriano; DMSO: dimetilsulfóxido.
Los compuestos 1 y 2, correspondientes a estructuras con Br y Cl en posición para respecto al grupo OH en el anillo, mostraron actividad frente a cepas de B. subtilis, S. aureus y P. aeruginosa. Los halos de inhibición correspondientes a la 1,5-bis-(5-cloro-2-hidroxifenil)pent-1,4-dien-3-ona (2) mostraron valores alrededor de los 19 mm, comparables con el efecto producido por los antibióticos comerciales usados como control positivo.
La 1,5-bis-(5-iodo-2-hidroxifenil)pent-1,4-dien-3-ona (3) no mostró actividad antibacteriana mientras que la 1,5-bis(4-hidroxi-3-iodo-5-metoxifenil)pent-1,4-dien-3-ona (4) solo mostró actividad frente a B. subtilis con halos de inhibición de 10 mm aproximadamente.
Se evidencia la sensibilidad de las cepas frente a los antibióticos comerciales empleados y no hubo crecimiento de bacterias frente al control negativo (DMSO), demostrando que los resultados obtenidos son producidos por las chalconas arilhalogenadas aplicadas.
Se determinó además la concentración inhibitoria mínima (Tabla III) para las estructuras que mostraron actividad antibacteriana, corroborándose los resultados anteriores.
Tabla III. Resultados de la determinación de la concentración inhibitoria mínima de las chalconas sintetizadas.
| Concentración inhibitoria mínima (µg/mL) frente a cepas bacterianas | ||||
| Sustancias evaluadas | Bacillus subtilis subsp. spizizenii ATCC (6633) (Gram positiva) | Staphylococcus aureus (Salvaje) (Gram positiva) | Pseudomonas aeruginosa (Salvaje) (Gram negativa) | |
| 1 | 31 | 16 | 250 | |
| 2 | 8 | 4 | 250 | |
| 4 | 500 | - | - | |
(-): Resultado negativo en la inhibición del crecimiento bacteriano
La concentración inhibitoria mínima de 1,5-bis-(5-bromo-2-hidroxifenil)penta-1,4-dien-3-ona (1) y 1,5-bis-(5-cloro-2-hidroxifenil)pent-1,4-dien-3-ona (2) frente a las cepas Gram positivas evaluadas muestra valores que pueden ser comparados con antibióticos comerciales, como la gentamicina y son superiores a los reportados frente a S. aureus para algunos análogos de chalconas heterocíclicas [13] y halogenadas [29].
Conclusiones
Se obtuvieron 4 nuevas chalconas halogenadas. Las mismas se evaluaron frente a cepas de bacterias Gram positivas y Gram negativas mostrando 3 de estas alguna actividad. La presencia de grupos hidroxilo y halógenos como sustituyentes le confieren a estas estructuras mayores potencialidades bioactivas, convirtiéndolas en promisorias candidatas para su aplicación farmacológica.
El método de síntesis B resultó ser el más adecuado para la obtención de la chalcona funcionalizada con I, así como metoxi en posición orto respecto al OH en el anillo aromático; mientras que el método A permitió la síntesis de chalconas con halógenos en posición para respecto al OH en el anillo aromático.
La actividad antibacteriana de las chalconas halogenadas sintetizadas se determinó frente a cepas Gram positivas (B. subtilis, S. aureus) y Gram negativas (P. aeruginosa) con resultados muy promisorios. La 1,5-bis-(5-cloro-2-hidroxifenil)pent-1,4-dien-3-ona (2) mostró CIM entre 4 y 8 µg/mL frente a las cepas de bacterias Gram positivas, valores comparables con antibióticos comerciales como la gentamicina.
Referencias:
1. Middleton E, Kandaswami C, Theoharides TC. (2000) The effects of plant flavonoids on mammalian cells: Implications for inflammation, heart disease, and cancer. Pharmacological Review. 52: 673-751.
2. Nowakowska Z (2007) A review of anti-infective and anti-inflammatory chalcones. European Journal of Medicinal Chemistry. 42: 125-137. DOI: 10.1016/j.ejmech.2006.09.019.
3. Echeverria C, Santibañez JF, Donoso-Tauda O, Escobar CA, Ramirez-Tagle R (2009) Structural antitumoral activity relationships of synthetic chalcones. International Journal of Molecular Sciences. 10: 221-231. DOI: 10.3390/ijms10010221.
4. Tran TD, Park H, Ecker GF, Thai KM (2008) 2’-Hydroxychalcone Analogues: Synthesis and Structure-PGE2 Inhibitory Activity Relationship. 12th International Electronic Conference on Synthesis Organic Chemistry. http://www.usc.es/congresos/ecsoc/12/ECSOC12.htm & http://www.mdpi.org/ecsoc-12
5. Youssef KM, El-Sherbeny MA, El-Shafie FS, Farag HA, Al-Deeb OA, Awadall SAA (2004) Synthesis of curcumin analogues as potential antioxidant, cancer chemopreventive agents. Archiv der Pharmazie. Pharmaceutical Medicinal Chemistry. 337: 42–54. DOI:10.1002/ardp.200300763.
6. Won SJ, Liu CT, Tsao LT, Weng JR, Ko HH, Wang JP, Lin CN (2005) Synthetic chalcones as potential anti-inflammatory and cancer chemopreventive agents. European Journal of Medicinal Chemistry.40: 103-115. DOI: 10.1016/j.ejmech.2004.09.006.
7. Rani A, Jain S (2011) 1,5-Bis(2-hydroxyphenyl)pent-1,4-diene-3-one: a miraculous compound with versatile applications. International Conference on Biology, Environment and Chemistry. IPCBEE ACSIT Press Singapoore. 24: 83-88.
8. Alam S, Mostahar S (2005) Studies of antimicrobial activity of two synthetic 2',4',6'-trioxygenated flavones. Journal of Applied Sciences. 5: 327-333. DOI: 10.3923/jas.2005.327.333.
9. Arockia- Babu M, Shakya N, PrathipatI P, Kaskhedikar SG, Saxena AK (2002) Development of 3D-QSAR models for 5-Lipoxygenase antagonists: chalcones. Bioorganic Medicinal Chemistry. 10: 4035-4041. DOI: 10.1016/S0968-0896(02)00313-9.
10. Ram VJ, Saxena AS, Srivastava S, Chandra S (2000) Oxygenated chalcones and bischalcones as potential antimalarial agents. Bioorganic Medicinal Chemistry Letter. 10: 2159-2161. DOI: 10.1016/S0960-894X(00)00409-1.
11. Dyrager CH, Wickström M, Fridén-Saxin M, Friberg A, Dahlén K, Wallén EA, Gullbo J, Grøtli M, Luthman K (2011) Inhibitors and promoters of tubulin polymerization: synthesis and biological evaluation of chalcones and related dienones as potential anticancer agents. Bioorganic Medicinal Chemistry. 19: 2659-2665. DOI: 10.1016/j.bmc.2011.03.005.
12. Ramírez ME, Barajas L, Pérez C, Sáenz A, Silva SY (2012) Síntesis y actividad biológica de chalconas. Revista Mexicana de Ciencias Farmacéuticas. 43: 7-14.
13. Thanh-Dao T, Thi-Thao-Nhu N, Tuong-Ha D, Thi-Ngoc-Phuong H, Cat-Dong T, Khac-Minh T (2012) Synthesis and antibacterial activity of some heterocyclic chalcone analogues alone and in combination with antibiotics. Molecules. 17: 6684-6696. DOI: 10.3390/molecules17066684.
14. Konieczny M, Skladanowski A, Lemke K, Pieczykolan J (2011) Novel chalcone derivatives with cytotoxic activity. WO2011009826.
15. Zhang H, Liu JJ, Sun J, Yang XH, Zhao TT, Lu X, Et al (2012) Design, synthesis and biological evaluation of novel chalcone derivatives as antitubulin agents. Bioorganic Medicinal Chemistry. 20: 3212-3218. DOI: 10.1016/j.bmc.2012.03.055.
16. Karthikeyana CH, Narayana NSH, Ramasamyc S, Vanamc U, Manivannand E, Karunagaranc D, Trivedi P (2015) Advances in chalcones with anticancer activities. Recent Patents on Anti-Cancer Drug Discovery.10: 1-19. DOI: 10.2174/1574892809666140819153902.
17. Boumendjel A, Boccard J, Carrupt PA, Nicolle E, Blanc M, Geze A, Et al (2008) Antimitotic and antiproliferative activities of chalcones: Forward structure-activity relationship. Journal of Medicinal Chemistry. 51: 2307-2317.
18. Herrera-Rodriguez LN, Khan F, Robins KT, Meyer HP (2011) Perspectives on biotechnological halogenation. Chimica oggi/Chemistry Today. 29: 31-33.
19. Patil CB, Mahajan SK, Katti SA (2009) Chalcone: A Versatile Molecule. Journal of Pharmaceutical Sciences and Research. 1: 11-22.
20. Claisen L, Claparéde A (1881) Condensationen von Ketonen mit Aldehyden. Chemische Berichte. 14: 2460-2468. DOI:10.1002/cber.188101402192.
21. Schmidt JG (1881) Ueber die Einwirkung von Aceton auf Furfurol und auf Bittermandelöl bei Gegenwart von Alkalilauge. Chemische Berichte. 14: 1459-1461. DOI:10.1002/cber.188101401306.
22. Sardjiman SS, Reksohadiprodjol MS, Hakiml L, Van Der Goot H, Timmerman H (1997) 1,5-Diphenyl-1,4-pentadiene-3-ones and cyclic analogues as antioxidative agents. Synthesis and structure-activity relationship. European Journal of Medicinal Chemistry. 32: 625-630. DOI: 10.1016/S0223-5234(97)83288-6.
23. Ryu EK, Choe YS, Lee KH, Choi YY, Kim BT (2006) Curcumin and dehydrozingerone derivatives: synthesis, radiolabeling, and evaluation for β-amyloid plaque imaging. Journal of Medicinal Chemistry. 49: 6111-6119. DOI: 10.1021/jm0607193.
24. Bauer AW, Kirby WMM, Sherris JC, Truck M (1966) Antibiotic susceptibility testing by a standardized single disk method. American Journal of Clinical Pathology. 45: 493-496.
25. Clinical and Laboratory Standards Institute (2007) M100-S17 (M2). Disk Diffusion Supplemental Tables, CLSI, Wayne Pa.
26. National Committee for Clinical Laboratory Standards (2003) Methods for Dilution Antimicrobial Susceptibility Tests for Bacteria That Grow Aerobically. NCCLS M7-A6. Wayne, PA.
27. Hjorth H, Karlsen J (1985) Kinetics of Curcumin Degradation in Aqueous Solution. Lebensm Unters Forsch. 180: 402-404. DOI: 10.1007/BF01027775.
28. Krackov MH, Bellis HE (1997) Process for the synthesis of curcumin-related compounds. US Patent 5, 679, 864.
29. Choudhary AN, Juyal V (2011) Synthesis of chalcone and their derivatives as antimicrobial agents. International Journal of Pharmacy and Pharmaceutical Sciences. 3: 125-128.
|
Revista QuímicaViva Número 2, año 15, Agosto 2016 quimicaviva@qb.fcen.uba.ar |