El vínculo inmunológico madre - hijo a través de la leche: mucho más que inmunidad pasiva
Claudio Rodríguez-Camejo, Ana Hernández
Cátedra de Inmunología. Facultad de Ciencias - Facultad de Química, Universidad de la República. Instituto de Higiene. Montevideo, Uruguay
Resumen
La leche humana establece una conexión efectiva entre el sistema inmune materno y el del recién nacido que se encuentra completando su desarrollo en los primeros meses de vida. La compleja naturaleza fisicoquímica de la leche permite vehiculizar eficientemente junto con los macro y micro nutrientes una diversidad de componentes con propiedades inmunológicas que otorgan protección pasiva en el intestino neonatal, siendo las inmunoglobulinas IgA e IgM secretorias, las proteínas microbicidas y las mucinas algunos de los componentes más relevantes y extensamente estudiados en este sentido. Además, durante la lactancia temprana el sistema inmune del recién nacido se desarrolla en presencia de anticuerpos maternos IgG además de los secretorios y otros componentes con propiedades inmunomoduladoras que contribuyen a la configuración de los mecanismos de tolerancia oral en el intestino neonatal así como a la selección del repertorio de especificidades de los linfocitos B; además algunos componente influyen sobre la composición de la microbiota, y su homeostasis favoreciendo el establecimiento de una simbiosis efectiva con efectos inmunomoduladores sobre la barrera epitelial.En suma, en esta revisión nos focalizamos en las propiedades inmunoreguladoras de los componentes bioactivos que aporta la leche materna, críticos para el adecuado desarrollo del sistema inmune intestinal del recién nacido, y cuyos efectos beneficiosos tienen impacto en la salud a más largo plazo en la vida del individuo.
Palabras clave: leche materna, anticuerpos, inmunoregulación
Summary
Human milk establishes an effective connection between the mature maternal immune system and the newborn's which is completing its development in the first months of life. The complex physicochemical nature of milk allows the efficient transport of the macro and micro nutrients in concomitance with a variety of immunological components which confer passive protection in neonatal intestine, being secretory IgA and IgM immunoglobulins, microbicides proteins and mucins some of the most widely studied components in this context. In addition, during early lactation the newborn immune system develops in the presence of maternal secretory and IgG antibodies besides other components with immunomoregulatory properties that contribute to the setting of oral tolerance in the neonatal intestine and to the selection of the repertoire of B lymphocytes; some components also influence the composition of the microbiota, and its homeostasis favoring the establishment of an effective symbiosis with immunomodulatory effects on the epithelial barrier. In short, in this review we focus on the immunoregulatory properties of bioactive components provided by breast milk, whose support is critical to the proper development of the intestinal immune system of the newborn, whose beneficial effects have an impact on health beyond childhood.
Keywords: breast milk, antibodies, immunoregulation
Introducción
Los efectos beneficiosos de la lactancia sobre la salud del recién nacido son reconocidos desde hace décadas. Sin embargo, a medida que se fue avanzando en la caracterización de la gran diversidad de componentes presentes en la leche, las perspectivas sobre el alcance de los beneficios sobre la salud del individuo se amplificaron considerablemente. Desde el punto de vista inmunológico, clásicamente se ha jerarquizado la importancia de la leche materna en las defensas frente a infecciones, a través del aporte de inmunoglobulinas en conjunto con otros componentes con actividad microbicida (ej. lisozima, lactoferrina) y factores que fortalecen la función barrera del epitelio intestinal.
En las últimas décadas se ha puesto gran atención en los efectos beneficiosos de la lactancia que impacten sobre la salud del individuo a más largo plazo, particularmente en la capacidad de proteger frente al desarrollo de patologías con una base inmunológica que incluyen a las alergias, asma y enfermedades autoinmunes como la diabetes tipo 1 y Enfermedad celíaca [1,2].
Si bien los mecanismos moleculares que median los efectos protectores no se conocen aún en humanos, la inducción de la tolerancia oral es el proceso central sobre el cual los componentes de la leche tendrían efecto; estos mecanismos se establecen durante una ventana de tiempo crítica de la vida del individuo en la que se configura el funcionamiento del sistema inmune y se instala la microbiota que luego permanece relativamente estable de por vida. Por otra parte, los efectos beneficiosos de una dieta saludable sobre la inmunidad de un individuo se han observado desde hace mucho tiempo, aunque es más recientemente que se ha comenzado a dilucidar la interconexión entre las vías metabólicas y de señalización de células del sistema inmune, que permitirían en un futuro plantear intervenciones nutricionales racionales [3,4].
Los efectos de la dieta sobre el sistema inmune son particularmente críticos durante el período neonatal, en el cual la leche materna representa un sustento nutritivo único, que podría considerarse un alimento funcional modelo por la enorme diversidad de componentes con actividad biológica que contiene, en una matriz compleja que garantiza el adecuado transporte de macro y micronutrientes; es por ello que la temática también tiene interés desde una perspectiva tecnológica para el diseño de alimentos funcionales.
La leche contiene una diversidad de componentes con efectos directos o indirectos sobre el funcionamiento del sistema inmune concentrados mayoritariamente en la fracción acuosa: inmunoglobulinas, citoquinas, vitamina A, factores de crecimiento y una diversidad de carbohidratos. Por otra parte, los glóbulos de grasa que derivan de las células epiteliales de la glándula mamaria y que representan la fase dispersa de la emulsión láctea, también aportan componentes con efectos inmunomoduladores como los ácidos grasos poliinsaturados y la lactaderina, una molécula que contribuye a la fagocitosis de células apoptóticas, promoviendo su eficiente eliminación controlando la inflamación [5]. Adicionalmente, en la fase en suspensión de la leche se encuentran componentes como células maternas, microorganismos y exosomas con diversas acciones a nivel del intestino del lactante que también impactan sobre la inmunidad [6,7] (Figura 1A).
En esta revisión nos centraremos en el análisis de los principales componentes con actividad inmunomoduladora de la leche humana que actúan sobre el sistema inmunológico de la mucosa intestinal del niño. En particular, nos focalizamos en la tríada: microbiota - sistema inmune intestinal - compuestos bioactivos de la leche, ya que la adecuada interrelación entre estos componentes es fundamental para la salud del recién nacido a corto y a largo plazo.
Los carbohidratos de la leche y sus efectos inmunomoduladores
Una característica muy sorprendente de la leche humana es la gran cantidad y diversidad de la fracción de carbohidratos, que comprende oligosacáridos, mucinas, glicolípidos y gangliósidos [6]. Estos componentes presentan gran variabilidad a nivel individual y durante el curso de la lactancia [8,9,10,11]. A su vez, la glicosilación de proteínas es dinámica y variable durante la lactancia, tanto en términos de grado de glicosilación como de especies de glicanos incorporados. Esto último tiene efectos sobre la funcionalidad de proteínas como la lactoferrina cuyo nivel de glicosilación influye sobre su capacidad de unión a patógenos e interferencia con las células epiteliales [12].
La función clásicamente reconocida para los carbohidratos de la leche se basa en actuar como sustrato de fermentación y contribuir a la configuración de la microbiota mediante un efecto prebiótico. La colonización del intestino del recién nacido es un proceso importante que condiciona el desarrollo del sistema inmune de las mucosas, con un patrón particular para cada individuo y en parte dependiente de los microorganismos que inician dicho proceso, que a su vez están determinados por el tipo de nacimiento (parto vaginal ó cesárea) [13,14]. Luego del nacimiento, y durante cierta ventana de tiempo, la composición de la microbiota intestinal posee cierto dinamismo, cambiando desde una comunidad limitada de bacterias hasta alcanzar la enorme variabilidad de especies que integran la microbiota intestinal adulta [15].
En el niño, la evolución de la microbiota intestinal es afectada por factores ambientales, genéticos y por la dieta. Tal es así que los niños alimentados con leche materna poseen una microbiota muy distinta a la que presentan los alimentados con fórmulas [16,17,18,19]; estas diferencias son atribuidas básicamente a los carbohidratos de la leche materna.
Además, los carbohidratos de la leche contribuyen en forma directa e indirecta a la función inmunológica del recién nacido. La forma más evidente de incidir sobre la salud del niño se basa en la capacidad de algunos carbohidratos de interferir con la unión de microorganismos patógenos al epitelio intestinal en base a sus propiedades de adherencia [20,21]. Es así que se ha reportado correlación inversa entre los niveles de oligosacáridos y la incidencia de diarreas causadas por varios agentes infecciosas [22,23].
Un trabajo reciente muestra que MUC1, la principal glicoproteina en leche humana, bloquea el ingreso de patógenos a las células mediante su interacción con el dominio lectina del receptor tipo C-lectina Dendritic Cell-Specific Intercellular adhesion molecule-3-Grabbing Non-integrin - DC-SIGN [24]. Además, la internalización de antígenos por DC-SIGN está implicada en la inducción de tolerancia modificando las respuestas mediadas por linfocitos T [25]; la interacción de DC-SIGN con M. tuberculosis o HIV resulta en la inhibición de la respuesta inmune con importante producción de IL-10 y expresión disminuida de citoquinas proinflamatorias [26]. Por otra parte, algunas especies de Lactobacillus con propiedades probióticas contribuyen a la generación de linfocitos T regulatorios a través de la interación con DC-SIGN [27].
En suma, en base a las propiedades inmunomoduladoras de DC-SIGN y a su expresión en la mucosa intestinal en edades tempranas se ha sugerido que MUC1 además de promover las defensas mediaría mecanismos de regulación de la inmunidad del neonato capturando antígenos de la leche materna con la subsecuente inducción de tolerancia oral, presumiblemente con efectos beneficiosos sobre su salud a largo plazo [24].
Algunos oligosacáridos con propiedades prebióticas son particularmente utilizados como sustrato de fermentación por especies de la microbiota del lactante pertenecientes a las bifidobacterias. Por ejemplo, B. breve y B. infantis son potentes fermentadoras de oligosacáridos pequeños fucosilados y sialilados así como de almidón conduciendo a la formación de ácidos grasos de cadena corta (ácidos butírico, propiónico y acético). En particular, la generación de ácido acético a partir de oligosacáridos de la leche causa una disminución del pH que favorece la función barrera epitelial del neonato.
El ácido butírico es producido principalmente del almidón, e interacciona con receptores expresados en células del sistema inmune (GPR43 y GPR41 en neutrófilos y células mononucleares periféricas) así como en enterocitos [28]. La interacción de ácidos grasos de cadena corta con estos receptores en leucocitos tienen efectos antiinflamatorios, al inhibir la infiltración leucocitaria, la producción de TNF-a por neutrófilos y el efecto quimiotáctico; en parte estos efectos son mediados a través de su interacción con la vía de señalización NF-kB [29]. Además, más recientemente se ha reportado que el receptor para niacina (GPR109A) a través de su interacción con el butirato en células dendríticas y macrófagos, promueve la diferenciación de linfocitos Treg [30]. En algunos modelos se evidenció que este efecto fue mediado por modificación del gen de Foxp3 en linfocitos T, causando el incremento de la diferenciación de Treg [31].
En suma, en base al poder intrínseco inmunoregulador de la microbiota en su interacción directa con los enterocitos y las células dendríticas así como en forma indirecta a través de los productos de fermentación generados, se condiciona la inmunidad neonatal que puede predisponer y/ó proteger frente a patologías inmunológicas y/ó metabólicas, dependiendo del trasfondo genético del hospedador.
Por otra parte, la homeostasis de la microbiota es controlada por las inmunoglobulinas de la leche materna, con las que se establece un mecanismo de mutua regulación.
La interrelación entre los anticuerpos de la leche materna y la microbiota
La leche humana contiene anticuerpos mayoritariamente producidos por el sistema inmune de las mucosas materno, con un amplio espectro de especificidades. La intensa recirculación entero-mamaria promovida por las hormonas lactogénicas garantiza que plasmoblastos productores de anticuerpos contra agentes infecciosos, componentes dietarios y la microbiota dominante migren a la mucosa mamaria desde el intestino y otros tejidos. Allí, los anticuerpos mayoritariamente IgA diméricos son transportados por el RpIg hacia le leche adquiriendo la estructura de IgA secretoria (IgAs), en forma análoga aunque en mucho menor cantidad se encuentra la IgM secretoria de la leche (IgMs).
Varios trabajos han mostrado que las bacterias en las heces se encuentras recubiertas por anticuerpos secretorios del tipo IgA, y que están concentradas en la capa más laxa de mucus, en contraparte a la zona con mayor densidad de mucus adyacente a las células epiteliales, la cual es prácticamente estéril [32]. Probablemente, esta compartimentalización tiene la finalidad de controlar la invasividad por microorganismos de la microbiota, aunque no se conocen exactamente los efectos de la unión de los anticuerpos sobre la viabilidad bacteriana así como el repertorio de reconocimiento contra distintas especies. Se propone que los anticuerpos específicos para la microbiota participan en su homeostasis y en la regulación de la función epitelial en base a una mutua interrelación de cooperativismo [33] (Figura 1B).
La IgAs regula la homeostasis de la microbiota y ésta en contraparte influye sobre la expresión del receptor de poli inmunoglobulina (RpIg) en las células epiteliales así como la expresión génica en enterocitos colónicos. Los ratones deficientes (knock out) para el RpIg y las crías resultantes del entrecruzamiento endogámico y con ratones con expresión normal de RpIg, permiten disponer de animales con deficiencia selectiva de IgAs de origen materno ó endógena, así como de animales completamente deficientes de IgAs [34]. Este interesante modelo de Rogier et al (2014) puso en evidencia que la ausencia de IgAs materna propicia el transporte de bacterias aerobias oportunistas a los ganglios mesentéricos en forma comparable a lo observado en individuos inmunodeficientes. Además, la composición de la microbiota en la etapa adulta difirió entre animales que recibieron IgAs materna, con cierto paralelismo entre especies de la microbiota de individuos con enfermedad inflamatoria intestinal pediátrica.
En suma, los resultados ponen de manifiesto que el mutualismo entre la microbiota y el hospedador es regulado por la IgAs a lo largo de la vida; en una primera etapa a través de la IgAs introducida pasivamente por la leche materna que luego será reemplazada por la IgAs endógena, cuya producción estable en el ser humano es más tardía que los otros isotipos e influenciada por diversos factores ambientales y la microbiota.
Participación de los anticuerpos de la leche en los mecanismos de tolerancia oral
La tolerancia oral se define como la ausencia de mecanismos inmunes efectores frente a antígenos inocuos que ingresan al organismo a través de las mucosas; su inducción es un proceso complejo que involucra más de un mecanismo y está influenciado por diversos factores como la predisposición genética, la integridad de la barrera epitelial, el grado de maduración del sistema inmune, la dosis y naturaleza del antígeno [35].
La inducción de tolerancia oral en animales de experimentación se ve favorecida si la administración de los antígenos a animales neonatales se realiza a través de la leche materna [36,37]. Este fenómeno se explica parcialmente por la presencia de niveles relativamente altos de TGF-β [38] y otras citoquinas menos abundantes como IL-10 que también podrían tener un rol fundamental durante el periodo de lactancia [1]. De hecho,animales alimentados con fórmulas exentas de TGF-β han mostrado inflamación intestinal y desarrollo de alergia a la β-lactoglobulina, el alérgeno de la leche de vaca más importante en edad pediátrica [39,40].
La generación de linfocitos T regulatorios es central para la tolerancia oral como se demuestra en un modelo en el cual las madres fueron sensibilizadas con ovoalbúmina (OVA) en aerosol y la progenie en edad adulta fue sometida a un protocolo clásico de inducción de alergia; se observó que las crías de madres sensibilizadas con el antígeno presentaron menos efectos adversos en comparación con las crías de madres que no estuvieron expuestas a OVA. En este modelo la transferencia de protección fue anulada por la neutralización del TGF-β en la leche materna y se verificó que la protección estaba sostenida por linfocitos T regulatorios. [41].
Los anticuerpos específicos para componentes de la dieta y la microbiota también tendrían un rol en el establecimiento de la tolerancia oral. En particular, los anticuerpos de isotipo IgG pueden ser transportadas por el receptor neonatal (FcRn) expresado en el intestino de ratones neonatos, y a través de su interacción con receptores expresados en células presentadoras, los anticuerpos modularían la magnitud y las características de las respuestas efectoras. Hembras sensibles a ovoalbúmina y expuestas al antígeno durante la lactancia presentaron altos niveles de inmunocomplejos del antígeno de isotipo IgG1 en la leche. La inducción de tolerancia contra OVA fue de mayor amplitud y duración en los ratones amamantados por madres previamente sensibilizadas. Estos resultados muestran que una efectiva inducción de tolerancia contra el antígeno depende de una eficiente trasferencia de inmunocomplejos del antígeno de clase IgG probablemente a través del receptor neonatal FcRn [42,43]. Interesantemente, se obtuvieron resultados similares en un modelo de alergia alimentaria al maní, en el cual las crías de madres expuestas al alérgeno fueron protegidas frente al desafío intragástrico con el mismo[44].
Por otro lado, las IgAs también podrían estar implicadas en los mecanismos de tolerancia oral. Se ha descrito un receptor que interacciona con los dominios Cα1 y Cα2 de la IgAs en la cara apical de las células M que mediaría el pasaje de complejos inmunes, promoviendo su captación por células dendríticas y direccionándolos a los órganos linfoides donde se desarrollan los procesos de tolerancia, con una potente producción de IL-10 [45]. De esta manera, no se descarta que los inmunocomplejos de IgAs contra antígenos dietarios y microbiota sean transportados desde el lumen intestinal por IgAs para ser internalizados por las células dendríticas que, en un contexto antiinflamatorio, inducirían tolerancia hacia esos antígenos en los órganos linfoides asociados a las mucosas [35] (Figura 1).
La presencia de antígenos dietarios en la leche humana se ha reportado por varios autores, en particular se encontraron proteínas como gliadina, ovoalbúmina y β-lactoglobulina(BLG) en forma intacta en leche materna, en niveles del orden de ng-µg/ml [46,47,48], libre ó formando inmunocomplejos.
Consistentemente con estos trabajos, nuestro grupo ha analizado la presencia de anticuerpos e inmunocomplejos de estos componentes en calostros donados al Banco de Leche Humana del Centro Hospitalario Pereira Rossell de la ciudad de Montevideo, Uruguay, destinados a la alimentación de recién nacidos prematuros, tanto en su estado crudo y luego del tratamiento térmico de pasteurización mediante el cual se garantiza la seguridad microbiológica. Hemos detectado anticuerpos de isotipos IgA, IgM e IgG específicos para OVA, BLG y gliadina en la mayoría de las muestras, tanto crudas como procesadas, así como inmunocomplejos (isotipos IgA e IgG) de BLG [49]. Los resultados ponen de manifiesto el potencial inmunomodulador de la leche donada y enfatizan el valor de la misma como recurso en salud, más allá del aporte nutricional.
La demostración experimental de que los inmunocomplejos participen en los mecanismos de tolerancia brinda una base científica para los datos epidemiológicos que muestran que la restricción materna a los alérgenos durante el embarazo y lactancia no contribuye a mejorar el estado del salud del lactante en relación al desarrollo futuro de estas patologías [50]. De hecho, en los últimos años se ha planteado un cambio de dogma en tal sentido y por ejemplo, la Asociación Americana de Pediatría ha modificado las recomendaciones de conductas a seguir por madres alérgicas [51]. Un trabajo epidemiológico muy reciente documenta que el consumo materno de alérgenos alimentarios comunes durante los primeros meses de embarazo se asoció con menores índices de alergia y asma durante la niñez [52].
Interesantemente, se ha descrito la presencia de anticuerpos naturales polireactivos en la leche cuyo patrón de reconocimiento abarca antígenos tisulares y de microorganismos [53,54,55], algunos de los cuales integrarían la red de regulación idiotipo-antiidiotipo que es funcional a través del mutuo reconocimiento de epítopes [53].
Tal como hemos evidenciado en modelos experimentales de inmunización, los anticuerpos anti-idiotípicos pueden modular la respuesta contra antígenos foráneos en animales neonatos [56], y se considera que participan en la homeostasis inmune y en la selección del repertorio de reconocimiento de linfocitos B [57].
En suma, estos mecanismos de regulación podrían ocurrir también por los anticuerpos naturales que ingresan a través de la leche materna y podrían ser eventualmente inducidos por una inmunización previa materna [58].
Consideraciones finales y perspectivas
La leche humana puede considerarse una conexión eficaz entre el sistema inmune materno y el del recién nacido ya que por su compleja naturaleza fisicoquímica vehiculiza no solo macro y micro nutrientes sino también una diversidad de componentes con propiedades inmunológicas que otorgan protección pasiva en el intestino neonatal. A esto se agrega que, durante la lactancia temprana, el sistema inmune del recién nacido se desarrolla en presencia de diversos componentes con propiedades inmunomoduladoras de la madre que contribuyen a la tolerancia oral en el intestino neonatal. Las evidencias recientes indican que otros mecanismos de regulación están favorecidos a través de la lactancia, aunque hacen falta aún más estudios en modelos experimentales que permitan dilucidar las bases celulares y moleculares de tales mecanismos. En este sentido, los estudios basados en la leche materna como un alimento funcional modelo serán muy útiles para plantear diseños de intervenciones terapéuticas en la alimentación neonatal con potenciales beneficios para las patologías alérgicas, enfermedades inflamatorias y autoinmunes.
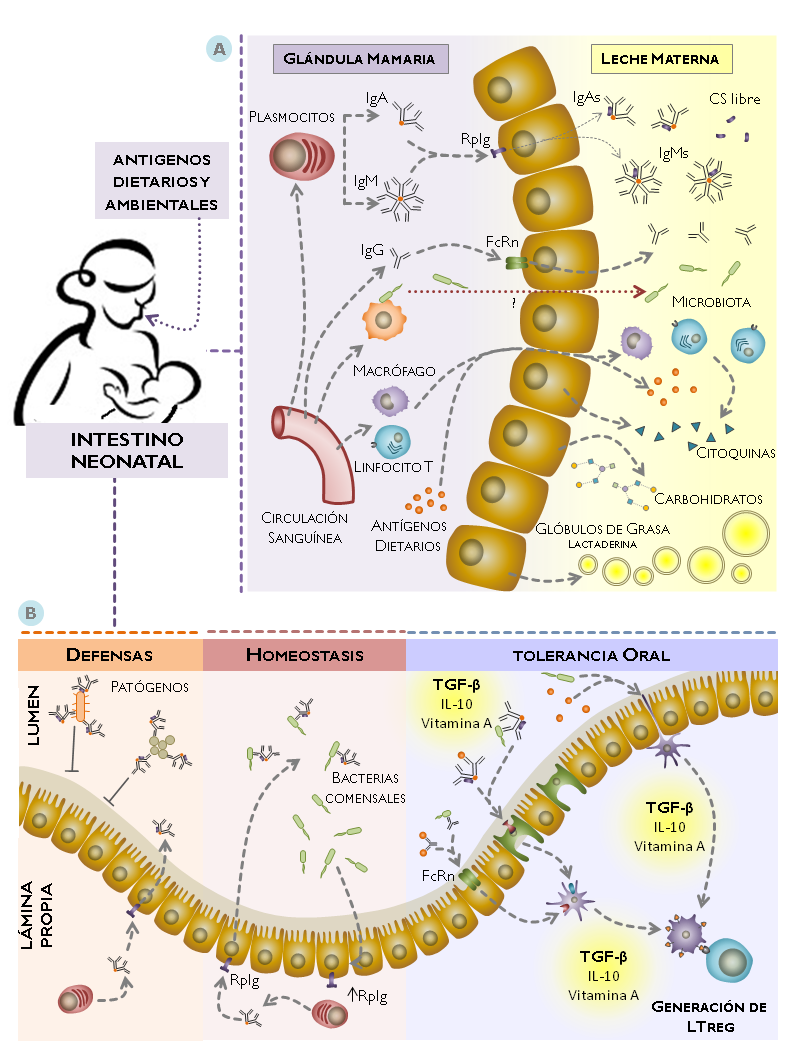
Figura 1 A. Se muestran los principales componentes de la leche materna con actividad inmunológica que son derivados de las células epiteliales, o transportados desde la lámina propia por distintos mecanismos. B. Se esquematizan los principales mecanismos en los cuales están implicados los anticuerpos de la leche materna en las defensas frente a patógenos, en la homeostasis de la microbiota y su interacción con el epitelio intestinal así como su participación en los mecanismos de tolerancia oral de acuerdo a los modelos actualmente propuestos. RpIg, receptor de poliinmunoglobulina; FcRn, receptor neonatal; CS, componente secretor.
Claudio Rodriguez Camejo es Ayudante de Inmunología y Ana Hernández profesora adjunta, ambos de la Cátedra de Inmunología de la Facultad de Ciencias y Facultad de Química. Universidad de la República. Uruguay.
Referencias:
1. Verhasselt V (2010) Neonatal tolerance under breastfeeding influence Current Opinion in Immunology 22: 623-630.
2. Ip S, Chung M, Raman G, Chew P, Magula N, et al. (2007) Breastfeeding and maternal and infant health outcomes in developed countries Evidence report/technology assessment (Full Rep): 1-186.
3. Maslowski KM, Mackay CR (2011) Diet, gut microbiota and immune responses Nature Immunology 12: 5-9.
4. Wolowczuk I, Verwaerde C, Viltart O, Delanoye A, Delacre M, et al. (2008) Feeding our immune system: impact on metabolism Clinical and Developmental Immunology 2008: 639803.
5. Baghdadi M, Chiba S, Yamashina T, Yoshiyama H, Jinushi M (2012) MFG-E8 regulates the immunogenic potential of dendritic cells primed with necrotic cell-mediated inflammatory signals PLoS One 7: e39607.
6. Ballard O, Morrow AL (2013) Human milk composition: nutrients and bioactive factors Pediatric Clinics of North America 60: 49- 74.
7. Admyre C, Johansson SM, Qazi KR, Filen JJ, Lahesmaa R, et al. (2007) Exosomes with immune modulatory features are present in human breast milk Journal of Immunology 179: 1969-1978.
8. Ninonuevo MR, Lebrilla CB (2009) Mass spectrometric methods for analysis of oligosaccharides in human milk Nutrition Reviews 67 Suppl 2: S216-226.
9. Chaturvedi P, Warren CD, Altaye M, Morrow AL, Ruiz-Palacios G, et al. (2001) Fucosylated human milk oligosaccharides vary between individuals and over the course of lactation Glycobiology 11: 365-372.
10. Thurl S, Henker J, Taut H, Tovar K, Sawatzki G (1993) Variations of neutral oligosaccharides and lactose in human milk during the feeding Z Ernährungswiss Journal 32: 262-269.
11. Thurl S, Munzert M, Henker J, Boehm G, Muller-Werner B, et al. (2010) Variation of human milk oligosaccharides in relation to milk groups and lactational periods British Journal of Nutrition 104: 1261-1271.
12. Barboza M, Pinzon J, Wickramasinghe S, Froehlich JW, Moeller I, et al. (2012) Glycosylation of human milk lactoferrin exhibits dynamic changes during early lactation enhancing its role in pathogenic bacteria-host interactions Molecular & Cellular Proteomics 11: M111 015248.
13. Brandtzaeg P (2003) Mucosal immunity: integration between mother and the breast-fed infant Vaccine 21: 3382- 3388.
14. Dominguez-Bello MG, Costello EK, Contreras M, Magris M, Hidalgo G, et al. (2010) Delivery mode shapes the acquisition and structure of the initial microbiota across multiple body habitats in newborns Proceedings of the National Academy of Sciences of th United States of America 107: 11971-11975.
15. Rogier EW, Frantz AL, Bruno ME, Wedlund L, Cohen DA, et al. (2014) Lessons from mother: Long-term impact of antibodies in breast milk on the gut microbiota and intestinal immune system of breastfed offspring Gut Microbes 5: 663-668.
16. Roger LC, Costabile A, Holland DT, Hoyles L, McCartney AL (2010) Examination of faecal Bifidobacterium populations in breast- and formula-fed infants during the first 18 months of life Microbiology 156: 3329-3341.
17. Fallani M, Amarri S, Uusijarvi A, Adam R, Khanna S, et al. (2011) Determinants of the human infant intestinal microbiota after the introduction of first complementary foods in infant samples from five European centres Microbiology 157: 1385-1392.
18. Azad MB, Konya T, Maughan H, Guttman DS, Field CJ, et al. (2013) Gut microbiota of healthy Canadian infants: profiles by mode of delivery and infant diet at 4 months Canadian Medical Association Journal 185: 385-394.
19. Gomez-Llorente C, Plaza-Diaz J, Aguilera M, Munoz-Quezada S, Bermudez-Brito M, et al. (2013) Three main factors define changes in fecal microbiota associated with feeding modality in infants Journal of Pediatric Gastroenterology and Nutrition 57: 461- 466.
20. Liu B, Yu Z, Chen C, Kling DE, Newburg DS (2012) Human milk mucin 1 and mucin 4 inhibit Salmonella enterica serovar Typhimurium invasion of human intestinal epithelial cells in vitro Journal of Nutrition 142: 1504-1509.
21. Yolken RH, Peterson JA, Vonderfecht SL, Fouts ET, Midthun K, et al. (1992) Human milk mucin inhibits rotavirus replication and prevents experimental gastroenteritis Journal of Clinical Investigation 90: 1984-1991.
22. Newburg DS, Ruiz-Palacios GM, Altaye M, Chaturvedi P, Meinzen-Derr J, et al. (2004) Innate protection conferred by fucosylated oligosaccharides of human milk against diarrhea in breastfed infants Glycobiology 14: 253-263.
23. Morrow AL, Ruiz-Palacios GM, Altaye M, Jiang X, Guerrero ML, et al. (2004) Human milk oligosaccharides are associated with protection against diarrhea in breast-fed infants Journal of Pediatrics 145: 297-303.
24. Koning N, Kessen SF, Van Der Voorn JP, Appelmelk BJ, Jeurink PV, et al. (2015) Human Milk Blocks DC-SIGN-Pathogen Interaction via MUC1 Frontiers in Immunology 6: 112.
25. Gringhuis SI, den Dunnen J, Litjens M, van Het Hof B, van Kooyk Y, et al. (2007) C-type lectin DC-SIGN modulates Toll- like receptor signaling via Raf-1 kinase-dependent acetylation of transcription factor NF-kappaB Immunity 26: 605- 616.
26. Hodges A, Sharrocks K, Edelmann M, Baban D, Moris A, et al. (2007) Activation of the lectin DC-SIGN induces an immature dendritic cell phenotype triggering Rho-GTPase activity required for HIV-1 replication Nature Immunology 8: 569- 577.
27. Smits HH, Engering A, van der Kleij D, de Jong EC, Schipper K, et al. (2005) Selective probiotic bacteria induce IL-10- producing regulatory T cells in vitro by modulating dendritic cell function through dendritic cell-specific intercellular adhesion molecule 3-grabbing nonintegrin Journal of Allergy and Clinical Immunology 115: 1260-1267.
28. Smilowitz JT, Lebrilla CB, Mills DA, German JB, Freeman SL (2014) Breast milk oligosaccharides: structure-function relationships in the neonate Annual Review of Nutrition 34: 143-169.
29. Brugman S, Perdijk O, van Neerven RJ, Savelkoul HF (2015) Mucosal Immune Development in Early Life: Setting the Stage Archivum immunologiae et therapiae experimentalis Instytut Immunologii i Terapii Doświadczalnej (Warsz) 63: 251-268.
30. Singh N, Gurav A, Sivaprakasam S, Brady E, Padia R, et al. (2014) Activation of Gpr109a, receptor for niacin and the commensal metabolite butyrate, suppresses colonic inflammation and carcinogenesis Immunity 40: 128-139.
31. Furusawa Y, Obata Y, Fukuda S, Endo TA, Nakato G, et al. (2013) Commensal microbe-derived butyrate induces the differentiation of colonic regulatory T cells Nature 504: 446-450.
32. van der Waaij LA, Limburg PC, Mesander G, van der Waaij D (1996) In vivo IgA coating of anaerobic bacteria in human faeces Gut 38: 348-354.
33. Kaetzel CS (2014) Cooperativity among secretory IgA, the polymeric immunoglobulin receptor, and the gut microbiota promotes host-microbial mutualism Immunology Letters 162: 10-21.
34. Rogier E, Frantz AL, Bruno ME, Kaetzel CS (2014) Secretory IgA is concentrated in the outer layer of colonic mucus along with gut bacteria Pathogens 3: 390-403.
35. Brandtzaeg P (2010) Food allergy: separating the science from the mythology Nature Reviews Gastroenterology & Hepatology 7: 380- 400.
36. Hanson DG (1981) Ontogeny of orally induced tolerance to soluble proteins in mice. I. Priming and tolerance in newborns Journal of Immunology 127: 1518-1524.
37. Strobel S (1996) Neonatal oral tolerance Annals of the New York Academy of Sciences 778: 88-102.
38. Penttila IA (2010) Milk-derived transforming growth factor-beta and the infant immune response Journal of Pediatrics 156: S21- 25.
39. Penttila I (2006) Effects of transforming growth factor-beta and formula feeding on systemic immune responses to dietary beta-lactoglobulin in allergy-prone rats Pediatric Research 59: 650-655.
40. Penttila IA, Flesch IE, McCue AL, Powell BC, Zhou FH, et al. (2003) Maternal milk regulation of cell infiltration and interleukin 18 in the intestine of suckling rat pups Gut 52: 1579-1586.
41. Verhasselt V, Milcent V, Cazareth J, Kanda A, Fleury S, et al. (2008) Breast milk-mediated transfer of an antigen induces tolerance and protection from allergic asthma Nature Medicine 14: 170-175.
42. Mosconi E, Rekima A, Seitz-Polski B, Kanda A, Fleury S, et al. (2010) Breast milk immune complexes are potent inducers of oral tolerance in neonates and prevent asthma development Mucosal Immunology 3: 461-474.
43. Qiao SW, Lencer WI, Blumberg RS (2007) How the controller is controlled - neonatal Fc receptor expression and immunoglobulin G homeostasis Immunology 120: 145-147.
44. Lopez-Exposito I, Song Y, Jarvinen KM, Srivastava K, Li XM (2009) Maternal peanut exposure during pregnancy and lactation reduces peanut allergy risk in offspring Journal of Allergy and Clinical Immunology 124: 1039-1046.
45. Corthesy B (2007) Roundtrip ticket for secretory IgA: role in mucosal homeostasis? Journal of Immunology 178: 27-32.
46. Chirdo FG, Rumbo M, Anon MC, Fossati CA (1998) Presence of high levels of non-degraded gliadin in breast milk from healthy mothers Scandinavian Journal of Gastroenterology 33: 1186-1192.
47. Fukushima Y, Kawata Y, Onda T, Kitagawa M (1997) Consumption of cow milk and egg by lactating women and the presence of beta-lactoglobulin and ovalbumin in breast milk American Journal of Clinical Nutrition 65: 30-35.
48. Kilshaw PJ, Cant AJ (1984) The passage of maternal dietary proteins into human breast milk International Archives of Allergy and Applied Immunology 75: 8-15.
49. Rodríguez-Camejo C (2015) Anticuerpos específicos contra antígenos dietarios en calostro humano donado en Banco de Leche: efectos del procesamiento térmico sobre la reactividad inmunológica. Tesis de Licenciatura en Química de la Facultad de Química - Universidad de la República (Montevideo, Uruguay) Orientadora: Dra Ana Hernández.
50. Greer FR, Sicherer SH, Burks AW (2008) Effects of early nutritional interventions on the development of atopic disease in infants and children: the role of maternal dietary restriction, breastfeeding, timing of introduction of complementary foods, and hydrolyzed formulas Pediatrics 121: 183-191.
51. Thygarajan A, Burks AW (2008) American Academy of Pediatrics recommendations on the effects of early nutritional interventions on the development of atopic disease Current Opinion in Pediatrics 20: 698-702.
52. Bunyavanich S, Rifas-Shiman SL, Platts-Mills TA, Workman L, Sordillo JE, et al. (2014) Peanut, milk, and wheat intake during pregnancy is associated with reduced allergy and asthma in children Journal of Allergy and Clinical Immunology 133: 1373-1382.
53. Quan CP, Berneman A, Pires R, Avrameas S, Bouvet JP (1997) Natural polyreactive secretory immunoglobulin A autoantibodies as a possible barrier to infection in humans Infection and Immunity 65: 3997-4004.
54. Vassilev TL, Veleva KV (1996) Natural polyreactive IgA and IgM autoantibodies in human colostrum Scandinavian Journal of Immunology 44: 535-539.
55. Pribylova J, Krausova K, Kocourkova I, Rossmann P, Klimesova K, et al. (2012) Colostrum of healthy mothers contains broad spectrum of secretory IgA autoantibodies Journal of Clinical Immunology 32: 1372-1380.
56. Baz A, Hernandez A, Dematteis S, Carol H, Nieto A (1995) Idiotypic modulation of the antibody response of mice to Echinococcus granulosus antigens Immunology 84: 350-354.
57. Freitas AA, Viale AC, Sundblad A, Heusser C, Coutinho A (1991) Normal serum immunoglobulins participate in the selection of peripheral B-cell repertoires Proceedings of the National Academy of Sciences of the United States of America 88: 5640-5644.
58. Okamoto Y, Tsutsumi H, Kumar NS, Ogra PL (1989) Effect of breast feeding on the development of anti-idiotype antibody response to F glycoprotein of respiratory syncytial virus in infant mice after post-partum maternal immunization Journal of Immunology 142: 2507-2512.
|
Revista QuímicaViva Número 3, año 14, Diciembre 2015 quimicaviva@qb.fcen.uba.ar |