Metabolitos secundarios y actividad antibacteriana in vitro del extracto etanólico de la raíz de Rumex crispus L.
Marilú Roxana Soto Vásquez1, Karina Soto Vásquez2, Amado Agustín Santos Mendoza 1, Nadya Katherine Moncayo Vargas1
1Área de Farmacognosia. Facultad de Farmacia y Bioquímica. Universidad Nacional de Trujillo
2Área de Microbiología. Hospital Belén de Trujillo, Trujillo, Perú
Trujillo, Perú
Recibido: 28/04/2015 - Aceptado: 21/08/2015
Resumen
El presente trabajo estuvo orientado a determinar los metabolitos secundarios y evaluar la actividad antibacteriana in vitro del extracto etanólico de la raíz de Rumex crispus L. El material vegetal fue recolectado de la provincia de Otuzco, región La Libertad, Perú. El extracto etanólico de la raíz fue preparado mediante la técnica de extracción de reflujo con etanol al 70%. El tamizaje fitoquímico preliminar del extracto evidenció la presencia de catequinas, lactonas, saponinas, compuestos fenólicos, taninos, quinonas, flavonoides y leucoantocianidinas. Para realizar el ensayo antimicrobiano se empleó el método de difusión en pozos según Kirby- Bauer y se determinó la concentración inhibitoria mínima mediante el método de macro dilución en agar. El extracto etanólico mostró actividad antimicrobiana frente Escherichia coli y Staphylococcus aureus a todas las concentraciones ensayadas (5, 15 y 30%). Las concentraciones inhibitorias mínimas fueron de 1,0 y 2,5 mg/mL para S. aureus y E. coli respectivament
Palabras clave: Actividad antibacteriana, Rumex crispus, metabolitos secundarios, Staphylococcus aureus, Escherichia coli.
Summary
This study was performed to determine the secondary metabolites and evaluate the in vitro antibacterial activity of ethanol extract of the root of Rumex crispus L. Plant material was collected from the Otuzco province, La Libertad region, Peru. The ethanol extract of the root was prepared by the refluxing extraction technique with 70% ethanol. Preliminary phytochemical screening of the extract showed the presence of catechins, lactones, saponins, phenolic compounds, tannins, quinones, flavonoids and leucoanthocyanidins. The antimicrobial testing was done using well diffusion method according to Kirby-Bauer and the minimum inhibitory concentration was determined by agar macro dilution method. The ethanol extract showed antimicrobial activity against Escherichia coli and Staphylococcus aureus at all concentrations tested (5%, 15% and 30%). The MICs were 1.0 and 2.5 mg/ml for S. aureus and E. coli respectively.
Keywords: Antibacterial activity, Rumex crispus, secondary metabolites, Staphylococcus aureus, Escherichia coli.
Introducción
Según la Organización Mundial de la Salud la resistencia antimicrobiana revela una gran amenaza que puede afectar a cualquier persona de cualquier edad en cualquier país [1]. Panorama que impulsa al hombre a la búsqueda y descubrimiento de nuevas drogas con eficacia terapéutica para la resolución de los problemas de salud, donde los productos naturales surgen como alternativas en el desarrollo de nuevos fármacos [2].
La familia Polygonaceae tiene distribución cosmopolita, encontrándose en regiones de clima templado, los trópicos y subtrópicos. Está conformada por un número aproximado de 43 géneros y 1100 especies; de los cuales el género Rumex y Polygonum proporcionan el 90% de las especies [3], hallándose en el Perú, 10 géneros y 73 especies [4].
Se ha evaluado el potencial de varias especies del género Rumex, como el extracto metanólico de las raíces de Rumex nepalensis, el cual posee actividad antimicrobiana contra S. aureus, Streptococcus mutans, E. coli, Pseudomonas aeruginosa y Candida albicans [5]. Del mismo modo, Rumex dentatus posee actividad antibacteriana, antifúngica, citotóxica, antitumoral y potencial alopático [6]. De diferentes especies del género Rumex, han sido aislados compuestos como el crisofanol y la parietina, efectivos fungicidas; además del nepodin, compuesto con efecto antidiabético y actividad antimalárica [5,7].
Rumex crispus, comúnmente conocida como lengua de vaca, patu cjallu, romaza o acedera, es una hierba perenne, cuya raíz es usada tradicionalmente en el Perú para combatir la anemia, aumentar el apetito, dermatosis, inflamaciones renales, enfermedades del hígado, etc. [8-10]. En los Estados Unidos de América, los indios navajos y zuni la utilizaban para tratar úlceras orales y cutáneas; así como laxativo [11], y en el noreste patagónico de la Argentina se usa como cicatrizante y estimulante [12]. Bajo este contexto es posible que los extractos etanólicos de las raíces de Rumex crispus puedan inhibir el crecimiento de diferentes cepas bacterianas.
Materiales y Métodos
Material vegetal
El material vegetal se recolectó del distrito de Otuzco, provincia de Otuzco, región La Libertad-Perú, ubicado a 2645 msnm, con coordenadas geográficas de 7º54’10’’ latitud sur y 78º34’20’’ longitud oeste, durante el mes de abril del 2014.
La identificación de la especie fue realizada por el Biólogo Eric Rodríguez Rodríguez, y un ejemplar de la planta fue depositado en el Herbarium Truxillense (HUT), de la Universidad Nacional de Trujillo con número de depósito 52886.
Preparación del extracto etanólico
Las raíces fueron seleccionadas, lavadas con agua potable y posterior inmersión con hipoclorito de sodio al 2 % durante 10 min. Luego fueron cortadas en trozos pequeños y secados en una estufa (Memmert) con circulación de aire, a 40°C por 7 días. Se trituraron las raíces con molino (Corona) y luego se pasaron a través de un set de tamices (Alphalabs). Se trabajó con partículas de diámetro menor que 3 mm [13].
El material pulverizado fue sometido a un proceso de extracción alcohólica, con la técnica de reflujo (durante 2 horas). Se emplearon 50 g de muestra y 250 mL de etanol al 70%. El extracto etanólico obtenido en este proceso, se filtró e inmediatamente, se concentró en el rotaevaporador (Heidolph WB 2000) a presión reducida. Una vez evaporado el solvente, se llevó a sequedad en una estufa a 40°C. Este fue almacenado en frascos de vidrio ámbar a 4°C hasta el momento de su utilización.
Tamizaje fitoquímico
Luego de la preparación del extracto, se realizaron diferentes ensayos con reacciones químicas de identificación, para determinar la presencia de metabolitos secundarios: catequinas (catequinas), lactonas (Baljet), triterpenos y esteroides (Liebermann-Burchard), saponinas (espuma), compuestos fenólicos (cloruro férrico), taninos (gelatina), quinonas (Bornträger), flavonoides (Shinoda), cardenólidos (Kedde), leucoantocianidinas (Rosemhein) y alcaloides (Dragendorff, Mayer y Wagner) [13-14].
Evaluación de la actividad antibacteriana del extracto.
Se empleó el método de difusión en pozo según Rodríguez [15] con algunas modificaciones. Se realizó la siembra de los microorganismos S. aureus (ATCC 25923) y E. coli (ATCC 25922), previamente ajustados a la escala de Mc Farland 0,5 (1,5 x 108 UFC/mL) en agar Müeller-Hinton. Luego, con la ayuda de un sacabocado, se realizaron 4 perforaciones de 11 mm de diámetro, donde se colocaron 200 μL de los extractos etanólicos disueltos en dimetilsulfóxido (DMSO) a las concentraciones de 5%, 15% y 30 % p/v y del control negativo DMSO. En placa aparte se realizaron tres perforaciones con las medidas antes mencionadas donde se colocaron 200 μL del control positivo (gentamicina 10 µg/mL). Se incubaron las placas a 37 °C, por un periodo de 24h. Transcurrido el tiempo de incubación, se procedió a medir los halos de inhibición de los extractos y controles positivo y negativo, utilizando una regla milimetrada. Todos los ensayos se realizaron por triplicado
Determinación de la concentración inhibitoria mínima (CIM).
La CIM se determinó mediante el método de dilución en agar en microplacas de fondo plano de 24 pozos, donde se colocaron en cada pozo las diferentes concentraciones del extracto (5 mg/mL, 2,5 mg/mL, 1,0 mg/mL, 0,5 mg/mL, 0,25 mg/mL y 0,1 mg/mL) disueltos en medio de cultivo (Müeller-Hinton). Luego en cada pozo se sembraron 2 μL de cultivo bacteriano (E. coli y S. aureus) ajustada a la escala de Mc. Farland 0,5 (1,5 x 108 UFC/mL). Se empleó como control negativo DMSO y como control positivo gentamicina 10 µg/mL. Después de 24 horas de incubación a 37°C, las microplacas, se examinaron visualmente. Se consideró la CIM a la menor concentración del extracto a la cual el microorganismo ensayado no presentó desarrollo visible. Todos los ensayos se realizaron por triplicado [16].
Resultados y Discusión
En la tabla 1 se muestran los resultados del tamizaje fitoquímico realizado al extracto etanólico de la raíz de R. crispus, donde se observa una gran variabilidad de metabolitos secundarios presentes en este extracto como: catequinas, lactonas, saponinas, compuestos fenólicos, taninos, quinonas, flavonoides y leucoantocianidinas, encontrándose una alta intensidad de saponinas, compuestos fenólicos, taninos y quinonas. Estos metabolitos secundarios coinciden con lo reportado en otros trabajos de investigación realizados a esta especie [17] y a otras especies del género Rumex [18-20], lo cual justifica la utilidad de esta planta en la cura de diversas afecciones [6,7].
Tabla 1: Tamizaje fitoquímico del extracto etanólico de la raíz de Rumex crispus L.
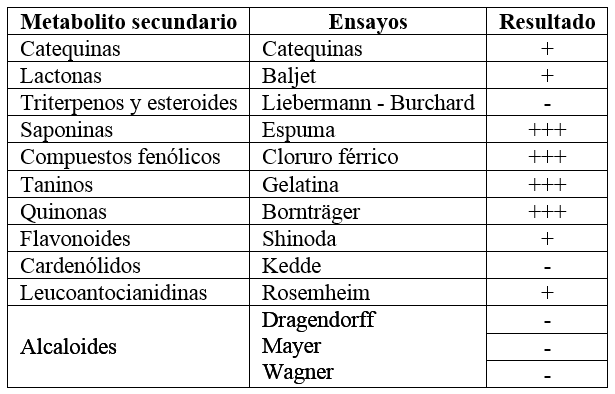
Intensidad: (+): poca; (++): moderada; (+++): alta. Identificación: (+): presencia (-): ausencia
En la tabla 2 se observan los valores promedios de los halos de inhibición de los extractos etanólicos de la raíz de R. crispus a las diferentes concentraciones (5%,15% y 30% p/v) frente a S. aureus ATCC 25923 y E. coli ATCC 25922, siendo la concentración de 30% p/v la que presentó mayores promedios de halos de inhibición de 25,3±0,58 mm y 17,2±0,29 mm frente a S. aureus y E. coli respectivamente.
Tabla 2: Actividad antibacteriana in vitro del extracto etanólico de la raíz de Rumex crispus L. frente a S. aureus (ATCC 25923) y E. coli (ATCC 25992). Halo a las 24 horas*.
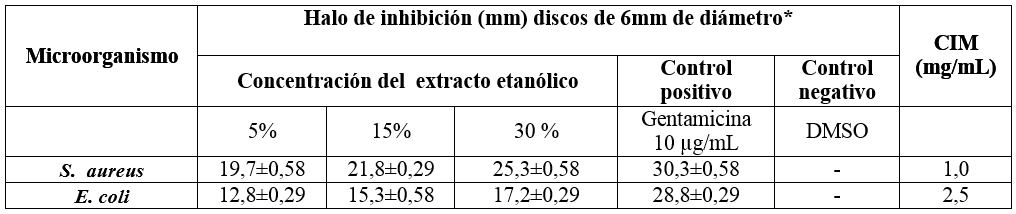
*: Promedio del halo de inhibición de 3 placas y desviación estándar.
Por otro lado el control negativo (DMSO) no presentó halos de inhibición, lo que indica la inocuidad del solvente frente a estos microorganismos. Asimismo el control positivo (gentamicina 10 μg/mL) presentó promedios de halos de inhibición que, según el Comité Nacional de Normas de Laboratorio Clínico, estarían catalogados como sensible frente a estos microorganismos ensayados [21].
En cuanto a la concentración inhibitoria mínima (CIM) del extracto etanólico, los valores fueron de 1,0 y 2,5 mg/mL frente a S. aureus y E. coli respectivamente.
Si bien es cierto, no existen trabajos previos de índole antibacteriana con respecto a la raíz de la especie en estudio, si existen en referencia a otras partes de la planta como hojas y semillas, las cuales evidencian actividad antibacteriana frente a bacterias Gram positivas y Gram negativas [22]. Asimismo los extractos de las raíces de otras especies del género Rumex exhiben un amplio espectro de actividad antibacteriana [5, 6, 23].
Por otra lado, Ramírez (2007) reportó que los extractos y fracciones de la raíz de R. conglomeratus presentan concentraciones inhibitorias mínimas de 50 a 100 µg/mL frente a S. aureus [24], concentraciones que se encuentran por debajo de lo reportado en la presente investigación.
Los metabolitos secundarios presentes en el extracto etanólico de la raíz de R. crispus, como compuestos fenólicos, flavonoides, quinonas, taninos y saponinas pueden adjudicarle la actividad antibacteriana. Esto debido a que, los flavonoides por tener en su estructura química un número variable de grupos hidroxilo fenólicos, penetran fácilmente a través de la membrana celular bacteriana, se combinan y precipitan las proteínas protoplasmáticas desnaturalizándolas y actuando como venenos protoplasmáticos [25]. De igual manera, las quinonas presentan un rango amplio de acción, actuando posiblemente sobre las adhesinas expuestas en la superficie de las bacterias, sobre los polipéptidos de la pared celular y sobre las enzimas unidas a membranas [26]. Asimismo, los taninos pueden inhibir las enzimas microbianas extracelulares [27]. Por otro lado, las saponinas son un grupo de sustancias glicosídicas que se disuelven en agua y poseen la propiedad de formar espuma al agitar la solución. Se cree, que la toxicidad de las saponinas es debido a su capacidad de formar complejos con esteroles de las membranas celulares, produciendo grandes poros en las mismas y alterando su permeabilidad, por lo que la célula se lisa, ocasionando la ruptura de las membranas bacterianas [28].
Conclusiones
El extracto etanólico de la raíz de Rumex crispus L. presenta metabolitos secundarios como catequinas, lactonas, saponinas, antocianidinas, fenoles, taninos, quinonas y flavonoides.
El extracto etanólico de la raíz de Rumex crispus L., a las concentraciones de 5%, 15% y 30%, presenta actividad antibacteriana in vitro frente a S. aureus y E. coli, con CIM de 1,0 mg/mL y 2,5 mg/mL, respectivamente.
Referencias:
1. WHO (2014) Antimicrobial resistance: global report on surveillance Geneva: WHO Press.
2. Soto MR (2014) Actividad antinociceptiva y antibacteriana de los alcaloides totales de dos especies de la familia Solanaceae Revista Cubana de Plantas Medicinales 19:361-373.
3. Calderón G (2001) Polygonaceae Flora fanerogámica del Valle de México Veracruz: Instituto de Ecología AC.
4. León B (2006) Polygonaceae endémicas del Perú Revista Peruana de Biología 13:575-576.
5. Yadav S, Kumar S, Jain P, Kumar R, Jadon S, Sharma A, Khetwal KS, Gupta KC (2011) Antimicrobial activity of different extracts of roots of Rumex nepalensis Spreng Indian Journal of Natural Products and Resources 2:65-69.
6. Fatima N, Zia M, Rehman R, Fatima Z, Ahmad S, Mirza B, Caudhary MF (2009) Biological activities of Rumex dentatus L: Evaluation of methanol and hexane extracts African Journal of Biotechnology 8:6945-6951.
7. Lee KH, Rhee KH (2013) Antimalarial activity of nepodin isolated from Rumex crispus Archives of Pharmacal Research 36:430-435.
8. León JF, Sulca L, Delgado P, Cáceres C, Auccasi A (2003) Diversidad florística medicinal altoandina y propuesta de aprovechamiento de especies endémicas como recurso terapéutico en el departamento de Tacna Trabajo de investigación Tacna: Universidad Nacional Jorge Basadre Grohmann.
9. Gamero GK, Blanco MT (2014) Uso de plantas medicinales como conocimiento tradicional en la sociedad urbana del Cuzco Trabajo de investigación Cuzco: Centro para la Conservación Bioandina CECOBI.
10. Vásquez L (2009) Las plantas medicinales en Lambayeque Agrored Norte Chiclayo.
11. Hoffmann JJ, Timmermann BN, McLaughlin SP, Punnapayak H (1993) Potential antimicrobial activity of plants from the Southwestern United States Pharmaceutical Biology 31:101-115.
12. Ladio A (2005) Malezas exóticas comestibles y medicinales utilizadas en poblaciones del Noroeste patagónico: aspectos etnobotánicos y ecológicos Boletín Latinoamericano y del Caribe de Plantas Medicinales y Aromáticas 4: 75-80.
13. Miranda M, Cuéllar A (2002) Manual de Prácticas de laboratorio de Farmacognosia y Productos Naturales Instituto de Farmacia y Alimentos Universidad de la Habana La Habana
14. Lock de Ugaz O (1994) Investigación Fitoquímica Métodos de Estudios de Productos Naturales Fondo Editorial PUCP Lima
15. Cruz A, Rodríguez N, Rodríguez C (2010) Evaluación in vitro del efecto antibacteriano de los extractos de Bidens pilosa, Lantana camara, Schinus molle y Silybum marianum Revista UDCA Actualidad y Divulgación Científica 13:117-124.
16. Corzo D (2012) Evaluation of antimicrobial activity of ethanol extract of Cestrum buxifolium Kunth Revista Mexicana de Ciencias Farmacéuticas 43:81¬-86.
17. Rodica I (2002) 1,5-dihydroxyanthraquinones and an anthrone from roots of Rumex crispus Natural Product Letters 16:65-70.
18. Rodríguez de Vera B, Jiménez H, Navarro E, Alonso J, Trujillo J (2004) Componentes fitoquímicos de las especies botánicas de Rumex, plantas de uso medicinal Canarias Médica y Quirúrgica 4:48-58.
19. Navarro E, Rodríguez de Vera B, Jiménez J, Navarro R, Alonso S (2012) Identificación y aislamiento de compuestos de Rumex lunaria L Endemismo canario con actividad farmacológica Canarias Médica y Quirúrgica 9:53-59.
20. Jimoh F, Adedapo A, Aliero A, Afolayan J (2008) Polyphenolic Contents and Biological Activities of Rumex ecklonianus Pharmaceutical Biology 46:333–340.
21. National Committee for Clinical Laboratory Standards (1999) Performance standards for antimicrobial susceptibility testing NCCLS approved standard M100-S9 Wayne : National Committee for Clinical Laboratory Standards.
22. Yildirim A, Mavi A, Kara A (2001) Determination of antioxidant and antimicrobial activities of Rumex crispus L extracts Journal of Agricultural and Food Chemistry 49: 4083–4089.
23. Humeera N, Kamili AN, Bandh SA, Amin SU, Lone BA, Gousia N (2013) Antimicrobial and antioxidant activities of alcoholic extracts of Rumex dentatus L Microbial Pathogenesis 57:17-20.
24. Ramírez L, Díaz H (2007) Actividad antibacteriana de extractos y fracciones del ruibarbo (Rumex conglomeratus) Scientia et Technica 13:397-400.
25. Puupponen PR, Nohynek L, Meier C, Kähkönen M, Heinonen M, Hopia A, Oksman M (2001) Antimicrobial properties of phenolic compounds from berries Journal of Applied Microbiology 90: 494-507.
26. Cowan MM (1999) Plant Products as antimicrobial agents Clinical Microbiological Reviews 12:564–582.
27. Akiyama H, Fuji K, Yamasaki O, Oono T, Iwatsuki K (2001) Antibacterial action of several tannins against Staphylococcus aureus Journal of Antimicrobial Chemotherapy 48:487- 491.
28. Díaz LN (2009) Interacciones moleculares entre plantas y microorganismos: saponinas como defensas químicas de las plantas y su tolerancia a los microorganismos Una revisión RET Revista de Estudios Transdisciplinarios 1:32-55
|
Revista QuímicaViva Número 3, año 14, Diciembre 2015 quimicaviva@qb.fcen.uba.ar |