Papel dual de la linfopoyetina estromal tímica (TSLP):
¿Regulador
homeostático o mediador pro-inflamatorio?
María Soledad Gori, Julieta Alcain, Mónica Vermeulen y Gabriela Salamone
Academia Nacional de Medicina, IMEX-CONICET y Facultad de Medicina, UBA
Buenos Aires, Argentina
Resumen
Linfopoyetina estromal tímica o TSLP es una citoquina emparentada con la IL-7, producida principalmente por células epiteliales del pulmón, piel e intestino. La TSLP fue originalmente descripta por activar fuertemente a las células dendríticas mieloides, induciendo una respuesta Th2 inflamatoria caracterizada por alta producción de TNF- α y poca o nula producción de IL-10, diferenciándose de las respuestas Th2 regulatorias caracterizadas por una baja producción de TNF- α y alta producción de IL-10. En los últimos años, se ha descripto una correlación directa entre la expresión de TSLP por el epitelio y la patogénesis de enfermedades tales como la dermatitis atópica y el asma, al observarse una elevada expresión de esta citoquina en queratinocitos de lesiones cutáneas de pacientes con dermatitis atópica y en la mucosa bronquial de pacientes asmáticos. Sin embargo, estudios más recientes sugieren que TSLP también puede desempeñar un papel clave en el desarrollo de un perfil Th2 protector en intestino, siendo crítico para el mantenimiento de la homeostasis y tolerancia de la mucosa intestinal mediante la limitación de las respuestas inmunitarias.
Palabras clave: Linfopoyetina estromal tímica (TSLP); células dendríticas; reacciones alérgicas; inmunoregulación.
A dual role of Thymic Stromal Lymphopoietin (TSLP): Homeostatic regulator or proinflammatory mediator?
Summary
Thymic stromal lymphopoietin (TSLP) is an IL-7–like cytokine produced by epithelial cells of lung, gut and skin, mainly. It was originally described by activate strongly human myeloid dendritic cells to induce an inflammatory Th2 response characterized by high TNF-α and little or null IL-10 production, distinct from the regulatory Th2 responses characterized by low TNF-α and high IL-10 production. In the last years was described an interaction direct between the TSLP expression with the pathogenesis of atopic dermatitis and asthma. TSLP was found highly expressed by keratinocytes of skin lesions of patients with atopic dermatitis and bronchial mucosa of asthmatic patients. However more recent study suggests that TSLP may also play a key role in the development of a protective Th2-immunity in the gut, which is critical for maintaining mucosal immune homeostasis and tolerance by limiting immune responses.
Keywords: Thymic Stromal Lymphopoietin (TSLP); dendritic cell; allergic reaction; immunoregulation.
Introducción
La Linfopoyetina Estromal Tímica o TSLP ha sido implicada en el desarrollo de diferentes enfermedades alérgicas como el asma, la dermatitis atópica, la rinitis, así como en el desarrollo de la artritis inflamatoria. En los últimos años, sorpresivamente, también se ha informado un efecto anti-inflamatorio de esta citoquina, cuya función principal sería mantener la tolerancia y homeostasis en las mucosas evitando respuestas autoinmunes y/o una inflamación exacerbada.
La función de TSLP en individuos humanos y en ratón es pleiotrópica, siendo el principal efecto la regulación de la activación, diferenciación y homeostasis de las células T generado a través de la activación de las Células Dendríticas mieloides (CDm) [1].
TSLP es una citoquina emparentada con la Interleuquina (IL) 7 que fue originalmente identificada como un factor promovedor de crecimiento de células B inmaduras [2] y de progenitores T [3], producido por células estromales tímicas murinas. En el 2001, Reche y colaboradores demostraron la expresión de esta citoquina en células epiteliales del pulmón, la piel y el intestino, principalmente [4]. El receptor funcional de TSLP (TSLPR) es un complejo heterodimérico formado por la cadena α del receptor de IL-7 (IL-7Rα) y otra cadena del receptor de TSLP propiamente dicho [4]. Esta última cadena es miembro de la familia del receptor hematopoyético y se une con baja afinidad al TSLP; en cambio, combinada con la cadena del receptor de IL-7α no sólo es más afín a dicha citoquina sino también, es capaz de activar los transductores de señal STAT3 y STAT5 [5].
Diversas poblaciones celulares hematopoyéticas, como los linfocitos T, B, células NKT (Células T Natural Killer), Monocitos, Macrófagos, Basófilos, Eosinófilos, Mastocitos, Células de Langerhans y Células Dendríticas (CD), así como también linajes celulares no hematopoyéticos, como las células epiteliales de diversos órganos (pulmón, piel, timo, intestino) y fibroblastos pulmonares [6] expresan el TSLPR funcional [7]. Se han identificado diferentes fuentes de TSLP incluyendo células epiteliales, fibroblastos, células musculares lisas, células estromales y queratinocitos, mastocitos y basófilos activados, macrófagos CD68+ [8-10]. Sin embargo, no es producida por otras células linfo-hematopoyéticas como neutrófilos, células B, células T, monocitos y CDm no activados, CD plasmacitoides (CDp) y células endoteliales. En contraste, Kashyap y colaboradores han descripto que CDm y monocitos humanos activados vía receptores Toll (TLR, Toll Like Receptor) también expresan ARNm de TSLP [8].
La regulación de la expresión de TSLP en las células epiteliales aún no está completamente dilucidada. El hecho que la presencia y composición de la microflora afecte la producción de TSLP en la célula epitelial intestinal sugirió que los patógenos microbianos tienen un rol regulatorio en la expresión de TSLP. Se ha demostrado que la producción de TSLP puede ser inducida por diversos estímulos exógenos como alérgenos, trauma, infección con microbios, exposición a ligandos de TLR y a citoquinas pro-inflamatorias y derivadas de Th2 [6]. Los factores que regulan negativamente la expresión de TSLP no se conocen aún en profundidad, aunque ya se ha demostrado que el Interferón (IFN) γ, el factor de crecimiento transformante (TGF) β y la IL-17 suprimen la liberación de TSLP por los queratinocitos humanos estimulados por polyI:C, un ligando viral de TLR3. Sin embargo, factores reguladores de la inflamación derivada de Th2, como IL-10, TGF-β o IFN-γ, no muestran un efecto inhibitorio sobre la liberación de TSLP en explantos de piel humanos estimulados con citoquinas Th2 pro-inflamatorias [6]. A partir de técnicas inmunohistoquímicas en muestras de piel de pacientes con dermatitis atópica (respuesta Th2), dermatitis por contacto (respuesta Th1) y lupus eritematoso (respuesta autoinmune), Soumelis y colaboradores han reportado la expresión selectiva de la TSLP en queratinocitos propios de las secciones lesionadas de las muestras de pacientes con dermatitis atópica, siendo indetectable la expresión en las secciones de piel normal de estos pacientes y en las muestras de las otras dos patologías analizadas [7].
Evidencias del rol de TSLP como mediador pro-inflamatorio
El estudio de TSLP ha generado un gran interés debido a su función reguladora de la inflamación. Hace ya varios años que se estudia, principalmente, el rol de esta citoquina en la inflamación alérgica. Se ha propuesto que es producida por células epiteliales activadas a causa de la exposición a diversos estímulos como alérgenos, activando a las CDm, las cuales inducen la diferenciación de los linfocitos T hacia un perfil Th2 particular llamado “Th2 Inflamatorio”, caracterizado principalmente por una producción elevada de Factor de Necrosis Tumoral α (TNF-α) y nula de IL-10. Además de tener efectos sobre otras células inmunes, la TSLP actúa directamente sobre las células T, promoviendo su supervivencia y proliferación en respuesta a la activación del TCR [8–10].
Se ha observado que las CDm humanas, al cultivarlas ex-vivo en medio de cultivo o en presencia de diferentes estímulos, expresan el TSLPR rápidamente y maduran al exponerlas al TSLP. Similar a lo observado en la CDm expuestas a diferentes estímulos activadores, como CD40 ligando (CD40L) y ligandos de TLR (LPS bacteriano), la TSLP aumenta fuertemente la expresión de moléculas de clase II del Complejo Mayor de Histocompatibilidad (MHC II), CD54, CD80, CD83, CD86, y DC-lamp, todas moléculas estimulatorias y co-estimulatorias de las CDm [7]. Sin embargo, al contrario de los estímulos activadores antes nombrados, TSLP no induce sobre la CDm la producción de IL-12, citoquina que conduce a un perfil Th1, ni de las citoquinas pro-inflamatorias TNF-α, IL-1β e IL-6; tampoco induce la producción de IL-4 ni IL-13, ni de la citoquina anti-inflamatoria IL-10 [11, 12]. Además se ha descripto que las CDm activadas con TSLP no expresan ningún miembro de la familia de IL-12 (IL-12, IL-23, IL-27), ni tampoco IFN de tipo I e IFN-γ, todas citoquinas que inducen la diferenciación a Th1 [12]. Sin embargo, la TSLP induce un aumento de la producción de IL-12 en CDm pre-activadas con CD40L, y estas CDm expuestas a ambos estímulos conducen a una diferenciación de células T CD4+ productoras de ambas citoquinas tipo Th1 y Th2 [6]. Es interesante remarcar que en ausencia de IL-12, TSLP induce la expresión de OX40L en las CDm, el cual interactúa con su receptor OX40 expresado en las células T, siendo esta interacción crítica para la diferenciación hacia un perfil Th2 Inflamatorio, el cual se caracteriza por una producción elevada de IL-4, IL-5, IL-13, TNF-α, y nula producción de IL-10 [13].
Las CDm activadas por TSLP producen altos niveles de las quimioquinas Eotaxina-2, CCL17 o TARC (Thymus and activation-regulated chemokine - quimioquina reguladora de la actividad del timo) y CCL21 o MDC (Macrophage-derived chemokine - quimioquina derivada del macrófago), cuales favorecen el reclutamiento de células Th2 hacia los sitios inflamatorios, así como también IL-8 e IL-15, las [13].
Por otro lado, se ha observado que la TSLP no sólo activa fuertemente a las CDm y Células de Langerhans, sino también, mantiene su supervivencia como resultado de la activación de STAT3 y STAT5 [11].
En resumen, la TSLP producida por las células epiteliales activadas podría rápidamente inducir una fase innata de la respuesta inflamatoria alérgica mediante la activación de las CDm, los mastocitos, y las células NK (Natural Killer). Esto tendría cuatro consecuencias: (1) inducir una respuesta inflamatoria vía IL-6, IL-13, y GM-CSF (Granulocyte Macrophage Colony-Stimulating Factor – Factor estimulante de colonia granulocítico-macrófago); (2) reclutar eosinófilos vía IL-5 y Eotaxina-2, así como neutrófilos vía IL-8; (3) producir las quimioquinas TARC y MDC que atraerán a los linfocitos Th2 generados subsecuentemente por las CDm estimuladas con TSLP durante la fase adaptativa de la respuesta inmune alérgica; y (4) educar a una única población de CDm para que adquieran la capacidad de inducir la diferenciación de células T CD4+ naive a células Th2 Inflamatorias, al inducir la expresión de OX40L en ausencia de IL-12 [14]. Estos eventos se esquematizan en la Figura 1.
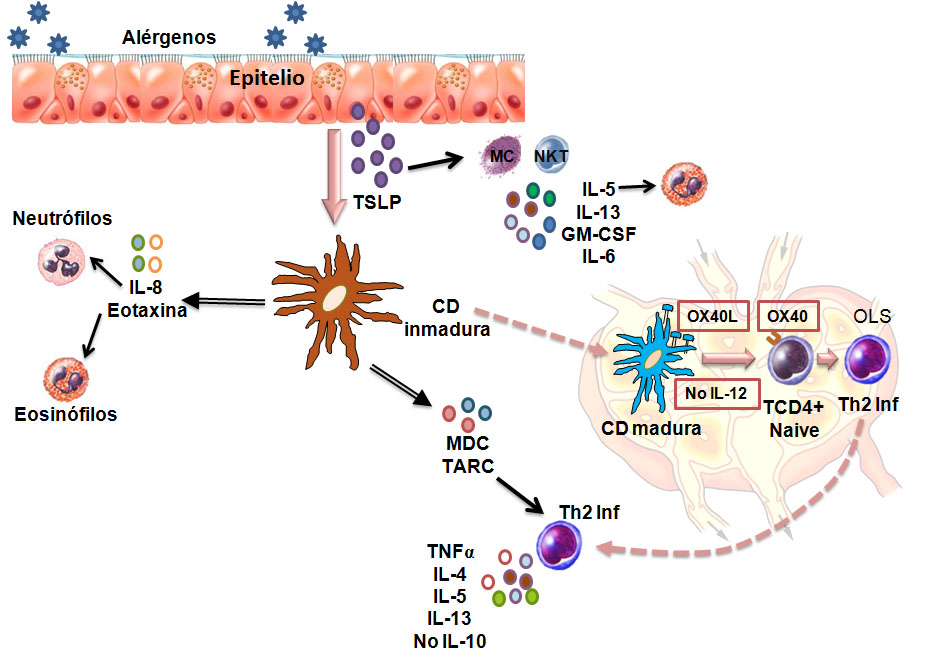
Figura 1:El esquema representa los efectos de TSLP liberada por el epitelio (arriba) que activa diferentes poblaciones leucocitarias como Mastocitos (MC), células NKT y CDm inmaduras. Las células MC y las NKT activadas liberan factores como IL-13, IL6, GM-CSF e IL-5, esta última favorece la movilización de eosinófilos (arriba). Por su parte, la CDm activada produce IL-8 y eotaxina que favorecen el reclutamiento de los neutrófilos y eosinófilos, respectivamente, al tejido inflamado (izquierda), para luego migrar a los órganos linfáticos secundarios (OLS). Al llegar al OLS, la CDm madura, mediante la expresión de la molécula OX40L (derecha), logra la activación y diferenciación de los linfocitos T CD4+ naive hacia un perfil Th2 Inflamatorio (Th2 Inf) que será reclutado por las quimioquinas MDC y TARC (abajo), producidas por las propias CDm activadas por TSLP, hacia el tejido inflamado y producirán allí las citoquinas características del perfil: IL4, IL5, IL13 y TNF-α. (Modificado de [14].
Recientemente, nuestro grupo de trabajo ha realizado un hallazgo sumamente interesante en la patogénesis del asma, que involucra a las CDm tratadas con TSLP y con el principal neurotransmisor del sistema nervioso parasimpático, la Acetilcolina (ACh), molécula clave en esta patología. La CDm tratada con ambos estímulos presenta una incrementada expresión de OX40L, de HLA-DR (MHC II) y CD83, así como un aumento en la producción de citoquinas pro-inflamatorias como TNF-α e IL-8, respecto a las CDm tratadas solo con uno de los dos estímulos. Hemos demostrado, además, que la estimulación con ACh de la CDm activada por TSLP, incrementa su capacidad estimulatoria en un cultivo mixto linfocitario e induce el desarrollo de un perfil de respuesta Th2 más “agresivo”, al desencadenar una mayor respuesta proliferativa y un aumento en la producción de citoquinas Th2 inflamatorias, TNF-α e IL-13, significativamente mayor que el generado por las CDm estimuladas solo con TSLP o ACh [15]. Por último, hemos observado que la estimulación con TSLP desencadena el aumento en la expresión de M3 [16], uno de los tres receptores muscarínicos de ACh que la CDm expresa basalmente, resultado que ya había sido reportado por nuestro grupo [17], y el cual se halla dramáticamente incrementado en condiciones patológicas favoreciendo la inflamación [18]. En conjunto, nuestros hallazgos ofrecen nuevas evidencias para la TSLP en el desarrollo de la patogénesis del asma, resultando favorecida gran parte de su acción por la ACh.
TSLP en el mantenimiento de la homeostasis de células T
Es sabido que las CDm cumplen un importante rol en el mantenimiento de la homeostasis de las células T bajo condiciones fisiológicas, aunque aún no está del todo claro cómo esta capacidad de las CDm se encuentra regulada.
Mediante técnicas inmunohistoquímicas, Watanabe y colaboradores descubrieron que la TSLP se encuentra expresado en células epiteliales de las amígdalas humanas y que esta expresión se encuentra fuertemente asociada a CDm activadas bajo condiciones fisiológicas normales [19]. Debido a que fue informada la capacidad que tienen las CDm activadas por TSLP de inducir una fuerte expansión de células T CD4+, se ha hipotetizado que la TSLP humano expresado en las células epiteliales de los tejidos linfoides de la mucosa periférica podría jugar un rol crítico en la proliferación homeostática de las células T naive y de memoria. A favor de esto, se halló que sólo las CDm activadas por TSLP y no por otros estímulos como IL-7, CD40L, LPS o polyI:C, podrían inducir una robusta y sostenida expansión de células T CD4+ autólogas naïve sin la exposición a antígenos foráneos, citoquinas ni suero bovino fetal [19]. Esta capacidad única de las CDm activadas por TSLP se correlaciona con su fuerte capacidad de formar conjugados con los T CD4+ autólogos naïve por tiempo prolongado, proveyéndoles señales sostenidas de supervivencia y proliferación [19]. Todo esto podría ser mediado por la expresión upregulada de complejos MHC- péptido propio y moléculas co-estimulatorias en CDm primadas con TSLP [19]. El mismo grupo de investigadores demostró que las CDm activadas por TSLP son críticas para mantener la homeostasis de las células T CD4+ Th2 de memoria central, las cuales podrían potencialmente expandirse y diferenciarse en células Th2 de memoria efectoras, mediante la interacción con TSLP o con otras moléculas pro-alergénicas (por ejemplo, IL-25) en los sitios de inflamación [20].
Efectos tolerogénicos de TSLP en mucosas: Nuevas evidencias
Hace pocos años se ha descripto un posible rol anti-inflamatorio de la TSLP en la mucosa intestinal. Se ha sugerido que una pequeña producción constitutiva de TSLP en el epitelio de la mucosa conduce a las CDm de la misma hacia un fenotipo anti-inflamatorio que mantenga la homeostasis [21]. A favor de esto, se ha observado una clara asociación entre el decremento en la producción de TSLP y la enfermedad de Crohn (enfermedad autoinmune inflamatoria del sistema digestivo) [21].
Al compararlas con las CDm convencionales, las CDm intestinales poseen un fenotipo más tolerogénico hacia la microflora y los antígenos alimenticios. Contrariamente al rol inflamatorio que posee la TSLP en la CDm convencional, en la CDm residente de la mucosa intestinal la TSLP, induce la producción de IL-10 e IL-6 pero no de IL-12, conduciendo hacia una respuesta Th2 protectiva capaz de proteger ante una posible infección, pero sin generar una respuesta inflamatoria ante la exposición a un patógeno microbiano de la flora intestinal [6].
A partir de estas evidencias, se ha postulado que la función normal de la TSLP sería mantener la homeostasis de linfocitos Th2 no inflamatorios productores de las citoquinas Th2 típicas (IL-5, IL-4 e IL13) e IL-10 en la superficie de las barreras naturales, sugiriendo que TSLP podría contribuir a la tolerancia local en las mucosas a partir de CDm no inflamatorias [6], y que solo una expresión desregulada del mismo podría resultar en el desarrollo de una respuesta inflamatoria Th2 como, por ejemplo, una enfermedad alérgica [13].
TSLP y tolerancia en el timo
Relacionado también a este rol homeostático de TSLP, se ha sugerido su participación en la generación de CDm tolerogénicas que conduciría a la diferenciación de un perfil regulatorio de linfocitos T (T Reg) [13]. Los T Reg son una pequeña subpoblación de células T CD4+CD25+ que se diferencian bajo control del factor de transcripción Foxp3. Los linfocitos T Reg tienen una función supresora que ayuda a mantener la tolerancia y prevenir las respuestas autoinmunes. Se ha reportado que la TSLP se encuentra expresado selectivamente en las células epiteliales de los corpúsculos de Hassall’s en la médula tímica, y que su principal función es activar a la subpoblación de CDm presente en este órgano; validando esto se encuentran estudios realizados por Watanabe y colaboradores donde hallaron a los corpúsculos de Hassall’s asociados a la subpoblación de CDm activadas, y también estudios in vitro donde se confirma que la TSLP activa fuertemente a CDm humanas purificadas de timo [22]. Teniendo en cuenta que la señal dada por la molécula CD28 en células T Reg es crítica para su desarrollo, que el timo normalmente no se encuentra expuesto a infecciones microbianas ni a respuestas inflamatorias, y por ende, que la TSLP representaría la única señal fisiológica presente para activar a las CDm tímicas y por lo tanto aumentar la expresión de los ligandos de CD28 (CD80/86), es válido considerar que la función de TSLP en el timo sea la de promover la diferenciación de los T Reg. Además, como se explicó anteriormente, la capacidad única que tienen las CDm activadas con TSLP de inducir una fuerte expansión de células T CD4+ autólogas sin la presencia de antígenos foráneos y de formar conjugados con las mismas por tiempo prolongado, confirman la validez de esta teoría [19]. Por último, Watanabe y colegas demostraron que la TSLP humano promueve la diferenciación de células T Foxp3+ a partir de timocitos naive CD4+CD8-CD25 de una manera CD-dependiente: CDm purificadas de timo humano estimuladas con TSLP pero no con IL-7, CD40L o polyI:C, inducen una vigorosa expansión de timocitos CD4+CD8-CD25-, siendo la mitad de estos además Foxp3+ [22].
Consideraciones finales
En los últimos años se comenzaron a estudiar, cada vez más, los diferentes roles que podría cumplir la TSLP, no sólo relacionado a su acción inflamatoria, sino a su posible vinculación a la homeostasis y tolerancia, lo que podría explicar el por qué de su presencia en los tejidos en condiciones fisiológicas normales. Parecería ser que la clave está en el nivel de expresión de TSLP alcanzado en las células epiteliales del tejido y el microambiente del mismo, lo cual condicionaría a las CDm residentes a un perfil inflamatorio o anti-inflamatorio. Como se explicó anteriormente, una baja expresión de TSLP en el intestino, se encuentra asociada a la enfermedad de Crohn, mientras que una sobreexpresión en la piel se asocia a la dermatitis atópica. A partir de esto podemos concluir que cuando el nivel de expresión de TSLP cambia, se rompe la homeostasis local. Asimismo, la participación en la inmunidad de mucosas referida antes [6, 21] es un dato promisorio acerca de su potencial terapéutico en condiciones de mantenimiento y pérdida de la homeostasis inmunológica.
M.S. Gori es becaria Postdoctoral de CONICET y Ayudante de primera de la cátedra de Inmunología del Depto. de Microbiología, Parasitología e Inmunología de FMED-UBA. J. Alcain es becaria de Postgrado de CONICET. G. Salamone es investigadora adjunta de CONICET. M. Vermeulen es investigadora independiente de CONICET y Directora del Lab. CPA y Respuesta Inflamatoria IMEX-CONICET.
Referencias
1. Ziegler SF, Liu Y (2006) Thymic stromal lymphopoietin in normal and pathogenic T cell development and function. Nature Immunology 7: 709–714 DOI: 10.1038/ni1360.
2. Friend SL, Hosier S, Nelson A, Foxworthe D, Williams DE, Farr A (1994) A thymic stromal cell line supports in vitro development of surface IgM+ B cells and produces a novel growth factor affecting B and T lineage cells. Experimental Hematology 22: 321–328.
3. Sims JE, Williams DE, Morrissey PJ, Garka K, Foxworthe D, Price V, Friend SL, Farr A, Bedell MA, Jenkins NA, Copeland NG, Grabstein K, Paxton RJ (2000) Molecular cloning and biological characterization of a novel murine lymphoid growth factor. Journal of Experimental Medicine 192: 671–680.
4. Reche PA, Soumelis V, Gorman DM, Clifford T, Liu Mr, Travis M, Zurawski SM, Johnston J, Liu YJ, Spits H, de Waal Malefyt R, Kastelein RA, Bazan JF (2001) Human thymic stromal lymphopoietin preferentially stimulates myeloid cells. Journal of Immunology 167: 336–343.
5. Pandey A, Ozaki K, Baumann H, Levin SD, Puel A, Farr AG, Ziegler SF, Leonard WJ, Lodish HF (2000) Cloning of a receptor subunit required for signaling by thymic stromal lymphopoietin. Nature Immunology 1: 59–64 DOI: 10.1038/76923.
6. He R, Geha RS (2010) Thymic stromal lymphopoietin. Annals of the New York Academy of Sciences 1183: 13–24 DOI: 10.1111/j.1749-6632.2009.05128.x.
7. Soumelis V1, Reche PA, Kanzler H, Yuan W, Edward G, Homey B, Gilliet M, Ho S, Antonenko S, Lauerma A, Smith K, Gorman D, Zurawski S, Abrams J, Menon S, McClanahan T, de Waal-Malefyt Rd R, Bazan F, Kastelein RA, Liu YJ (2002) Human epithelial cells trigger dendritic cell mediated allergic inflammation by producing TSLP. Nature Immunology 3: 673–680 DOI: 10.1038/ni805.
8. Kashyap M, Rochman Y, Spolski R, Samsel R, Leonard WJ (2011) Thymic stromal lymphopoietin is produced by dendritic cells. Journal of Immunology 187: 1207–11 DOI: 10.4049/jimmunol.1100355.
9. Salamone G, Nahmod K, Biglione M (2011) Hipersensibilidad. In Introducción a la Inmunología Humana, 6° Ed. L. Fainboim, and J. Geffner, eds. Editorial Médica Panamericana. 503–528.
10. Gori S, Alcain J, Salamone G, Vermeulen G Inflammatory Mediators and Neuromodulators: Targeting in Asthma and Chronic Obstructive Pulmonary Disease. In “Frontiers in Clinical Drug Research- Anti Allergy Agents” Bentham Science Publishers. In press.
11. Wang YH, Liu YJ (2009) Thymic stromal lymphopoietin, OX40-ligand, and interleukin-25 in allergic responses. Clinical and Experimental Allergy 39: 798–806 DOI: 10.1111/j.1365-2222.2009.03241.x.
12. Liu YJ1, Soumelis V, Watanabe N, Ito T, Wang YH, Malefyt Rde W, Omori M, Zhou B, Ziegler SF (2007) TSLP: an epithelial cell cytokine that regulates T cell differentiation by conditioning dendritic cell maturation. Annual Review of Immunology 25: 193–219 DOI: 10.1146/annurev.immunol.25.022106.141718.
13. Ziegler SF (2012) Thymic stromal lymphopoietin and allergic disease. Journal of Allergy Clinical Immunology 130: 845–852 DOI: 10.1016/j.jaci.2012.07.010.
14. Liu YJ (2009) TSLP in epithelial cell and dendritic cell cross talk. Advances in Immunology 101: 1–25 DOI: 10.1016/S0065-2776(08)01001-8.
15. Gori S, Vermeulen M, Sabbione F, Towstyka N, Ruiz M, Scordo W, Jancic C, Geffner J, Salamone G (2014) The Cholinergic System modulates the physiology of dendritic cell activated by TSLP. Medicina (B. Aires) 74 (III): 146–147.
16. Gori S, Vermeulen M, Remes-Lenicov F, Sabbione F, Jancic C, Scordo W, et al. (2015) Acetylcholine polarizes dendritic cells toward a Th2-promoting profile. In Book of Abstracts SAI-FAIC 39.
17. Salamone G, Lombardi G, Gori S, Nahmod K, Jancic C, Amaral MM, Vermeulen M, Español A, Sales ME, Geffner J (2011) Cholinergic modulation of dendritic cell function. Journal of Neuroimmunology 236: 47–56 DOI: 10.1016/j.jneuroim.2011.05.007.
18. Xu ZP, Song Y, Yang K, Zhou W, Hou LN, Zhu L, Chen HZ, Cui YY (2014) M3 mAChR-mediated IL-8 expression through PKC/NF-κB signaling pathways. Inflammation Research 63: 463–473 DOI: 10.1007/s00011-014-0718-4.
19. Watanabe N, Hanabuchi S, Soumelis V, Yuan W, Ho S, de Waal Malefyt R, Liu YJ (2004) Human thymic stromal lymphopoietin promotes dendritic cell-mediated CD4+ T cell homeostatic expansion. Nature Immunology 5: 426–434 DOI: 10.1038/ni1048.
20. Wang YH, Liu IJ (2007) OX40-OX40L interactions: a promising therapeutic target for allergic diseases? Journal of Clinical Investigation 117: 3655–3657 DOI: 10.1172/JCI34182.
21. Rimoldi M, Chieppa M, Salucci V, Avogadri F, Sonzogni A, Sampietro GM, Nespoli A, Viale G, Allavena P, Rescigno M (2005) Intestinal immune homeostasis is regulated by the crosstalk between epithelial cells and dendritic cells. Nature Immunology 6: 507–514 DOI: 10.1038/ni1192.
22. Watanabe N, Wang YH, Lee HK, Ito T, Wang YH, Cao W, Liu YJ (2005) Hassall’s corpuscles instruct dendritic cells to induce CD4+CD25+ regulatory T cells in human thymus. Nature 436: 1181–1185 DOI: 10.1038/nature03886
|
Revista QuímicaViva Número 3, año 14, Diciembre 2015 quimicaviva@qb.fcen.uba.ar |