Estrategias bacterianas de supervivencia como herramientas en biotecnología ambiental
Irene C. Lazzarini Behrmann1*, María L. Ferreira1*, Mauricio J. Alessandrello1*, Silvana Ramírez1 y Diana L. Vullo1,2
1 Área Química, Instituto de Ciencias, Universidad Nacional de General Sarmiento-CONICET. Los Polvorines, Buenos Aires.
2Área Microbiología, Departamento de Química Biológica. Facultad de Ciencias Exactas y Naturales. Universidad de Buenos Aires. Argentina.
dvullo@ungs.edu.ar
Recibido: 22/03/2015 - Aceptado: 25/03/2015
*Los tres primeros autores contribuyeron de la misma manera en la confección del presente artículo
Resumen
Las diversas actividades humanas, desde industriales hasta agropecuarias, generan desechos que al ser vertidos al ambiente provocan serios desequilibrios en los diversos ecosistemas. Las comunidades microbianas son las involucradas en la recuperación de suelos y cuerpos de agua gracias a su versatilidad de respuestas. Pseudomonas veronii 2E es una bacteria aislada a partir de sedimentos del río Reconquista, el curso de agua más importante de la zona noroeste del Área Metropolitana de Buenos Aires, cuya cuenca recibe las descargas de las principales actividades industriales y agropecuarias de la zona. El objetivo general de nuestro proyecto es explotar las estrategias adaptativas de P. veronii 2E para el desarrollo de sistemas de tratamiento de efluentes industriales. Algunas de estas estrategias aplicables a la biotecnología ambiental son: su capacidad de formación de biopelículas, la reducción microbiana de Cr(VI) y la producción de sideróforos.
Palabras clave: biotratamiento, efluentes de galvanoplastías, interacciones metal-microorganismos, Pseudomonas veronii.
Bacterial strategies as tools for Environmental Biotechnology
Abstract
Industrial activities lead to a constant perturbation in ecosystem equilibriums which restoration is mediated by microorganisms thanks to their adaptability. Electroplating and metallurgical industry discharges are loaded with metals such as Cu(II), Cd(II), Zn(II) and Cr(VI), causing environmental damages because of metal persistence and high mobility in aqueous systems. Pseudomonas veronii 2E - isolated from polluted surface waters (Reconquista River, Buenos Aires Metropolitan Area)- is able to biotransform Cr(VI) to Cr(III) and showed adsorption capacity towards Cd(II) and Zn(II) and ability to develop biofilms on different polymeric matrices. The aim of the study is to exploit the strategies developed by Pseudomonas veronii 2E for the development of wastewater biotreatments, especially directed to electroplating effluents.
Keywords: waste biotreatment, electroplating effluents, metal-microbe interactions, Pseudomonas veronii.
Introducción
Las actividades industriales generan residuos que perturban el equilibrio de los ecosistemas. Muchos de sus residuos contienen metales como Cd(II), Zn(II), Ni(II), Pb(II), Cu(II) y Cr(VI), los cuales son altamente persistentes en el ambiente. Algunas especies metálicas son móviles, acrecentando el riesgo sobre todo en sistemas acuosos. Los microorganismos poseen una capacidad adaptativa frente a las perturbaciones desarrollando o expresando estrategias de supervivencia que resultan de interés a la hora de pensar en técnicas de restauración de los ambientes contaminados. Pseudomonas veronii 2E es una bacteria autóctona de la cuenca del Río Reconquista, el curso de agua más importante de la zona noroeste del Área Metropolitana de Buenos Aires, cuya cuenca recibe las descargas de las principales actividades industriales y agropecuarias de la zona. Es un microorganismo resistente a altas concentraciones de Cd(II), Zn(II), Cu(II) y Cr(VI). Posee una capacidad biosortiva muy alta de Cd(II), Zn(II) y Cu(II) [1], mientras que es capaz de biotransformar la especie altamente tóxica de Cr(VI) a una de menor toxicidad como Cr(III) [2, 3]. El objetivo general de nuestro proyecto es explotar las estrategias adaptativas de P. veronii 2E para el desarrollo de sistemas de tratamiento de efluentes industriales. Algunas de estas estrategias aplicables a la biotecnología ambiental son: su capacidad de formación de biopelículas, la reducción microbiana de Cr(VI) y la producción de sideróforos.
Formación de biopelículas
El desarrollo de biopelículas de P. veronii 2E posee diversas aplicaciones, dada la capacidad adsortiva de metales de relevancia ambiental como Cd(II), Zn(II) y Cu(II) que presentan los exoplímeros que conforman la matriz [1, 4]. Estos metales aparecen en los principales efluentes de la industria galvanoplástica, por lo que el diseño de biorreactores de lecho fijo o fluidizado son las opciones viables para una descarga ecológicamente amigable. Además del desarrollo de biorreactores, la interacción entre las biopelículas de P. veronii 2E y los metales abre la posibilidad de ampliar el espectro de uso. El hecho de utilizar como soporte de las biopelículas una superficie conductora habilita la medición de una respuesta eléctrica y, como consecuencia, el diseño de biosensores.
Con el propósito de desarrollar biosensores utilizando biopelículas, la superficie elegida debe tener las siguientes características: por un lado el P. veronii 2E debe ser capaz de formar biopelículas sobre la misma en una buena proporción y por otro lado dicha superficie debe tener una buena respuesta electroquímica para poder censar el analito de interés. Como se desea desarrollar un sensor de bajo costo es conveniente elegir superficies de grafito comerciales de fácil acceso y económicas.
El objetivo en este aspecto es estudiar el desarrollo de biopelículas de P. veronii 2E sobre superficies conductoras de grafito y evaluar su respuesta electroquímica en diferentes condiciones.
Producción de sideróforos
Los sideróforos son productos bacterianos secretados al medio. Estas moléculas complejan fuertemente al Fe(III) y son sintetizadas cuando las concentraciones de hierro libre en el ambiente en el cual viven son extremadamente bajas. Sin embargo, a pesar de su preferencia por el hierro, pueden interaccionar con otros metales como Ni(II), Zn(II), Co(II), Cu(II), Pb(II), Cd(II) como una estrategia de supervivencia en ambientes contaminados [5-7].
Los sideróforos secretados por Pseudomonas son pigmentos fluorescentes de un color verde-amarillo que posee una estructura compuesta por: dihidroxiquinolina (cromóforo responsable de la fluorescencia), una cadena peptídica y una cadena de otro tipo (generalmente compuesta por ácidos di-carboxílicos) [8, 9].
Estos compuestos han recibido una atención particular en los últimos años debido a las posibles aplicaciones en el ambiente. Dentro de esta área a explotar, se encuentra la utilización de estos analitos para la movilización y solubilización de metales de transición, haciendo de los sideróforos una herramienta útil en la biorremediación [10, 11]
El objetivo de este estudio es evaluar la producción de sideróforos producidos por P. veronii 2E en presencia de Cd(II) en el medio de cultivo y explorar una posible interacción entre este compuesto y dicho metal.
Biotransformación de Cr(VI) a Cr(III)
Las aguas residuales provenientes de galvanoplastias, de la industria metalúrgica y la industria química en general presentan concentraciones de Cr(VI) por encima de los niveles permitidos por ley para su descarga en cuerpos de agua receptores o en plantas de tratamiento cloacal. Debido a los efectos tóxicos del Cr(VI), en el mundo existen leyes que limitan la concentración de cromo hexavalente que debe haber en un agua residual industrial para que pueda ser descargado en forma segura. En Argentina la ley nacional 26.221, artículo 122, anexo B, regula los niveles de Cr(VI) y Cr(III) que deben tener los desagües cloacales y establece que las descargas no deben tener una concentración mayor a los 0,2 ppm para Cr(VI) y de 2 ppm para Cr(III). En Estados Unidos el código de regulaciones federales (Code of Federal Regulations) en su título 40, volumen 24, inciso 141.62 establece que el nivel máximo de cromo total en sistemas acuáticos debe ser de 0,1 ppm. En Europa, la directiva 98/83/CE del consejo establece una concentración de cromo en aguas para consumo humano de menos de 0,05 ppm.
Por lo tanto, estas industrias deben tratar sus aguas previamente a la descarga. Sin embargo, los tratamientos convencionales del tipo químico (reducción de Cr(VI) con bisulfito de sodio y posterior precipitación del Cr(III) generado) son muchas veces ineficientes y costosos. En el presente trabajo se presenta un sistema de tratamiento biológico que es más económico, eficiente y ambientalmente amigable.
Materiales y Métodos
Formación de biopelículas
Crecimiento de biopelículas sobre superficies conductoras
Se inocularon 10mL de diferentes medios de cultivo (Tabla 1) suplementados con 0,5% glucosa (Anedra), glutamato (Sigma-Aldrich) o succinato (Sigma-Aldrich), en presencia de distintos perfiles de grafito (Faber Castell® 9B, CRETACOLOR® 4B, Arcair® y KOOH-I-NOR®) de 2-3mm de espesor, con 1 mL de un cultivo overnight de Pseudomonas veronii 2E. Cada uno de ellos se incubó a 32ºC, 100 o.p.m. (órbitas por minuto) durante 72 h. Se realizó por duplicado.
| Nombre | Composición (g/L) |
| M9 | Na2HPO4 (Anedra) 3,0; KH2PO4 (Cicarelli) 1,5; NaCl (Anedra) 0,25; NH4Cl 0,5 (Riedel-de Haën); MgSO4 (JT Backer) 0,2 |
| PY (B) | bactopeptona (DIFCO) 2,5; extracto de levadura (Merck) 1,25 |
| PY (T) | triptona (Anedra) 2,5; extracto de levadura (Merck) 1,25 |
Tabla 1. Medios utilizados con su respectiva composición.
Determinación del crecimiento y la biomasa de la biopelícula con tinción Cristal Violeta
Se midió la Densidad Óptica a 600 nm (DO600nm) del medio de cultivo para determinar el crecimiento celular planctónico. Para la determinación de la biomasa presente en la biopelícula se utilizó el método descripto por O´Toole [12] y Sheikh [13]. Primero se lavaron las superficies de grafito con abundante agua, las mismas se tiñeron con Cristal Violeta 1 %(m/V) durante 10 minutos. A continuación se quitó el exceso de Cristal Violeta realizando lavados sucesivos con agua destilada y se realizó la extracción del colorante con 5 mL de etanol 96 %(v/v) durante 20 minutos. Se midió la absorbancia del extracto resultante a 590 nm y se comparó contra curva de calibrado realizada con una solución patrón de Cristal Violeta.
Evaluación del comportamiento electroquímico de las superficies de grafito
La respuesta electroquímica del grafito en ausencia de la biopelícula se midió realizando voltamperometría cíclica en una celda convencional de tres electrodos utilizando como electrodo de trabajo el grafito a testear, como contraelectrodo una barra de grafito comercial y como electrodo de referencia un electrodo de Ag/AgCl Metrohm. Se utilizó NaNO3 (Sigma-Aldrich) o KCl (JT Backer) 0,1 M como electrolito soporte y la velocidad de barrido fue 0,1 V/s en ausencia y presencia de una sonda electroquímica de K4[Fe(CN)6] 50 mM (JT Backer).
Producción de sideróforos
En estudios anteriores se ha podido obtener las mejores condiciones para la producción de sideróforos por parte de P. veronii 2E. La producción de sideróforos fue realizada en un sistema en lote usando como medio líquido de cultivo M9-succinato (K2HPO4 7,3 g/l, KH2PO4 3 g/l, NH4Cl 6,6 g/l, NaCl 3,3 g/l, succinato 5 g/l). Las condiciones óptimas de incubación fueron 25ºC, 120 rpm y 48 h.
Efecto de Cd(II) en el medio de crecimiento y en la producción de sideróforos
Para evaluar si se observaba o no una estimulación en la secreción de los sideróforos por parte de P.veronii 2E, se agregó Cd(II) al medio de cultivo en concentraciones finales de 0,01mM, 0,1 mM y 0,5 mM, utilizando una solución madre 0,25 M CdCl2 (Sigma). Luego se inocularon con un cultivo de P.veronii 2E en medio M9-succinato sin metal (24 h, fase exponencial) y se incubaron en las mismas condiciones descriptas anteriormente. Posteriormente, los cultivos se centrifugaron (6300 g, 15 min, 4ºC), descartando el pellet y se filtró el sobrenadante a través de una membrana de acetato de celulosa de 0,45 µm de diámetro de poro (Millipore®). La producción de sideróforos fue analizada realizando un espectro de absorción entre 300 nm y 500 nm. Nuevamente como control se utilizó en medio de cultivo sin inocular.
Estudio de la interacción de sideróforos producidos por P. veronii 2E con Cd(II)
Se estudió una posible interacción metal-sideróforo en los sobrenadantes de cultivo obtenidos con M9-succinato. Para ello se realizaron agregados de 1 µM, 10 µM o 100 µM de concentración final de Cd(II) a partir de una solución madre de CdCl2 0,25 M (Sigma). Luego de 3 h de incubación con agitación a temperatura ambiente se realizó un espectro de absorción de cada muestra. Como control se utilizó medio de cultivo sin inocular con las tres concentraciones de Cd(II).
NOTA: todo el material de vidrio fue lavado previamente con HCl 6 M y enjuagado con agua 18 Mωcm Millipore® para eliminar trazas de Fe(III). Las soluciones y los medios de cultivo fueron preparados en agua 18 MΩcm Millipore®.
Biotransformación de Cr(VI) a Cr(III)
Tratamiento de aguas residuales industriales
Se obtuvo una suspensión bacteriana de 500 mL (densidad: 54g/L) en agua destilada a partir de la cosecha de 10 cultivos en lote de 1 L en caldo nutritivo (5 g/L peptona de carne, 3 g/L extracto de levadura (Merck) y 1 g/L glucosa (Sigma)) utilizando un biorreactor de diseño propio (incubación: 24 h a 32ºC). Las células fueron luego inmovilizadas en alginato de calcio. Brevemente, la suspensión bacteriana fue mezclada con 500 mL de una solución de alginato de sodio (Sigma) 1 %(m/v) y la mezcla fue goteada con una jeringa de 60 mL sobre una solución de CaCl2 (Merck) 0,05 M a 4ºC. Las esferas formadas reposaron en esta solución por 15 minutos a 4ºC, luego fueron lavadas dos veces con agua destilada y utilizadas inmediatamente. Las células inmovilizadas fueron empaquetadas en una columna de 1 L termostatizada con camisa externa. A través del lecho de la columna se bombearon dos aguas residuales industriales, AR1 y AR2, de 0,26 y 0,69 ppm de Cr(VI) respectivamente (ver composición en Tablas 2 y 3) y suplementados con 200 ppm de glucosa. El caudal fue de 7 mL/min de manera de establecer un tiempo de retención hidráulico de 30 minutos. El volumen de columna fue de 0,21 L y la temperatura de trabajo fue de 32ºC. Las aguas residuales fueron bombeadas alternativamente: cada 10 horas de tratamiento de AR2, el afluente fue cambiado por AR1 que circulaba por la columna durante 14 h antes de cambiar el afluente nuevamente por AR2. Periódicamente se determinó la concentración de Cr(VI) y Cr(III) en el líquido tratado.
Tabla 2. Composición del agua residual AR1. |
Tabla 3. Composición del agua residual AR2. |
Determinación de la concentración de Cr(VI)
Para la determinación de Cr(VI) se utilizó el método descripto por Patra [14]: se mezcló 1 mL de muestra con 1 mL de H2SO4 1N y 0,2mL de solución de 1,5-difenilcarbazida (DPC) preparada disolviendo 4 g de ácido ftálico y 0,25 g de DPC en 100 mL de etanol 96 %(v/v). La absorbancia de la solución resultante se midió a 540 nm.
Determinación de la concentración de Cr(III)
La determinación de Cr(III) se realizó según el método descripto por Souza [15]. Brevemente el sobrenadante fue llevado a pH 12, se le agregó H2O2 a una concentración final de 1,4 M y se incubó a 60°C por 40 minutos para la oxidación completa del Cr(III) a Cr(VI). El Cr(VI) obtenido en la solución fue determinado como fue descripto anteriormente.
Producción de biomasa con medios de cultivo alternativos
Se prepararon medios de cultivo alternativos con melaza de caña (marca El trébol) 2 %(m/v) o glicerol ácido 5 %(v/v) (proveniente de la planta de elaboración de biodiesel del partido de Malvinas Argentinas, Buenos Aires) como fuente de carbono y fertilizante (marca Afital) 0,6 %(v/v) como fuente de nitrógeno. Las fuentes de carbono fueron esterilizadas por calor a 121ºC por 15 minutos. El fertilizante fue esterilizado por filtración y luego agregado a las fuentes de carbono estériles. El pH de los medios fue neutralizado con NaOH 6 M. El caldo nutritivo (Merck) (5 g/L peptona de carne, 3 g/L extracto de levadura) más glucosa (Sigma) (1 g/L) fue esterilizado por calor a 121ºC por 15 minutos.
Se inoculó P. veronii 2E en 10mL de caldo nutritivo en un erlenmeyer de 125mL y se incubó a 32ºC y 120 rpm de agitación. Luego, se inocularon 5mL del cultivo en 45mL de caldo nutritivo o en medios alternativos con melaza de caña o glicerol ácido como fuente de carbono y fertilizante como fuente de nitrógeno. Se utilizaron erlenmeyers de 250mL para esta operación. Los cultivos se incubaron a 32ºC hasta que alcanzaron la fase estacionaria: 24 h para los cultivos en caldo nutritivo y con melaza y 72 h para los cultivos en glicerol. El crecimiento bacteriano se evaluó por peso seco: se centrifugó la totalidad del cultivo a 6300 g por 15 minutos, se lavaron los pellets dos veces con solución fisiológica y se secaron a 60ºC hasta peso constante
Resultados y Discusión
Formación y cuantificación de biopelículas
A través de una curva de calibración se pudo relacionar la absorbancia a 590 nm con la concentración del Cristal Violeta, y con ella se cuantificó de manera indirecta la cantidad de biopelícula formada, si bien se debió tener en cuenta que cierto porcentaje del Cristal Violeta fue adsorbido a la superficie de manera inespecífica sin deberse a la presencia de la biopelícula. Esto se pudo observar en el grafito KOOH-I-NOR® donde no se observó formación de biopelícula aunque se cuantificó una leve concentración de cristal violeta.
Por otra parte se observó formación de biopelículas sobre las superficies de grafito Faber Castell® 9B, CRETACOLOR® 4B y Arcair®.
Respecto de cuál es la fuente de carbono más adecuada en la cual P. veronii 2E se registra un mejor desarrollo de la biopelícula, se pudo ver que ésta dependía de la superficie de grafito en cuestión. Los resultados se exponen en la Figura 1.
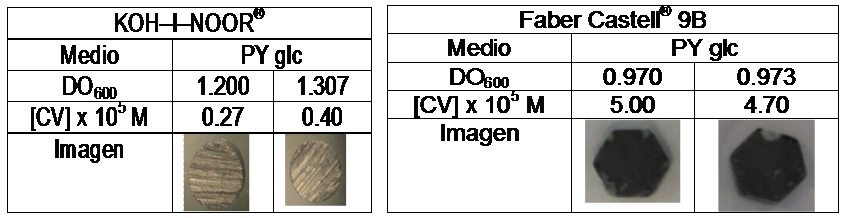
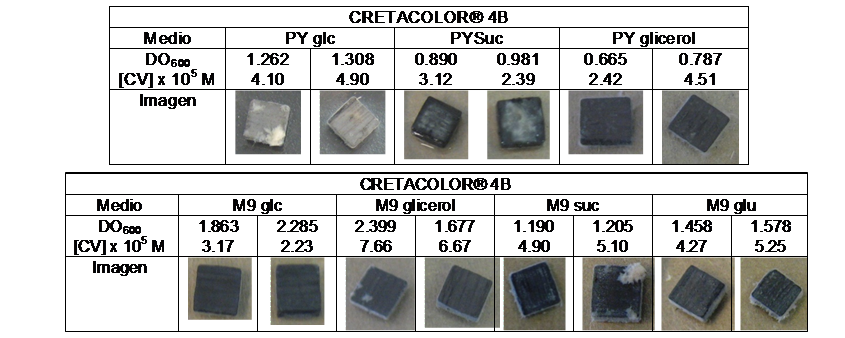
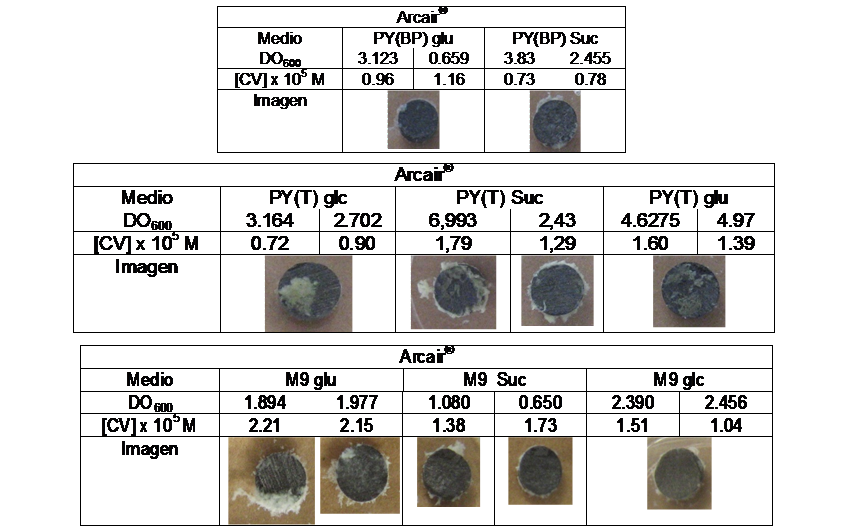
Figura 1: Desarrollo de biopelículas en diferentes medios de cultivo sobre superficies de grafito.
Para analizar el comportamiento electroquímico se utilizó Voltamperometría Cíclica, en la cual se midió la intensidad de corriente en un rango de potencial. En la misma, se partió de un potencial de partida V0 y éste se aumentó a una velocidad de 0,1 V/s hasta un valor máximo V1 para luego regresar a V0. Si en la solución se encuentran una especie con propiedades óxido-reducción, se espera observar un pico correspondiente a la reducción de dicha especie al ir de V0 a V1, y al realizar el camino inverso se espera obtener un pico correspondiente a la oxidación. Dichos voltamperogramas, son característicos para cada cupla redox.
Con el fin de desarrollar un sensor se desea que la superficie del electrodo no haya una respuesta electroquímica en presencia de un electrolito soporte, es decir que no se desea observar ningún pico en el rango de potenciales analizados en la voltamperometría cíclica, por lo cual la intensidad de corriente observada permanecerá casi constante. Asimismo, en presencia de una cupla conocida, como [Fe(CN)6]3-/[Fe(CN)6]4-, se espera observar una señal en el potencial característico de la cupla y cuya intensidad sea considerablemente significativa.
Se observó que las superficies de Faber Castell® presentaron una respuesta no deseable pues la misma resultó ser muy resistiva (Figura 2A), por lo que la intensidad aumenta a medida que el potencial es mayor. Esto no nos permitiría detectar otros procesos de óxido-reducción de interés en el rango de potenciales explorados. Por otro lado las superficies CRETACOLOR® y KOH-I-NOOR® presentaron una buena respuesta en presencia del electrolito soporte, ya que no se observaron picos; pero en presencia de la cupla [Fe(CN)6]3-/[Fe(CN)6]4- la señal esperada fue imperceptible (Figura 2B) o muy pequeña (Figura 2C). Por el contrario el grafito Arcair® en presencia del electrolito soporte no se observó señal debida a procesos de óxido-reducción y en presencia de la cupla redox conocida presentó un voltamperograma característico (Figura 2D), es decir se observaron los picos característicos de la cupla con una señal significativa.
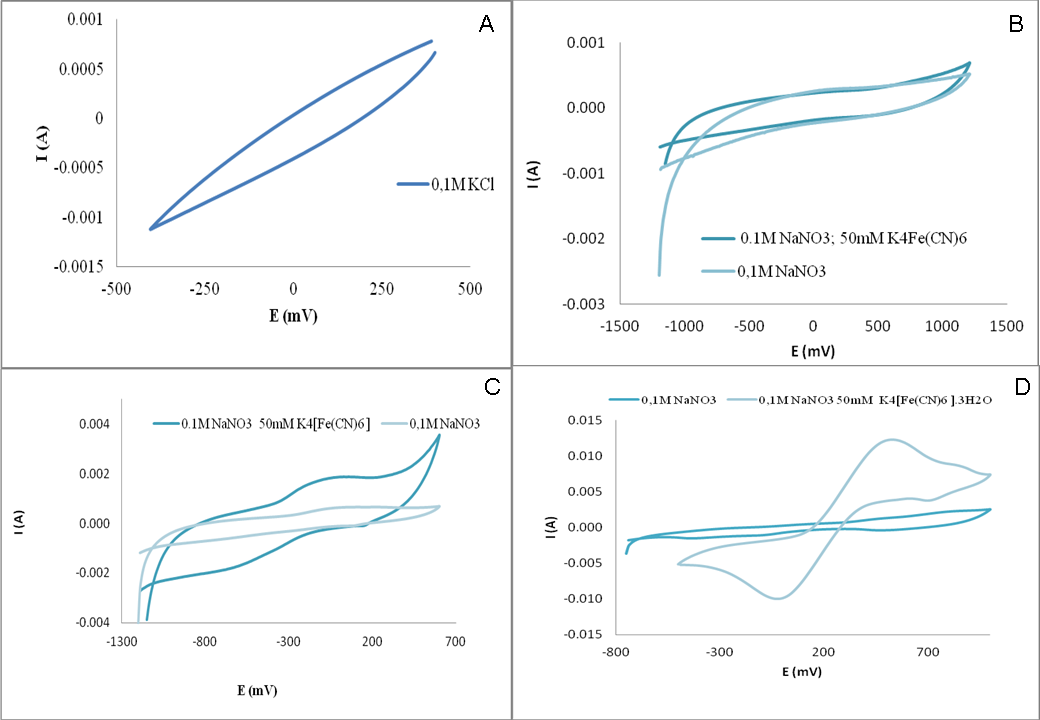
Figura 2: Voltamperometría cíclica correspondiente al grafito: A. Faber Castell®, B. CRETACOLOR®, C. KOH-I-NOOR® y D. Arcair®.
Si se desea desarrolla un sensor, se desea que éste no sea costoso, por tal motivo se eligieron superficies de grafito de fácil acceso y relativamente económicas. Pero más allá del costo es necesario que la superficie de grafito cumpla con dos requisitos más; por un lado P. veronii 2E debe ser capaz de formar biopelículas con un buen cubrimiento y por el otro lado debe poseer una buena respuesta electroquímica, es decir que no se observe una respuesta en presencia de un electrolito soporte y que en presencia de una cupla conocida se espera que posea una respuesta significativa. Por todo esto, con el fin de desarrollar sensores se eligió para los próximos ensayos la superficie de grafito Arcair® ya que cumple con los requisitos antes mencionados.
Producción de sideroforos con agregado de Cd(II) en el medio de cultivo
Pseudomonas veronii 2E posee la capacidad de tolerar altas concentraciones de metales, tales como Cr(III), Zn(II), Cu(II), Ni(II) y Cd(II) [1]. Las estrategias utilizadas por esta especie implican la biotransformación y la interacción de compuestos celulares con los metales tóxicos. Es por ello que se estudió si una de las estrategias utilizadas por dicha bacteria era la producción de compuestos extracelulares como los sideróforos. En investigaciones anteriores, se observó que la P. veronii 2E secretaba al medio líquido cantidades importantes de sideróforos y se pudieron obtener las condiciones óptimas de producción del compuesto. En este trabajo, se quiso estudiar si la producción de este metabolito era afectada cuando se encontraba Cd(II) en el medio de crecimiento y si era capaz de interaccionar con el mismo, indicando que existía una posible detoxificación por parte de la bacteria.
Para estudiar la producción de sideróforos por parte de P. veronii 2E en presencia de Cd(II) y la posible interacción sideroforo-Cd(II), se utilizó un método simple que se basa en las características estructurales del compuesto: espectrofotometría de absorción. Según Mehri [16], una absorbancia máxima cercana a los 400 nm es característica de los grupos cromóforos presentes en los sideróforos producidos por Pseudomonas del grupo fluorescente y sus complejos metálicos. La Figura 3 muestra los espectros de absorción entre 300 y 500 nm de los sobrenadantes de P. veronii 2E crecida en presencia o ausencia de Cd(II). La absorbancia máxima obtenida para el sobrenadante sin metal fue de 403 nm, mientras que cuando el metal se encontraba presente en el medio de crecimiento tuvo un desplazamiento del máximo de absorción (efecto batocrómico).
La Figura 4 muestra la curva de dosis-respuesta del Cd(II) en la producción de los sideróforos. Los valores de la absorbancias están expresados como absorbancia máxima (absorbancia típica del grupo cromóforo de los sideróforos producidos por Pseudomonas) sobre absorbancia a 600 nm (longitud de onda en la cual se mide el crecimiento bacteriano). De esta forma, se hizo independiente del crecimiento bacteriano el valor obtenido para la producción del metabolito. Como se puede observar en la Figura 4, no se evidenció una estimulación en la producción de los sideróforos por parte de P. veronii 2E en presencia del metal en el medio de cultivo.
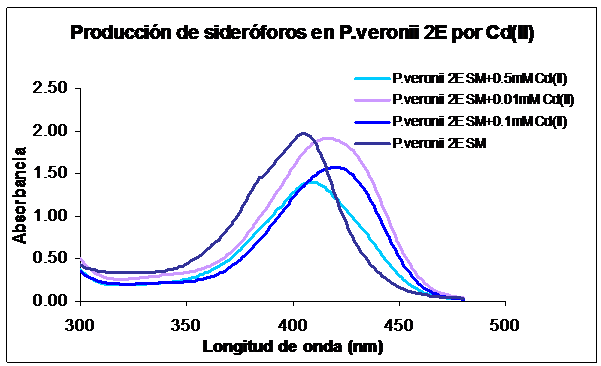
Figura 3: Espectro de absorción de sobrenadante filtrado de P. veronii 2E crecida en M9 succinato suplementado con 0,01mM, 0,1 mM y 0,5 mM de Cd(II).
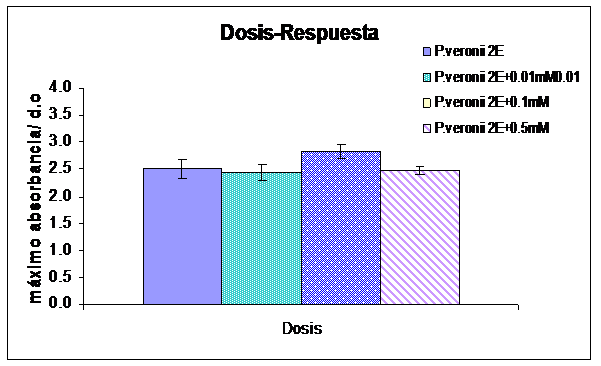
Figura 4: Efecto dosis respuesta de Cd(II) sobre la producción de sideróforos producidos por P. veronii 2E crecida en M9 succinato suplementado con 0,01mM, 0,1 mM y 0,5 mM de Cd(II).
Estudio de la interacción de sideróforos producidos por P. veronii 2E con Cd(II)
Los primeros estudios de interacción sideróforo-Cd(II) mostraron un corrimiento del máximo de absorción acompañado por un cambio de la forma de la curva cuando las concentración del metal adicionada era de 100 µM. No se observaron cambios significativos para concentraciones finales de Cd(II) de 1 µM y 10 µM con respecto al control.
Algunos estudios han mostrado que los metales influyen en la producción de sideróforos. Según Braund [5], este compuesto en el medio extracelular complejaria a los iones metálicos, diferentes que el Fe(III), disminuyendo su difusión intracelular, haciendo a la bacteria tolerante a los ambientes con altas concentraciones de Al(III), Co(II), Cu(II), Ni(II), Pb(II) y Zn(II). Mehri [16] observó un decrecimiento en la producción de sideróforo cuando se suplementaba en el medio Zn(II) y una siderogénesis al aumentar la concentración de Mn(II) en el medio de cultivo para el género Pseudomonas. Por otro lado, Sinha [17] observó que la producción de sideróforos por parte de Pseudomonas aeruginosa estaba inducida por Cd(II). En el presente trabajo, se observó una disminución en la producción del sideróforo producido por P. veronii 2E al aumentar la concentración de Cd(II) en medio líquido. Este fue acompañado por una disminución en el crecimiento bacteriano. En contraste a lo observado por otros autores en otras especies de Pseudomonas, la presencia de Cd(II) en el medio de cultivo no solo afectó el crecimiento sino también podría estar afectando la síntesis y/o secreción del sideróforo.
Al estudiar la interacción entre el sobrenadante que contenía el metabolito de interés producido en medio M9-succinato y el catión Cd(II), se pudo observar una deformación de la curva característica para los sideróforos producidos por Pseudomonas fluorescentes cuando la concentración era de 100 µM (Figura 5). Este cambio de la curva y el desplazamiento del máximo de absorción del compuesto en presencia del ión podría deberse la complejación del metal por parte del sideróforo.
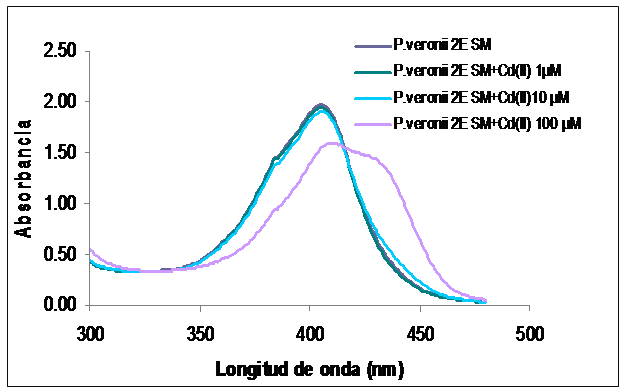
Figura 5: Espectro de absorción con 1µM, 10µM o 100µM de Cd(II) del sobrenadante filtrado de P. veronii 2E crecida en M9 succinato.
Biotransformación de Cr(VI) a Cr(III)
Tratamiento de aguas residuales industriales
Se bombearon alternativamente dos aguas residuales industriales (AR1 y AR2) a través de la columna empaquetada con células inmovilizadas en alginato de calcio. La Figuras 6a y 6b muestran el contenido de Cr(VI) en el líquido a la entrada (afluente) y a la salida de la columna luego de 30 minutos (efluente). La concentración de Cr(VI) en el líquido tratado permaneció siempre por debajo de la concentración permitida para la descarga de efluentes según la norma norteamericana (0,1ppm). En total pudieron tratarse 42 L de agua residual, es decir, 200 volúmenes de columna (VC): 88 VC (18,4 L) correspondieron AR2 y 112 VC (23,52 L) a AR1. El tratamiento total fue de 96,5 h. En ningún momento se detectó Cr(III) en el líquido tratado.
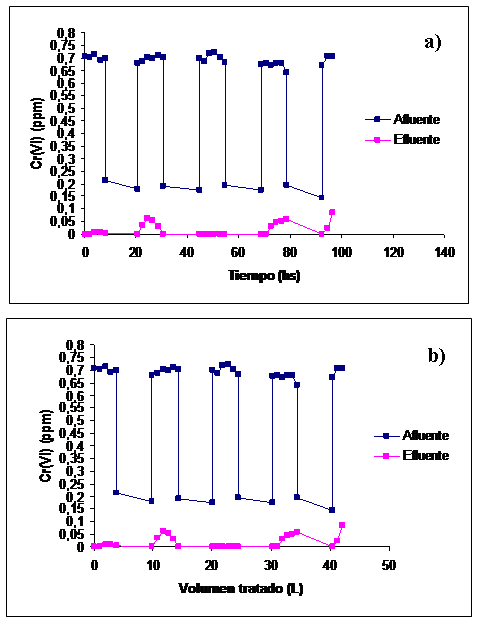
Figura 6: a) Concentración de Cr(VI) del líquido a la entrada (afluente) y a la salida (efluente) de la columna de tratamiento en función del tiempo y b) en función del volumen del líquido tratado.
Producción de biomasa con medios de cultivo alternativos
La Figura 7 muestra el crecimiento alcanzado por P. veronii 2E en los distintos medios de cultivo. El mayor rendimiento se produjo con glicerol 5 %(v/v) y fertilizante 0,6 %(v/v) alcanzando una biomasa de 9,5 g/L. Con melaza de caña y caldo nutritivo el crecimiento fue similar. La biomasa producida en estos casos fue de 4,8 y 4,9 g/L respectivamente. La productividad en glicerol fue de 1,52 mg/h mientras que con caldo nutritivo y melaza fue de 2,06 mg/h y 1,87 mg/h respectivamente.
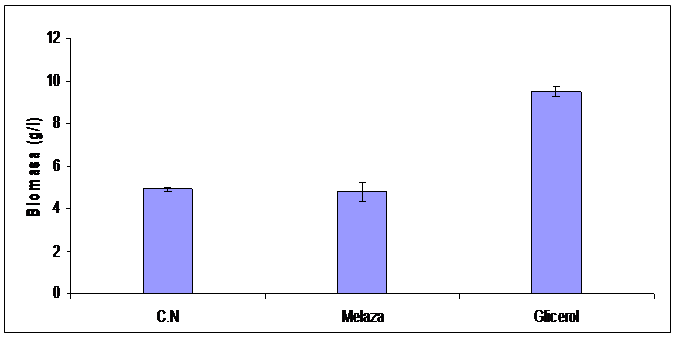
Figura 7: Crecimiento bacteriano en los distintos medios de cultivo (C.N: caldo nutritivo. Melaza: melaza 2 %(m/v) y fertilizante 0,6 %(v/v). Glicerol: glicerol ácido 5 %(v/v) y fertilizante 0,6 %(v/v)).
Numerosos autores proponen diversos tratamientos de aguas residuales que contienen Cr(VI). Qu y col. [18] y investigan el uso de bacterias magnetotácticas para la remoción de Cr(VI) por adsorción. La gran ventaja de este sistema es la fácil separación del adsorbente del agua residual por aplicación de un campo magnético que hace innecesaria la inmovilización. Yu y col. [19] emplean nanopartículas de hierro cero-valente para la reducción de Cr(VI). Este método tiene la ventaja de la fácil remoción del catalizador al aplicar un campo magnético y la alta tasa de reducción que se obtiene. Gopalakannana y col. [20] utilizaron nanopartículas de magnetita inmovilizadas en alginato entrecruzado con cationes Ce(III) para la remoción por adsorción del Cr(VI). Sin embargo, pocos estudios realizan una evaluación económica de los métodos propuestos. En el presente trabajo se propone un método para el tratamiento de aguas residuales con bajo contenido Cr(VI) y una alternativa para reducir los costos en la producción de la biomasa. Utilizando glicerol y fertilizante como medio de cultivo y glicerol como dador de electrones durante el tratamiento de reducción de Cr(VI), se obtiene un costo de la materia prima de U$D 1782,4 para el tratamiento de 785m3 de dos aguas residuales tipo AR1 y AR2 con un tiempo de retención hidráulico de 30 minutos (ver Tabla 4). El tratamiento químico que es comúnmente usado en la industria, en cambio, tiene un costo de U$D 2139,1 considerando sólo los reactivos para acidificar (la reducción química se favorece a pH ácido) y neutralizar (precipitación del Cr(III)) el agua a tratar más el floculante utilizado para la remoción del Cr(III) generado. Por lo tanto, el tratamiento biológico es viable a bajas concentraciones de Cr(VI) ya que es más económico que el tratamiento químico convencional.
| Reactivos | Cantidad (kg o L) | Precio (U$D)/ kg o L | Costo total (U$D) |
| Glicerol ácido | 360L | 0,1/L | 36 |
| Glicerol ácido | 7950L | 0,1/L | 795 |
| Fertilizante | 216L | 0,4/L | 86,4 |
| NaOH | 120,8 kg | 1,55/kg | 187,24 |
| Alginato de sodio | 60kg | 11/kg | 660 |
| CaCl2 | 88,8kg | 0,2/kg | 17,76 |
Tabla 4. Cantidades y costo de los distintos reactivos usados para el tratamiento biológico de 785 m3 de agua residual de baja concentración de Cr(VI) tipo AR2 y AR1.
Conclusión
Los resultados obtenidos en este trabajo muestran una diversidad de respuestas de Pseudomonas veronii 2E en cuanto a la formación de biopelículas, producción de sideróforos y biotransformación de Cr(VI). Esta versatilidad hace de la bacteria una herramienta promisoria aplicable en soluciones de problemas ambientales generados por los sistemas productivos.
Agradecimientos
Este trabajo fue realizado gracias al financiamiento facilitado por el Consejo Nacional de Investigaciones Científicas y Tecnológicas (CONICET), la Agencia Nacional de Promoción Científica y Tecnológica (ANPCyT, PICTO Nº00086) y la Universidad Nacional de General Sarmiento.
Referencias
1. Vullo DL, Ceretti HM, Daniel MA, Ramírez SA, Zalts A (2008) Cadmium, zinc and copper biosorption mediated by Pseudomonas veronii 2E Bioresource Technology 99: 5574-5581.
2. Alessandrello MJ, Vullo DL (2014) Biotreatment of Cr(VI)-containing wastewaters mediated by indigenous bacteria Environmental Engineering and Management Journal, en prensa.
3. Garavaglia L, Cerdeira SB, Vullo DL (2010) Chromium (VI) biotransformation by β- and γ-Proteobacteria from natural polluted environments: A combined biological and chemical treatment for industrial wastes Journal of Hazardous Materials 175: 104-110.
4. Mendez N, Ramirez SAM, Ceretti HM, Zalts A, Candal R, Vullo DL (2011), Pseudomonas veronii 2E surface interactions with Zn(II) and Cd(II), Global Journal of Environmental Science and Technology 1, 3.
5. Braud A, Hoegy F, Jezequel K, Lebeau T, Schalk IJ (2009) New insights into the metal specificity of the Pseudomonas aeruginosa pyoverdine-iron uptake pathway. Environmental Microbiology 11: 1079-1091.
6. Neubauer U, Nowack B , Furrer G, Schulin R (2000) Heavy Metal Sorption on Clay Minerals Affected by the Siderophore Desferrioxamine B Environmental Science and Technology 34(13): 2749–2755.
7. Visca P, Colotti G, Serino L, Verzili D, Orsi N, Chiancone E (1992) Metal regulation of siderophore synthesis in Pseudomonas aeruginosa and functional effects of siderophore-metal complexes Applied and Environmental Microbiology 58: 2886–2893.
8. Meyer JM (2000) Pyoverdines: pigments, siderophores and potential taxonomic markers of fluorescent Pseudomonas species Archives of Microbiology 174: 135-42.
9. Meyer JM, Geoffroy VA, Baida N, Gardan L, Izard D, Lemanceau P, Achouak W, Palleroni NJ (2002) Siderophore typing, a powerful tool for the identification of fluorescent and nonfluorescent pseudomonads Applied and Environmental Microbiology 68: 2745-53.
10. Ahmed E, Holmström SJM (2014) Siderophores in environmental research: roles and applications Microbial Biotechnology 7: 196–208.
11. Rajkumar M, Sandhya S, Prasad MNV, Freitasc H (2012) Perspectives of plant-associated microbes in heavy metal phytoremediation. Biotechnology Advances 30: 1562–1574.
12. O´Toole G, Kolter R (1998) Initiation of biofilm formation in Pseudomonas fluorescens WCS365 proceeds via multiple, convergent signalling pathways: a genetic analysis Molecular Microbiology 28: 449-461.
13. Sheikh J, Hicks S, Dall’Agnol M, Phillips AD, Nataro JP (2001) Roles for Fis and YafK in biofilm formation by enteroaggregative Escherichia coli Molecular Microbiology 41: 983–997.
14. Patra RM, Malik S, Beer M, Megharaj M, Naidu R (2010) Molecular characterization of chromium (VI) reducing potential in Gram positive bacteria isolated from contaminated sites Soil Biology and Biochemistry 42:1857-1863.
15. Souza e Silva PT, Torres de Mello N, Menezes Duarte MM, Montenegro MCBSM, Aráujo AN, Barros Neto B, da Silva VL (2006) Extraction and recovery of chromium from electroplating sludge Journal of Hazardous Materials B128: 39–43.
16. Mehri I, Khessairi A, Turki Y, Saidi N, Daly I, Meyer JM, Hassen A (2012) Effect of Dose-Response of Zinc and Manganese on Siderophores Production. American Journal of Environmental Sciences 8: 143-151.
17. Sinha S, Mukherjee SK (2008) Cadmium-induced siderophore production by a high Cd-resistant bacterial strain relieved Cd toxicity in plants through root colonization Current Microbiology 56: 55-60.
18. Qu Y, Zhang X, Xu J, Zhang W, Guo Y (2014) Removal of hexavalent chromium from wastewater using magnetotactic bacteria Separation and Purification Technology 136: 10–17.
19. Yu R-F, Chi F-H, Cheng W-P, Chang J-C (2014) Application of pH, ORP, and DO monitoring to evaluate chromium(VI) removal from wastewater by the nanoscale zero-valent iron (nZVI) process Chemical Engineering Journal 255: 568–576.
20. Gopalakannana V, Viswanathan N (2015) Synthesis of magnetic alginate hybrid beads for efficient chromium(VI) removal International Journal of Biological Macromolecules 72: 862–867.
|
Revista QuímicaViva Número 1, año 14, Abril 2015 quimicaviva@qb.fcen.uba.ar |