Síntesis y evaluación de la actividad antitumoral in vitro de un éster prenilado análogo a productos naturales
1*Eugenio Torres R., 1Manuel Almeida S., 2José Quincoses S., 3Christian Vogel
1Centro de Estudio de Química Aplicada. Universidad de Granma. Bayamo. Cuba.
2 Universidad Bandeirante de Sao Paulo, Brasil.
3 Instituto de Química. Universidad de Rostock. Alemania.
Recibido: 14/11/2014 - Aceptado: 04/03/2015
Resumen
Muchos compuestos prenilados existentes en el propóleo se caracterizan por presentar un amplio rango de actividad biológica, entre ellas, antitumoral e inductor de apoptosis, pero la composición química del propóleo depende de la flora y el clima. En este trabajo se describe la síntesis y caracterización de un éster prenilado análogo a compuestos existentes en el propóleo y la evaluación de su actividad antitumoral in vitro frente al melanoma B10F16.
Palabras clave: compuestosprenilados, melanoma B10F16, actividad antitumoral.
Synthesis and evaluation of antitumor activity in vitro of a prenylatedester analogue of natural products
Summary
Many existing prenylated compounds in propolis are characterized by a wide range of biological activities, including antitumor and inducer of apoptosis, but the chemical composition of propolis depends on the flora and climate. In this paper the synthesis and characterization of a prenylated ester similar to compounds existing in propolis and evaluation of their antitumor activity in vitro against B10F16 melanoma is described.
Keywords: prenylated compounds, melanoma B10F16, antitumor activity
Introducción
El grupo prenil se encuentra en muchos productos naturales con actividad biológica [1], forma parte de vitaminas y algunos componentes del propóleocomoel artepillin C, al que se le reporta actividad antitumoral, inductora de apoptosis, inmunomodulador y antioxidante [2]. Sin embargo, la composición química del propóleovaría según la zona geográfica, por lo que muchas veces determinados componentes activos no siempre se encuentran en su constitución [3].En los países de clima soleado es muy común la aparición de cáncer de piel, entre ellos el melanoma, un tipo de tumor pigmentado altamente invasivo por su capacidad de generar metástasis [4].La síntesis química de análogos a compuestos prenilados existentes en el propóleo podría conducir a la obtención de moléculas con potencial actividad antitumoral [5].
En este trabajo se reporta la síntesis, caracterización estructural y evaluación in vitro de la actividad antitumoral frente al melanoma B10F16 de un éster prenilado análogo a productos naturales.
Materiales y métodos
Los reactivos y disolventes empleados en el trabajo experimental fueron de calidad “puros” o “analíticos” provenientes de las firmas Merck y Sigma-Aldrich.
Las reacciones bajo la acción de microondas fueron realizadas en un horno microondas CEM, modelo MDS-81D, equipado con control de presión y temperatura. El curso de las reacciones se monitoreó por cromatografía de capa delgada en cromatofolios (Al) de gel de sílice 60 F 254 con espesor de capa 0,2 mm (Merck).
Los espectros 1H-RMN (300 MHz) y 13C-RMN (75,46 MHz) fueron obtenidos en equipos AC 250 y ARX 30 a 20 °C. Los espectros de masas de alta resolución se registraron en un espectrómetro INTECTRA GmbH, modelo AMD-402/3, mediante las técnicas de ionización por electrospray (ESI).
La actividad antitumoral para el compuesto (A8) se determinó mediante el test colorimétrico MTT, frente a células tumorales (melanoma B16F10) ATCC.La cuantificación de la absorbancia fue realizada en un lector de ELISA con longitud de onda 540 nm. Las alteraciones de toxicidad fueron expresadas como IC50% después de 24 h del cultivo.
Síntesis de 1-[2-(3-metilbut-2-eniloxi)fenil]etanona (I)
(1,5 mL; 13 mmol) de bromuro de prenilo fueron añadidos a una disolución de 2-hidroxiacetofenona (0,58 mL; 5 mmol), carbonato de cesio (1,62 g; 5 mmol) en dimetilformamidaDMF) anhidra (20 mL), la mezcla de reacción fue agitada a temperatura ambiente durante 12 h. Posteriormente fueron añadidos 50 mL de agua, la mezcla se extrajo con CHCl3 (3 x 50 mL), la fase orgánica se secó con Na2SO4 anhidro y se concentró, el residuo fue purificado mediante cromatografía de columna, empleando gel de sílice como fase estacionaria y como fase móvil (Éter de petróleo-Acetato de Etilo 30:1)
Síntesis de 1-[2-hidroxi-5-(3-metilbut-2-enil)fenil]etanona (II)
En un tubo de presión fueron disueltos 10 mmol de 1-[2-(3-metilbut-2-eniloxi)fenil]etanona en 29 mL de DMF, la mezcla fue irradiada con microondas a 200 0C durante 40 minutos, después de enfriar fueron añadidos 50 mL de CHCl3, la mezcla fue lavada con agua (5 x 20 mL), la fase orgánica se secó con Na2SO4 anhidro y fue concentrada, el residuo se purificó mediante cromatografía de columna empleando gel de sílice como fase estacionaria y como fase móvil (Éter de petróleo-Acetato de Etilo 30:1)
Síntesis de benzoato de 2-acetil-(3-metilbut-2-enil)fenilo (A8)
Fueron mezclados (0,57 g; 2,7 mmol) de (II), (1,129 mL; 11,17mmol) de cloruro de benzoilo y 3 mL de piridina anhidra en 5 mL de CHCl2, la mezcla fue agitada a temperatura ambiente durante 12 h, posteriormente se añadieron 100 mL de CHCl3, la mezcla se trató con disolución de KHSO3 al 15 % (3 x 50 mL), luego se lavó con agua (2 x 50 mL), posteriormentese secó con Na2SO4 anhidro y se concentró, el residuo se purificó mediante cromatografía de columna empleando gel de sílice como fase estacionaria y como fase móvil (Tolueno -Acetato de Etilo 7:1)
Resultados
Para la obtención del compuesto (A8)se diseñó una estrategia de síntesis que constó con tres pasos de reacción, partiendo de la 2-hidroxiacetofenona (Esq. 1).
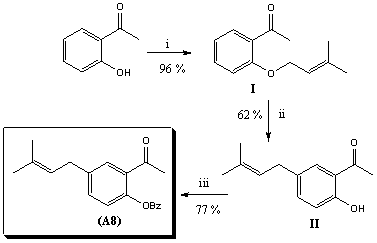
Esquema 1: Síntesis de 2-acetil-4-(3-metilbut-2-enil)fenil benzoato; i: Cs2CO3, DMF; ii: DMF, Microondas, 200 0C; iii: BzCl, piridina, CH2Cl2.
Primeramente se realizó la prenilaciónde la2-hidroxiacetofenona y en un segundo paso se efectuó un reordenamiento de Claisen en el compuesto O-prenilado (I), obteniéndose el intermediario de síntesis (II), en la tercera y última etapa se produjo la benzoilación de (II), generándose el producto deseado (A8).
Los datos espectroscópicos de los compuestos (I) y (II) coinciden con los reportados por L. Pisco y colaboradores [5].
2-acetil-4-(3-metilbut-2-enil)fenil benzoato (A8)
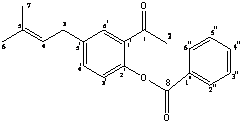
Sólido blanco (0,64g; 77 %), Tf= 67 0C
RMN-1H (CDCl3, 300 MHz): δ = 1,75 (s, 3H, H-6); 1,80 (s, 3H, H-7); 2,31(s, 3H, H-2); 4,63 (d, 2H, H-3, 3J2,3 = 7,18 Hz); 5,52 (m, 1H, H-4); 6,94-8,1(m, 8H, Ph-H)
RMN-13C (CDCl3, 75,46 MHz): δ = 17,85 (C-7); 25,75 (C-6); 29,90(C-2); 33,06 (C-3); 117,52 (C-3'); 120,43(C-1'); 121,36 (C-1''); 122,48(C-4); 128,69(C-5''); 130,30(C-2''); 131,24 (C-6''); 131,67 (C-3''); 132,65(C-6'); 133,26(C-5'); 133,42 (C-5); 133,63(C-4''); 137,38 (C-4'); 159,85 (C-2'); 196,63 (C-1); 197,81(C-8).
EMAR: M (C20H20O3) calculada: 308,14; experimental (M+): 308,0
Análisis elemental: calculado para (C20H20O3): %C (77,90); %H (6,54), encontrado: %C (77,88); %H (6,22)
Evaluación de la actividad antitumoral in vitro.
Se determinó la actividad antitumoral (IC50%) mediante el test colorimétrico MTT para la 1-[2-hidroxi-5-(3-metilbut-2-enil)fenil]etanona (II) y (A8), frente a células tumorales (melanoma B16F10) ATCC empleando concentraciones de 5; 2,5; 1,25; 0,62; 0,31; 1,15; 0,078; 0,039 y 0,019.
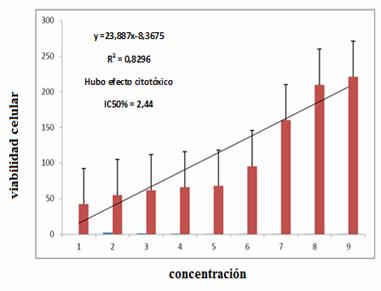
Figura 1: Actividad citotóxicamostrada por el compuesto (A8) frente a melanoma B10F16
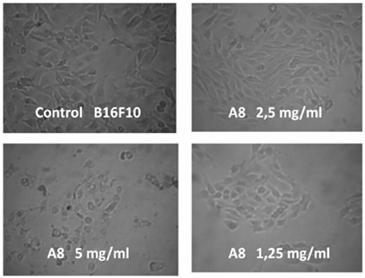
Figura 2: Variaciones citológicas causadas en el melanona B10F16 por el compuesto (A8).
Discusión
La conversión de (I) a (II)transcurre por un reordenamiento sigmatrópico (3+3)del grupo preniloa la posición ortorespecto al grupo OH en la estructura (I), formándose el intermediario (a)cuando la mezcla se calienta a 180 0C, por encima de esta temperatura(a) experimentaun segundo reordenamiento (3+3), obteniéndose el producto C-alquilado (II) (Esq. 2).
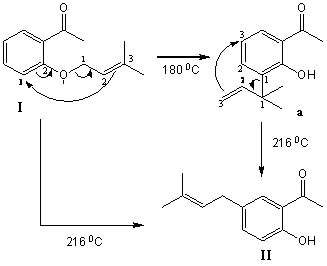
Esquema 2: Doble reordenamiento (3+3) para la obtención del derivado C-alquilado (A8).
Para la obtención de (II), se siguieron las condiciones de reacción descritas por Pisco y colaboradores [5], se realizaron cinco experimentos en los que se variaron la temperatura y el tiempo de reacción, cuando se calentó a 200 0C durante 12 hse alcanzó el mejor rendimiento del producto (II),12 %. En ningún caso fue posible replicar los resultados reportados por Pisco y colaboradores [5].
Para incrementar el rendimiento se ensayó una modificación del método reportado por G. Majectich y colaboradores [6], quienes realizaron el reordenamiento de Claisenen compuestos O-preniladoscon el empleo de microondas. La reacción se realizó en un tubo de presión y se sustituyó la dietilanilina por DMF. La mezcla de reacción fue irradiada en un horno microondas durante 40 minutos, lográndose alcanzar los 200 0C a los 2 segundos de iniciado el proceso,minimizando la formación de (a), lo que permitióincrementar el rendimiento del producto deseado (II) hasta un 62%.
La dietilanilina es un disolvente tóxico, ambientalmente peligroso y muy difícil de separar de la mezcla de reacción debido a su elevada temperatura de ebullición y escasa solubilidad en agua. El empleo de un tubo de presión como recipiente de reacción permite usar DMF como disolvente, su menor temperatura de ebullición y mayor solubilidad en agua permitesepararlamás fácil de la mezcla de reacción mediante sucesivos lavados con agua y posterior roto-evaporación. La obtención del compuesto (A8) se realizó mediante benzoilación directa del grupo OH del compuesto (II) con cloruro de benzoilo como agente acilante y piridina como catalizador básico. En el espectro RMN-1H del compuesto (A8) aparece un multipleto de gran intensidad entre 6,94 y 8,1 ppm correspondiente a los ocho protones aromáticos existentes en la molécula, un singulete en 2,31 ppm asignado el grupo metilo(H-2), la presencia del grupo prenilosecorroboramediante las siguientes señales: dos singuletes en 17,85 y 1,80 ppm característicos de los grupos metilos geninales, un duplete en 4,63 pm asignado a los protones metilénicos H-3 y un mutiplete en 5,52 ppm correspondiente al protón H-4.
En el RMN-13C se observan las señales correspondientes a los 20 átomos de carbono que forman la molécula, en 196,63 y 197,81 ppm se observan los singuletes correspondientes a los átomos de carbonos más desapantallados de la molécula, C-1 y C-8 respectivamente.
Mediante espectrometría de masas de alta resolución (EMAR) se midió un pico molecular (M+) con valor 308,0 que se corresponde conlaestructura delcompuesto (A8)
Los resultados combinados del estudio espectroscópico y el análisis Elemental cuantitativo, permitieron corroborar La estructura propuesta para el compuesto(A8).
De losdos compuestos testados sólo (A8)mostró toxicidad frente a células tumorales B16F10, con IC50% de 2,44 y una CIM de0,039 mg/mL (Fig. 1).En las imágenes que muestran las alteraciones citológicas causadas por el compuesto (A8) sobre el melanoma B10F16 (Fig. 2), se observa la disminución de la densidad de células tumoralesy la formación de agregados de células sanas, lo que sugiere la ocurrencia de apoptosis en células cancerígenas, sin producir efectos citotóxicos notables en células sanas [7].Estos resultados permiten inferir que cambios estructurales en la 2-hidroxiacetofenona, como la introducción de grupos C-prenilos y O-benzoilos, pudieran potenciar la actividad antitumoral. Un problema actual de los fármacos usados en el tratamiento del cáncer es precisamente incapacidad para diferenciar entre células sanas y enfermas, actuando sobre ambas indistintamente, lo que conlleva a efectos secundarios indeseables de la quimioterapia [8]. La selectividad por células cancerígenas mostrada por el compuesto (A8) puede considerarse como un punto de partida en la búsqueda de nuevos fármacos con acción antitumoral.
Referencias:
1. ZengXu, LeiHuang, Xiao-Hong Chen, Xiao-Feng Zhu, Xiao-Jun Qian, Gong-Kan Feng, Wen-Jian Lan (2014) Cytotoxic Prenylated Xanthones from the Pericarps of Garciniamangostana 19: 1820-1827.
2. Hori, R. O, Sforcin J. M, Rall V. L. M, Funari S. R. C, Barbosa L, Fernandes. JR A (2005) Susceptibility profile of Salmonella against the antibacterial activity of propolis produced in two regions of Brazil. Journal of Venomous Animals and Toxins including Tropical Diseases 11: 109–16.
3. Vassya Bankova, Milena Popova, Boryana Trusheva (2014) Propolis volatile compounds: chemical diversity and biological activity: a review. Chemistry Central Journal 8:1-8.
4. Doraiquis Lázara, Acosta Medina, Alicia Bravo Hernández, Diana Ruíz Acosta, Gloria María Acosta Medina (2014) Comportamiento del cáncer de piel en Güines y San José de las Lajas. Revista de Ciencias Médicas. La Habana 20: 44-53.
5. Laura Pisco, Marcus Kordian, Klaus Peseke, Holger Feist, Dirk Michalik, Ernesto Estrada, João Carvalho, Gerhard Hamilton, Daniela Rando, Jose Quincoces (2006) Synthesis of compounds with antiproliferative activity as analogues of prenylated natural products existing in Brazilianpropolis. European Journal of Medicinal Chemistry 41: 401–407.
6. Majectich and R. Hicks (1995) Applications of Microwave-accelerated Organic Synthesis.Journal of Microwave Power and Electromagnetic Energy 30: 27-45.
7. Torres E, Almeida M, Garcia M,Maria D, Passarelli, C, Rando D, Maduro S, Junqueira L, Vogel C, Quincoces J (2013) 36 Reunião Anual Siciedade Brasileria de Química, Sao Paulo, Brasil.
8. Julie Thompson, Kathryn Silliman, Dawn E Clifford (2013) Impact of an early education multimedia intervention in managing nutrition-related chemotherapy side effects: a pilot study. Springer Plus 2: 179.
|
Revista QuímicaViva Número 1, año 14, Abril 2015 quimicaviva@qb.fcen.uba.ar |