Estudio metabólico y molecular de cultivos bacterianos degradadores de hidrocarburos aromáticos policíclicos (PAH) y resistentes a metales pesados
M. Cecotti1, I.S.Morelli1,2,B.M. Coppotelli1
1Centro
de Investigación y Desarrollo en Fermentaciones Industriales, CINDEFI (UNLP;
CCT-La Plata, CONICET), y
2Comisión de Investigaciones Científicas de la Provincia deBuenos Aires (CIC-PBA),La Plata, Buenos Aires, Argentina
Recibido: 03/03/2015 - Aceptado: 30/03/2015
Resumen
La contaminación mixta con PAH y metales pesados conlleva dificultades debido a la potencial toxicidad del metal, limitando la supervivencia solo a los microorganismos que toleren ambos contaminantes. El estudio de cepas degradadoras de PAH y resistentes a metales pesados promete proporcionar herramientas claves para el proceso de biorremediación. Este trabajo tuvo como objetivos la selección, identificación y caracterización de cepas degradadoras de PAH y resistentes a metales pesados aisladas a partir de suelos proveniente de la Antártida y de zonas aledañas a la ciudad de La Plata. La identificación a nivel molecular mostró que las cepas antárticas A, B y C, filogenéticamente relacionadas al género Pseudomonas, presentaron alta resistencia al CdCl2 (CIMs de 500 µg/ml) en caldo R3. Las cepas A y C mostraron porcentajes de degradación de fenantreno por encima del 40 %, mientras que B no superó el 25 %, en todos los casos se observó la acumulación del intermediario ácido 1-hidroxi-2-naftoico. Las tres cepas fueron capaces de degradar fenantreno en presencia de 100 µg/ml de CdCl2. Las cepas bacterianas estudiadas podrían cumplir un importante rol frente a contaminaciones mixtas de fenantreno y metales como Cd+2, usualmente presentes en suelos co-contaminados.
Palabras clave: Biodegradación, PAH, Metales pesados
Metabolic and molecular study of PAH (polycyclic aromatic hydrocarbons)-degrading bacterial cultures resistant to heavy metals
Summary
PAH pollution mixed with heavy metals creates difficulties because of the potential toxicity of the metal, limiting the survival of microorganisms who tolerate both pollutants. Study of PAH degrading and heavy metal resistant strains promise to provide keys for the bioremediation process. The aim of this study consisted in the selection, identification and characterization of PAH degrading and heavy metals resistant strains isolated from soil from Antarctica and areas surrounding the city of La Plata. Identification at molecular level showed that the Antarctic strains A, B and C, phylogenetically related to the genus Pseudomonas, showed high resistance to CdCl2 (MICs 500 µg/ml) in broth R3. Strains A and C showed phenanthrene degradation percentages above 40% while B did not exceed 25%, in all cases the accumulation of acid intermediate 1-hydroxy-2-naphthoic acid was observed. The three strains were able to degrade phenanthrene in the presence of 100 µg/ml of CdCl2. The bacterial strains studied could play an important role in soils with mixed contamination of phenanthrene and metals such as Cd+2, usually present in co-contaminated soils.
Keywords: Biodegradation, PAH, Heavy Metals
Introducción
Los metales pesados y los hidrocarburos policíclicos aromáticos (PAH) son dos de los contaminantes más abundantes y potencialmente dañinos encontrados en la mayoría de los suelos contaminados.
Los PAH son contaminantes ambientales ubicuos, siendo sus principales fuentes la aplicación de pesticidas en agricultura, las actividades industriales, la incineración de desechos y emisiones por el tráfico [1]. Muchos de ellos han sido clasificados como contaminantes prioritarios debido a su potencial genotoxicidad y carcinogénesis [2].Dentro de los PAH el fenantreno es un hidrocarburo de alta prevalencia en productos del petróleo, y ha sido utilizado como compuesto modelo para determinar el potencial de biodegradación de suelos contaminados.
Los metales pesados constituyen un grupo de elementos químicos que tienen una densidad mayor o igual a 5 g/ml. Muchos son esenciales para el crecimiento, como el Mn, Fe, Co, Ni, Cu, Zn, Cr y Mo, mientras que otros no lo son, como es el caso de Ag, Al, Au, Pb, Hg y Cd [3]. Para ambos grupos, concentraciones altas pueden tener efectos tóxicos sobre las células debido a su capacidad para alterar o desnaturalizar las proteínas, producir alteraciones conformacionales en la estructura de ácidos nucleicos e interferir en la fosforilación oxidativa y el balance osmótico celular [4].
Las tecnologías de biorremediación han sido una alternativa a los métodos convencionales de tratamiento de sitios contaminados [5], convirtiéndose en la alternativa más segura, ecológica y viable para la restauración de los sitios contaminados, especialmente por resultar más económica y con menores consecuencias posteriores [6].
Los metales se encuentran frecuentemente asociados a PAH, y los suelos contaminados con estos últimos suelen contener gran cantidad de metales pesados [7]. Dicha co-contaminación dificulta la remediación ya que la toxicidad del metal puede inhibir la actividad de las bacterias degradadoras [8].
Por otro lado los PAH, compuestos lipofílicos, pueden interactuar con las membranas citoplasmáticas de las bacterias, afectando su estructura y permeabilidad [9]. Por lo tanto, en suelos contaminados con PAH, los metales pesados pueden penetrar más fácilmente en las células microbianas y afectar sus funciones.
Dentro de los metales pesados, el Te (δ=6,24 g/ml) presenta una abundancia baja. Sin embargo su aplicación en electrónica, óptica, baterías, procesos de refinería y la industria minera han expandido su distribución en los últimos años [10]. En su forma reducida Te0 no presenta toxicidad, sin embargo sus oxianiones solubles TeO32- y TeO42- pueden ser tóxicos a muy bajas concentraciones para muchas formas de vida [11]. Se ha planteado como mecanismo de toxicidad la generación de estrés oxidativo intracelular [12].
El Cd (δ=8,65 g/ml) no es un metal esencial para el crecimiento celular. Las principales fuentes son: la metalurgia del hierro y acero, la fabricación de fertilizantes fosfatados, la incineración de residuos de madera, carbón o plásticos, la combustión de aceite y gasolina y las aplicaciones industriales [13]. El Cd2+ ingresa a las células mediante sistemas de transporte de iones divalentes de amplia especificidad (básicamente el sistema de transporte de magnesio) e interfiere con importantes funciones celulares mediante la unión a grupos sulfhidrilos de proteínas esenciales [14]. Desplaza además metales esenciales como Co y Cu, los cuales al acumularse desencadenan reacciones que llevan a estrés oxidativo intracelular y puede generan ruptura de DNA en E. coli [15].
Las bacterias poseen una enorme diversidad metabólica que les permite utilizar muchos compuestos químicos complejos como fuente de carbono y de energía [16]. Los procesos microbiológicos también son de importancia en la movilización de metales, teniendo aplicaciones potenciales reales en la biorremediación [17].
Hasta el momento, han sido poco estudiadas las bacterias que muestran capacidad concomitante para degradar los PAH y resistir a los metales pesados. Si bien se sabe que los aislados de suelos que reciben aguas residuales de refinación de petróleo presentan mayor resistencia a metales y antibióticos, no se ha caracterizado la habilidad de degradación de hidrocarburos de esas cepas [18].
El presente trabajo se propone seleccionar e identificar microorganismos claves para el proceso de biorremediación de hidrocarburos en presencia de metales. Para ello se seleccionaron e identificaron cultivos bacterianos efectivamente degradadores de PAH y resistentes a metales pesados (Te, Cd), se estudió su cinética de crecimiento con PAH como única fuente de carbono y energía y el efecto de la presencia de metales pesados sobre la biodegradación de PAH.
Materiales y métodos
Selección de cultivos degradadores de fenantreno: se trabajó con 21 cepas previamente aisladas de suelo antártico no contaminado (King George, Deception,y Southern Shetland Islands) y otras de suelo de alrededores de la ciudad de La Plata (Bs.As.) artificialmente contaminado con fenantreno y telurito de potasio.
Las cepas fueron incubadas en MML estéril suplementado con 2000 mg/L de fenantreno, a 150 rpm por 10 días. Las cepas provenientes de la Antártida se incubaron a 15 °C y 37 °C; mientras que las aisladas de suelos de La Plata fueron incubadas a 24 °C, de acuerdo a los protocolos utilizados en cada caso para realizar los aislamientos de las diferentes cepas. Estas condiciones de incubación se mantuvieron para todos los ensayos realizados en el trabajo.
La capacidad de degradación de fenantreno se evidenció a partir de la coloración del medio debida a la acumulación de productos parciales de oxidación de dicho PAH.
Caracterización fenotípica de los cultivos puros obtenidos: observación de las características macroscópicas de los cultivos aislados en placa con medio Luria Bertani (LB); coloración de Gram; pruebas bioquímicas clásicas.
Identificación de los cultivos obtenidos: a partir de un cultivo puro de 24 h de cada cepa en caldo LB, se extrajo el DNA y se procedió con la identificación por secuenciación según Festa y col. (2013). Los primers utilizados en este caso fueron 27-F (5'-AGAGTTTGATCCTGGCTCAG-3') y 1387-R (5'-GGGCGGWGTGTACAA GGC-3'). Los productos PCR obtenidos fueron secuenciados por Macrogen, Korea
Determinación de la concentración inhibitoria mínima de metales pesados (CIM): se prepararon placas de 96 pocillos con diluciones de K2TeO3, CdCl2 y K2CrO4 en caldo LB, de 0,98 µg/ml a 1000,00 µg/ml. Por cada pocillo se inocularon 20 µl de cultivo líquido de 24 h en caldo LB de cada cepa. Las placas se incubaron 48 h. El crecimiento se evidenció por aumento de turbidez y se registró como CIM la dilución más baja de la sal que inhibió el desarrollo bacteriano.
Curvas de crecimiento de los cultivos aislados en MML suplementado con fenantreno como única fuente de carbono y energía: para cada cepa, se realizó la curva de crecimiento en MML estéril suplementado con 200 mg/L fenantreno, partiendo de un inóculo estimado de 2.106 células/ml al tiempo cero. El crecimiento se monitoreó durante 48 h mediante recuento de microorganismos viables en placa con LB.
Estudio cuantitativo de la degradación de fenantreno: para cada cepa se determinó la degradación de fenantreno por HPLC-UV según Festa y col. [19], en cultivos con el mismo medio utilizado para las curvas de crecimiento. La degradación se monitoreó a los 10 días.
Estudio de la capacidad de degradación de fenantreno en MML en presencia de metales pesados: las cepas aisladas se cultivaron en MML estéril suplementado con 200 mg/L fenantreno y K2TeO3 o CdCl2 en concentraciones de 50 µg/ml y 100 µg/ml, luego de 10 días. Se consideraron resistentes aquellos cultivos que evidenciaron degradación de fenantreno al observarse coloración en el medio.
Resultados y discusión
Selección de cultivos degradadores de fenantreno
A partir de cepas previamente aisladas de dos sistemas de suelo: suelo antártico y suelo de los alrededores de la ciudad de La Plata artificialmente contaminado con 1 µg de K2TeO3/gr de suelo seco y 1000 mg de fenantreno/gr de suelo seco, se seleccionaron cultivos degradadores de fenantreno.
La capacidad de degradación se evaluó en MML suplementado con 2000 mg/L fenantreno. La acumulación de productos parciales de la oxidación de fenantreno lleva a la coloración del medio en tonos ocres y permite así evidenciar cualitativamente su degradación (Figura 1). A partir de este ensayo se seleccionaron 5 cultivos efectivamente degradadores de fenantreno. Dos de ellos fueron aislados del suelo de La Plata, donde el cambio de coloración se detectó a los 5 días de incubación. Los tres restantes fueron aislados antárticos y en los que se observó coloración luego de3 días de incubación.

Figura 1: Degradación de fenantreno en medio líquido. Los ensayos se realizaron en cultivos en MML suplementado con 2000 mg/L de fenantreno como única fuente de carbono y energía. La coloración del medio evidencia la acumulación de productos parciales de oxidación de dicho PAH y permite la selección de cultivos degradadores.
Caracterización e identificación de los cultivos degradadores de fenantreno
Identificación de las cepas aisladas por secuenciación del gen 16S rRNA
Sobre las 5 cepas seleccionadas se realizó un análisis fenotípico mediante la realización de una serie de pruebas bioquímicas clásicas (datos no mostrados) y se analizó la secuencia del gen 16S rRNA de cada cepa por el método de comparación utilizando el programa BLAST (Basic Local Aligment Search Tools).Los resultados se muestran en la Tabla 1.
| Cepa | Género más relacionado según secuencia del gen 16SrRNA | % Similitud | N° de acceso al GenBank de la secuencia bacteriana más relacionada |
| A | Pseudomonas sp. | 98% | NR_025588.1 |
| B | Pseudomonas sp. | 99% | NR_025103.1 |
| C | Pseudomonas sp. | 97% | EU557337.2 |
| M | Sinorhizobium sp. | 97% | NR_025251.1 |
| T | N/D |
Tabla 1: Afiliación filogenética de las cepas aisladas. Para la cepa T no pudo determinarse la relación taxonómica (N/D).
El análisis mostró que las cepas poseen alta similitud con los géneros Pseudomonas y Sinorhizobium. Las bacterias pertenecientes al género Pseudomonas suelen encontrarse en lugares contaminados con hidrocarburos y metales pesados [20, 21] y bacterias pertenecientes a la familia Rhizobiaceae también han sido encontradas en sitios contaminados con metales pesados [22].
Determinación de la CIM de metales pesados sobre los cultivos aislados
Para cada cepa aislada, se determinó el valor de la CIM para K2TeO3 y CdCl2 en caldo LB. Los resultados se leyeron a las 48 h y se resumen en la Tabla 2.
La CIM de CdCl2 para las cepas antárticas fue de 500 µg/ml, mientras que para el caso del K2TeO3 las concentraciones inhibitorias mínimas fueron menores a 16 µg/ml.
De las cepas aisladas de suelo contaminado con fenantreno y telurito, la cepa M no evidenció crecimiento en presencia de ninguno de los metales estudiados durante el período de incubación del ensayo. El aislamiento T mostró una CIM de 125,00 µg/ml para el telurito y presentó precipitación de color negro en todos los pocillos. La CIM de T correspondiente al CdCl2 fue de 1,95 µg/ml.
| Cepa | A | B | C | M | T |
| CIM para K2TeO3 (µg/ml) | 3,91 | 15,62 | 7,81 | <0,98 | 125,00 (precipitado negro a las 48h) |
| CIM para CdCl2 (µg/ml) | 500,00 | 500,00 | 500,00 | < 0,98 | 1,95 |
Tabla 2: Resultados de CIM para las cepas aisladas. En caldo LB con K2TeO3 y CdCl2 se estudió la resistencia a dichas sales de metales en el rango de concentraciones de 0,98 µg/ml a 1000,00 µg/ml.
Se conocen cepas de E. coli que presentan alta resistencia al K2TeO3 con valores de CIM de hasta 1028 µg/ml. Cepas sensibles muestran CIM de 1-2 µg/ml [11]. En base a estos datos, puede destacarse que la cepa T tendría cierto grado de resistencia al K2TeO3. Si bien poco se conoce sobre los mecanismos de resistencia a este oxianión, se han planteado ciertas hipótesis, como la exclusión directa del TeO32-, su transformación a formas volátiles (por metilación por ejemplo) y la reducción enzimática o no enzimática a Te0 (evidenciada por depósitos negros citoplasmáticos).Debe tenerse en cuenta, sin embargo, que en general la mayoría de los microorganismos son capaces de reducir el telurito a teluro, siendo resistentes sólo una fracción de los mismos. [10].
En cuanto al cadmio, pueden considerarse con una alta resistencia a CdCl2 aquellos microorganismos con valores de CIM mayores a 500 µM (91,6 µg/ml). Los más susceptibles, presentan CIMs variables, por debajo de 125 µM (22,9 µg/ml) [23]. Tomando estos valores de referencia puede inferirse que las cepas antárticas mostraron alta resistencia a cloruro de cadmio. Dentro de los mecanismos de resistencia que pueden presentar los microorganismos predominan distintos sistemas de membrana de expulsión de cationes divalentes: proteínas facilitadoras de difusión de cationes (CDF), ATPasas tipo P (como la CadA, codificada en un plásmido de Staphylococcus aureus) y transportadores de membrana interna de la familia RND (generalmente en un complejo con otras proteínas que lo anclan a la membrana). Además, existen bacterias capaces de acumular CdS en la pared celular [24], de secuestrar Cd2+ por unión a metalotioneínas o proteínas ricas en residuos de cisteína [25] y otras capaces de formar complejos insolubles con fosfatos [26].
Caracterización metabólica
Curvas de crecimiento en MML suplementado con fenantreno como única fuente de carbono y energía
Las curvas obtenidas se muestran en la Figura 2. Se pudo observar que las 5 cepas estudiadas son capaces de crecer con fenantreno como única fuente de carbono y energía. Puede destacarse que las cepas A, B, C y M hubo un aumento de dos órdenes de magnitud durante las 48 horas de incubación.
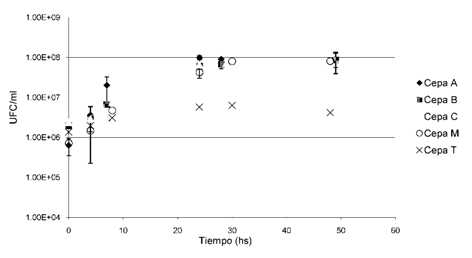
Figura 2: Curvas de crecimiento de las cepas A, B, C, M y T en fenantreno. Las determinaciones se realizaron en a partir de cultivos en MML suplementado con 200 mg/L de fenantreno como única fuente de carbono y energía. Se grafica el valor promedio de dos ensayos independientes con su respectiva desviación estándar.
Estudio cuantitativo de la degradación de fenantreno
Para cada cepa, se realizó un estudio para cuantificar el porcentaje de degradación de fenantreno después de 10 días de incubación (HPLC). Se estudió también la producción de ácido 1-hidroxi-2-naftoico, producto parcial de una de las vías de degradación del PAH. Este intermediario metabólico suele acumularse en cultivos de bacterias Gram negativas [27]. Los resultados obtenidos se muestran en la Tabla 3.
Puede observarse que las cepas A y C presentaron los mayores porcentajes de degradación (> 40%). Esto coincide con el color rojizo observado en el medio de cultivo. Sin embargo, muestran una significativa diferencia en la cantidad del intermediario metabólico producido (A: 57,81 mg/L y C: 24,74 mg/L), lo que sugiere que la cepa C posee enzimas que actúan sobre el intermediario permitiendo una mayor velocidad en la mineralización del PAH.
Para las cepas B, M y T se observó que la degradación no superó el 25 %. Mientras que para la cepa B la acumulación del intermediario fue significativa, no se pudo detectar su presencia en los cultivos de M y T.
| Cepa | % de fenantreno degradado | Ácido 1-hidroxi-2-naftoico producido (mg/L) |
| A | 52,3 ± 10,1 | 57,8 ± 7,6 |
| B | 19,6 ± 6,4 | 28,2 ± 3,1 |
| C | 45,5 ± 0,3 | 24,7 ± 4,3 |
| M | 7,8 ± 10,1 | Nd |
| T | 11,2 ± 7,4 | Nd |
| Control | 0 | Nd |
Tabla 3: Porcentaje de degradación de fenantreno y cantidad de ácido 1-hidroxi-2-naftoico producido por las cepas aisladas. Las determinaciones se realizaron a los 10 días de incubación de cada cepa en MML suplementado con 200 mg/L de fenantreno (nd: no detectable).Se grafica el valor promedio de los tres ensayos independientes con su respectiva desviación estándar.
Estudio de degradación de fenantreno en MML en presencia de metales pesados
Sobre los cultivos puros obtenidos se evaluó la capacidad de crecimiento en MML con fenantreno como única fuente de carbono y energía en presencia de metales pesados.
Los resultados obtenidos se resumen en la Tabla 4. La cepa T, que había presentado cierto grado de resistencia al K2TeO3, no mostró degradación de fenantreno en presencia de concentraciones de 50 y 100 µg/ml de K2TeO3. En presencia de 100 µg/ml de CdCl2, las cepas antárticas evidenciaron degradación presentando clara coloración del medio a los 3 días mientras que en los cultivos de las cepas M y T no se observó coloración durante el período de incubación.
| Degradación de fenantreno en presencia de metales | A | B | C | M | T |
| K2TeO3 50 µg/ml | nd | nd | nd | nd | - |
| K2TeO3 100 µg/ml | nd | nd | nd | nd | - |
| CdCl2 100 µg/ml | + | + | + | - | - |
Tabla 4: Degradación de fenantreno en MML en presencia de metales pesados. Las determinaciones se realizaron luego de 3 días de incubación de cada cepa en MML suplementado con 200 mg/L de fenantreno y la sal correspondiente. En caso de observarse coloración del medio, se considera positivo (+) el resultado para la degradación de dicho PAH. nd: no determinado
En el presente trabajo se han logrado seleccionar y aislar cinco cepas bacterianas degradadoras de fenantreno. Estas cepas pertenecen a géneros comúnmente hallados en sitios contaminados con hidrocarburos y metales pesados y son capaces de crecer con fenantreno como única fuente de carbono y energía.
Mediante el ensayo de la CIM se logró observar una alta resistencia a CdCl2 por parte de las cepas antárticas A, B y C, que no evidenciaron resistencia a telurito.
En el ensayo cuantitativo de degradación de fenantreno se evidenció una significativa degradación por las tres cepas antárticas (A, B y C), las cuales también fueron capaces de degradar fenantreno en presencia de 100 µg/ml de CdCl2.
Es interesante que las bacterias para las que se encontró mayor resistencia a CdCl2 y capacidad de degradar hidrocarburos sean las aisladas de suelos prístinos, donde no habría contacto previo con contaminantes.
Sin embargo, aunque la Antártida todavía puede considerarse una zona casi virgen, el continente exhibe una combinación de varios factores extremos como radiación UV, alta desecación, congelación y condiciones que de una forma u otro puede generar estrés oxidativo [28], por lo que sus suelos son una fuente potencial para la obtención de cepas que puedan utilizarse en procesos de biorremediación en contaminaciones con metales pesados ya que pudieron adquirir sus mecanismos de resistencia por haber sido expuestas previamente a otras condiciones de stress.
Dentro de las cepas bacterianas estudiadas, las cepas A, B y C pertenecientes al género Pseudomonas podrían cumplir un importante rol haciendo frente a contaminaciones mixtas de fenantreno y metales como Cd+2.
Agradecimientos
Este trabajo se realizó en el marco del Proyecto de cooperación bilateral CH/10/09 "Estudio de los procesos de biorremediación de suelos contaminados con metales pesados e hidrocarburos policíclicos aromáticos (PAH)", financiado por MINCyT y CONICYT. Martina Cecotti realizó este trabajo con una Beca de Estímulo a las Vocaciones Científicas del Consejo Interuniversitario Nacional.
Referencias:
1. Bethe-Corti L, Del Panno T, Hulsch R, Morelli IS (2007) Bioremediation and bioaugmentation of soils contaminated with polyaromatic hydrocarbons. Current Trends in Microbiology 3:1-30.
2. Morelli IS (2001). Caracterización de la Toxicidad de Residuos con Hidrocarburos. Importancia de la Aplicación de Bioensayos en Procesos de Biorremediación en Suelos. Trabajo de tesis. Facultad de Ciencias Exactas. UNLP.
3. Bruins MR, Kapil S, Oehme FW (1999) Microbial Resistance to Metals in the Environment. Ecotoxicology and Environmental Safety 45:198-207.
4. Poole RK, Gadd GM (1989) Metals: Microbe Interactions, pp. 1-37. IRL Press, Oxford.
5. Kabiri M, Amoozegar MA y col. (2009) Effects of selenite and tellurite on growth, physiology, and proteome of a moderately halophilic bacterium. Journal of Proteome Research 8: 3098-3108.
6. Dua M, Singh A, Sethunathan N, Johri AK (2002) Biotechnology and bioremediation: successes and limitations. Applied Microbiology and Biotechnology 59:143-152.
7. Vivas A, Moreno B, del Val C, Macci C, Masciandaro G, & Benitez E (2008) Metabolic and bacterial diversity in soils historically contaminated by heavy metals and hydrocarbons. Journal of Environmental Monitoring 10:1287-1296.
8. Colombo M L, Cavalca L, Bernasconi S, Andreoni V (2011). Bioremediation of polyaromatic hydrocarbon contaminated soils by native microflora and bioaugmentation with Sphingobium chlorophenolicum strain C3R: A feasibility study in solid- and slurry-phase microcosms. International Biodeterioration and Biodegradation 65: 191-197.
9. Sikkema JJ, de Bont A y col. (1994). Interactions of cyclic hydrocarbons with biological membranes. Journal of Biological Chemistry 269: 8022-8028.
10. Chasteen TG, Fuentes DE, Tantale JC, Vásquez CC (2009) Tellurite: history, oxidative stress, and molecular mechanisms of resistance. FEMS Microbiology Reviews 33: 820-832.
11. Taylor DE (1999) Bacterial tellurite resistance. Trends in Microbiology 7:111-115.
12. Pérez JM, Calderón IL, Arenas FA, Fuentes DE, Pradenas GA, Fuentes EL, Sandoval JM, Castro ME, Elías AO, Vásquez CC (2007) Bacterial toxicity of potassium tellurite: unveiling an ancient enigma. PLoS ONE 2:e211.
13. Ramirez A (2002) Toxicología del Cadmio. Conceptos actuales para evaluar exposición ambiental u ocupacional con indicadores biológicos. Anales de la Facultad de Medicina 63:51-64.
14. Nies DH (1992) Resistance to cadmium, cobalt, zinc, and nickel in microbes. Plasmid 27:17-28.
15. Trevors JT, Stratton GW, Gadd GM (1986) Cadmium transport, resistance, and toxicity in bacteria, algae, and fungi. Canadian Journal of Microbiology 32:447-464.
16. Seo J-S, Keum Y-S, Li QX (2009) Bacterial Degradation of Aromatic Compounds a Review. International Journal of Environmental Research in Public Health 6:278-309.
17. Mathiyazhagan N, Natarajan D (2011). Bioremediation on effluents from Magnesite and Bauxite mines using Thiobacillus spp and Pseudomonas spp. Journal of Bioremediation and Biodegradation 2:115
18. Ben Said O, Goñi-Urriza MS, El Bour M, Dellali M, Aissa P, Duran R (2007) Characterization of aerobic polycyclic aromatic hydrocarbon-degrading bacteria from Bizerte lagoon sediments, Tunisia. Journal of Applied Microbiology 104:1365-2672.
19. Festa S, Coppotelli BM, Morelli IS (2013). Bacterial diversity and functional interactions between bacterial strains from a phenanthrene-degrading consortium obtained from a chronically contaminated-soil. International Biodeterioration and Biodegradation 85:42-51.
20. Campbell JIA, Jacobsen CS, Sørensen J (1995) Species variation and plasmid incidence among fluorescent Pseudomonas strains isolated from agricultural and industrial soils. FEMS Microbiology Ecology 18:51-62.
21. Kozlova EV, Puntus IF, Slepenkin AF, Boronin AM (2004) Naphthalene degradation by Pseudomonas putida strains in soil model systems with arsenite. Process Biochemistry 39:1305-1308.
22. Carrasco JA, Armario P, Pajuelo E, Burgos A, Caviedes MA, López R, Chamber MA, Palomares AJ (2005) Isolation and characterization of symbiotically effective Rhizobium resistant to arsenic and heavy metals after the toxic spill at the Aznalcóllar pyrite mine. Soil Biology and Biochemistry 37:1131-1140.
23. Gelmi M, Apostoli P, Cabibbo E, Porru S, Alessio L, Turano A (1994) Resistance to Cadmium Salts and Metal Absorption by Different Microbial Species. Current Microbiology 29:335-341.
24. Vullo DL (2003) Microorganismos y metales pesados: una interacción en beneficio del medio ambiente. Revista Química Viva 2:3.
25. Silver S, Phung LT (1996) Bacterial heavy metal resistance: new surprises. Annual Review of Microbiology 50:753-789.
26. McEntee JD, Woodrow JR, Quirk AV (1986) Investigation of cadmium resistance in Alcaligenes sp. Applied and Environmental Microbiology 51:515-520.
27. Habe H, Omori T (2003) Genetics of polycyclic aromatic hydrocarbon metabolism in diverse aerobic bacteria. Bioscience, Biotechnology and Biochemistry 67:225-243.
28. Arenas FA, Pugin B, Henríquez NA, Arenas-Salinas MA, Díaz-Vásquez WA, Pozo MF, Vásquez CC (2014) Isolation, identification and characterization of highly tellurite-resistant, tellurite-reducing bacteria from Antarctica. Polar Science 8:40-52.
|
Revista QuímicaViva Número 1, año 14, Abril 2015 quimicaviva@qb.fcen.uba.ar |