Evaluación de la actividad antibacteriana del extracto seco de las hojas de Faramea occidentalis
Mijail Mijares Bullaín Galardis1, Yosvel Viera Tamayo1 y Yanelis Avilés Tamayo2
1Centro de Estudios de Biotecnología Vegetal. Facultad de Ciencias Agrícolas. Universidad de Granma, Km 17½ carretera a Manzanillo. Peralejo. Bayamo.
2Departamento de Biología Agrícola. Facultad de Ciencias Agrícolas. Universidad de Granma,
Granma, Cuba
Recibido 22/07/2014 - Aceptado 04/11/2014
Resumen
Faramea occidentalis (L.) A. Rich. (Rubiaceae) se utiliza de forma tradicional como astringente, galactógeno y antiséptico. Sin embargo, existen escasos reportes sobre estudios de la actividad antibacteriana de los extractos de esta planta. El objetivo de esta investigación fue evaluar la actividad antibacteriana, in vitro, del extracto seco obtenido a partir de las hojas de Faramea occidentalis. La planta fue identificada por especialistas del Jardín Botánico Cupaynicú. La tintura al 20 % se obtuvo con el empleo de la extracción asistida por ultrasonido, se concentró bajo presión reducida para obtener el extracto seco, al que se le realizaron los ensayos para determinar la actividad antibacteriana, mediante el método de difusión en agar por diseminación superficial en disco de Bauer-Kirby y la concentración inhibitoria mínima del crecimiento bacteriano mediante el método de microdilución en caldo. El extracto seco mostró actividad antibacteriana frente a Salmonella typhimurium (ATCC 14028) y Bacillus subtilis subsp spizizenii (ATCC 6633) a 1240 µg/disco; mientras que la concentración inhibitoria mínima para ambas cepas fue de 2048 µg/mL. El extracto seco de las hojas de Faramea occidentalis presenta una aplicación potencial como antibacteriano.
Palabras clave: Faramea occidentalis, actividad antiséptica, actividad antibacteriana, concentración inhibitoria mínima
Evaluation of antibacterial activity of dry extract from the leaves of Faramea occidentalis
Summary
Faramea occidentalis (L.) A. Rich. (Rubiaceae) is traditionally used as astringent, galactogen and antiseptic. However, there are few reports on the antibacterial activity of this plant extracts. The objective of this study was asses the antibacterial activity of dry extract obtained from the leaves of Faramea occidentalis under in vitro conditions. The plant was identified by specialists of Cupaynicú Botanical Garden. Dye at 20 % was obtained through the ultrasonic assisted extraction and was concentrated under reduced pressure to obtain dry extract. Then, assays were performed to determine the antibacterial activity of the extract by the Bauer-Kirby disk agar diffusion method, and minimum inhibitory concentration was calculated using broth microdilution method. The dried extract showed antibacterial activity against Salmonella typhimurium (ATCC 14028) and Bacillus subtilis. subsp spizizenii (ATCC 6633) to 1240 µg/disc; while the minimum inhibitory concentration for both strains was to 2048 µg/mL. Dry extract of Faramea occidentalis leaves has a potential as antibacterial application.
Keywords: Faramea occidentalis, antiseptic activity, antibacterial activity, minimum inhibitory concentration.
Introducción
La medicina natural surgió desde tiempos inmemoriales y se ha ido transmitiendo a través de varios miles de generaciones hasta nuestros días. La práctica más conocida por nuestra población en cuanto a medicina natural y tradicional se refiere al uso de plantas medicinales (las “yerbas”), utilizadas de generación en generación y cuya aplicación ha hecho necesario el estudio profundo y minucioso de todas y cada una de ellas [1].
Aunque el avance científico en este tipo de investigaciones es notable, todavía existe un porcentaje elevado de la flora que está sin estudiar; por eso constituye un recurso excepcionalmente vasto en productos biológicamente activos que pueden ser útiles por si, o bien pueden servir como fuente natural de prototipos químicos para el desarrollo de derivados modificados, con actividades incrementadas y toxicidad reducida.
El aumento de microorganismos resistentes a los agentes antimicrobianos es uno de los principales problemas a los que se enfrenta la ciencia médica. Las bacterias y los hongos son responsables de varias enfermedades contagiosas. El aumento de implicaciones clínicas por resistencia a las drogas por hongos y bacterias lleva a incrementar las investigaciones de las drogas antimicrobianas [2].
El género Faramea se encuentra representado por más de 200 especies distribuidas desde México hasta el sur de Brasil [3]. Entre las plantas pertenecientes a este género se encuentra Faramea occidentalis; a esta se le atribuyen propiedades antisépticas, por lo que es empleada en el tratamiento de afecciones provocadas por la acción de microorganismos patógenos [4].
Faramea occidentalis se conoce en Latinoamérica con varios nombres, los más empleados son: nabaco, nabasco, palomonte, café cimarrón, cafetillo, galán de noche, jujano (Cuba); cafeillo, palo de toro (Puerto Rico); hueso (México); huesito (Panamá); cafecillo (El salvador) [5]. Algunos autores han dado a conocer su empleo como antiséptico, astringente, galactógeno y para el tratamiento de anemias con diarrea [4,5]. Hasta la fecha, no se han encontrado en las diversas fuentes de información consultadas, reportes sobre la actividad antibacteriana de esta planta.
Aunque Faramea occidentalis es común en toda Cuba, el conocimiento que presenta la población sobre su empleo como antiséptico se caracteriza por un elevado nivel de empirismo y se limita a algunas regiones de la geografía cubana, por ejemplo, en Camagüey, donde la conocen con el nombre de palomonte, la usan como antiséptico, astringente, y la emplean para baños. En el oriente de Cuba la consideran como galactógeno. En Remedio, Las Villas, se utiliza en infusión para la diarrea de los niños [5]. En la provincia Granma se emplea en Pión, Niquero, Media Luna, Campechuela, Manzanillo, Buey Arriba y Guisa, en estos municipios, se utiliza la decocción de las hojas para bañar a niños recién nacidos y para el tratamiento de los síntomas relacionados con desarrollo de la dentición primaria.
El estudio etnobotánico realizado indica que son pocos los reportes existentes sobre el empleo de Faramea occidentalis como antiséptico, por lo que se infiere que los extractos de las hojas de esta planta han sido poco empleados como terapia antibacteriana, lo que sugiere que las bacterias no han desarrollado mecanismos de defensa en su contra, entonces, es posible que estos puedan inhibir el crecimiento de diferentes cepas bacterianas.
Materiales y Métodos
Selección e identificación del material vegetal
El material vegetal fue colectado en la localidad de Cienaguilla, municipio Campechuela, provincia Granma, Cuba a las 7:30 a.m. del 18 de mayo de 2013 a una temperatura de 23,3 ºC y una humedad relativa del 92 %. Órganos y fotografías de la planta en su medio natural se trasladaron al Jardín Botánico Cupaynicú, ubicado en Los Mameyes, municipio Guisa, Provincia Granma, Cuba.
La identificación fue realizada por el asesor e investigador de dicha institución Dr. C. Luis Catasús Guerra y la planta herborizada se registró con el número 2340 en el herbario Catasús [6].
Posteriormente se clasificaron las hojas eliminando las que no reunían las condiciones óptimas para realizar el estudio, según la NRSP 309 del MINSAP [7]. El material vegetal seleccionado fue desinfectado mediante el lavado con agua potable y la inmersión durante 10 min en una disolución de hipoclorito de sodio al 2 % [8].
Las hojas se secaron en bandejas de cartón a la sombra a temperatura ambiente, removiéndose tres veces al día durante una semana; completaron su secado en una estufa (MLW modelo WSU 400, Alemania) con circulación de aire, a 40 ºC durante 3 h. Se procedió a pulverizar las hojas en un tamiz circular (TGL 0-4188 WEB, Alemania) hasta obtener un tamaño de partícula de un diámetro menor que 2,5 mm.
Obtención de la tintura al 20 % de las hojas de Faramea occidentalis
La tintura al 20 % se obtuvo a partir de los polvos (tamaño de partícula inferior a 2 mm de diámetro) de hojas, utilizando como menstruo una solución hidroetanólica al 70 % (v/v). Se emplearon 100 g de la droga cruda para obtener 500 mL de tintura al 20 %. El método de extracción aplicado fue la extracción asistida por ultrasonido (Ultrasonic Cleaner SB-3200 DTD, China) a una temperatura de 40 °C, frecuencia de 40 KHz durante dos horas.
El extracto obtenido se filtró a presión reducida y se almacenó en frascos de color ámbar dejándolo en reposo durante 3 días a una temperatura que osciló entre 4 y 8 °C. Transcurrido el tiempo de reposo se observó la formación de un precipitado, por lo que se efectuó una segunda filtración.
Obtención del extracto seco de las hojas de Faramea occidentalis
El extracto seco de las hojas de Faramea occidentalis se obtuvo a partir de 500 mL de la tintura al 20 %, por rotoevaporación a 40 °C y una velocidad de rotación de 60 rpm. Para ello se empleó un rotoevaporador (IKA, RV05 Basic, Alemania) conectado a un baño con termostato (IKA, HB4, Werke, Alemania), recirculador de agua para condensación (MLW, Alemania) y una bomba de vacio (VEM KMR 53 K4 FTH, Alemania).
Evaluación de la actividad antibacteriana del extracto seco de las hojas de Faramea occidentalis
Para la determinación de la actividad antibacteriana de los extractos secos de las hojas de Faramea occidentalis se realizaron ensayos in vitro empleando el método de difusión en agar por diseminación superficial en disco de Bauer-Kirby [9], el cual fue adoptado por el Clinical and Laboratory Standards Institute (CLSI, antes NCCLS) [10] con algunas modificaciones.
Los inóculos bacterianos se prepararon a partir de colonias crecidas durante 24 h y se ajustaron con el patrón 0,5 de McFarland. Se realizó la siembra sobre el agar Mueller-Hinton (BioCen, Cuba) con hisopos estériles. A partir del extracto seco de las hojas de F. occidentalis se elaboró una disolución stock a 248 mg/mL, utilizando dimetilsulfóxido (DMSO) como disolvente. Se adicionaron 5 µL de esta disolución a discos de papel de filtro (Whatman, Inglaterra) de 6 mm de diámetro previamente esterilizados, quedando aproximadamente 1240 µg/disco. Finalmente, las placas de Petri se incubaron a 37 ± 0,1 ºC durante 24 horas en una incubadora (Boxun BG-80, China). Las zonas de inhibición del crecimiento del microorganismo alrededor de los discos se midieron en milímetros.
Cada tratamiento tuvo tres repeticiones. Se utilizaron como controles negativos, discos de papel de filtro de 6 mm de diámetro cargados con 5 μL de DMSO; y como controles positivos, discos de los antibióticos comerciales Gentamicina, Ciprofloxacina y Amoxicilina de 30, 5 y 30 µg/disco, respectivamente (Sensi–DiscTM, Francia). Los resultados se declararon como el promedio de los halos de inhibición para cada tratamiento.
Bacterias evaluadas
Se utilizó una batería constituida por tres cepas de referencia internacional, depositadas en el American Type Culture Collection (ATCC).
- Bacillus subtilis. subsp spizizenii (ATCC 6633)
- Pseudomonas aeruginosa (ATCC 37853)
- Salmonella typhimurium (ATCC 14028)
Determinación de la concentración inhibitoria mínima (CIM)
Para la determinación de la concentración inhibitoria mínima se empleó el método de microdilución en caldo [11].
Se emplearon las dos cepas que mostraron inhibición del crecimiento bajo la acción del extracto seco de las hojas.
- Salmonella typhimurium (ATCC 14028)
- Bacillus subtilis. subsp spizizenii (ATCC 6633)
Se elaboró una solución stock a partir de 82 mg del extracto seco de las hojas y se disolvieron en 2 mL de dimetilsulfóxido (DMSO) para una concentración final de 41 mg/mL. Se obtuvo una solución de trabajo mediante una dilución 1/5 a partir de la solución stock para una concentración final de 8,2 mg/mL.
Se añadieron 100 µL de caldo Mueller-Hinton (BioCen, Cuba) en los pocillos de una placa de cultivo de 96 pocillos (Corning). Luego se mezclaron en la primera hilera de pocillos 100 µL de la solución de trabajo y se realizaron diluciones seriadas dobles hasta la hilera 10. Se adicionaron 100 µL del inóculo en todos los pocillos excepto en la última hilera, que constituyó el control de esterilidad. Finalmente, se obtuvo un rango de concentración del extracto entre 2048 - 4 (µg/mL); así como un control de crecimiento y un control de esterilidad sin el extracto.
La placa de cultivo se incubó a 37 ± 0,1°C por un período de 24 horas en una incubadora (Boxun BG-80, China). La concentración inhibitoria mínima se determinó como la concentración mínima del extracto que inhibió completamente el crecimiento bacteriano a simple vista. El ensayo se realizó por triplicado para cada una de las bacterias.
Resultados
Los resultados de la evaluación preliminar de la actividad antimicrobiana del extracto seco de las hojas de Faramea occidentalis frente a las tres cepas bacterianas (Tabla 1) se muestran a continuación.
Tabla 1. Resultados de la evaluación de la actividad bacteriana del extracto seco de las hojas de Faramea occidentalis.
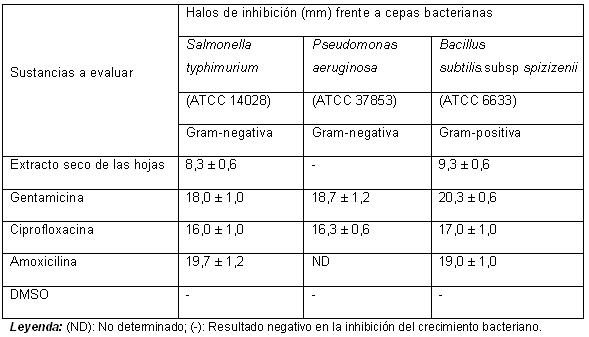
Los resultados muestran que el extracto seco provocó inhibición del crecimiento bacteriano en un diámetro de 8 mm para la cepa de referencia internacional Salmonella typhimurium (ATCC 14028), Gram-negativa. Se observó un halo de inhibición de 9 mm para la cepa Bacillus subtilis. Subsp spizizenii (ATCC 6633), Gram-positiva, mientras que los resultados fueron negativos en la inhibición del crecimiento bacteriano para la cepa de referencia internacional Pseudomonas aeruginosa (ATCC 37853), Gram-negativa.
Todas las cepas manifestaron sensibilidad ante los antibióticos comerciales evaluados. Sin embargo, el control negativo (DMSO) no provocó inhibición del crecimiento bacteriano, por lo que se infiere que el resultado obtenido no estuvo determinado por el solvente empleado en la obtención de la solución stock a partir del extracto seco de las hojas de Faramea occidentalis.
Estos resultados muestran que el extracto seco obtenido a partir de la tintura al 20% de las hojas de Faramea occidentalis tiene propiedades antibacterianas frente a cepas Gram-positivas y Gram-negativas, pues se observó la inhibición del crecimiento en dos de las tres cepas evaluadas.
Los resultados en la determinación de la concentración inhibitoria mínima corroboraron lo observado en la evaluación preliminar de la actividad antibacteriana del extracto seco de las hojas de Faramea occidentalis, al mostrar que este inhibió el crecimiento de Salmonella typhimurium (ATCC 14028) y de Bacillus subtilis. Subsp spizizenii (ATCC 6633). La concentración inhibitoria mínima del extracto para estas dos cepas fue de 2048 µg/mL.
Discusión
Los resultados obtenidos corroboran la hipótesis de que los extractos de las hojas Faramea occidentalis pueden inhibir el crecimiento in vitro de diferentes cepas bacterianas, tanto Gram-positivas como Gram-negativas, ya que en ambos ensayos se observó inhibición del crecimiento bacteriano in vitro de Salmonella typhimurium (ATCC 14028) y de Bacillus subtilis. Subsp spizizenii (ATCC 6633).
Estos resultados coinciden con el criterio de que los extractos de las rubiáceas exhiben un amplio espectro de actividad antibacteriana Karou (2011) [12].
En las fuentes consultadas no existen reportes de referencia sobre la actividad antibacteriana de los extractos de Faramea occidentalis que nos permitan comparar los resultados obtenidos, no obstante, varios autores han evaluado la actividad antibacteriana de otros representantes de esta familia.
Adomi y Umukoro (2010) [13], reportaron que el extracto etanólico de la raíz de Morinda lucida, representante de la familia Rubiaceae, mostró actividad antimicrobiana contra Salmonella typhimurium y Pseudomonas aeruginosa a una concentración de 1000 mg/mL, superior a la empleada en esta investigación.
Los resultados obtenidos concuerdan con reportes previos de Kone et al. (2004) [14], Okoli e Iroegbu (2004) [15] y Kubmarawua et al. (2007) [16], quienes registraron la actividad antibacteriana de extractos etanólicos de Keetia hispida y Nauclea latifolia, ambas representantes de la familia Rubiaceae.
Para el extracto etanólico de Keetia hispida, Kone et al. (2004) [14], reportó una concentración inhibitoria mínima de 0,023-0,375 mg/mL frente a Gram-positivas, mientras que Kubmarawua et al. (2007) [16], para el extracto etanólico de Nauclea latifolia, reportó una concentración inhibitoria mínima de 0,5 mg/mL frente a Gram-positivas y 1 mg/mL ante Gram-negativas, concentraciones inferiores a las empleadas en esta investigación.
Para el extracto etanólico de Nauclea latifolia, Okoli e Iroegbu (2004) [15], reportaron una concentración inhibitoria mínima de 12-50 mg/mL ante Gram-positivas y 6,25 mg/mL frente a Gram-negativas, en ambos casos, concentraciones superiores a las utilizadas en esta investigación.
Las diferencias en los resultados podrían ser consecuencia de diferentes factores, entre otros, la cepa bacteriana empleada, el método de extracción, la procedencia de la planta, la fuente botánica del extracto y el tratamiento de la planta (fresca o seca).
Los resultados evidencian la actividad antibacteriana in vitro del extracto seco obtenido a partir de la tintura al 20 % de las hojas de Faramea occidentalis frente a Gram-positivas y Gram-negativas, así como la importancia de las plantas como fuente de nuevos agentes antibacterianos.
Referencias
1. Rodríguez C, Medina G, Cabrera D (2002) Medicina Natural y Tradicional. Conocimientos y aplicaciones de enfermería en MINAS-II. Revista Cubana Enfermería 18(3):138-43.
2. http://www.redalyc.org/articulo.oa?id=85615225003, accesado 4/11/2013.
3. http://www.efloras.org/florataxon.aspx?flora_id=201&taxon_id=112647, accesado 6/11/2013.
4. Roig J.T (1988) Diccionario botánico de nombres vulgares cubanos. T.2. M-Z La Habana: Editorial Científico-Técnica.
5. http://www.ecured.cu/index.php/Nabaco, accesado 8/11/2013.
6. Regalado L, Ventosa I, Morejón R (2008) Revisión histórica de los herbarios cubanos con énfasis en las series de especímenes. Revista del Jardín Botánico Nacional 29: 101-138.
7. Norma Ramal de Salud Pública 309 (1992) Medicamentos de origen vegetal: droga cruda. Métodos de ensayos. La Habana Cuba.
8. Carballo C (2005) Desinfección química de Pedilanthus tithymaloides L. Poit Revista Cubana de Plantas Medicinales 10 (2): 45-49.
9. Bauer A.W, Kirby W.M.M, Sherris J.C, Truck M (1966) Antibiotic susceptibility testing by a standardized single disk method. American Journal of Clinical Pathology 45: 493-496.
10. Clinical and Laboratory Standards Institute (2007). M100-S17 (M2). Disk Diffusion Supplemental Tables, CLSI, Wayne Pa.
11. National Committee for Clinical Laboratory Standards (2003) Methods for Dilution Antimicrobial Susceptibility Tests for Bacteria That Grow Aerobically. NCCLS M7-A6.Wayne, PA.
12. Karou S.D, Tchacondo T, Ilboudo D.P, Simpore J (2011) Sub- Saharan Rubiaceae: A Review of Their Traditional Uses, Phytochemistry and Biological Activities Pakistan Journal of Biological Sciences 14(3): 149-169.
13. Adomi O.P, Umukoro E.G (2010) Antibacterial activity of aqueous and ethanol crude extracts of the root barks of Alstonia boonei and preliminary phytochemical test of Morinda lucida Journal of Medicinal Plants Research 4(8): 644-648.
14. Kone W.M. et al.(2004) Traditional medicine in North Cote-d’Ivoire: Screening of 50 medicinal plants for antibacterial activity. Journal of Ethnopharmacology 93: 43-49.
15. Okoli A.S, Iroegbu C.U (2004) Evaluation of extracts of Anthocleista djalonensis, Nauclea latifolia and Uvaria afzalii for activity against bacterial isolates from cases of non-gonococcal urethritis. Journal of Ethnopharmacology 92: 135-144.
16. Kubmarawua D et al (2007) Preliminary phytochemical and antimicrobial screening of 50 medicinal plants from Nigeria African Journal of Biotechnology 6: 1690-1696.
|
Revista QuímicaViva Número 3, año 13, Diciembre 2014 quimicaviva@qb.fcen.uba.ar |