Celdas de combustible biológicas basadas en el metabolismo fotosintético
Federico Figueredo, Albert Olaya y Eduardo Cortón
Laboratorio de Biosensores y Bioanálisis (LABB), Departamento de Química Biológica e IQUIBICEN-CONICET, Facultad de Ciencias Exactas y Naturales, Universidad de Buenos Aires, Argentina.
Pabellón 2, Ciudad Universitaria, Ciudad Autónoma de Buenos Aires (1428), Argentina
Recibido 21/11/2014 - Aceptado 28/11/2014
Resumen
Las celdas de combustible biológicas son dispositivos bio-electroquímicos, donde generalmente el ánodo (pero a veces el cátodo, o ambos) contiene microorganismos capaces de generar y mantener un gradiente electroquímico que se utiliza típicamente para generar energía eléctrica. En la configuración más estudiada, el ánodo contiene bacterias heterótrofas en condiciones anaerobias, capaces de oxidar moléculas orgánicas, liberando protones y electrones, así como otros subproductos. Los protones liberados pueden alcanzar el cátodo (típicamente a través de una membrana o un puente salino), mientras que los electrones viajan a través de un circuito externo, originando un flujo de corriente fácilmente medible. Se presentan aquí resultados obtenidos con distintas configuraciones de celdas de combustible, empleando organismos autótrofos, plantas y algas. Los resultados obtenidos indican que la producción de energía por estos dispositivos es aún muy baja para resultar competitivos con respecto a otros sistemas de acumulación/producción de energía eléctrica. La optimización tanto desde el punto de vista del diseño, materiales de electrodo y catalizadores, selección y/o modificación genética de los organismos utilizados, podría permitir en el futuro utilizar estos sistemas como una fuente de energía renovable adecuada para una variedad de aplicaciones de baja potencia.
Palabras clave: bioelectroquímica, energías renovables, MFC, curvas de polarización
Microbial Fuel Cells Based in Photosynthetic Metabolism
Summary
Biological fuel cells are electrochemical bio-devices, where usually the anode (but sometimes the cathode, or both) contains microorganisms capable of generate and maintain an electrochemical gradient, which is typically used to generate electricity. In the most studied configuration, the anode contain heterotrophic bacteria in anaerobic conditions, capable of oxidizing organic molecules, releasing protons and electrons as well as other by-products. Released protons can reach the cathode (typically through a membrane or a salt bridge), while electrons travel through an external circuit, producing an easily measurable current flow. Here we present results obtained with different configurations of fuel cells using autotrophic organisms, plants and algae. The results indicate that the production of energy by these devices is still too low to be competitive with other storage / power production systems. Optimization from the point of view of design, electrode materials and catalysts, selection and / or genetic modification of the organisms used could allow in the future the use of such systems as a renewable energy source, suitable for a variety of low power applications.
Keywords: bioelectrochemistry, green energy, MFC, polarization curves
Introducción
Las pilas de combustible son sistemas electroquímicos diseñados para convertir la energía liberada en una reacción química directamente en energía eléctrica. A diferencia de una batería, una pila de combustible suministra continuamente corriente mientras que los reactivos químicos estén disponibles. Las pilas o celdas de combustible de hidrógeno, donde este gas se utiliza como combustible y el oxígeno es el oxidante, son los sistemas más desarrollados y maduros tecnológicamente. Cuando el oxígeno y el hidrógeno se combinan para formar agua, se libera energía debido a que los electrones en la molécula de agua están en un estado de energía más bajo que los presentes en las moléculas de gas. En una reacción de combustión, como en un motor de cohete, la energía aparece como calor. En una celda de combustible la mayoría de la energía liberada (típicamente alrededor de 50-60%) se convierte directamente en energía eléctrica [1].
La aplicación obvia y más importante de los sistemas electroquímicos aquí mencionados (hay por lo menos cinco tipos de pilas de combustible de H2, a menudo clasificadas por el electrolito usado) es la producción de electricidad. Estos sistemas, si utilizan hidrógeno proveniente de una fuente renovable, evitan la producción de gases de efecto invernadero. Aunque los principios de pilas de combustible de H2 son bien conocidos por la comunidad científica desde hace mucho tiempo, cuando comenzó la carrera a la Luna mostraron sus posibilidades reales como una forma competitiva para producir energía eléctrica para misiones tripuladas, como las Apollo.
Las celdas de combustible biológicas (MFC por sus siglas en inglés) son dispositivos que utilizan microorganismos que transforman la energía química contenida en compuestos orgánicos en energía eléctrica, de forma directa, sin combustión [2]. Las MFC son sistemas altamente prometedores por su factibilidad técnica, simplicidad y economía, además de tener el potencial de acoplarse a otros procesos innovadores como los biosensores, la remediación ambiental como lo son las plantas de tratamiento de aguas residuales, etc., lo que las convierte en una prioridad científica compatible con las políticas actuales de una sociedad que busca ser sustentable ambientalmente [3]. Si bien la mayoría de los estudios publicados hasta la fecha emplea un repertorio relativamente limitado de microorganismos como material biológico, hay una tendencia a la búsqueda de mejores organismos (capaces de producir más electricidad) y en especial a explotar la biodiversidad presente en los diferentes ecosistemas; en la Argentina recientemente se han publicado trabajos donde se han aislado bacterias electrogénicas provenientes de lodo del Rio de la Plata [4].
Un concepto que explota una fuente de bioenergía in situ es la incorporación de plantas en la tecnología de celdas de combustible microbiana (plant microbial fuel cell, P-MFC). En las P-MFC, las plantas y las bacterias del suelo están presentes, y colaboran para convertir la energía solar en electricidad "verde". La idea principal es que las plantas producen rizodepósitos, principalmente en forma de hidratos de carbono, y las bacterias convierten estos rizodepósitos en energía eléctrica a través de la celda de combustible.
La P-MFC utiliza la cooperación natural entre las bacterias electrogénicas en el suelo y las plantas para convertir la energía solar en electricidad. Se ha propuesto que el sistema está basado en dos procesos:
A) Rizodeposición de compuestos orgánicos por las plantas vivas y la generación de electricidad a partir de compuestos orgánicos en la P-MFC [5].Las plantas convierten la radiación solar en energía química (hidratos de carbono) para su metabolismo, y hasta el 40% del carbono fijado neto puede ser liberado por las raíces, por ejemplo para la absorción de nutrientes. Por lo tanto, la idea principal es que los rizodepósitos de las plantas son utilizados como sustratos por las bacterias para generar electricidad en la P- MFC. Las bacterias electroquímicamente activas en la P-MFC utilizan la energía química del sustrato para su metabolismo, y simultáneamente utilizan como aceptor de electrones el ánodo de la celda de combustible [6].
B) La oxidación de la materia orgánica por las bacterias (mineralización), produce electrones en el compartimiento anódico. Estos electrones llegan al ánodo, y de ahí al cátodo, circulando por un circuito conductor externo [3]. También se producen protones por la oxidación de la materia orgánica; estos difunden (atravesando una membrana de intercambio iónico, puente salino, o una capa de suelo/sedimento), hasta alcanzar el cátodo.
Materiales y Métodos
Material Biológico
Plantas de las especies Spartina alterniflora y Salicornia ambigua fueron obtenidas durante un viaje de campaña en las cercanías del Puerto de General Lavalle, Bahía de Samborombón, Buenos Aires, Argentina; el sitio de muestreo puede observarse en la Figura 1, panel izquierdo. Oryza sativa fue cultivada a partir de semilla de arroz comercial.
Se utilizó una microalga ácido-tolerante Parachlorella kessleri (anteriormente Chlorella kessleri), inicialmente aislada de Laguna Verde [7], una laguna geotermal que se encuentra ubicada en el parque provincial Copahue-Caviahue (Neuquén, Argentina). Esta es una laguna geotérmica, meso termal, con temperaturas de entre 30-35 °C. Las aguas de la Laguna Verde son sulfurosas (ácido sulfúrico libre) con valores de pH en un rango de entre 2,5- 2,8. En nuestros experimentos, el alga fue crecida y utilizada en medio BBM [8] a pH neutral (donde crece a mayor velocidad). Una foto de estas algas (microscopio de campo claro) puede observarse en la Figura 1, panel derecho.

Figura 1. Material biológico utilizado. Izquierda, zona de muestreo en las cercanías del Puerto de General Lavalle, en la zona de la Bahía de Samborombón, Argentina; adelante se ven plantas de Salicornia ambigua, y detrás Spartina alterniflora. Derecha, células (10-15 µm de diámetro) de Parachlorella kessleri (fotos de los autores).
Medios y Soluciones
Solución de Hoagland: 224 ppm KNO3; 235 ppm Ca(NO3)2.4H2O; 160 ppm (NH4)2PO4; 62 ppm MgSO4.7H2O; 1,77 ppm KCl; 0,27 ppm H3BO3; 0,11 ppm MnSO4.H2O; 0,131 ppm ZnSO4.7H2O; 0,032 ppm CuSO4.5H2O; 0,05 ppm H2MoO4; 1,12 ppm Fe-EDTA.
Medio BBM: Se preparó siguiendo las instrucciones publicadas previamente por Nichols y Bold (1965)[8]/p>
Buffer Britton-Robison: 0,1 M: 6,75 mL de ácido fosfórico; 5,71 mL de ácido acético y 6,18 g de ácido bórico para 1000 mL.
Puesta en marcha de las P-MFCs
Las P-MFCs consistieron en dos recipientes plásticos, conectados por un puente salino conteniendo KCl 2 M y agar (3%). En recipientes de polietileno de alta densidad de 19x19x20 cm, se crecieron las distintas plantas (o sólo suelo, utilizado como control). Este compartimento mayor (ánodo), con un volumen de aproximadamente 5,5 L, se conectaba a un compartimento menor (mediante el puente salino) de aproximadamente 0,5 L (cátodo), como puede observase en la Figura 2, panel izquierdo.
Los electrodos para el cátodo y ánodo consistieron en barras de grafito de 2,5 cm de diámetro y 12,5 cm de largo (La Casa del Grafito SRL, Bs. As, Argentina, densidad de 1,84, pureza de 99,8%), con un área superficial de 108 cm2. El colector de corriente fue de cable de acero inoxidable (Famiq S.A, #304L, 1 mm), conectando los electrodos de grafito y terminando en un cocodrilo. Después de comprobar la continuidad eléctrica, el cable fue protegido con un aislante térmico de plástico retráctil (tubo termocontraíble). Todos los electrodos se pulieron con lija 120/150, obteniendo así una superficie homogénea. Finalmente los electrodos fueron sumergidos en HCl 1M y NaOH 1M durante 1 hora en cada solución (limpieza/activación); después del tratamiento los electrodos se almacenaron en agua destilada. Los electrodos fueron colocados de manera transversal en los dos compartimientos (anódico y catódico), a una altura de 4 cm de la base del compartimiento; se colocaron 2 electrodos por compartimiento.

Figura 2. Diseño experimental (set-ups) utilizado. En el panel de la izquierda, varias de las P-MFCs construidas; de izquierda a derecha se observa suelo (control), Spartina, Salicornia, y Oryza. En el panel de la derecha, celdas de combustible basadas en algas.
Las plantas utilizadas fueron de dos especies halófilas (Spartina alterniflora y Salicornia ambigua), que viven en zonas donde el suelo se inunda periódicamente (mareas y sudestadas) con agua salobre (20-35 g/L) y una especie típica de suelos continentales no-salinos (Oryza sativa). Las plantas de naturaleza halófila fueron recolectadas de la bahía Samborombón, Argentina (35°56’0” S, 57°6’0” O). O. sativa fue sembrada al inicio del experimento. Las plantas halófilas fueron trasplantadas en el compartimiento anódico de las P-MFC con sedimento recolectado en la Bahía Samborombón; los recipientes se llenaron con sedimento hasta en un 75% de su volumen total. Para O. sativa se utilizó suelo de jardinería comercial. Controles de suelo sin plantas (suelo salino y suelo no-salino) fueron empleados. Todos los experimentos se realizaron por duplicado, las P-MFCs y sus controles se midieron por 90 días.
Operación de las P-MFC
Los experimentos fueron realizados a temperatura ambiente, humedad de 75%, intensidad de luz de la región fotosintética activa de 248 +/- 44 µmol m-2s-1 y periodo de iluminación de 14 horas/día, condiciones descritas para Spartina anglica [9]. Para la iluminación se utilizaron 3 lámparas led de 12 Watts; cada una está compuesta por 6 leds de color rojo, 4 azules y 2 amarillos. Eventualmente se completó la iluminación con tubos fluorescentes blancos.
El compartimiento del ánodo fue irrigado una vez por semana con solución de Hoagland modificada, hasta ocupar un volumen aproximado del 90% del compartimiento del ánodo y se mantuvo por 12 horas, con el fin de evitar estrés hídrico. La solución de Hoagland contenía 20 g/L de NaCl sodio para S. alterniflora y S. ambigua, y sin NaCl para O. sativa. En la operación normal de la celda, el circuito eléctrico se cerró conectando una resistencia externa de 1000 Ω entre ánodo y cátodo. Como se ve en la sección siguiente, una vez por semana se desconectó el resistor de 1000 Ω overnight, y luego se ensayo la respuesta de las celdas al variar los resistores externos.
Análisis de datos de las P-MFC
Con el fin de evaluar el comportamiento del P-MFC y sus características eléctricas, se realizaron mediciones intercalando resistores externos de 100, 40, 10, 2, 1 kΩ, y 500, 200, 50, 20 y 10 Ω. Luego de incorporar un resistor al circuito, se esperó el tiempo necesario para que la lectura de potencial se estabilizara, y se pasó al siguiente resistor.
El potencial fue medido por un tester digital (MASTECH®, M890G), la intensidad de la corriente (I) se calculó utilizando la ley de Ohm (I = V/R), donde V es el potencial y R es la resistencia. La densidad de corriente, j (A/cm2), fue calculada como j = I/S; donde S es el área superficial geométrica del ánodo (en nuestros experimentos las áreas de ánodos y cátodos son idénticas). La densidad de potencia, P (W/cm2), se calculó como P = IV/S [2].
Construcción y operación de las celdas de combustible algales
En este caso los compartimentos de la celda fueron más pequeños (40 mL y 10 mL, para el compartimento que contiene las algas y para el compartimento abiótico, respectivamente). Los electrodos fueron de papel de carbón (Toray paper), y ambos compartimentos fueron separados por una membrana de Nafion 117 (Dupont). Luego de inocular las celdas con el alga, densidad óptica (OD, 600 nm) igual a 1, se midieron durante unos 15 d, hasta su estabilización. Las mediciones intercalando resistores externos de distintos valores fueron similares a lo realizado con las P-MFCs. Algunas de estas celdas pueden observarse en la Figura 2, panel derecho.
Resultados y Conclusiones
Sistemas de P-MFC
El potencial de una celda de combustible es en general menor que su potencial de equilibrio debido a diferentes tipos de pérdidas. Tres diferentes tipos de pérdidas pueden ser distinguidas, denominadas pérdidas óhmicas, por activación y por concentración [2]. En este trabajo, nuestra hipótesis fue que el utilizar un suelo salino, de menor resistividad, permitiría disminuir las perdidas óhmicas, y por lo tanto aumentar la eficiencia eléctrica en celdas de combustible que utilicen plantas halófilas, con respecto a plantas que viven en suelos continentales de menor salinidad, como el arroz.
Se trabajó con Oryza sativa (arroz) con el fin de comparar una planta que prefiere suelos no-salinos con dos especies de halófilas. O. sativa es un modelo utilizado en diferentes trabajos en esta área, se han reportado altas densidad de corriente y de potencia, desde 44 a 120 mA/m2 y 22 a 26 mW/m2, utilizando un cátodo de gran eficiencia que no limita la corriente, como el de ferricianuro [5,10]. Otros trabajos informan valores de 163 mA/m2 y 14 mW/m2 utilizando cátodos enriquecidos con Pt como catalizador (y oxígeno como oxidante) [11]. Además, en un trabajo donde se utilizó un cátodo de oxígeno, sin catalizadores, se obtuvieron valores de 52 mA/m2 y 6 mW/m2 para las P-MFCs construidas utilizando Chlorella vulgaris como material biológico [12]. De los reportes descritos solo el último se podría comparar con nuestro trabajo, dado que en ambos se evitó el uso de ferricianuro y electrodos con gran capacidad catalítica (Pt u otros) para optimizar el rendimiento de la P-MFC.
La operación de un cultivo de O. sativa tomó hasta hasta 120 días [12], en nuestros experimentos el tiempo de operación fue de 84 días, y obtuvimos comparables valores de corriente y potencia, de 27 mA/m2 y 3,3 mW/m2 como máximo. En la Figura 3A se muestra una curva de polarización y una curva de potencial típicos, correspondiente al día 56 de operación, donde se observa el valor de densidad de potencia máxima (p) igual a 2,11 mW/m2, una densidad de corriente máxima (j, medida cuando la potencia p es máxima) de 4,6 mA/m2, y ello a un potencial de 540 mV. Los valores obtenidos son comparables (si bien menores), y por ello estos experimentos pueden ser usados como controles para las P-MFC basadas en plantas halófilas.
Aunque no hay muchos estudios en la aplicación de P-MFC, el género de Spartina sp. es una de las plantas halófilas más estudiadas. La bibliografía informa densidades de corriente de entre 32 mA/m2 y 214 mA/m2 y densidades de potencia de entre 4 mW/m2 y 50 mW/m2 [6].
Los valores obtenidos hasta la quinta semana de operación en este trabajo fueron muy bajos, de 1,2 mA/m2 y 0,3 mW/m2. Esto es explicable por el lento crecimiento observado en las condiciones de laboratorio de las plantas, con un largo periodo de adaptación. Sin embargo, durante la última semana de los experimentos estos valores se incrementaron sensiblemente, llegando a valores cercanos a 1,8 mA/m2 y 6,2 mW/m2 al final de los experimentos. En la Figura 3B se muestran datos típicos obtenidos en este trabajo.
Por otro lado Salicornia sp. es una planta que no ha sido estudiada previamente en aplicaciones de P-MFC como las aplicadas aquí, y se encuentra muy poca información sobre ella, pero al ser una especie halófila acompañante en su hábitat natural de Spartina sp., se decidió trabajar con ella. El difícil cultivo de S. ambigua, fue uno de las desventajas que se presentaron; aunque fuese trasplantada inmediatamente, se observó un largo periodo de adaptación de estas plantas a las condiciones del laboratorio; sólo en las últimas semanas observó mayor vigor y nuevos brotes en estas plantas. Probablemente por este bajo nivel de crecimiento, se obtuvo una baja producción de energía, además de manera irreproducible entre los duplicados. Los valores obtenidos al final del experimento fueron de 4 mA/m2 y 0,3 mW/m2; datos de un experimento típico se muestran en la Figura 3C. Se necesita realizar mayores esfuerzos para lograr la adaptación de esta planta, reconocida como de difícil cultivo.
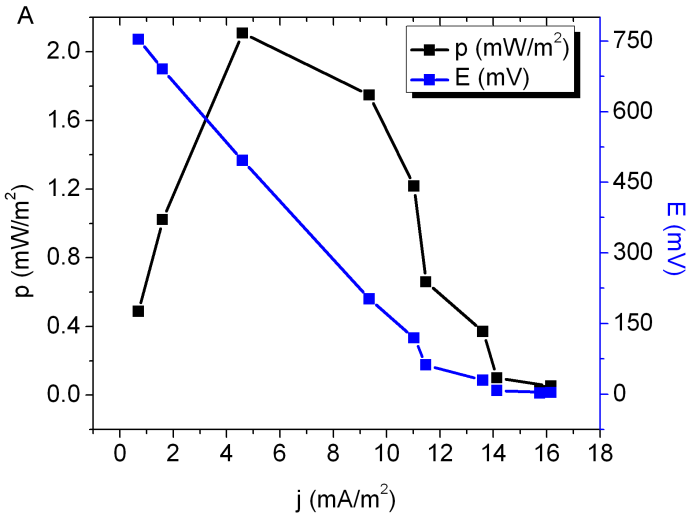
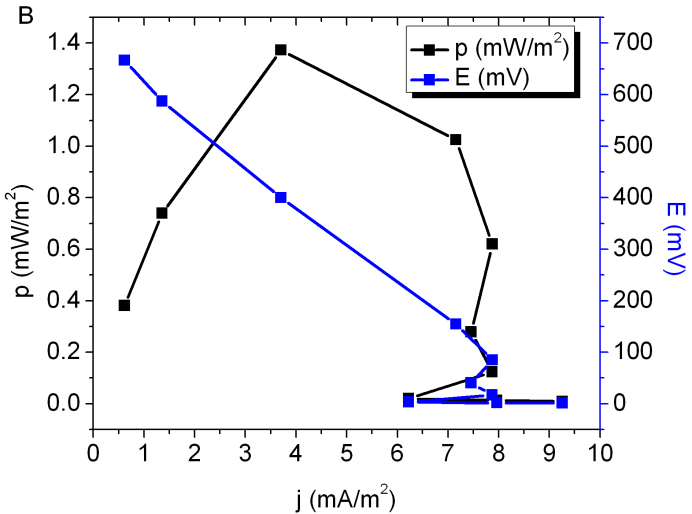
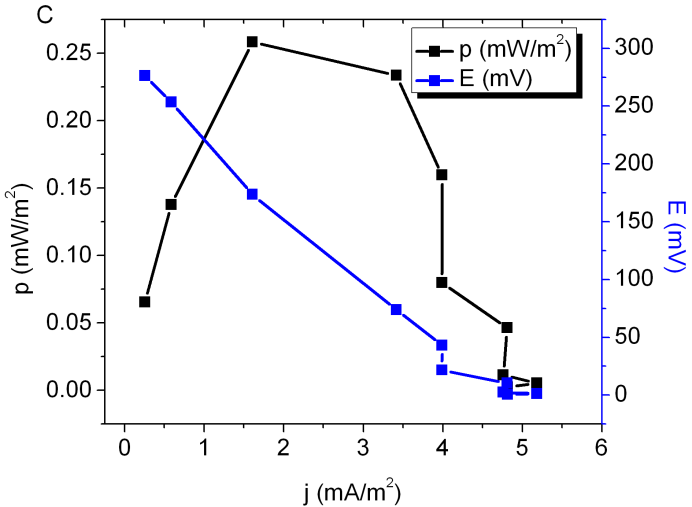
Figura 3: Se muestran curvas de potencia (en negro) y de potencial (en azul) típicas para los sistemas de P-MFC utilizados (datos obtenidos en el día 56 del experimento) para A) Oryza sativa, B) Spartina alterniflora, y C) Salicornia ambigua.
Sistemas de celdas de combustible basadas en algas
Al comparar los valores obtenidos en los experimentos con los resultados de trabajos con MFC similares en la literatura, se observó que tanto el potencial de la celda como la densidad de potencia obtenidos están en el rango de valores reportados por otros autores (si bien nuestros valores son en general menores). Por ejemplo, autores [13] reportan valores entre 0,1 y 2 mW/m2 para sistemas basados en Spirulina platensis. Powell et al. (2009), por su parte, reporta densidades de potencia óptimas de 0,95 mW/m2 para una MFC que combina Saccharomyces cerevisiae en el ánodo y una micro alga, Chlorella vulgaris, en el cátodo. Las curvas de polarización son también comparables en todos los casos, con valores de potencial que oscilan entre los 50 y 200 mV.
Por último, en un trabajo recientemente publicado [14], donde se utiliza una celda de combustible de diseño similar a la nuestra (el alga unicelular Chlorella vulgaris fue en este caso utilizada como material biológico), los autores han informado una densidad de potencia máxima de 14 µW/m2. Estos valores son similares a los obtenidos en este trabajo, de 23 µW/m2).
Este valor (23 µW/m2) se obtuvo en la celda de combustible algal, bajo iluminación, y corresponde también a una densidad de corriente de 0.5 mA/m2 y un potencial de 74.2 mV; se observó una dependencia de la luz, registrándose menores valores de potencia durante los ciclos de oscuridad, pero este fenómeno no se estudió sistemáticamente.
A pesar de que los valores obtenidos son menores a algunos de los informados para celdas de combustible microbianas (basadas generalmente en microorganismos heterótrofos), es importante destacar que este sistema algal (y también los basados en plantas), no requieren un sustrato orgánico (su fuente de poder es 100% lumínica), no hay producción de CO2, y por último, este sistema no requiere el agregado de mediadores (como el azul de metileno, o el rojo neutro) que permitan su operación. La construcción de los sistemas presentados aquí es sencilla y económica, y no requieren el agregado de reactivos o la utilización de catalizadores metálicos; por ello su operación puede ser durable y continua.
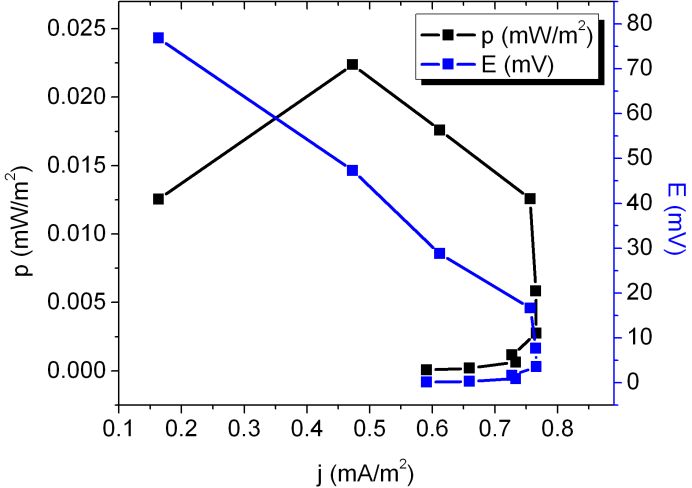
Figura 4:Curvas de potencia (en negro) y de potencial (en azul) típicas obtenidas para celdas de combustible basadas en P. kessleri.
La operación continua durante años, y una densidad de energía mucho mayor que la obtenida hasta la fecha, son requisitos previos para una implementación exitosa de las celdas de combustible biológicas como un sistema de producción de energía eléctrica. Los experimentos realizados con iluminación artificial y en recipientes pequeños mostraron muchas limitaciones, lo que hace pensar que sería adecuada la realización de experimentos en condiciones más parecidas a la realidad (recipientes de al menos 100 litros e iluminación natural). Se necesita lograr al menos un incremento de 100 veces en la eficiencia de estos dispositivos, para que su uso como fuente de energía sea económicamente rentable, al menos para algunos usos.
Sin embargo, la producción de energía no es la única aplicación de los distintos tipos de celdas de combustible biológicas; pequeños cambios (pero reproducibles) en los parámetros eléctricos de estos sistemas pueden ser utilizados como una señal analítica, como ha sido recientemente revisado en nuestro laboratorio [15,16].
Agradecimientos
Financiamiento del CONICET y la AGENCIA es agradecido, así como de la Facultad de Ciencias Exactas y Naturales, de la Universidad de Buenos Aires. Se agradece también la beca otorgada por la Universidad de las Naciones Unidas y el Programa de Biotecnología para América Latina y el Caribe (A.O, UNU-BIOLAC). También queremos agradecer al Dr. Carlos Guillermo Velez por sus consejos para el cultivo y manejo de algas y a la Dra. Nancy López por su ayuda en la preparación del manuscrito
Referencias
1. Wieckowski A, Norskov J (Eds.) ( 2010) Fuel Cell Science: Theory, Fundamentals, and Biocatalysis New York: Wiley
2. Logan BE (2008) Microbial Fuel Cells New York: Wiley,
3. Logan BE, Regan JM (2006) Microbial fuel cells: Challenges and applications. Environmental Science Technology 40: 5172-5180
4. Sacco NJ, Figuerola ELM, Pataccini G, Bonetto MC, Erijman L, Cortón E (2012) Rio de la Plata River Sedimentary Microbial Fuel Cells. Current production and its relationship to the anodophilic microbial community. Bioresource Biotechnology 126: 328-335.
5. De Schamphelaire L, Bossche L, Dang H, Hofte M, Boon N, Rabaey K, Vertaestre W (2008) Microbial fuel cells generating electricity from rhizodeposits of rice plants Environmental Science Technology 42: 3053-3058
6. Strik D, Hamelers HVM, Snel JFH, Buisman CJN (2008) Green electricity production with living plants and bacteria in a fuel cell International Journal of Energy Research 32 : 870-876
7. Juárez AB, Vélez CG, Iniguez AR, Martinez DE, Rodriguez MC, Vigna MS, del Carmen Ríos de Molina M (2011) A Parachlorella kessleri (Trebouxiophyceae, Chlorophyta) strain from an extremely acidic geothermal pond in Argentina Phycologia 50: 413
8. Nichols HW, Bold HC (1965) Trichorsarcina polymorpha gen. et. sp. nov Journal of Phycology 1: 34-38
9. Timmers RA, Strik DPBTB, Hamelers HVM, Buisman CJN (2010) Long-term performance of a plant microbial fuel cell with Spartina anglica Applied Microbiology and Biotechnology 86: 973- 981
10. De Schamphelaire, L. Cabezas A, Marzorati M, Friedrich MW, Boon N., Verstraete W (2010) Microbial community analysis of anodes from sediment microbial fuel cells powered by rhizodeposits of living rice plants Applied and Environmental Microbiology 76: 2002-2008
11. Takanezawa K, Nishio K, Kato S, Hashimoto K, Watanabe K (2010) Factors affecting electric output from rice paddy microbial fuel cells Bioscience Biotechnology Biochemical 74: 1271- 1273
12. Kaku N, Yonezawa N, Kodama Y, Watanabe K (2008) Plant/microbe cooperation for electricity generation in a rice paddy field Applied Microbiological Biotechnology 79:43-49
13. Fu CC, Su CH, Hung TC, Hsieh CH, Suryani D, Wu WT (2009) Effects of biomass weight and light intensity on the performance of photosynthetic microbial fuel cells with Spirulina platensis Bioresource Technology 10: 4183-4186.
14. De Caprariis B, De Filippis P, Di Battista A, Di Palma L, Scarsella M (2014) Exoelectrogenica of a green microalgae, Chlorella vulgaris, in a bio-photovoltaic cells (BPVs) Chemical Engineering Transactions 38: 523-528
15. Abrevaya XC, Sacco NJ, Bonetto MC, Hilding-Ohlsson A, Cortón E (2015a) Analytical applications of microbial fuel cells. Part I: Biochemical oxygen demand Biosensors and Bioelectronics 63: 580-590
16. Abrevaya XC, Sacco NJ, Bonetto MC, Hilding-Ohlsson A, Cortón E (2015b) Analytical applications of microbial fuel cells. Part II: Toxicity, microbial activity and quantification, single analyte detection and other uses. Biosensors and Bioelectronics 63: 591-601
|
Revista QuímicaViva Número 3, año 13, Diciembre 2014 quimicaviva@qb.fcen.uba.ar |