Digestibilidad de las proteínas alergénicas
Wilman Carrillo
Facultad de Ciencia e Ingeniería en Alimentos (FCIAL)
Universidad Técnica de Ambato Ecuador
Av. Los Chasquis y Rio Payamino Campus Huachi
correo: wi.carrillo@uta.edu.ec
Resumen
Las proteínas alimentarias además de su valor nutricional se sabe que pueden ejercer actividades biológicas sobre el organismo. Las proteínas pueden ser modificadas por distintos métodos tecnológicos como tratamiento térmico, químico y enzimático, estas modificaciones en su estructura pueden modificar sus propiedades biológicas y alergenicidad. Dentro de los métodos más usados para modificar proteínas se encuentra la hidrólisis enzimática. Muchas proteínas por la complejidad de su estructura resultan ser alergérnicas, dependiendo del grado de hidrólisis pueden reducir o no su potencial alergénico. Por esta razón resulta de mucho interés saber que le sucede a las proteínas alérgenas durante la digestión gastrointestinal ya sea en su forma nativa o desnaturalizada.
Palabras claves: alérgenos, hidrólisis enzimática y pepsina.
Abstract:
The food proteins in addition to its nutritional value are known to exert biological activities on the organism. Proteins may be modified by various technological methods such as thermal treatment, chemical and enzymatic; these structural modifications can alter their biological properties and allergenicity. Among the methods used to modify proteins is enzymatic hydrolysis. Many proteins by the complexity of their structure result to be allergenic, depending on the degree of hydrolysis may be reduced or not allergenic potential. For this reason it is of great interest to know what occurs to the allergenic proteins in the gastrointestinal digestion either in native or denatured form.
Key words: Allergenicity, allergens, , enzymatic hydrolysis and pepsin.
Las proteínas se hallan en el centro de acción de los procesos biológicos. Éstas llevan en su propia secuencia toda la información necesaria para alcanzar su destino y realizar sus funciones.
Algunas proteínas tienen una función estructural (son materiales estructurales de la célula), otras cumplen actividades fisiológicas, pues funcionan como enzimas que catalizan el complejo conjunto de reacciones químicas que se dan en las células. Las proteínas sirven como reguladores de estas reacciones, en forma directa como componentes de las enzimas y de manera indirecta como mensajeros químicos (hormonas) y como receptores de esas hormonas. Actúan en el transporte y almacenamiento de sustancias importantes de los procesos biológicos, por ejemplo, iones metálicos, O2, glucosa, lípidos y muchas otras moléculas. Las del sistema inmune las inmunoglobulinas, forman un sistema esencial de defensa biológica en los animales superiores (1, 2).
Las propiedades de una proteína están determinadas, en gran medida, por su estructura tridimensional. La estructura tridimensional de una proteína nativa (plegada desde el punto de vista fisiológico) está especificada por su estructura primaria, de modo que tiene un conjunto de características básicas. Esta estructura tridimensional se puede ver afectada por procesos externos que desestabilicen su estructura por ejemplo, desnaturalización por cambios de pH, detergentes, agentes químicos y calor que hacen que la proteína se despliegue. Esta alteración trae como consecuencia la modificación de sus propiedades fisicoquímicas: hidrofobicidad, solubilidad, viscosidad, etc. En algunos casos estos cambios permiten modificar y/o potenciar en ciertas proteínas alimentarias sus actividades biológicas. Convirtiéndolas así en elementos de interés para la industria alimentaria a la hora de obtener nuevos ingredientes funcionales (3).
Modificación de proteínas
Actualmente en el mundo existe un incremento en la demanda de productos alimenticios con propiedades funcionales, estas propiedades pueden ser conseguidas por medio de las proteínas modificadas.
Las modificaciones más conocidas son cambios estructurales en las proteínas por agentes físicos, químicos y enzimáticos. La modificación por desnaturalización térmica es usada para inducir cambios en la estructura de la proteína. La modificación química puede ser producida por acetilación, esterificación, fosforilación, tiolación y glicosilación. Estas modificaciones pueden producir cambios en la hidrofilicidad/ hidrofobicidad con aumento de la carga neta de la superficie de la proteína, y modificar el punto isoeléctrico y/o conformación resultando modificadas sus propiedades funcionales y como consecuencia pueden resultar alteradas su propiedades biológicas (4, 5,6).
La función principal de las proteínas presentes en los alimentos es aportar el nitrógeno y los aminoácidos esenciales (aminoácidos que no pueden sintetizarse) que en una proporción ideal se utilizan para la síntesis de las proteínas corporales y las demás sustancias nitrogenadas. Para poder utilizar estos aminoácidos, las proteínas deben ser digeridas. Por ello son sometidas a un complejo proceso de hidrólisis enzimática. Muchas proteínas por la complejidad de su estructura resultan ser alergénicas, dependiendo del grado de hidrólisis pueden reducir o no su potencial alergénico. Por esta razón resulta de mucho interés saber que le sucede a las proteínas alergénicas durante la digestión gastrointestinal ya sea en su forma nativa o desnaturalizada.
Digestibilidad de alérgenos alimenticios
La incidencia de alergias alimentarias en países desarrollados se encuentra en aumento y se estima que suele ser de un 10 % en niños y de un 2% en adultos (7,8). Se estima que en Estados Unidos mueren cerca de 125-150 personas al año por anafilaxis por alergias alimentarias (9). La prevalencia de las alergias al huevo se estima que puede llegar a ser entre 1,6- 3,2 % en los países desarrollados y es la segunda causa de alergias alimentarias en niños (10). Estudios epidemiológicos recientes sugieren que el mayor nivel de higiene en las poblaciones urbanas de los países desarrollados puede jugar un papel importante (11).
El término de hipersensibilidad alimentaria se refiere a todas aquellas reacciones individuales y adversas del organismo a determinados alimentos. Las proteínas son la principal causa de estas reacciones; otras moléculas también pueden provocar reacciones aunque suelen ser más leves y con menos frecuencia. Si en la respuesta del organismo está implicado el sistema inmunológico entonces la hipersensibilidad se denomina alergia alimentaria (12,13). Las alergias alimentarias son mediadas por anticuerpos denominados inmunoglobulinas E (IgE) y son clasificadas como reacciones de hipersensibilidad tipo I (14).
Un gran número de alérgenos alimenticios son estables en condiciones que simulan la digestión gastrointestinal in vivo. Entre estas proteínas no hay características comunes, aunque se asume que tienden a ser proteínas mayoritarias en los alimentos, resistentes a la digestión y estables a los tratamientos de procesado sobre todo al tratamiento térmico (15).
El cuerpo humano ha desarrollado un complejo sistema para descomponer los alimentos y extraer los nutrientes que necesita para mantener la salud. En la ingesta los alimentos en la boca se mezclan con la saliva. Luego son sujetos a un proceso gástrico por un periodo variable en el cual el pH puede ser muy bajo, este puede cambiar por el volumen, contenido de comida o presencia o ausencia de antiácidos consumidos por el individuo y finalmente entran los alimentos al duodeno donde son neutralizados, luego pasan al yeyuno e íleon. Durante esta fase de la digestión se mezcla con enzimas (amilasas, proteasas y lipasas) y con surfactantes (sales biliares y fosfolípidos) en el duodeno. Dependiendo del grado de hidrólisis en la fase gástrica y duodenal, las proteínas de los alimentos son degradadas a fragmentos más pequeños, para que puedan atravesar la capa de moco del epitelio. Para ello son convertidas en moléculas más pequeñas; como aminoácidos, di y tri-péptidos (16).
En general, lo que le sucede a las proteínas durante el proceso de digestión ha sido estudiado en sistemas animales in vivo, usando medidas de digestibilidad como el balance de nitrógeno, o con sistemas in vitro usando proteasas (17).
Las investigaciones en procesos digestivos en humanos supone tomar muestras principalmente del estómago y duodeno vía naso-gástrica/ vía-duodenal por aspiración, al resto del intestino es muy difícil acceder. Las muestras de este punto final se toman de voluntarios con ileoestomia o de heces. Los estudios en sistemas animales son una alternativa bastante buena para reemplazar los estudios en sistemas humanos, especialmente cuando se refiere al caso de las alergias. Los estudios en humanos se dificultan por consideraciones éticas y técnicas, especialmente por la cantidad y el número de individuos voluntarios que se necesitan. Por esta razón se ha desarrollado la aplicación de modelos in vitro que utilizan condiciones que ocurren en los procesos in vivo.
Los modelos in vitro tienen muchas ventajas: se usan muestras representativas y se puede utilizar cualquier tiempo, desde el inicio hasta el punto final, se pueden testar matrices alimentarias o proteínas purificadas, etc. En los modelos in vitro se consideran tres fases: 1) fase bucal, 2) fase gástrica y 3) fase duodenal. En la fase bucal se trituran los alimentos y se homogenizan. Las proteínas purificadas tienen un tamaño de partícula reducido y la fase bucal es omitida. Para estudios de hidrólisis de proteínas la acción de las enzimas en la boca no tiene mucha importancia, pero si en el estómago y duodeno (16).
Los ensayos de digestión in vitro con pepsina en un principio fueron desarrollados y utilizados para evaluar el valor nutricional de las proteínas como fuentes de aminoácidos viables (18,19).
Posteriormente los avances de la tecnología recombinante permitieron usar la pepsina y otras proteasas para identificar los segmentos de las proteínas que se unen a las IgE (20, 21,22).
Astwood y col., (1996) (23) fueron los primeros en reportar la aplicación de un ensayo de digestión in vitro con pepsina para evaluar la digestibilidad de proteínas alimentarias. En ese estudio se comparó la digestibilidad de proteínas alergénicas frente a proteínas no alergénicas, en SGF (Fluido Gástrico Simulado consistente de 0,035 M NaCl a pH 1,2 con pepsina según la US Pharmacopoeia, 1995) (24). Muchos de esos alérgenos fueron estables durante 60 minutos de digestión o formaron fragmentos estables. Mientras, que las proteínas no alergénicas fueron digeridas rápidamente, sin formar fragmentos peptídicos estables. En este estudio se concluyó que los alérgenos pueden ser más estables a la digestión que las proteínas que no eran alergénicas, proponiéndose que la digestión puede ser un parámetro eficaz para distinguir alérgenos de proteína no alergénicas (23).
Muchos otros estudios se han llevado a cabo para determinar el potencial alergénico de las proteínas alimentarias utilizando también ensayos de digestibilidad in vitro con pepsina en SGF. Estos estudios apoyan que la digestión puede ser utilizada como herramienta clave para predecir el potencial alergénico de las proteínas alimentarias (23, 25, 26,27). Muchos estudios han indicado la relación entre la estabilidad en SGF y el poder alergénico (28, 29, 30, 31, 32, 33,34).
Sin embargo, otros trabajos proponen que la resistencia a la digestión por pepsina no puede utilizarse como un método para predecir lel poder alergénico, ya que ciertas proteínas alergénicas son hidrolizadas con facilidad en SGF (17, 28, 35, 36,37).
También se han realizado estudios sobre la estabilidad a la digestión en SGF de proteínas transgénicas (proteínas modificadas genéticamente) y su potencial alergénico (35, 36, 37, 38,39). Debido al uso de estas nuevas proteínas alimentarias, se decidió evaluar su potencial alergénico. Así el primer trabajo fue publicado por el International Food Biotechnology Council en 1996 (39), donde se utilizaron sistemas informáticos para identificar los sitios de IgE, se determinó la resistencia a la pepsina y por último se realizaron estudios clínicos.
En el año 2001, la FAO/ WHO recomiendan para los ensayos de seguridad alimentaria de proteínas modificadas genéticamente usar pH 1,2 – 2 en los ensayos de digestión y sugiere pH 1,2 como el pH óptimo para las condiciones de la digestión gástrica, proponiendo además una serie de consideraciones a tener en cuenta (40). Aprovechando todas las evidencias sobre ensayos de digestibilidad de proteínas alimentarias, se tuvieron en cuenta una gran variedad de factores experimentales que permiten evaluar el potencial alergénico de nuevas proteínas. Estas recomendaciones fueron establecidas por el Codex Alimentarius Commission(Fig. 1); Codex, 2003) (40). Cabe destacar que dentro de estas recomendaciones se encuentran los ensayos in vitro de resistencia a la digestión con pepsina como criterio para determinar el posible poder alergéncio de las proteínas. También se ha medido la resistencia a la digestión en SIF (Fluido intestinal Simulado, US Pharmacopoeia, 2000) (41) de proteínas alergénicas y de proteínas no alergénicas (27).
Por otro lado se han realizado estudios de digestión gastrointestinal. En este tipo de ensayos se tienen dos fases: una primera donde se digiere con pepsina y seguidamente una segunda fase donde se utilizan una mezcla de enzimas (tripsina, quimotripsina, colipasa y lipasa). Estos ensayos permitieron determinar la digestibilidad de ciertos alérgenos y su posible potencial alergénico después de la digestión (43, 44,45).
La variabilidad en estudios sobre medida de la digestibilidad in vitro de las proteínas en parte puede deberse a la falta de estandarización de los protocolos para ensayos de digestión de proteínas usando SGF. Estas variaciones pueden ser diferencias en el pH del ensayo, la pureza de la pepsina, la relación enzima/sustrato, la pureza de la proteína y su estructura, diversos métodos de procesado a los que se someten los alimentos (tratamientos térmicos) y, por último, el método de detección (17).
La producción de pepsina A, la principal clase de pepsina en estómagos de vertebrados comienza a producirse a partir del quinto día postnatal. La pepsina A es la mayor proteasa en el estómago de adultos. La diferencia entre adultos e infantes se debe a la acidez del estómago pH 2 y pH 4 respectivamente (46). Dependiendo del sustrato el pH óptimo para la actividad máxima de la pepsina puede encontrarse entre pH 2 y pH 3.5 (47).
El pH de los ensayos de digestión con pepsina es determinante e influye en la digestibilidad de ciertas proteínas. A pH 2 muchas proteínas alergénicas presentan resistencia a la digestión por la pepsina, en algunos casos se forman fragmentos estables que conservan el potencial alergénico de la proteína nativa (35). La lisozima de clara de huevo presenta resistencia a la hidrólisis con pepsina a pH 2. La lisozima es más fácil de digerir con otras proteasas como la tripsina (17, 48, 49, 50, 51,52).
La relación enzima/sustrato juega un papel importante en la digestión de las proteínas. Se han realizado muchos estudios que han utilizado diferentes proporciones de enzima; esta variabilidad en la cantidad de enzima puede modificar la digestión de algunas proteínas (53). Algunas proteínas tienen resistencia a la digestión con pepsina aun cuando la relación de enzima/sustrato se modifique Fu y col., 2002, reportaron que la ß- lactoglobulina B digerida con pepsina en SGF a pH 1,2 con las siguientes relaciones E/ S , 10: 1, 1: 1 y 1: 10 permaneció estable hasta los 120 minutos de digestión.
Figura 1. Evaluación de alergias para proteínas alimentarias recomendada por el Codex 2003 (40) (modificada)
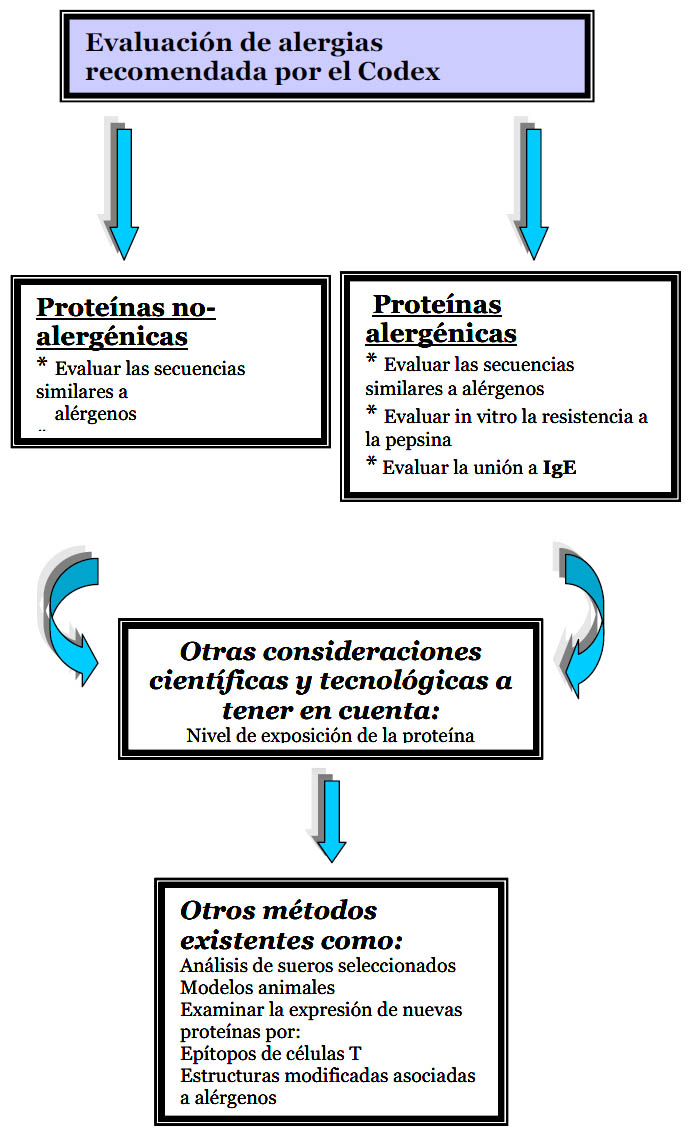
Cuando se aborda el
tiempo de digestión gástrica de proteínas alimentarias alergénicas siempre
se relaciona con su estabilidad. Para proteínas
Cuando se aborda el tiempo de digestión gástrica de proteínas alimentarias alergénicas siempre se relaciona con su estabilidad. Para proteínas alimentarias no alergénicas a medida que se aumenta el tiempo de incubación con la enzima la digestión aumenta. Sin embrago, en el caso de muchas proteínas alimentarias alergénicas se presenta una alta estabilidad después de 120 minutos como en el caso de la ß- lactoglobulina (27). A modo de ejemplo en la Tabla 1, se pueden ver la estabilidad en SGF de los cuatro alérgenos más importantes presentes en la clara de huevo.
Tabla 1. Digestión de alérgenos del huevo en SFG1
|
Alérgenos |
Tiempo (min) |
E/ S (p/p)2 |
pH |
|
Ovomucoide |
8 |
19 |
1.2 |
|
|
0 |
13 |
1.2 |
|
|
0.5 |
3 |
2.0 |
|
Ovoalbúmina |
60 |
19 |
1.2 |
|
|
5 |
13 |
1.2 |
|
|
30-60 |
3 |
1.2 |
|
|
30-60 |
3 |
2.0 |
|
|
5 |
2 y 8 |
1.2 |
|
|
60 |
3 |
2.0 |
|
Ovotransferrina |
0 |
19 |
1.2 |
|
|
0 |
13 |
1.2 |
|
Lisozima |
60 |
13 |
1.2 |
1Modificada de Moreno FJ. (42)
2Relación enzima/sustrato
Por otro lado, los alimentos sufren una cantidad de procesos ya sea a nivel de consumo o industrial, los cuales pueden cambiar la estructura de las proteínas y como consecuencia modificar su características funcionales. Por ejemplo, durante la cocción de los alimentos las proteínas son desnaturalizadas, exponiendo regiones que se encuentran ocultas, que cambian la superficie de la molécula, su hidrofobicidad, etc. La lisozima de huevo se desnaturaliza alrededor de 70-75º C, dependiendo del pH y las condiciones de la solución (54-55). Además es más sensible al calor cuando está en la clara que sola en solución de fosfato pH 7-9. Cuando la clara se calienta a 63,5º C durante 10 minutos la lisozima se inactiva, ocurriendo esto en mayor medida cuando el pH es superior a 7 (56).
Recientemente en el estudio de estructuras de proteínas envueltas en matrices complejas como la leche se han utilizado técnicas inmunoquímicas para determinar diferencias en sus estructuras. Las técnicas inmunoquímicas fueron utilizadas para distinguir entre la forma nativa y desnaturalizada de la α-lactoalbúmina (α La) en la leche. El tratamiento térmico como la ultra alta temperatura (UHT) o esterilización, permite que ciertos epitopos desaparezcan cuando aumenta la temperatura, mientras que nuevos epitopos aparecen gradualmente (57-58).
La desnaturalización térmica puede llegar a favorecer la digestión enzimática de ciertas proteínas, como la β lactoglobulina que vio favorecida su hidrólisis cuando fue previamente calentada (59). Ese aumento en la digestibilidad en algunos casos puede llegar a disminuir o no lsu capacidad alérgenica. Por ejemplo, se ha descrito que el ovomucoide, el mayor de los alérgenos de la clara de huevo, sigue manteniendo su poder después de ser calentado (60).
Las proteínas alimentarias se encuentran envueltas en matrices muy complejas. Además durante el cocinado interactúan con otros compuestos en los alimentos Por ejemplo, en el huevo se encuentra un elevado porcentaje de lípidos que pueden interactuar con las proteínas presentes. En el huevo se encuentra la fosfatidilcolina un fosfolípido de mucha importancia para el desarrollo normal de muchas células y regiones cerebrales (60). Por ello, se han llevado a cabo estudios para determinar la influencia en la digestibilidad y poder alergénico de las proteínas tratadas con fosfolipidos. Moreno y col., (2005a) realizaron un ensayo de digestibilidad de la α-lactoalbúmina con fosfatidilcolina y concluyeron que la digestibilidad gástrica in vitro con pepsina del complejo se ve protegida.
Conclusión
Una característica importante de un alérgeno es su capacidad de mantener cierta parte de su estructura a través del tracto digestivo. Por esta razón, es importante saber qué le ocurre a las proteínas alergénicas durante el proceso de la digestión. En principio se propuso la resistencia a la digestión con pepsina en SIF (Fluido Gástrico Simulado) como método para predecir el poder alergénico de proteínas alimentarias pero se sabe que ciertas proteínas alergénicas se digieren con facilidad en este medio. A pesar de esta contradicción este método sigue siendo aceptado como herramienta para predecir la capacidad alergénica de proteínas normales y transgénicas. Este método es sencillo y resulta fácil de estandarizar sus condiciones, es económico y reproducible.
Agradecimientos
Agradezco a la Comunidad de Madrid por el Contrato de Personal de Apoyo de Investigación y al Consejo Superior de Investigaciones Científicas por los medios proporcionados durante mi formación predoctoral.
Referencias
1. Bioquímica. Donald Voet and Judith G Voet (2006) Editorial: Médica Panamericana.
2. Pihlanto A, and Korhonen, H. (2003) Bioactive peptides and proteins. Advances in Food and Nutrition Research. Vol 47. DOI: 10.1016/S1043-4526(03)47004.
3. Touch V, Hayakawa S, Fukada K, Aratani Y and Sun Y (2003) Preparation antimicrobial reduced lysozyme compatible in Food Applications. Journal of Agriculture and Food Chemistry 53: 5154-5161.
4. Corzo-Martínez M, Soria AC, Belloque J, Villamiel M, Moreno FJ (2010) Effect of glycation on the gastrointestinal digestibility and immunoreactivity of bovine β-lactoglobulin. International Dairy Journal 20: 742-752.
5. Ramezani R, Esmailpour M, Aminlari M (2008) Effect of conjugation with glucosamine on the functional properties of lysozyme and casein. Journal of the Science of Food and Agriculture 88: 15: 2730-2737.
6. Foster RM, Kimber I, Dearman RJ (2013) Relationship between protein digestibility and allergenicity: Comparisons of pepsin and cathepsin. Toxicology 309: 30–38.
7. Sicherer SH and Sampson HA (2006) Food Allergy. Journal Allergy Clinical Immunology 117: 470-475.
8. Sampson HA, Sicherer SH and Birnbaum AH (2000) AGA technical review on the evaluation of gastrointestinal manifestations due to immunologic reactions to foods in infants and young children. Journal Pediatric Gastroenterology Nutrition 30: (suppl): S87-94.
9. Mine Y and Yang M (2008) Recent Advances in the Understanding of Egg Allergens: Basic, Industrial, and Clinical Perspectives. Journal of Agriculture and Food Chemistry 56: 4874-4900.
10. Renz H, Blümer N, Virna S, Sel S and Gran H (2006) The immunological basis of the hygiene hypothesis. En: Allergy and Asthma in Modern Society: A Scientific Approach. Chem. Immunol. Allergy. Ed. Crameri, R.; Karger. Basilea, Suiza 91: 30-48.
11. Johansson SGO, Bieber T, Friedman PS (2004) Revised nomenclature for allergy for global use: Report of the Rewie Committee of the world Allergy Organization. Journal of Allergy Clinical Immunology 113: 832-836.
12. Holgate ST, Polosa R (2008) Treatment strategies for allergy and asthma. Nature Reviews Immunology 8: 218-230.
13. Ebo D, Stevens W (2001) IgE- mediated Food Allergy. Acta Clinica Belgica 56:4: 234-247.
14. Taylor SL, Lehrer SB (1996) Principles and caracteristics of food allergens. Critical review in Food Science and Nutrition 36: S165-S186.
15. Wickham M, Faulks R, Mills C (2009) In vitro digestion methods for assessing the effect of food structure on allergen breakdown. Molecular Nutrition & Food Research 53:8:952-958.
16. Thomas K, Aalbers M, Bannon GA, Bartels M, Dearman RJ, Esdaile DJ, et al (2004) A multi-laboratory evaluation of a common in vitro pepsin digestion assay protocol used in assessing the safety of novel proteins. Regulatory Toxicology Pharmacology 39, 87-98.
17. Hochwallner H, Schulmeister U, Swoboda I, Spitzauer S, Valenta R (2014) Cow’s milk allergy: From allergens to new forms of diagnosis, therapy and prevention. Methods 66: 22–33.
18. Nielson SS (1988) Degradation of bean proteins by endogenous and exogenous proteasas-a review. Cereal Chemistry 65: 435-442.
19. Budd TW, Kuo CY, Cazin J and Yoo TJ (1983) Allergens of Altenaria: futher characterization of a basic allergen fraction. International Archives of Allergy Applications Immunology 71: 83-87.
20. Kawashima T, Taniai M, Usuai M, Ando S, Kurimoto M and Matuhasi T (1992) Antigenic analysis of Sugi basic protein by monoclonal antibodies: II. Detection of immunoreactive fragments in enzyme-cleaved Cry j 1. International Archives of Allergy Immunology 98: 118-126.
21. Lorusso JR, Moffat S, Ohman JL (1986) Immunologic and biochemical properties of the major mouse urinary allergen (Mus m 1). Journal of Allergy Clinical Immunology 78 (5), 928–937.
22. Astwood JD, Fuchs RL (1996) Allergenicity of foods derived from transgenic plants. Monogram Allergy 32, 105–120.
23. US Pharmacopoeia (1995) the National Formulary USP XXIII, NF XVIII, US Pharmacopoeia ConventionInc, Mack Printing Co, Easton PA p. 2053.
24. Besler M, Steinhart H, Paschke A (2001) Stability of food allergens and allergenicity of processed foods. Journal Chromatography B: Biomedical Sciences and Applications 756 (1-2), 207–228.
25. Burks AW, Sampson HA (1997) Anaphylaxis and food allergy. In: Metcalfe, D.D., Sampson, H.A., Simon, R.A. (Eds.), Food Allergy: Adverse Reactions to Foods and Food Additives. Blackwell Science, Cambridge, MA pp. 25–245.
26. Fu TJ, Abbott UR, Hatzons C (2002) Digestibility of food allergens and nonallergenic proteins in simulated gastric fluid and simulated intestinal fluid- A comparative study. Journal of Agriculture and Food Chemistry, 50: 7154-7160.
27. Kenna JG, Evans RM (2000) Digestibility of proteins in simulated gastric fluid. Toxicologist 54: 141.
28. Díaz-Perales A, Blanco C, Sánchez-Monge R, Varela J, Carrillo T, Salcedo G (2003) Analysis of avocado allergen (Prs a1) IgE-binding peptides generated by simulated gastric fluid digestion. Journal of Allergy Clinical Immunology 112: 1002-1007.
29. Herman RA, Woolhiser M, Ladics G, Schafer BW, Korjagin VA (2004) Digestion Efficiency of Allergens and Non-allergens in Simulated Gastric Fluid. MRID# 4638801. Washington, DC: U.S. Environmental Protection Agency.
30. Lee SK, Ion SH, Choi JH and Park SH (2005) Chestnut as food allergen: Identification of major allergens. Journal of Korean Medical Science 20: 573-578.
31. Murtagh GJ, Dumoulin M, Archer DB, Alcocer MJ (2002) Stability of recombinant 2 S albumin allergens in vitro. Biochemical Society Transactions 30:913–915.
32. Vieths S, Reindl J, Muller U, Hoffmann A, Haustein D (1999) Digestibility of peanut and hazelnut allergens investigated by a simple in vitro procedure. European Food Research Technology 209:379–388.
33. Yagami T, Haishima Y, Nakamura A, Osuna H, Ikezawa Z (2000) Digestibility of allergens extracted from natural rubber latex and vegetable foods. Journal of Allergy Clinical Immunology 106:752–762.
34. Bannon GA, Goodman RE, Leach JN, Rice E, Fuchs RL, Astwood JD (2002) Digestive stability in the context of assessing the potential allergenicity of food proteins. Comments Toxicology 8: 271–285.
35. Bannon G, Fu TJ, Kimber I, Hinton DM (2003) Protein digestibility and relevance to allergenicity. Environmental Health Perspectives111: 1122–1124.
36. Goodman RE, Hefle SL and Van Ree R (2005) Assessing genetically modified crops to minimize the risk of increased food allergy: a review. International Archives of Allergy Immunology 137: 153-166.
37. Mendelsohn M, Kough J, Vaituzis Z, Matthews K (2003) Are BT crops safe? Nature Biotechemical 21:1003–1009.
38. Metcalfe DD, Astwood JD, Townsend R, Sampson HA, Taylor SL, Fuchs RL (1996) Assessment of the allergenic potential of foods from genetically engineered crop plants. Critical Review Food Science and Nutrition 36 (S) 165–186.
39. FAO/WHO (2001). Evaluation of allergenicity of genetically modified foods. Report of a Joint FAO/WHO Expert Consultation on Allergenicity of Foods Derived from Biotechnology. January 22– 25. Rome, Italy.
40. Codex Alimentarius Commission (2003) Alinorm 03/34: Joint FAO/WHO Food Standard Programme, Codex Alimentarius Commission, Twenty-Fifth Session, Rome, Italy 30 June–5 July, 2003. Appendix III, Guideline for the conduct of food safety assessment of foods derived from recombinant-DNA plants and Appendix IV, Annex on the assessment of possible allergenicity, pp. 47–60.
41. US Pharmacopoeia (2000) the National Formulary. USP XXIV, NF XIX, US Pharmacopoeia Convention, Inc., Mack Printing Co, Easton, PA p. 2235.
42. Moreno FJ (2007) Gastrointestinal digestion of allergens: Effect on their allergenicity. Biomedicine and Pharmacotherapy 61: 50-60.
43. Moreno FJ, Mellon FA, Wickman MSJ, Bottrill AR and Mills ENC (2005a) Stabillity of the major allergen Brazil nut 2S albumin (Ber1) to physiologically relevant in vitro gastrointestinal digestion. FEBS Juornal 272: 341-352.
44. Moreno F J, Mackie AR, & Mills ECN (2005b) Phospholipid’s interactions protect the milk allergen alpha-lactalbumin from proteolysis during in vitro digestion. Journal of Agricultural and Food Chemistry 53: 9810–9816.
45. Ibrahim HR, Inazaki D, Abdou A, Aoki T, Kim M (2005) Processing of lysozyme at distinct loops by pepsin: A novel action for generating multiple antimicrobial peptide motifs in the newborn stomach. Biochimica et Biophysica Acta 1726: 102 –114.
46. De Ardila AH (2009) Fisiopatología de la enfermedad por reflujo gastroesofágico. Revista Colombiana de Gastroenterología 24:1: 87-94.
47. Polverino de Laureto P, Frare E, Gottardo R, Van Dael H and Fontana A (2002) Partly folded status of members of the lysozyme/lactalbumin superfamily: A comparative study by circular dichroism spectroscopy and limited proteolysis. Protein Science11: 2932-2946.
48. Mine Y, Ma FP and Lauriau S (2004) Antimicrobial peptides released by enzymatic hydrolysis of hen egg white lysozyme. Journal of Agriculture and Food Chemistry 58: 1088-1094.
49. Carrillo W, Lopez-Fandiño R, Belloque J, Molina E (2008) Immunogenic properties of hen egg White lysozyme digests. Allergy 68: 404-405.
50. Ofori-Anti AO, Ariyarathna H, Chen L, Pramod SN and Goodman RE (2008) Estalishing objective detection limits for pepsin digestion assay used in the assessment of genetically modified and foods. Regulatory Toxicology Pharmacology 52: 94-103.
51. Jiménez-Saiz R, Martos G, Carrillo W, López-Fandiño R, Molina E (2011) Susceptibility of lysozyme to in-vitro digestion and immunoreactivity of its digests. Food chemistry 127: 1719-1726.
52. Herman RA, Storer NP, GAO Y (2006) Digestion assays in allergenicity assessment of transgenic proteins. Environmental Health Perspective114: 1154–1157.
53. Ibrahim HR, Thomas U and Pellegrini A (2001) A helix-loop-helix peptide at the upper lip of the active site cleft of lysozyme confers potent antimicrobial activity with membrane permeabilization action. Journal of Biological Chemistry 276: 43767-43774.
54. Ibrahim HR, Higashiguchi S, Koketsu M, Juneja LR, Kim M, and Yamamoto T (1996) A structural phase of heat-denatured lysozyme with novel antimicrobial action. Journal of Agriculture and Food Chemistry 44: 1416-1423.
55. Fennema OR (1998) Food Chemistry. Ed. Marcel Dekker, Inc. 3ª Edi. pp. 321-429.
56. Jeanson S, Dupon D, Grattarol N and Rolet-Rópécaud O (1999) Caracterization of the Heat Treatment Undergone by Milk Using two Inhibition ELISAs for Quantification of Native and Heat Denatured a-Lactoalbumin. Journal of Agriculture and Food Chemistry 47: 2249-2254.
57. Dupon D, Rolet-Rópécaud O and Muller-Renaud S (2004) Determination of the Heat treatment Undergone by Milk by Following the Denaturation of a-Lactalbumin with a biosensor. Journal of Agriculture and Food Chemistry 52: 677-681.
58. Hernández-Ledesma B, Ramos M, Recio I, Amigo L (2006) Effect of beta-lactoglobulin hydrolysis with thermolysin under denaturing temperatures on the release of bioactive peptides. Journal of Chromatography A. 1116(1-2):31-37.
59. Mine Y and Yang M (2008) Recent Advances in the Understanding of Egg Allergens: Basic, Industrial, and Clinical Perspectives. Journal of Agriculture and Food Chemistry 56: 4874-4900.
|
Revista QuímicaViva Número 2, año 13, Agosto de 2014 quimicaviva@qb.fcen.uba.ar |