Petiveria alliacea L.: distintas condiciones experimentales en la elaboración de extractos con actividad antimicrobiana
Sandra Sariego Frómeta1, Jorge Erick Marin Morán2, Ania Ochoa Pacheco2, Yosvel Viera Tamayo3
1Departamento de Biología Agrícola. Facultad de Ciencias Agrícolas. Universidad de Granma, Km 17½ carretera a Manzanillo. Peralejo, Bayamo. Granma. Cuba. CP 85100.
2Departamento de Farmacia. Facultad de Ciencias Naturales. Universidad de Oriente. Santiago de Cuba
3Centro de Estudios de Biotecnología Vegetal. Facultad de Ciencias Agrícolas. Universidad de Granma
E-mail: ssariegof@udg.co.cu
Recibido 1 de Noviembre 2013- Reenviado 9 de Noviembre 2013-Aceptado 11 de Noviembre 2013
Resumen
La presente investigación comprende la revisión de dieciocho artículos científicos desarrollados en seis países distintos, relacionados con la actividad antimicrobiana de extractos de Petiveria alliacea L. Se realizó una tabla resumen detallada en la que se plasmaron las condiciones experimentales empleadas en estudios previos. Del análisis realizado se sugiere que futuras investigaciones en la planta pudieran encaminarse a reevaluar la efectividad de los extractos elaborados con hojas, tallos y raíces empleando material vegetal fresco, temperaturas que no excedan los 37°C durante la elaboración de los extractos y etanol al 70 o al 80%. Las diferencias obtenidas y los resultados negativos en los estudios publicados pudieran atribuirse a diversos factores entre los que se encuentran algunos vinculados con el material vegetal empleado y otros con las condiciones experimentales diseñadas en cada investigación.
Palabras clave: Petiveria alliacea, extractos vegetales, actividad antimicrobiana.
Petiveria alliacea L.: various experimental conditions in the extracts elaboration with antimicrobial activity
Abstract
The present investigation comprises the revision of eighteen scientific articles carried out in six different countries. The articles are related with the antimicrobial activity of Petiveria alliacea L. extracts. A detailed table was created in a summary of the experimental conditions used in previous studies was presented. Departing from the developed analysis, it is suggested that future investigations could be focused on the reevaluation of the effectiveness of extracts elaborated through leaves, stems and roots using fresh vegetal material, temperatures below 37°C during their elaboration and ethanol at 70 or 80%. The differences and negative results in the studies that were published could be attributed to different factors among which some related with the vegetal material used and others related with the experimental conditions designed in each investigation.
Key words: Petiveria alliacea, vegetal extracts, antimicrobial activity.
Introducción
Las enfermedades infecciosas constituyen una de las principales causas de morbilidad y mortalidad a nivel mundial. El uso indiscriminado de antibióticos sintéticos y comerciales ha empeorado el panorama, pues muchos de los microorganismos causantes de enfermedades comunes, que podían ser tratados fácilmente, han adquirido gran resistencia. Cuantiosas son las investigaciones enfocadas en la búsqueda de nuevos compuestos bioactivos a partir de fuentes naturales, dentro de estas, un gran número han sido dirigidas hacia la evaluación de actividades antimicrobianas en extractos y aceites esenciales de plantas medicinales y aromáticas. Las plantas ofrecen grandes posibilidades en el descubrimiento de nuevos fármacos, ya que de ellas se han aislado alrededor de 12 000 metabolitos secundarios, de los cuales un por ciento significativo presentan actividad antimicrobiana1. Petiveria alliacea L., es una planta perenne de la familia Phytolaccaceae, usualmente conocida como anamú en los países de habla hispana2 y originaria del sur de Estados Unidos, de Norteamérica y México. Esta especie tiene una distribución geográfica muy amplia, desde la Florida, en toda América Central, desde Colombia hasta la Argentina y en África3. En la figura 1 se muestra una fotografía de la planta y de su raíz.
Petiveria alliacea

Raíz de Petiveria alliacea

Lo anterior, llama la
atención acerca de que en un área geográfica relativamente extensa se
conozca la planta con distintos nombres comunes, pero con propiedades
curativas que a pesar de su diversidad, revelan una cierta consistencia
entre las diferentes regiones. Podría preguntarse: ¿Cómo fue posible
difundir el conocimiento y las aplicaciones de las propiedades etnobotánicas
de esta planta entre tantas y distintas etnias con diferentes lenguas y
religiones?4 La actividad antimicrobiana de esta especie es una de las
propiedades etnobotánicas más difundidas por países y regiones, razón por la
cual ha sido utilizada con fines medicinales y ha sido cultivada como
“planta de la suerte” a la cual se le atribuyen propiedades mágicas en la
preservación de la salud humana, alejando los males y las hechicerías3. De
manera general, en algunos países entre los que se encuentran Argentina,
Cuba, Brasil, Guatemala, Haití, México, Puerto Rico y Venezuela se le
atribuyen a esta planta propiedades etnobotánicas para el tratamiento de
infecciones cutáneas, urinarias, venéreas y del tracto respiratorio. Se le
han otorgado además, propiedades depurativas, antifúngicas y antisépticas5.
Lo anterior, ha sugerido la realización de estudios in vitro por
investigadores de estos países para comprobar científicamente su posible
efecto antimicrobiano. No obstante, las investigaciones desarrolladas han
evidenciado discrepancias en los resultados publicados entre autores. Podría
pensarse en la alternativa de reevaluar la actividad antimicrobiana de esta
planta frente a los microorganismos seleccionados en estudios anteriores,
modificando las condiciones experimentales durante la preparación de los
extractos. En la presente investigación pretendemos analizar las condiciones
experimentales empleadas en estudios previos relacionados con la evaluación
de la actividad antimicrobiana de esta planta y solucionar una interrogante
cuya respuesta basada en los resultados precedentes resulta muy
contradictoria en la actualidad.
Materiales y Métodos
Se revisaron un total de 18 artículos científicos (procedentes de 6 países distintos) referentes a la actividad antimicrobiana de Petiveria alliacea, aunque no desestimamos la posibilidad de la existencia de otros artículos que aborden la temática analizada. Se elaboró una tabla resumen en la que se clasificó la información atendiendo a la parte de la planta empleada en cada estudio, especificándose en todos los casos si se realizó o no el secado del material vegetal. Se detalló el país de procedencia de cada investigación, la actividad biológica probada, los tipos de extractos evaluados, las pruebas microbiológicas realizadas, y en los casos en los que las investigaciones lo declararan las dosis empleadas y los parámetros asumidos para inferir resultados positivos considerando las formulaciones farmacéuticas activas frente a los microorganismos. Se especificaron las especies de microorganismos analizadas en cada artículo, detallando en cada caso si las cepas empleadas eran o no de referencia internacional. En la tabla resumen se plasmaron además, los resultados de las evaluaciones antimicrobianas y los autores y el año de cada investigación.
Resultados y Discusión
Consideraciones generales
La artículos revisados
indican que han sido diversas las condiciones experimentales probadas en la
evaluación de la actividad antimicrobiana de Petiveria alliacea. Estos
estudios abordan la evaluación antimicrobiana de diversas formulaciones
farmacéuticas entre las que se encuentran decocciones, extractos fluidos,
extractos blandos y tinturas. De manera general, se han empleado una gran
variedad de solventes en la preparación de los extractos, entre los que se
encuentran el agua, etanol a diferentes por cientos (30, 50, 60, 70, 80, 95
y 100%), metanol, hexano, acetona, diclorometano, alcohol isopropílico, y
mezclas de solventes como diclorometano-metanol en la proporción 2:1. Los
solventes de mayor preferencia en la elaboración de los extractos han sido
el agua y el etanol. Resulta totalmente lógico que se centraran los estudios
en extractos elaborados con etanol por ser un solvente barato, abundante y
de baja toxicidad. Los resultados prácticos obtenidos por diferentes
investigadores corroboran que el etanol es el solvente más promisorio para
extraer la mayoría de los metabolitos secundarios6. En la realización de los
extractos se han utilizado las hojas, los tallos y las raíces de esta
planta, resultando las hojas el material vegetal de preferencia. Ochoa et
al. (2013)7 plantearon la necesidad de comparar la actividad antimicrobiana
de extractos elaborados a partir de hojas secas y hojas frescas,
considerando oportuno evaluar además el efecto de la concentración de los
extractos y el tamaño de partícula del material vegetal. Los estudios de
actividad antimicrobiana de esta planta se han desarrollado fundamentalmente
en Cuba y Guatemala, encontrándose que el 50% de los artículos revisados
fueron publicados en la década del noventa. La actividad antibacteriana del
anamú ha sido probada al menos frente a 30 especies pertenecientes a 17
géneros distintos. El 86,7% de las especies de bacterias evaluadas de manera
general en los artículos pueden teñirse con la tinción de Gram, de las
cuales un 50% en cada caso, se clasifican como gram-positivas y
gram-negativas. Se excluyen de esta clasificación, cuatro especies del
género Mycobacterium pues una vez teñidas con colorantes básicos no se
pueden decolorar en etanol independientemente del tratamiento con yodo, y
que por tanto, se tiñen con las tinciones de Ziehl-Neelsen y auramina. En
los artículos consultados, algunos autores utilizan indistintamente los
nombres científicos Salmonella typhosa y Salmonella typhi. Es válido
aclarar, que estos términos han sido atribuidos a la bacteria considerada el
agente etiológico de la fiebre tifoidea8 y por tanto, fueron analizados como
una misma especie; aunque reportamos en la tabla resumen los nombres
específicos utilizados originalmente por los autores de cada artículo. La
actividad antifúngica de extractos vegetales del anamú ha sido probada al
menos, frente a 16 especies de hongos pertenecientes a 9 géneros diferentes.
Se ha evaluado la actividad antifúngica frente a tres especies del género
Aspergillus, consideradas importantes agentes etiológicos de la
aspergilosis. La posible efectividad de los metabolitos secundarios
presentes en los extractos vegetales de esta planta se ha determinado frente
cinco especies de hongos dermatófitos íntimamente relacionados
(pertenecientes a los géneros Epidermophyton, Microsporum y Trichophyton) y
causantes de dermatofitosis (usualmente conocidas como tiñas). Cryptococcus
neoformans, considerada la especie más importante de este género desde el
punto de vista médico y conocida por causar una forma severa de meningitis y
meningo-encefalitis también ha sido evaluada en la actividad antifúngica de
esta planta. Otras especies de hongos como Neurospora crassa, dos especies
del género Cladosporium, tres del género Candida y cepas de referencia de la
levadura Saccharomyces cerevisiae han sido incluidas en estos estudios in
vitro.
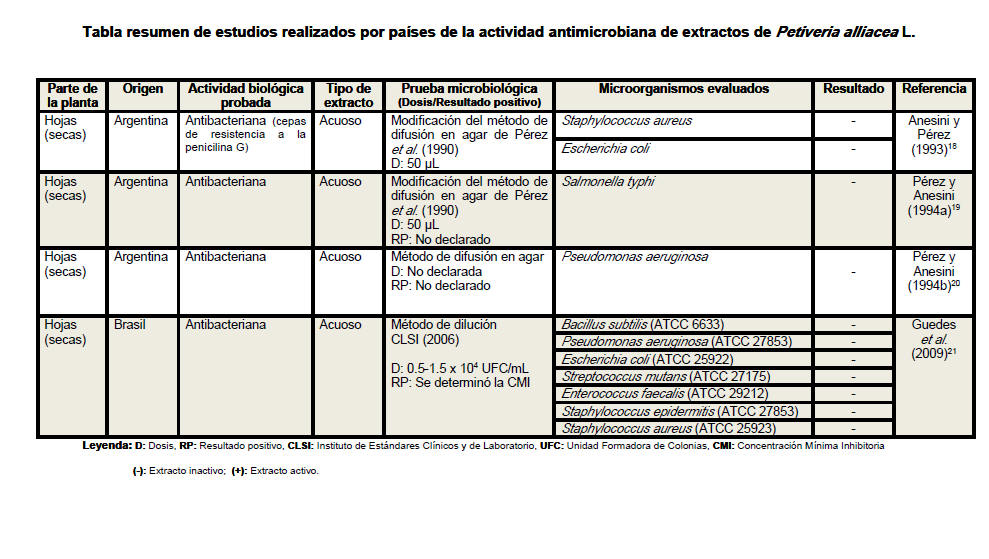
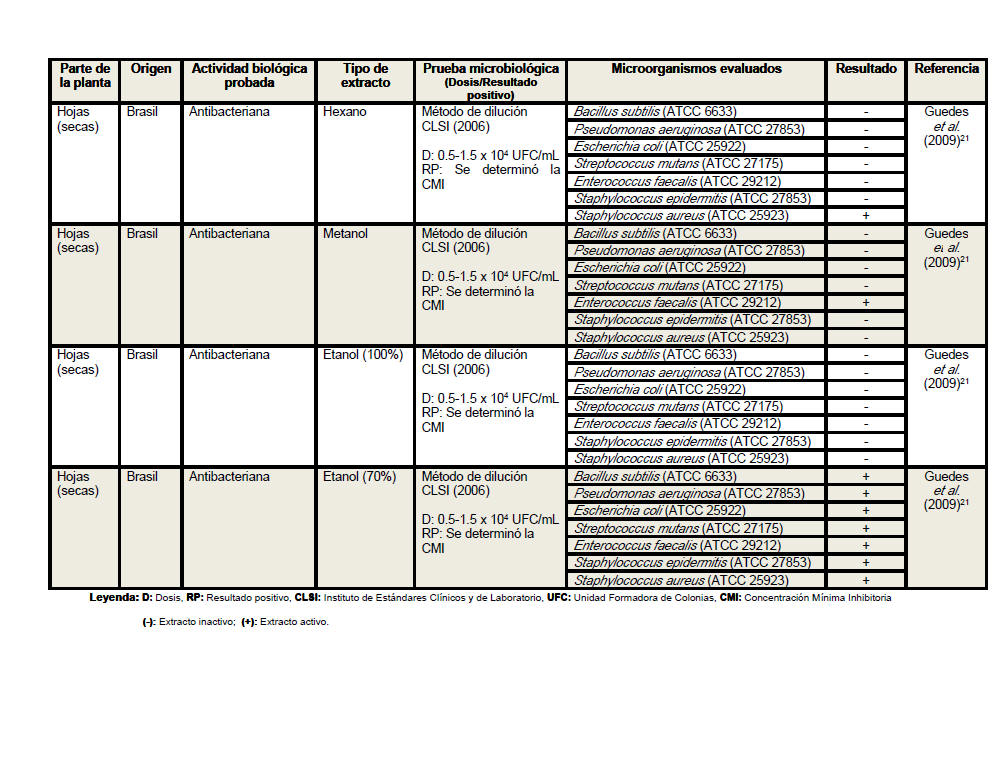
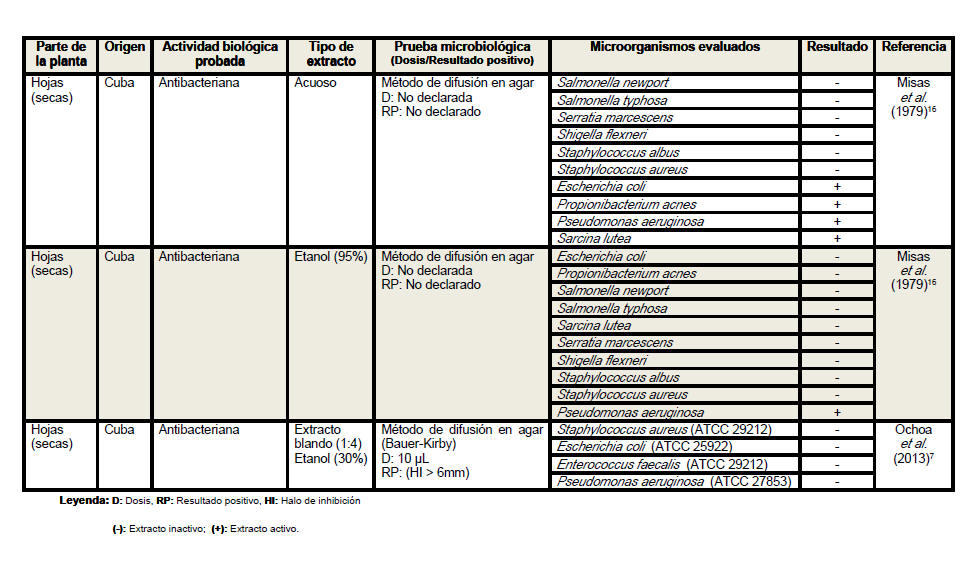
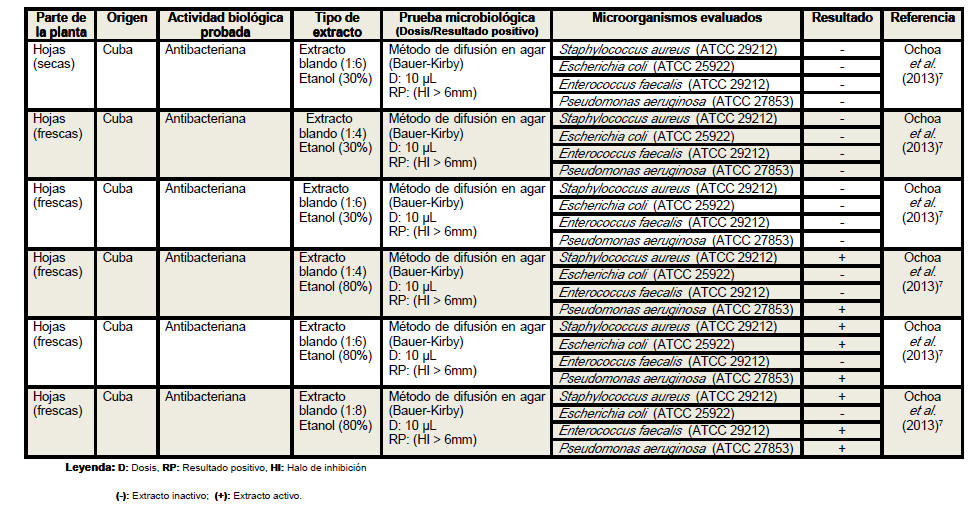
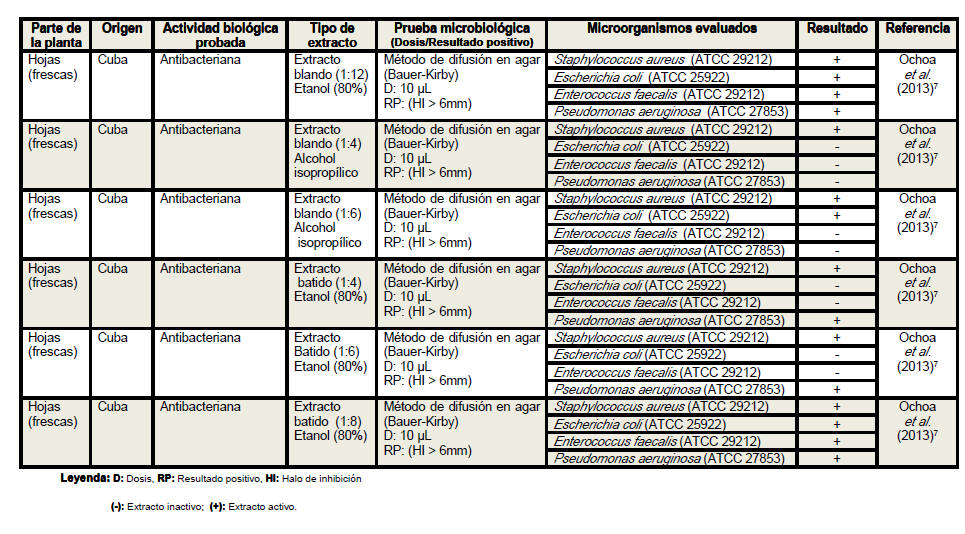
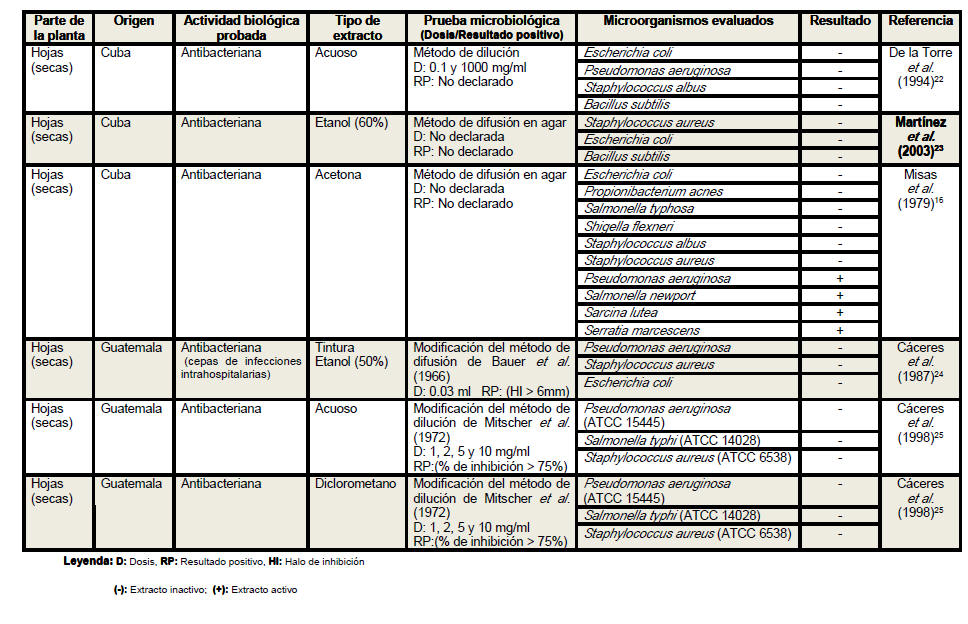
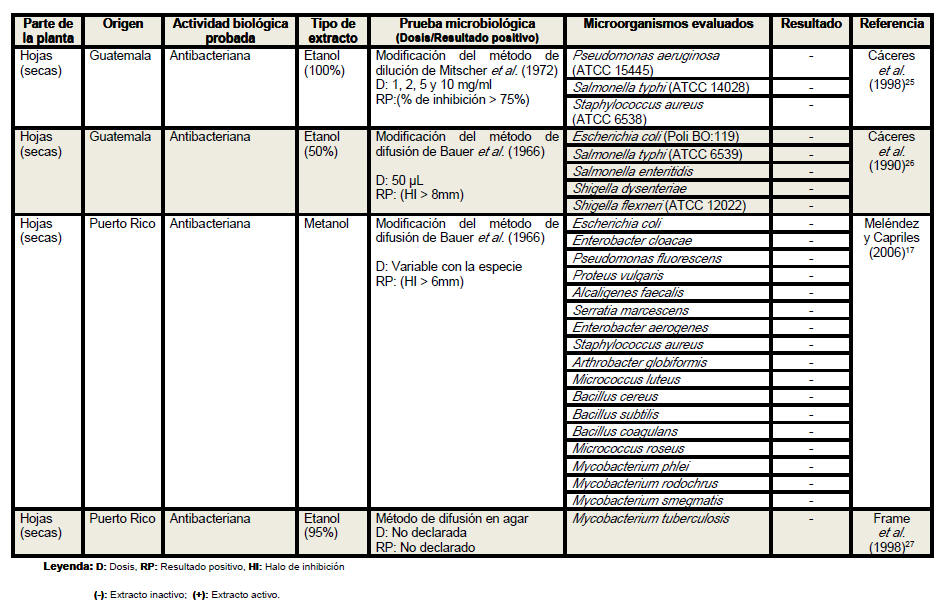
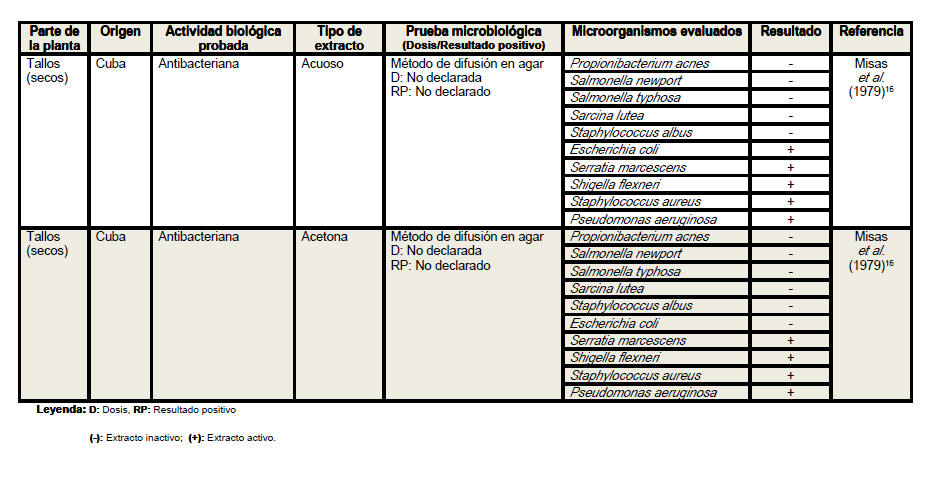
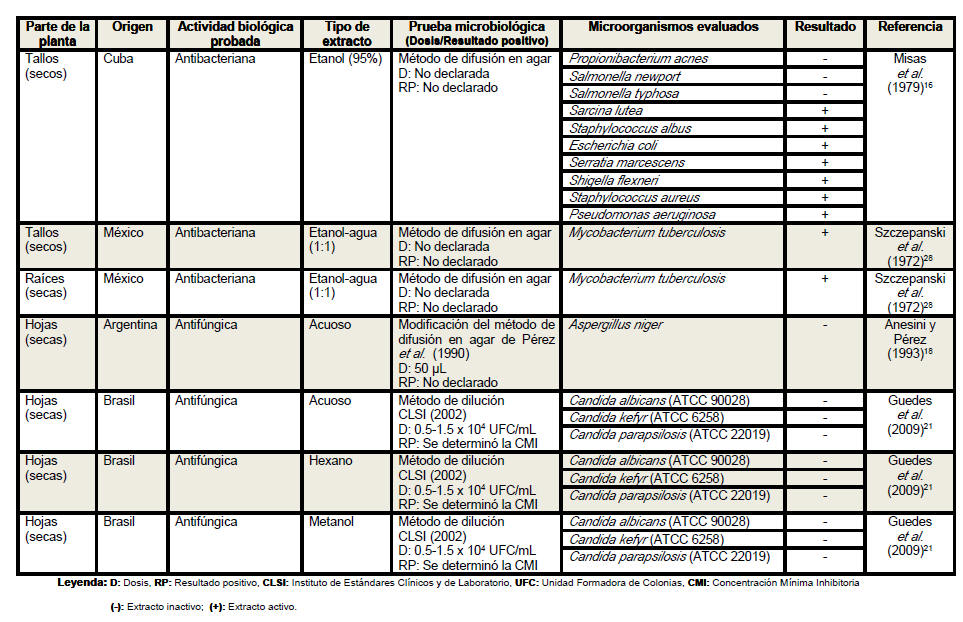
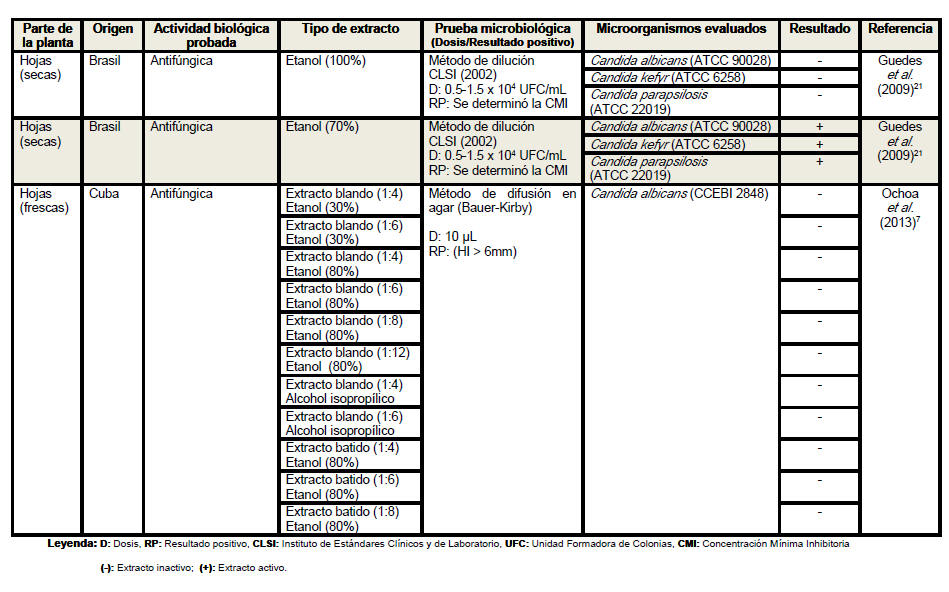
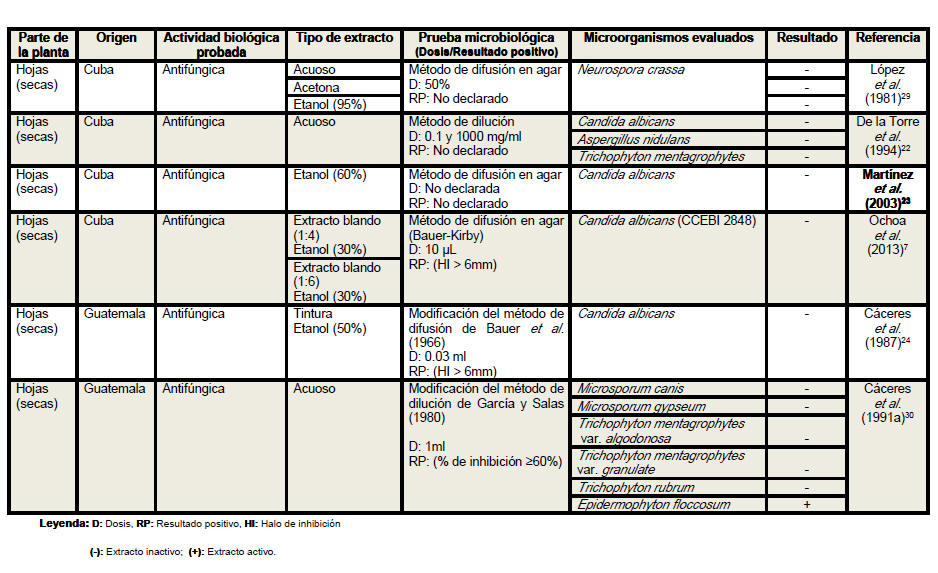
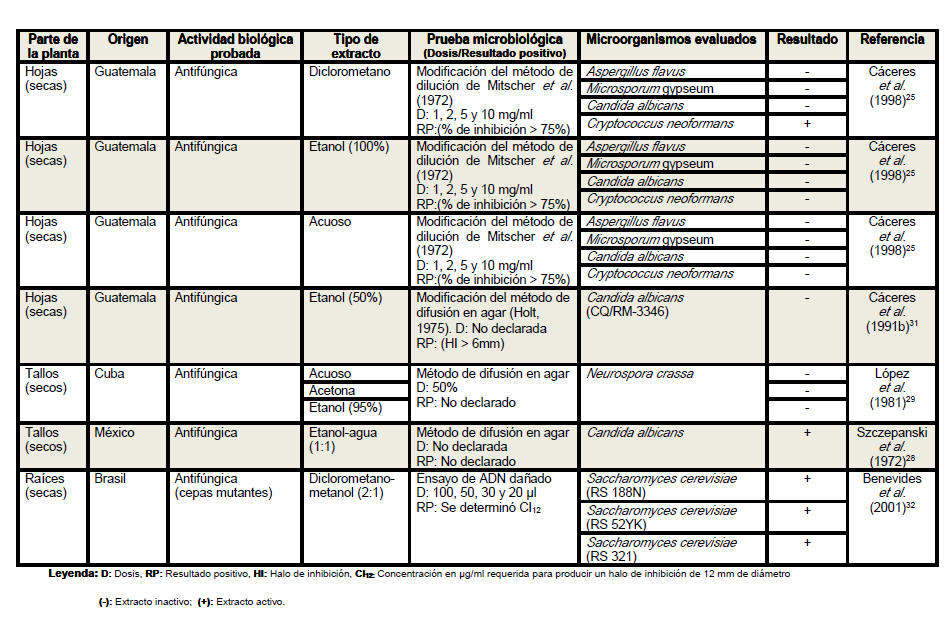
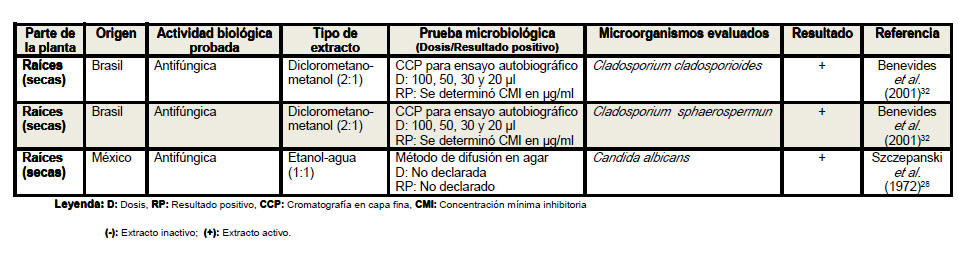
Del análisis de la tabla resumen es posible
apreciar que las hojas son el órgano vegetativo de la planta más empleado en
la elaboración de los extractos, independientemente de que los escasos
estudios realizados con tallos y raíces evidencian resultados más
alentadores. Se conoce que los precursores de los compuestos con actividad
antimicrobiana de Petiveria alliacea son algunos aminoácidos que contienen
azufre. En las raíces de esta planta se han aislado cinco aminoácidos en
cantidades variables entre los que se encuentran la S-metil-cisteína,
S-etil-cisteína y S-propil-cisteína. Estos tres aminoácidos han sido
encontrados en cantidades muy bajas en las raíces de esta planta (< 3μg/g de
peso fresco)9. Sin embargo, las concentraciones reportadas en este órgano de
la S-(2-hidroxietil) cisteína (0,2 mg/g de peso fresco)9 y de la
S-bencil-cisteína (<10μg/g de peso fresco) 10 indican que a partir de estos
dos aminoácidos, se obtienen otros dos compuestos conocidos trivialmente
como 6-hidroxietina y petiverina que constituyen los principales precursores
de los metabolitos secundarios a los que se le atribuye la actividad
antimicrobiana. Kubec y Musah (2001)10 aislaron dos diasteroisómeros del
sulfóxido de S-bencil-cisteína (petiverina A y petiverina B) y plantearon
que el contenido total de petiverinas en las hojas, tallos y raíces de esta
planta es muy variable, siendo de 0,07, 0,29 y 2,97 mg/g de peso fresco,
respectivamente. El elevado contenido de petiverinas en las raíces (42 veces
superior que el reportado en las hojas y 10 veces superior al reportado en
los tallos) de esta especie, sugiere la utilización de las mismas como el
principal órgano de elección durante la elaboración de los extractos. No
obstante, independientemente de que el anamú es una planta perenne y de
amplia distribución, su explotación a gran escala mediante la utilización de
las raíces podría afectar la supervivencia de la especie. En los estudios
anteriores, el principal criterio de elección de las hojas como material de
partida para la elaboración de los extractos podría atribuirse a que además
de ser el órgano más biodisponible del reino vegetal, su utilización no
implica la destrucción total de la planta lo que sugiere el uso sostenible
de la especie. Es posible asumir, que el contenido de petiverinas varía
entre plantas que crecen en localidades diferentes teniendo en cuenta que su
formación depende de diversos factores entre los que se encuentran la
composición del suelo, el suministro de azufre y nitrógeno, el clima y la
fecha de colecta10.
¿Es necesario secar el material vegetal?
Temperaturas a utilizar en la preparación de los extractos
El sulfóxido de cisteína liasa es una enzima considerada la primera
allinasa heteromérica, detectada y purificada de las raíces de Petiveria
alliacea11. Esta enzima es compartimentalizada en las vacuolas de las
células, mientras su sustrato son los Cis sulfóxidos de cisteína
S-sustituidos que se localizan en el citoplasma12. Al ocurrir la rotura de
los tejidos, la enzima reacciona esencialmente con las petiverinas para
producir ácidos sulfínicos y el ácido α-aminoacrílico, que son
intermediarios efímeros cuya formación no se puede rastrear fácilmente. Los
ácidos sulfínicos entre los que se encuentran el ácido fenilmetanosulfínico
(PMSA) rápida y espontáneamente se condensan con pérdida de agua para
producir los correspondientes tiosulfinatos, de los cuales el más abundante
en el anamú es el S-bencil-fenilmetanotiosulfinato, también conocido como
petivericina. El ácido α-aminoacrílico subsiguientemente se descompone en
piruvato, que es el producto estable formado en estas reacciones. De este
modo, la cinética de las reacciones de las allinasas se determina
monitoreando la formación de tiosulfinatos o piruvato. El PMSA formado puede
ser interceptado posteriormente por la enzima factor lacrimógeno sintasa
(LFS) y convertido en el factor lacrimógeno (PMTSO) conocido comúnmente como
sulfino. Las concentraciones relativas de petivericina y PMTSO en los
extractos varían en función de las proporciones en las que se encuentren las
enzimas LFS y las allinasas. Estudios in vitro han demostrado que si la
concentración de la enzima LFS es cinco veces mayor a la de las allinasas se
obtienen como resultado de esta reacción el PMTSO, sus productos de
descomposición, y benzaldehído. Si la concentración de las allinasas es al
menos 1,2 veces mayor con relación a la del LFS se obtienen cantidades
sustanciales de PMTSO y de petivericinas13. Kim et al. (2006)14 plantearon
que las discrepancias y la ausencia de actividad antimicrobiana de esta
planta en los estudios precedentes podían ser el resultado de diferentes
procedimientos empleados durante la preparación de las muestras. Concluyeron
además, que la inactivación de enzimas por el secado del material vegetal
y/o la aplicación de calor durante la preparación de los extractos podría
interferir en la formación efectiva del sulfino, los tiosulfinatos, y por
consiguiente de otros compuestos activos antimicrobianos como los
trisulfuros. Se ha demostrado que la actividad del sulfóxido de cisteína
liasa se incrementa con el aumento de la temperatura en un rango de 4 a
52°C. A 67°C la actividad de esta enzima disminuye precipitadamente y se
desnaturaliza a 84°C. Empleando como sustrato a las petiverinas la actividad
de esta enzima mostró un 80% de actividad a 37 °C y un 100% a 52 °C11. La
teoría más reciente que intenta explicar las contradicciones existentes en
los estudios de actividad antimicrobiana de esta planta se basa en el hecho
de que un exceso de la enzima LFS con relación a la allinasa puede disminuir
de forma efectiva la formación de tiosulfinatos. En tales casos es la
formación del sulfino lacrimógeno (PMTSO) en lugar de los tiosulfinatos
quien sirve como evidencia de la presencia de las allinasas debido a que las
allinasas proveen el ácido sulfínico (PMSA), que es el sustrato en el que
actúan las enzimas LFS para producir sulfino13. Se conoce que el sulfino y
los tiosulfinatos son compuestos termolábiles que sufren reacciones
subsecuentes particularmente cuando son sometidos a calentamiento dando
lugar fundamentalmente a diversos sulfuros, estilbenos, benzaldehído y otros
productos secundarios de descomposición, en su mayoría, carentes de
actividad antimicrobiana14. Las temperaturas empleadas en el secado del
material vegetal y durante la elaboración de los extractos podrían ser las
variables más significativas a tener en cuenta en los estudios de actividad
antimicrobiana de esta planta. Se sugiere la utilización de material vegetal
fresco y temperaturas que no excedan los 37°C durante la elaboración de los
extractos, aún cuando se conoce que las allinasas logran un 100% de
actividad catalítica a 52°C. Se trata de lograr el equilibrio entre la
actividad catalítica de la allinasa y la preservación del sulfino y los
tiosulfinatos, cuyas concentraciones elevadas en los extractos garantizan la
efectividad de la actividad antimicrobiana de esta planta. Esta actividad
atribuida esencialmente a los tiosulfinatos se debe a que estos compuestos
reaccionan con grupos tioles de proteínas celulares de los microorganismos
dando lugar esencialmente a disulfuros mixtos que inhiben complejos
enzimáticos, la transformación de proteínas, la síntesis de lípidos y de
ARN15. En el reino Plantae, existen bien definidas dos estrategias
defensivas. El anamú pertenece a los niveles evolutivos bajos (Subclase
Cariophylidae) y basa su sistema defensivo contra patógenos en la síntesis y
acumulación de sustancias antimicrobianas, las cuales estarán listas para
ser empleadas cuando ocurra el ataque a la planta. Este sistema defensivo se
conoce como “defensa cuantitativa o defensa estática”, pues estos productos
se concentran en cada uno de los órganos a defender. Para lograr esta
bioacumulación, las especies pertenecientes a estos niveles taxonómicos,
necesitan dedicar cantidades importantes de energía y precursores que le
permitan mantener éstos altos niveles de antimicrobianos en la planta.
Solventes de elección y actividad antimicrobiana de los extractos
De la revisión realizada es posible apreciar que los extractos de las
hojas han mostrado actividad frente al 36,7% de las bacterias evaluadas en
estudios antimicrobianos; presentando una mayor efectividad ante las
gram-positivas (63,6%). Las bacterias más susceptibles a los extractos de
las hojas han sido: Staphylococcus aureus, Pseudomonas aeruginosa,
Escherichia coli y Enterococcus faecalis. Una observación interesante es que
los extractos de los tallos han mostrado actividad frente al 72.7% de las
bacterias evaluadas en estudios antimicrobianos. Los extractos empleados se
han realizado con tres solventes diferentes entre los que se encuentran el
agua, la acetona y el etanol (al 95% o diluido en agua en la proporción
1:1). De estos solventes, el etanol al 95% resultó activo según Misas et al.
(1979)16 frente al 70% de las bacterias evaluadas. Lo anterior, indica que
se logra una mayor extracción de metabolitos antimicrobianos en los tallos
con respecto a las hojas, en las que solo se ha obtenido actividad en una de
once bacterias, con este solvente al por ciento analizado. Las bacterias más
susceptibles a los extractos de los tallos han sido: Staphylococcus aureus,
Pseudomonas aeruginosa, Shigella flexneri y Serratia marcescens. Se encontró
y revisó un solo artículo de actividad antibacteriana de los extractos de
las raíces que fue activo frente Mycobacterium tuberculosis (la única
bacteria analizada) y elaborado con agua y etanol en la proporción 1:1. Kim
et al. (2006)14 demostraron la actividad antibacteriana de ocho compuestos
sulfurados puros aislados de extractos de las raíces de anamú, los cuales
fueron activos frente a nueve especies de bacterias y resultaron inactivos a
Pseudomonas aeruginosa. El índice de polaridad de los solventes es un factor
importante a tener en cuenta durante la elaboración de los extractos. Los
extractos en acetona de hojas y tallos de esta planta han mostrado actividad
frente a un 40% de las bacterias evaluadas en estudios previos. Resulta
llamativo que extractos de las hojas elaborados con metanol, solvente con
igual índice de polaridad que la acetona (5.1) resultaron inactivos frente a
las 17 especies de bacterias evaluadas por Meléndez y Capriles (2006)17. Los
resultados negativos obtenidos por estos autores pudieran atribuirse al
secado del material vegetal realizado en estufa durante dos días
consecutivos a 65°C. De la revisión realizada es posible concluir que
Staphylococcus aureus y Pseudomonas aeruginosa han sido las especies de
bacterias más susceptibles a los extractos de esta planta. La actividad
antifúngica de extractos de las hojas, tallos y raíces de Petiveria alliacea
se ha evaluado frente a trece, dos y cuatro especies, respectivamente. Los
extractos de las hojas han mostrado actividad frente a cinco especies de
hongos, de ellos Epidermophyton floccosum resultó susceptible al extracto
acuoso y Cryptococcus neoformans fue sensible al extracto en diclorometano.
Se han utilizado una gran variedad de solventes en la determinación de la
actividad antifúngica de extractos de las hojas de anamú frente a Candida
albicans, solo el etanol al 70% ha mostrado efectividad frente a esta y
otras dos especies del mismo género. Extractos de tallos y raíces en una
mezcla de etanol y agua en la proporción 1:1 resultaron activos frente a
este importante patógeno humano. De manera general, los extractos elaborados
con etanol al 70 y al 80% han logrado una elevada efectividad frente a las
especies de bacterias y de hongos evaluadas en estudios de actividad
antimicrobiana de esta planta, lo que sugiere que con la utilización de este
solvente a estas concentraciones se incrementa su poder difusivo en las
células facilitándose una mayor extracción de metabolitos bioactivos. El
etanol a estas concentraciones presenta un índice de polaridad intermedio,
lo que corrobora que la utilización de solventes relativamente polares no
afecta la extracción de los tiosulfinatos, impidiendo la formación de sus
respectivos productos de descomposición14. Se ha demostrado además, que
batir el material vegetal fresco con la finalidad de disminuir su tamaño de
partícula favorece el incremento en los extractos de células lisadas por
destrucción mecánica de paredes y membranas celulares. Lo anterior,
justifica una mayor extracción de metabolitos durante la maceración del
material vegetal, los cuales se mezclarán directamente con el solvente una
vez destruidas las células implicando una reducción del proceso difusivo de
extracción como consecuencia del incremento de procesos cinéticos.
Métodos empleados en la evaluación de la actividad antimicrobiana de los
extractos de Petiveria alliacea
De manera general, los estudios de actividad antimicrobiana de Petiveria
alliacea se han realizado con los métodos de difusión en agar (72,2%). Esta
técnica es la más empleada en los estudios de susceptibilidad de los
microorganismos, ya que es posible evaluar una gran cantidad de antibióticos
en un corto período de tiempo. No obstante, estos métodos tienen varias
limitaciones como son: densidad del inóculo, temperatura de incubación,
tiempo de la incubación, tamaño de la placa, espesor y composición del
medio. Los artículos publicados indican que las concentraciones de los
extractos empleadas en estos estudios han sido muy variables. En este
sentido, es válido aclarar que en la actualidad no existe una organización o
institución que legisle o estandarice las concentraciones de extractos
vegetales a emplear, por tanto, la selección de las concentraciones a
evaluar es arbitraria aunque deben tenerse en cuenta los niveles de
toxicidad de los extractos frente a los modelos biológicos a los que esté
dirigida su aplicación. En términos de investigaciones científicas el método
de dilución es más sensible y revela datos cuantitativos, pero resulta de
engorrosa labor y se hace difícil evaluar una gran cantidad de antibióticos
al mismo tiempo.
Conclusiones
La actividad antimicrobiana de extractos de Petiveria alliacea se debe
probablemente, al sinergismo entre varios compuestos químicos presentes en
los mismos, de los cuales, los derivados sulfurados del metabolismo
secundario de esta planta juegan un rol esencial. Las diferencias obtenidas
y los resultados negativos reflejados en los estudios publicados pudieran
atribuirse a diversos factores entre los que se encuentran algunos
vinculados con el material vegetal empleado y otros con las condiciones
experimentales diseñadas en cada investigación. Las concentraciones
endógenas de petiverinas y las proporciones enzimáticas de allinasa y de LFS
en el material vegetal son factores aleatorios que influyen decisivamente en
los resultados. Sin embargo, el órgano vegetativo a utilizar, la realización
o no del secado del material vegetal, la temperatura empleada en la
elaboración y concentración de los extractos, así como la selección de los
solventes adecuados pudieran ser diseñados previamente para alcanzar
resultados positivos. Se sugiere que la elección de las raíces como material
vegetal en la elaboración de los extractos se valore en dependencia de la
escala de cada investigación, siempre y cuando implique el uso sostenible de
la especie. Los estudios futuros de actividad antimicrobiana de esta planta
pudieran encaminarse a reevaluar la efectividad de los extractos elaborados
con los órganos vegetativos comúnmente empleados teniendo en cuenta otras
condiciones experimentales para las que se sugiere emplear material vegetal
fresco, la utilización de temperaturas que no excedan los 37°C durante la
elaboración de los extractos y de etanol al 70 o al 80%.
Referencias
1 - Shaheen SZ, Vasu KB, Charya MS, 2009. Antimicrobial activity of the
fruit extracts of Coccinia indica. African Journal of Biotechnology 8 (24):
7073-7076.
2.- Duarte MR, Lopes JF, 2005. Leaf and stem morphoanatomy of Petiveria
alliacea. Fitoterapia 76: 599– 607.
3.- Schroeder MA, Burgos AM, 2011. Concentraciones foliares y dinámica
estacional de nutrientes en Petiveria alliacea L. Revista Cubana de Plantas
Medicinales 16(4):374-389.
4.- Ferrer JI, 2007. Principales referencias etnomédicas sobre el anamú
(Petiveria alliacea Linn) y principios activos encontrados en la planta. Un
acercamiento al tema. Revista CENIC Ciencias Biológicas 38(1): 27-30.
5.-Vilchez M, 2007. Estudio preliminar del Anamú (Petiveria alliacea) en la
reducción del puerperio bovino en la finca El Rosario, municipio de la
Trinidad, departamento de Estelí. Tesis de Licenciatura. Universidad
Nacional Agraria. Managua-Nicaragua.
6.- Cabrera D, Sánchez Y, Espinosa A, Almeida M, 2011. Tamizaje fitoquímico
y actividad antibacteriana de extractos de Bryophyllum pinnata. QuímicaViva.
7.- Ochoa A, Marín J, González Z, Hidalgo A, Mujawimana R, Tamayo K, Sariego
S, 2013. In vitro antimicrobial activity of total extracts of the leaves of
Petiveria alliacea L. (Anamu). Brazilian Journal of Pharmaceutical Sciences
49 (2): 241-250.
8. - Breed RS, 1955. Salmonella typhosa versus Salmonella typhi.
International Bulletin of bacteriological 5(4): 165-168.
9. Kubec R, Kim S, Musah R, 2002. S-Substituted cysteine derivatives and
thiosulfinate formation in Petiveria alliacea-part II. Phytochemistry 61:
675-680.
10. Kubec R, Musah RA, 2001. Cysteine sulfoxide derivatives in Petiveria
alliacea. Phytochemistry 58: 981-985.
11. Musah RA, He Q, Kubec R, Jadhav A, 2009. Studies of a Novel Cysteine
Sulfoxide Lyase from Petiveria alliacea: The First Heteromeric Alliinase.
Plant Physiology 151: 1304-1316.
12. Lancaster JE, Collin HA, 1981. Presence of alliinase in isolated
vacuoles and alkyl cysteine sulphoxides in the cytoplasm of bulbs in onion
(Allium cepa). Plant Sci Lett 22:169–176.
13. - Musah RA, He Q, Kubec R, 2009. Discovery and Characterization of a
Novel Lachrymatory Factor Synthase in Petiveria alliacea and Its Influence
on Alliinase-Mediated Formation of Biologically Active Organosulfur
Compounds. Physiology 151: 1294–1303.
14. Kim S, Kubec R, Musah RA, 2006. Antibacterial and antifungal activity of
sulfur-containing compounds from Petiveria alliacea L. Journal of
Ethnopharmacology 104: 188-192.
15. Ankri S, Mirelman D, 1999. Review Antimicrobial properties of allicin
from garlic. Microbes and Infection 2: 125−129.
16.- Misas C, Hernández N, Abraham A, 1979. The biological assessment of
Cuban plants.III. Revista Cubana de Medicina Tropical 31(1): 21-27.
17.- Meléndez PA, Capriles VA, 2006. Antibacterial properties of tropical
plants from Puerto Rico. Phytomedicine 13: 272–276.
18.- Anesini C, Pérez C, 1993. Screening of plants used in Argentine folk
medicine for antimicrobial activity. Journal of Ethnopharmacology 39:
119-128.
19. - Pérez C, Anesini C, 1994. In vitro antibacterial activity of Argentine
folk medicinal plants against Salmonella typhi. Journal of Ethnopharmacology
44: 41-46.
20.- Pérez C, Anesini C, 1994. Inhibition of Pseudomonas aeruginosa by
Argentinean medicinal plants. Fitoterapia 65 (2): 169-172.
21.- Guedes R, Nogueira N, Almeida A, Souza C, Oliveira W, 2009. Atividade
antimicrobiana de extratos brutos de Petiveria alliacea L. Latin American
Journal of Pharmacy 28 (4): 520-524.
22.- De la Torre R, Martínez M, Fernández M, Morón F, 1994. Caracterización
farmacológica y toxicológica de Petiveria alliacea L. (Anamú). I Evaluación
de la actividad antimicrobiana. Revista Cubana de Farmacia 28(1):55-59.
23.- Martínez P, Baracaldo N, Santos M, Guzmán N, 2003. Estudio
Farmacognóstico, Fitoquímico y Microbiológico de la Petiveria alliacea L.
Gaceta Médica Espirituana.
24.- Cáceres A, Girón L, Alvarado S, Torres M, 1987. Screening of
antimicrobial activity of plants popularly used in Guatemala for the
treatment of dermatomucosal diseases. Journal of Ethnopharmacology 20:
223-237.
25.- Cáceres A, López B, González S, Berger I, Tada I, Maki J, 1998. Plants
used in Guatemala for the treatment of protozoal infections. I. Screening of
activity to bacteria, fungi and American trypanosomes of 13 native plants.
Journal of Ethnopharmacology 62: 195-202.
26.- Cáceres A, Cano O, Samayo B, Aguilar L, 1990. Plants used in Guatemala
for treatment of gastrointestinal disorders. 1. Screening of 84 plants
against Enterobacteria. Journal of Ethnopharmacology 30: 55- 73.
27.- Frame A, Riosolivares E, De Jesús L, Ortiz D, Pagan J, Méndez S, 1998.
Plants from Puerto Rico with anti-Mycobacterium tuberculosis properties. PR
Health SCI J, 17(3): 243-253.
28. - Szczepanski V, Zgorzelak C, Hoyer P, Arzneim G, 1975. Isolation,
structure elucidation and synthesis of an antimicrobial substance from
Petiveria alliacea. Res Lab Schering ag Berlin D-100 Germany.
29.- López A, Hernández N, Misas C, 1981. Potential antineoplastic activity
of Cuban plants. IV. Revista Cubana de Farmacia 15(1): 71-77.
30.- Cáceres A, López B, Girón M, Logemann H, 1991. Plants used in Guatemala
for the treatment of dermatophytic infections.1. Screening for antimytotic
activity of 44 plant extracts. Journal of Ethnopharmacology 31: 263- 276.
31.- Cáceres A, Jauregui E, Herrera D, Logemann H, 1991. Plants used in
Guatemala for the treatment of dermatomucosal infections.1: Screening of 38
plant extracts for anticandidal activity. Journal of Ethnopharmacology 33:
277-283.
32.- Benevides P, Young M, Giesbrecht A, Roque N, Bolzani V, 2001.
Antifungal polysulphides from Petiveria alliacea L. Phytochemistry 57:
743-747.
|
|
Revista QuímicaViva |