Biodegradación de hidrocarburos policíclicos aromáticos (HPA) por hongos aislados de aguas contaminadas con petróleo, podredumbre blanca, y acíbar de Aloe vera
Karla A. Petit1, José L. Colina1, Francisco E. Yegres2, Hector G. Moran3, Nicole Richard-Yegres2
1) Departamento de Química, Universidad Nacional Experimental Francisco de Miranda (UNEFM), 2) Laboratorio de Investigación y Apoyo Docente Santa Ana (LIADSA), UNEFM, 3) Centro de Investigación de Ciencias Básicas (CICBa), UNEFM. Venezuela.
Recibido 13 de Noviembre 2013 – Reenviado 26 de noviembre 2013-Aceptado 30 de noviembre 2013
Resumen
Se evaluó la capacidad de cepas fúngicas aisladas de ambientes
contaminados con petróleo, podredumbre blanca de árboles, ambientes
cerrados y acíbar de Aloe vera para crecer y degradar antraceno,
fluoranteno y pireno. Las cepas se seleccionaron inicialmente por su
habilidad para crecer en placas con Czapek complementadas con diesel
como única fuente de carbono y energía, se identificaron hongos
pertenecientes a los géneros Acremonium, Aspergillus, Fusarium,
Paecillomyces, Penicilium y Trichoderma, seguidamente las cepas fueron
sometidas a ensayos de crecimiento en placas con medio Czapek
complementado con los hidrocarburos policíclicos aromáticos (HPA) como
única fuente de carbono, a partir de este ensayo se seleccionaron tres
cepas que presentaron mayor crecimiento en los HPA, todas del género
Aspergillus, con las cuales se determinó la degradación de HPA en
cultivos líquidos en 20 días de incubación. La cuantificación de los HPA
se realizó por cromatografía de gases. La cepa U2010-27A (Aspergillus
versicolor) mostró la mayor tasa de biotransformación de los HPA, entre
15 y 20 %, por lo que se seleccionó para ensayos de biorremediación en
un suelo contaminado con HPA, las tasas de degradación en 60 días de
incubación resultaron 23,6% pireno, 10,6% fluoranteno y 5,0% antraceno.
Estos resultados sitúan a la cepa U2010-27A como un hongo con potencial
para biorremediar suelos contaminados con HPA.
Palabras clave: Biodegradación, Hidrocarburos aromáticos
policíclicos, hongos
Biodegradation of polycyclic aromatic
hydrocarbons (PAHs) by fungi isolated from water contaminated with oil,
white rot and aloe from Aloe vera
Abstract
We evaluated the ability of fungal strains isolated from
oil-contaminated environments, white rot of trees, aloes indoors and
Aloe vera to grow and degraded anthracene, fluoranthene and pyrene. The
strains were initially selected for their ability to grow on plates with
Czapek Medium (Cz ) supplemented with diesel as the sole source of
carbon and energy. Several isolates were identified as fungi belonging
to the genera Acremonium, Aspergillus, Fusarium, Paecillomyces,
Penicillium and Trichoderma. The three strains selected by their best
growth with PAHs belonged to the Aspergillus genus. The degradation of
PAHs was determined in liquid cultures during 20 days of incubation,
quantifying PAHs by gas chromatography. The strain U2010-27A
(Aspergillus versicolor) showed the highest yield of biotransformation
of PAHs, between 15 and 20%, so it was chosen for testing bioremediation
in contaminated soil. The degradation yields at 60 days incubation were
23.6 % pyrene, 10.6 % fluoranthene and 5.0 % anthracene. These results
indicated that the strain U2010-27A could be a potential candidate for
bioremediation of contaminated soils.
Keywords: Biodegradation, polycyclic aromatic hydrocarbons, fungi
Introducción
El petróleo tiene una gran importancia en la sociedad moderna, sin
embargo, éste muestra varios aspectos negativos, siendo los problemas
ambientales derivados de su explotación y uso los más importantes. Su
sola presencia en el ambiente implica una serie de problemas
relacionados con la contaminación, la disminución de la calidad del
agua, el suelo y de la vida de muchas plantas y animales; pudiendo
afectar finalmente, la calidad de vida de los seres humanos, que
interactúan con los ecosistemas y cadenas alimenticias afectadas [1].
Entre los numerosos compuestos que contiene el petróleo, están los
hidrocarburos aromáticos, los cuales varían en estructura, tamaño y
complejidad; desde compuestos monocíclicos hasta estructuras de cadenas
largas y complejas constituidas por anillos aromáticos [2]. De éstos
compuestos, los hidrocarburos policíclicos aromáticos (HPA) han sido los
más estudiados debido a que forman parte de una amplia variedad de
productos de importancia biológica, química e industrial [3].
Los HPA se encuentran entre los contaminantes de mayor impacto biológico
debido a los efectos cancerígenos y mutagénicos que provocan en los
sistemas vivos [4]. Este efecto biológico varía en función de la
estructura del HPA, la agencia para la protección ambiental americana
(EPA) seleccionó 16 de los HPA, llamados prioritarios debido a su alta
toxicidad, entre los que se encuentran antraceno, fluoranteno y pireno
[5].
En los últimos años se ha incrementado el interés en el uso de
biotecnologías destinadas a recuperar ambientes contaminados con
petróleo o sus derivados, que complementen los métodos químicos y
físicos tradicionales. Aparece así la biorremediación, una técnica
basada en el uso de microorganismos para degradar los hidrocarburos
presentes en el petróleo y otros combustibles que representa uno de los
principales mecanismos por los cuales estos contaminantes pueden ser
eliminados del ambiente y generalmente resulta más económica que otras
alternativas de restauración [6].
Gran parte de los estudios de biorremediación, se han centrado en las
bacterias, por la facilidad que ofrecen para estudiar sus vías
metabólicas y llevar a cabo construcciones genéticas que permitan
degradar específicamente determinados compuestos contaminantes; sin
embargo la capacidad de los hongos, para transformar una gran variedad
de compuestos orgánicos y llevarlos hasta compuestos más simples, ofrece
un potencial indiscutible para su utilización en procesos de tratamiento
de contaminaciones. Ese potencial radica fundamentalmente en las
características de su sistema enzimático y en su vigoroso crecimiento
que les permite, a través del desarrollo de su micelio, colonizar
diferentes tipos de sustratos y acceder a los compuestos que constituyen
las contaminaciones más frecuentes [7].
El objetivo de este estudio fue aislar e identificar cepas fúngicas de
diferentes fuentes con potencial para biodegradar antraceno, fluoranteno
y pireno, tres HPA de alto impacto debido a su frecuencia y
recalcitrancia en ambientes impactados por actividades petroleras, con
lo cual se pretende hacer un aporte biotecnológico al saneamiento de
ambientes contaminados con estos compuestos.
Materiales y Métodos
Aislamiento de cepas fúngicas
Muestras de corteza de árboles (aprox.10 g) con podredumbre blanca
[3,8], acíbar de Aloe vera (aprox. 5 g) con crecimiento fúngico [9,10],
agua contaminada con petróleo crudo (10 mL) [11], ambientes
cerradosfueron suspendidas en 100 mL de medio líquido Czapek (Cz) [13].
Luego de 24 h de incubación, a partir de estas soluciones se aislaron
cepas fúngicas con la capacidad para crecer en medio Cz[14]
complementado con una emulsión de diésel comercial 5% (CzD) como única
fuente de carbono y energía [15]. Las colonias se incubaron a 32ºC
durante 7 días. Los cultivos de hongos puros se obtuvieron mediante
posteriores transferencias a placas de agar fresco.
La identificación de las especies fúngicas se realizó mediante estudios
macro y microscópicos de características morfológicas (hifas, conidios,
células conidiogenas y conidióforos), la información fue compilada y
comparada con claves taxonómicas descritas en bibliografía especializada
[16, 17, 18,19, 20].
Habilidad de las cepas fúngicas para crecer
en HPA
Las cepas fúngicas con capacidad para crecer en CzD se seleccionaron por
su habilidad para crecer en medio Cz complementado con antraceno,
fluoranteno o pireno 0,5 mg/mL como única fuente de carbono y energía
[20]. Se utilizó un control positivo de medio Cz sacarosa y negativo de
Cz sin ninguna fuente de carbono. Los cultivos se incubaron durante 7
días a 32 ºC. Para evaluar el crecimiento de las cepas se estableció una
escala basada en el tamaño de la colonia: (++) Buen crecimiento; (+)
Moderado crecimiento; (-/+) Escaso crecimiento; (-) No se observó
crecimiento.
Preparación del inóculo
Los inóculos fueron preparados a partir de cultivos puros colocados en
recipientes inclinados con medio Papa-Dextrosa-Agar (PDA) estos se
incubaron a 32 ºC. Luego de 7 días el cultivo fue lavado con 10 mL de
agua desionizada estéril con lo cual se obtuvo una suspensión de
esporas, eliminando los fragmentos de micelio de la suspensión por
filtración con lana de vidrio estéril [21]. La concentración de esporas
en el inóculo se estimó con una cámara de Neubauer.
Ensayo de degradación de HPA en cultivos
líquidos
Las cepas seleccionadas se sometieron a ensayos de degradación en
Erlenmeyers de 125 mL que contenían 20 mL de medio Cz líquido,
complementado con antraceno, fluoranteno o pireno (CzH) (como única
fuente de carbono) disueltos en acetona hasta una concentración de 0,5
mg/mL. Evaporado totalmente el solvente, los medios se esterilizaron a
121ºC y 15 psia por 20 min. Los recipientes se inocularon con una
suspensión de esporas de cada una de las cepas hasta una concentración
de 105 esporas/mL [21]. Adicionalmente se inoculó Cz líquido
complementado con 0,5 mg/mL de sacarosa (Control [+]), medio Cz sin
fuente de carbono (Control [-]) y medio CzH sin inóculo (Controles [0]),
con la finalidad de establecer comparaciones. Todos los experimentos se
realizaron por duplicado. Los cultivos fueron incubados a 32°C y 130 rpm
en un agitador de mesa (Innova 2100). Se tomaron cultivos transcurridos
5, 10, 15 y 20 días de incubación, se determinó el peso seco de la masa
fúngica y cantidad de antraceno, fluoranteno, pireno o sacarosa residual
en los medios.
Tratamiento de la muestra de suelo
La muestra de suelo utilizada para los microcosmos (aprox. 2 Kg) fue
colectada de una parcela de cultivo de la Unidad de Apoyo Académico Ing.
José Landaeta (UNEFM) localizada en Coro, Venezuela. El suelo presento
pH 6.5, Nitrógeno total 2,8 g/Kg, Potasio 2,3 g/Kg, Fósforo 0,8 g/Kg, CE
0,52 dS/m. El suelo fue secado al aire y tamizado a 2 mm, luego
almacenado en la oscuridad a 4 ºC hasta su uso [22].
Ensayo de degradación en un microcosmos
contaminado con HPA
Los microcosmos se instalaron en Erlenmeyer (2 L) que contenían 250 g de
suelo contaminado con antraceno, fluoranteno y pireno (MH), los cuales
se agregaron disueltos en acetona, evaporado el solvente en su
totalidad. El sistema fue agitado durante 1 h [23]. La concentración
final de los hidrocarburos en el suelo fue 500 mg/kg de suelo. Cada MH
fue inoculado con una suspensión de 105 esporas/g de suelo, disponiendo
de MH control no inoculados (MC). El contenido de humedad en los
microcosmos se mantuvo alrededor de 70% de la capacidad de retención de
agua del suelo, con agua destilada estéril [21]. Los Erlenmeyers fueron
tapados con algodón y fibra de lana estéril la cual se sustituyó cada 20
días y colocados a temperatura ambiente (aprox. 32ºC), realizando un
duplicado para cada recipiente. Se tomó un MH y MC cada 15, 30, 45 y 60
días para determinar la cantidad de antraceno, fluoranteno y pireno
residual en las muestras se suelo.
Procedimiento analítico
La extracción de los HPA de los cultivos líquidos se realizó con
diclorometano (DCM), los extractos se hicieron pasar por cámara de
sulfato de sodio anhídrido y aforados a 10 mL. Los HPA de las muestras
de suelo fueron extraídos con DCM por 16 h usando un dispositivo Soxhlet
[21]. La cuantificación de los HPA se realizó en un cromatógrafo de
gases (Agilent Technologies modelo 6890N, Netwook GC) acoplado a un
detector de ionización de llama.Usando una columnacapilar 19091-j913,
HP-5% Fenil-Metil Siloxano (30.0 m x 320 μm x 0.25 μm,
AgilentTechnologies). Se programó una temperatura inicial de 150°C por
30 seg y un incremento lineal de 20°C/min hasta 230 °C. La temperatura
del detector e inyector se mantuvo en 280°C, el volumen de inyección fue
de 1 µL. La cuantificación de los HPA en cultivos líquidos se realizó
por medio de la relación del área del analito respecto al área del
estándar interno con una curva de calibrado, usando fluoranteno o pireno
como estándar interno. La cuantificación de HPA en las muestras de suelo
se realizó estimando las áreas de los picos obtenidos y calculando la
concentración del analito utilizando relación lineal con una curva
patrón.
La biomasa fúngica producida se obtuvo filtrando al vacío el contenido
de los cultivos con papel Whatman Nº1. El filtrado se lavó dos veces con
10 mL de acetona y agua destilada estéril y el material fue secado en
estufa a 60 ºC hasta peso constante. El peso se determinó en una balanza
analítica (Ohaus Adventur). La cantidad de sacarosa residual en los
cultivos se determinó mediante método espectrofotométrico [24] a 490 nm
utilizando un espectrofotómetro (Genesys, UV/VIS).
Análisis estadístico
La significancia de los resultados se comprobó por análisis de varianza,
ANOVA y sistemas de comparación múltiples utilizando el test de Duncan,
para resultados con 95% de confianza, empleando el software Infostat.
Resultados
Capacidad de las cepas fúngicas para crecer
en HPA
Se estudió la habilidad de hongos de diferentes fuentes para crecer en
medios de cultivo complementados con diesel obteniéndose 10 diferentes
aislados (resultados similares han sido reportados por Bento et al.[15]
y Hettige et al.[25]) los cuales fueron purificados e identificados,
seguidamente las cepas fúngicas se ensayaron por su capacidad para
crecer en medios de cultivo con antraceno, fluoranteno o pireno como
única fuente de carbono. Las cepas aisladas (Tabla 1) pertenecen
principalmente al género Aspergillus, el cual ha sido ampliamente
descrito por su capacidad para metabolizar HPA [26,27,28]. El resto de
las cepas aisladas pertenecen a los géneros Acremonium, Fusarium,
Paecillomyces, Penicilium y Trichoderma, todos reportados por su
capacidad hidrocarbonoclástica [20,28,29]. Estas cepas fueron
almacenadas en el cepario de hongos y levaduras del LIADSA-UNEFM. Los
ensayos de crecimiento de las cepas en cultivos con HPA muestran que los
hongos aislados de ambientes contaminados con petróleo crecieron en
todos los HPA de prueba, característica que ha sido descrita por
Okerentugba et al. [11] y Naranjo et al. [20]. Las cepas aisladas de
podredumbre blanca de árbol crecieron en medios con antraceno y pireno
(resultados similares obtenidos por Van Hamme et al.[3,31]; Acevedo et
al.[30]; Gianfreda et al.[32]), aunque solo la cepa U2010-26C fue capaz
de utilizar fluoranteno como sustrato. Los hongos aislados de los
espacios cerrados del Laboratorio de Análisis Químico (LAQ) no
evidenciaron crecimiento aparente sobre los HPA durante este ensayo. La
cepa U2010-1A aislada a partir de una muestra de acíbar de A. vera
mostró crecimiento en todos los medio con HPA, siendo este el primer
informe de crecimiento de un hongo aislado de esta fuente sobre HPA.
Estos resultados permitieron seleccionar las cepas U2010-27A, U2010-1A y
U2010-26C para próximos ensayos en cultivos líquidos.
Tabla 1.
Crecimiento de las cepas fúngicas en los sustratos de prueba
|
|
|
|
|
Medio Czapek Dox complementado con |
||||
|
Cepa |
Género |
Especie |
Fuente |
Sacarosa |
Control (-) |
Antraceno |
Fluoranteno |
Pireno |
|
U 2010-2C |
Aspergillus |
niger |
Agua a |
++ |
- |
+ |
+ |
+ |
|
U 2011-2A |
Penicilium |
sp |
Ambiente b |
++ |
- |
- |
- |
-/+ |
|
U 2010-27A |
Aspergillus |
versicolor |
Agua a |
++ |
- |
++ |
++ |
++ |
|
U 2010-26C |
Aspergillus |
oryzae |
Madera c |
++ |
-/+ |
++ |
+ |
+ |
|
U 2011-5A |
Acremoniun |
sp |
Maderac |
++ |
- |
+ |
- |
-/+ |
|
U 2010-2E |
Trichoderma |
sp |
Agua a |
+ |
- |
+ |
+ |
+ |
|
U 2010-1A |
Aspergillus |
nidulans |
Acibar d |
++ |
- |
++ |
+ |
++ |
|
U 2011-1A |
Fusarium |
solana |
Ambiente b |
+ |
- |
- |
- |
- |
|
U 2010-1B |
Paecillomyces |
variotti |
Agua a |
++ |
- |
+ |
+ |
+ |
|
U 2011-3A |
Aspergillus |
flavus |
Maderac |
++ |
- |
+ |
- |
+ |
Aislamiento a partir: a Aguas de servicio petrolero, Refinería Amuay; b Ambientes cerrados, LAQ-UNEFM; c Podredumbre blanca de árboles;dAcíbar de A. vera.(++) Buen crecimiento; (+) Moderado crecimiento; (-/+) Escaso crecimiento; (-) No se observó crecimiento.
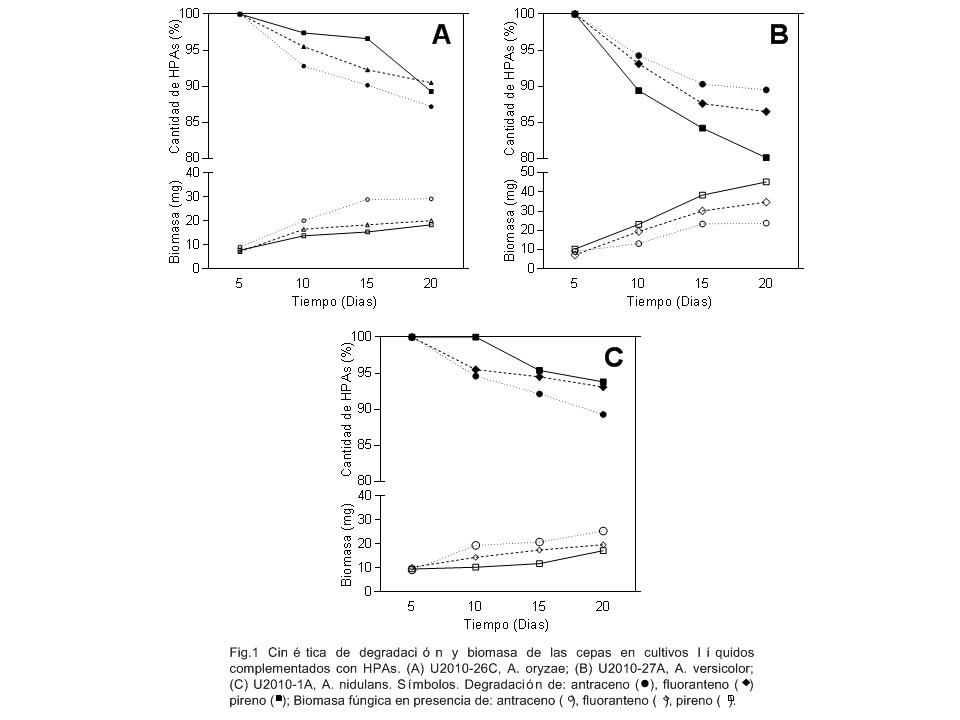
Degradación de HPA en cultivos líquidos
Se determinó la habilidad para degradar antraceno, fluoranteno o pireno
en cultivos líquidos de 20 días de incubación de tres cepas
seleccionadas del ensayo de crecimiento en HPA. La figura 1 muestra el
patrón cinético de consumo de HPA y la biomasa fúngica producida durante
el ensayo. Las cepas cumplieron con una fase adaptativa, en la cual el
hongo ajusta su aparato enzimático para metabolizar el sustrato,
observándose degradación a partir de los días 5 a 10 del ensayo,
evidenciado por la disminución de la cantidad del HPA residual y el
aumento de la biomasa producida por el hongo. Luego de la fase de
adaptación cada una de las cepas ensayadas mostró un comportamiento
específico de metabolización de los HPA y crecimiento, aunque ninguna de
ellas logró agotar completamente el sustrato. Las cepas U2010-26C y
U2010-1A reportaron porcentajes de degradación entre 5 y 15 % hasta el
día 20 del ensayo (figuras 1A y 1C), demostrando que la cepa aislada del
acíbar de A. vera es capaz biodegradar antraceno, fluoranteno y pireno a
las concentraciones de estos ensayos. Este resultado evidencia que la
capacidad para metabolizar algunos HPA no es exclusiva de hongos
aislados de ambientes contaminados con hidrocarburos o podredumbre
blanca de árboles. Aunque son muchos los informes publicados de
bioconversión de HPA por hongos del genero Aspergillus [26,27,28], esta
es la primera evidencia de degradación de HPA por un hongo aislado de A.
vera. Antraceno fue el HPA degradado en mayor cantidad, seguido de
fluoranteno y pireno, esto debido a que durante la degradación
microbiana de compuestos aromáticos los HPA de menor peso molecular se
degradan con mayor rapidez [33]. U2010-27A fue el hongo que reportó las
mayores porcentajes de consumo de HPA, entre 15 y 20 %, en contradicción
con lo esperado esta cepa presentó un mayor consumo de pireno 19,9%
seguido de fluoranteno 15,5% y antraceno 11,5%. Estos resultados, aunque
contrastan con lo expuesto anteriormente, han sido también reportados
por Viñas et al.[34]. Esta característica de la cepa para degradar
preferiblemente pireno -un HPA de mayor número de anillos aromáticos y
peso molecular que fluoranteno o antraceno- probablemente se deba a una
marcada selectividad en el complejo enzimático de este hongo.
Característica que lo hace recomendable para procesos de biorremediación
en suelos contaminados con HPA de alto peso molecular (4 o más anillos
aromáticos).
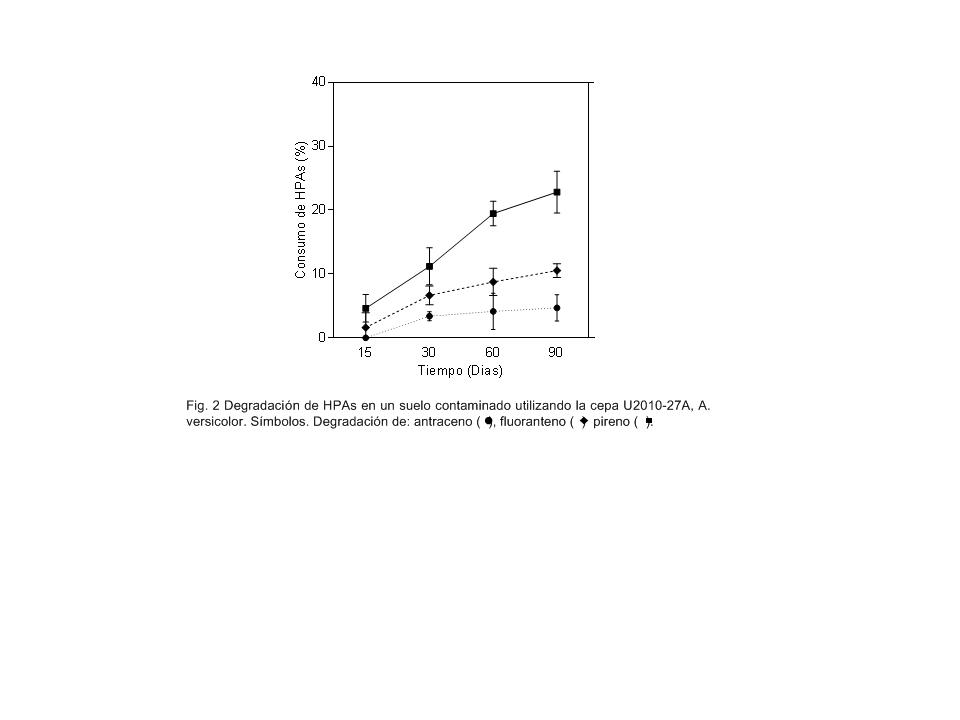
Degradación de HPA en un suelo contaminado
La capacidad para biorremediar un suelo contaminado con HPA se evaluó
utilizando la cepa U2010-27A, la cual mostró la mejor asimilación de HPA
en cultivos líquidos. Los resultados de agotamiento de antraceno,
fluoranteno y pireno en 60 días de ensayo (figura 2) muestran un
comportamiento similar al presentado por el hongo en cultivos líquidos
(figura 1B), con porcentajes de degradación entre 5 y 10% para antraceno
y fluoranteno respectivamente. La pendiente de las curvas indica que la
degradación de estos dos HPA se realizó en mayor medida durante los
primeros 15 días de ensayo, luego de este periodo la degradación
disminuyó con una cinética constante hasta el final del ensayo. Pireno
fue el HPA que desapareció en mayor cantidad, agotándose 23,6% al día 60
del ensayo, presentando mayor degradación de este compuesto entre los
días 15 y 30 La asimilación sostenida de los HPA sugiere que la cepa
U2010-27A mantuvo la producción de esporas durante el ensayo, lo que
demuestra que este hongo es capaz de colonizar ambientes distintos al
autóctono, ofreciendo versatilidad de hábitat para futuros procesos de
biorremediación. Aunque no se analizaron intermediarios metabólicos
durante este ensayo [33,35], las concentraciones en los MC (en los
cuales no se detectó cambios significativos en las concentraciones de
los HPA) confirman la biodegradación de los HPA por la cepa.
Discusión
Se estableció un ensayo preliminar de crecimiento de cepas en diesel
comercial previo a los ensayos de crecimiento en HPA, se seleccionó
diesel comercial como sustrato selectivo ya que se han reportado
informes de crecimiento de hongos en este combustible con potencial para
degradar otros hidrocarburos [15]. De acuerdo con Pino et al.[36], el
diesel es una mezcla compleja de hidrocarburos que contiene
principalmente alcanos, alquenos e hidrocarburos aromáticos, por lo que
este ensayo permitió el aislamiento de 10 cepas con la habilidad para
crecer en diesel y posiblemente usarlo como fuente de carbono. Las
mismas fueron clasificadas e identificadas, obteniéndose 6 géneros
diferentes, todos reportados por su capacidad para biodegradar HPA y
otros hidrocarburos [29]. Los resultados de crecimiento de estos hongos
en los HPA muestran que las cepas aisladas de aguas contaminadas con
petróleo, podredumbre blanca y acíbar de A. vera poseen el potencial
para crecer en medios de cultivo complementados con antraceno,
fluoranteno y pireno, característica que para las dos primeras fuentes
ha sido reportada por Van Hamme et al.[3,31]; Naranjo et al.[20],
Acevedo et al.[30]. Sin embargo no se encontraron informes de hongos
aislados de acíbar de A. vera con capacidad para crecer en HPA,
constituyendo este el primer reporte de un hongo aislado de esta fuente
con habilidad para crecer en antraceno, fluoranteno y pireno.
Los experimentos anteriores permitieron la
selección de tres cepas con la habilidad de crecer y degradar cada uno
de los HPA. El ascenso en la cantidad de biomasa proporcional al
agotamiento de los hidrocarburos indica que efectivamente los hongos
seleccionados son capaces de utilizar los HPA como fuente de carbono y
energía, aunque durante las determinaciones cromatograficas no se
detectaron picos con áreas relevantes que permitieran afirmar la
presencia de compuestos intermedios de la degradación de alguno de los
HPA. La cepa U2010-26C A. oryzae, un hongo aislado a partir de
podredumbre blanca de árbol, mostró porcentajes de degradación entre 5 y
15%. La capacidad de estos hongos lignolíticos para degradar HPA ha sido
descrita recientemente por Dashtban et al.[37]; Acevedo et al.[30];
Lladó et al. [38]. De acuerdo con Asgher et al. [39] y Rubilar et
al.[40], los hongos aislados de esta fuente son los principalmente
utilizados debido a la producción de enzimas oxidativas de importancia
en procesos de biorremediación. Aunque esta investigación no abarcó la
determinación de enzimas extracelulares asociadas a la degradación de
HPA, se sabe que la degradación por hongos lignolítico se produce en dos
pasos, primeramente por la acción del sistema hidrolítico que produce
hidrolasas responsable de la transformación de macromoléculas y
posteriormente por el sistema oxidativo lignolítico, responsable de la
degradación de varios contaminantes, entre ellos los HPA [41]. La
ventaja de este mecanismo radica en la estructura irregular de la
molécula de lignina, que hace que los hongos adaptados a su asimilación
produzcan enzimas con muy baja especificidad de sustrato que los hace
adecuados para la degradación de diferentes compuestos [42]. Los
porcentajes de degradación para U2010-27A A. versicolor, muestran que
este hongo presentó el mayor crecimiento y degradación de HPA (15-20%)
de las cepas evaluadas. Hongos aislados de aguas contaminadas con
petróleo han sido también reportados por Okerentungba et al.[11], el
cual aisló e identifico cepas de Aspergillus sp de aguas contaminadas
con petróleo de los ríos Omuihuechi y New Calabar en Nigeria. La
capacidad de A. versicolor para degradar HPA ha sido reportada por
Uzoamaka et al.[26], el cual describe su alta capacidad para degradar
HPA. El mecanismo enzimático para la degradación de HPA para hongos
aislados de ambientes contaminados con petróleo ha sido estudiado por
Naranjo et al.[20,43] en cuyos informes se reporta evidencias de
producción de enzimas lignolíticas, principalmente lacasa y lignina
peroxidasas. La degradación de HPA por la cepa U2010-1A A. nidulans un
hongo aislado de acíbar de la planta de A. vera estuvo entre 5 y 15%,
reportes de degradación de HPA por hongos aislados de esta fuente no se
encontraron, aunque se sospecha que el mecanismo que le permitió a esta
cepa metabolizar HPA, podría ser similar al de los hongos lignolítico ya
que los componentes principales del acíbar son aloína y emodina, dos
antraquinonas complejas que poseen varios anillos aromáticos en su
estructura [44].
El ensayo de biorremediación con la cepa U2010-27AA versicolor, mostró
que esta cepa es capaz de disminuir los niveles HPA en un suelo
contaminado con 60 días de incubación (tiempos similares de incubación
en microcosmos han sido reportados por Potin et al. [21]. La degradación
en el MH se comparó con la cantidad de HPA en el MC, se utilizó un
control de suelo no estéril con la finalidad de evaluar una posible
degradación de HPA por poblaciones indígenas presentes en el suelo [21].
Los resultados evidencian que estas poblaciones no mostraron habilidad
para metabolizar ninguno de los HPA, ya que no se detectaron variaciones
significativas en la concentración de ninguno de los hidrocarburos. Los
niveles de agotamiento de HPA en MH muestran que la cepa U2010-27A,
degrada entre el 5 y 25% los HPA presentes en el suelo; aunque han sido
reportados niveles de degradación para A. versicolor de hasta 99% de una
amplia variedad de HPA entre ellos antraceno, fluoranteno y pireno [26].
Los niveles de transformación y asimilación de HPA en suelos suelen ser
bajos comparados con los estudios realizados en cultivos líquidos [45].
Además la degradación presentada por U2010-27A en estos ensayos es
frecuente para hongos del género Aspergillus, el cual de acuerdo con
Pernía et al. [29], son hongos de mínima degradación, con porcentajes
que alcanzan el 22%. Comparativamente, la degradación de cada uno de los
HPA en el suelo indica que la cepa mantiene su capacidad para degradar
preferiblemente compuestos con mayor peso molecular. Este comportamiento
es especialmente importante ya que se sabe que la persistencia de los
HPA en el medio ambiente aumenta con el tamaño de la molécula, además la
toxicidad de estos compuestos se incrementa con el peso molecular y
carácter lipofílico [46]. La degradación ascendente y cultivos en placas
con PDA tomados de MH demuestran que U2010-27A además de tener la
habilidad para colonizar un medio distinto el autóctono, fue capaz
sobrevivir durante todo el ensayo. Esta cualidad para de colonizar
ambientes distintos a su hábitat, sobrevivir a condiciones de baja
disponibilidad de nutrientes y competir con poblaciones indígenas, le
confiere a la cepa U2010-27A especiales atributos para la
biorremediación de suelos contaminados con HPA.
Conclusión
Este estudio permitió el aislamiento de cepas fúngicas con potencial
para degradar antraceno, fluoranteno y pireno. Sucesivos ensayos de
degradación en cultivos líquidos con tres cepas seleccionadas mostraron
efectiva degradación de los HPA en 20 días de incubación. De estos
hongos hidrocarbonoclásticos se seleccionó la cepa U2010-27A A.
versicolor para ensayos de biorremediación en un suelo contaminado con
los HPA, logrando una disminución en los niveles de los contaminantes,
especialmente los de mayor peso molecular. Estos resultados demuestran
la capacidad de esta cepa para la biorremediación de suelos contaminados
con HPA, por lo que el próximo paso a seguir en la investigación será la
evaluación de mayores tiempos de incubación en suelos contaminados y la
determinación e identificación de las principales enzimas extracelulares
producidas por el hongo.
Agradecimientos
Los autores agradecen al Dr. Iván Leál Granadillo (Departamento de
Química, UNEFM) por facilitar los estándares utilizados en los análisis
de CG.Así mismo, se agradece a los laboratorios de Química General,
Análisis Químico y LIADSA de la Universidad Nacional Experimental
Francisco de Miranda por su apoyo al desarrollo de esta investigación.
Referencias
[1] San Sebastian M, Hurtig A (2004) Oil exploitation in the Amazon
basin of Ecuador: a public health emergency. Rev. Panam. Salud
Publica/Pan. Am. J. Public Health, 15(3):109-116.
[2] Tisot B, Welte D (1984) Petroleum formation and ocurrence,
Springer-Verlag. New York. pp 699.
[3]Van Hamme J, Singh A, Ward O (2003a) Recent advances in petroleum
microbiology. Microbiol Mol Biol Rev 67:503549.
[4] Cuadras A, Ramírez N, Rovira E, Marcé R, Borrull F (2012) Evaluación
del riesgo asociado a la exposición de hidrocarburosaromáticos
policíclicos en la salud de la población residente alrededor del
complejo químico de Tarragona. Rev. salud ambient, 12(1):14-25
[5] Peltonen K, Kuljukka T (1995) Air sampling and analysis of
polycyclic aromatic hydrocarbons. J. Chomatogra, 710: 93-108.
[6] Riojas H, Torres L, Moncada I, Balderas J, Gortáres P (2010) Efectos
de los surfactantes en la biorremediación de suelos contaminados con
hidrocarburos. Revista Química Viva, 3(9):120-145.
[7] Hammel K (1995) Mechanisms for polycyclic Aromatic Hydrocarbons.
Degradatión by ligninolytic fungi. Environmental Health perspectives,
103:508-512.
[8]Conesa A, Punt P, Van den Hondel C (2002) Fungal peroxidases:
Molecular aspects and applications. J Biotechnol, 193:143-158.
[9] Tschaplinsk T, González M, Gebre G, Páez A (2000) Soluble
carbohydrates, and aloin concentration of Aloe vera plants exponed to
three irradiance levels. Environmen Experimental Botany 2000; 44:
133-139. Environmen Experimental Botany, 44: 133-139.
[10] Jiménez J (1997) Aislamiento y caracterización de un hongo del
género Aspergillus que contamina y consume el Acíbar de Aloe vera. Rev.
de la Sociedad Venezolana de Microbiología, 21(1):26-27.
[11] Okerentugba P y Ezeronye O (2003) Petroleum degrading potentials of
single microbial cultures isolated from rivers and effluent in Nigeria.
African Journal of Biotechnology,2(9): 288-292.
[12] Márquez M, Navas P, López E, Yegres J (2013)Capacidad degradadora
de hongos aerógenos aislados en la campana de extracción del laboratorio
de VASSA, S.A. sobre desechos del ensayo del punto de anilina para
aceites minerales. Rev. de la Sociedad Venezolana de Microbiología,
33(1):111-115.
[13] Prenafeta-Boldú F, Kuhn A, Luykx M, Anke H, Van Groenestijn J, De
Bont J (2001) Isolation and characterization of fungi growing on
volatile aromatic hydrocarbons as their sole carbon and energy source.
Mycol Res, 105:477-484.
[14] Pelaéz F, Martinez M, Martinez A (1995) Screening of 68 species of
basidiomycetes for enzymes evolved in lignin degradation. Mycol Res,
99:37-42.
[15]Bento F, Gaylarde C (2001) Biodeterioration of stored diesel oil:
studies in Brazil. International Biodeterioration and Biodegradation,
47: 107–112.
[16]Abarca M (2000) Taxonomía e identificación de especies implicadas en
la aspergilosis nosocomial. Rev Iberoam Micol, 17: 79-84.
[17]Booth C (1971) The genus Fusarium. Commonwealth Mycological
Institute, Kew, Surrey, England.
[18]Kohlmeyer J, Volkmann B (1991) Illustrated key to the filamentous
higher marine fungi. Botanica Marina, 34: 1-61.
[19]De Hoog G (2000) Atlas of Clinical Fungi, Second Edition,Amer
Society for Microbiology, pp1126.
[20] Naranjo L, Urbina H, De Sisto A, León V (2007) Isolation of
autochthonous non-white rot fungi with potential for enzymatic upgrading
of Venezuelan extra-heavy crude oil. Biocatalysis and Biotransformation,
25: 1- 9.
[21] Potin O, Rafin C, Veignie E (2004) Bioremediation of an aged
polycyclic aromatic hydrocarbons (PAHs)-contaminated soil by filamentous
fungi isolated from the soil. Int. Biodet. Biodegrad, 54:45-52.
[22] Yucheng W, Yongming L, Dexun Z, Jinzhi N, Wuxin L, Ying T, Zhengao
L (2007) Bioremediation of polycyclic aromatic hydrocarbons contaminated
soil with Monilinia sp.: degradation and microbial community analysis.
Biodegradation, 19:247-257.
[23] Andersson B, Henrysson T (1996) Accumulation and degradation of
dead-end metabolites during treatment of soil contaminated with
polycyclic aromatic hydrocarbons with five strains of white-rot fungi.
Appl. Microbiol. Biotechnol, 46: 647-652.
[24] Dubois M, Gilles K, Hamilton J, Rebers P, Smith F (1956)
Colorimetric Method for Determination of Sugars and Related
Substances.Anal. Chem, 28(3):350-356
[25] Hettige G. y Sheridan J (1984)
Mycoflora of stored diesel fuel in New Zealand. International
biodeterioration 20: 225-227.
[26] Uzoamaka G, Floretta T, Florence M (2009) Hydrocarbon Degradation
Potentials of Indigenous Fungal Isolates from Petroleum Contaminated
Soils. Journal of Physical and Natural Sciences, 31: 1-6.
[27] Oudot J, Dupont J, Haloui S, Roquebert M (1993) Biodegradation
potential of hydrocarbon-degrading fungi in tropical soil. Soil Biology
and Biochemistry, 25: 1167- 1173.
[28] Chaineau C, Morel J, Dupont J, Bury E, Oudot J (1999) Comparison of
the fuel oil biodegradation potential of hydrocarbonassimilating
microorganisms isolated from a temperate agricultural soil. Science of
the Total Environment, 227: 237–247.
[29] Pernía B, Demey J, Inojosa Y, Naranjo L (2012) Biodiversidad y
potencial hidrocarbonoclastico de hongos aislados de crudo y sus
derivados: Un meta-análisis. Rev Latinoam Biotecnol Amb Algal,
3(1):1-40.
[30] Acevedo F, Pizzul L, Castillo M, González M, Cea M, Gianfreda L,
Diez M (2010) Degradation of polycyclic aromatic hydrocarbons by free
and nanoclay-immobilized manganese peroxidase from Anthracophyllum
discolor. Chemosphere 80(3): 271-8.
[31] Van Hamme J, Wong E, Dettman H, Gray M, PickardM (2003b) Dibenzyl
sulfide metabolism by white rot fungi. Appl Environ Microbiol,
69:1320-1324.
[32] Gianfreda L, Rao M (2004) Potential of extra cellular enzymes in
remediation of polluted soils: A review. Enzyme Microb Technol,
35:339-354.
[33] Cerniglia C (1992) Biodegradation of polycyclic aromatic
hydrocarbons. Biodegradation, 3: 351-368.
[34]Viñas M, Sabaté J, Espuny M, Solanas M (2005) Bacterial Community
Dynamics and Polycyclic Aromatic Hydrocarbon Degradation during
Bioremediation of Heavily Creosote-Contaminated Soil. Appl Environ
Microbiol, 71: 7008-7018.
[35]Vila J, Lopez Z, Sabate J, Minguillon C, Solanas A, Grifoll M (2001)
Identification of a novel metabolite in the degradation of pyrene by
Mycobacterium sp. Strain AP1: actions of the isolate on two- and
three-ring polycyclic aromatic hydrocarbons. Appl Environ Microbiol, 67:
5497–5505.
[36]Pino N, Carvajal S, Gallo A, Peñuela G (2012) Comparación entre
bioestimulación y bioaumentación para la recuperación de suelos
contaminados con diesel. Rev Producción+Limpia, 7(1): 101-108.
[37]Dashtban M, Schraft H, Syed T, Qin W (2010) Fungal biodegradation
and enzymatic modification of lignin. Int J Biochem Mol Biol, 1(1):
36–50.
[38] Lladó S, Grácia E, Solanas A, Viñas M (2013) Fungal and bacterial
microbial community assessment during bioremediation assays in an aged
creosote-polluted soil. J. Soil Biology and Biochemistry, 67:114-123.
[39] Asgher M, Nawaz B, Ashraf M, Legge R (2008) Recent developments in
biodegradation of industrial pollutants by white rot fungi and their
enzyme system. Biodegradation, 19:771-783.
[40] Rubilar O, Diez M, GianfredaL (2008) Transformation of chlorinated
phenolic compounds by white rot fungi. Crit. Rev. Environ. Sci. Technol,
38: 227-268.
[41] Sánchez C (2009) Lignocellulosic
residues: biodegradation and bioconversion by fungi. Biotechnol. Adv,
27: 185-194.
[42] GianfredaL, Rao M, Scelza R, Scotti R (2010) Role of enzymes in the
remediation of polluted environments. J. soil sci. plant nutr, 10 (3):
333- 353.
[43] Naranjo L, Pernía B, Guerra M, Demey J, De Sisto A, Inojosa Y,
González M, Fusella E, Freites M, Yegres F (2013) Potential role of
oxidative exoenzymes of theextremophilic fungus Pestalotiopsis palmarum
BM-04 in biotransformation of extra-heavy crude oil. Microbial
Biotechnology, 6(6):720–730.
[44] Palanikumar L, Panneerselvam N (2010) Aloin: Medicinal Properties
and Future perspectives. Journal of Pharmacy Research, 3(11): 2682-2685
[45] Pointing S (2001) Feasibility of bioremediation by white-rot fungi.
Appl Microbiol Biotechnol, 57(1-2):20-33.
[46] Sienra M, Préndez M, Romero R (2002) Metodología para la
extracción, fraccionamiento y cuantificación de hidrocarburos aromáticos
policiclico presentes en material partículado urbano. Boletin de la
Sociedad Chilena de Química. Appl Microbiol Biotechnol, 47(4):
|
|
Revista QuímicaViva |