Sensor electroquímico para la determinación de sulfito
Laura, Méndez1; José Miguel, Ortega2; Marisela, Choy3
Laboratorio Electroquímica. Universidad de Los Andes. Venezuela-Mérida 5101.
Recibido 11 de Agosto 2013- Reenviado y Aceptado 1 de Diciembre 2013
Resumen
En el presente trabajo se describe un nuevo dispositivo electródico que
podría ser utilizado para la determinación de sulfito. Este dispositivo
está basado en el uso de un electrodo de pasta de carbón modificado con
p-rosanilina-formaldehído (PRA) en un buffer fosfato a pH 7. El
modificador fue soportado sobre alúmina neutra. El PRA-formaldehído ha
sido utilizado como un método estándar para la detección de dióxido de
azufre en la atmósfera y sulfitos en alimentos usando técnicas
espectroscópicas. Los resultados por voltametría cíclica y voltametría
de pulso diferencial muestran que el electrodo modificado con estas
especies químicas exhibe actividad cuando se sumerge en soluciones cuya
concentración es del orden milimolar en sulfito. Mediante el método de
adición de estándar se pudo determinar la concentración de sulfito en
dos muestras de vino blanco, cuyos valores oscilaron entre 0,34 y 0,36
mM. Se observó que las muestras no presentan interferencias provenientes
de la matriz para este análisis y los porcentajes de recuperación
exhiben valores ente 99 y 103.
Palabras Clave: Sulfito, Aditivos en alimentos, Para-rosanilina (PRA)
Electrochemical sensor for the determination of sulfite
Abstract
The present paper describes a new electrodic device which could be used
for the determination of sulfite. This device is based on the use of a
carbon paste electrode modified with p-rosaniline-formaldehyde (PRA) in
a phosphate buffer at pH 7. The modifier was supported on neutral
alumina.The pair PRA-formaldehyde has been used as a standard method for
the detection of sulfur dioxide in the atmosphere and sulfites in foods
by using spectroscopic techniques. The results from cyclic voltammetry
and differential pulse voltammetry show that the
p-formaldehyde-rosaniline modified electrode exhibits activity when
immersed in solutions whose sulfite concentration is in the order of
millimoles. It was observed that the samples do not show interference
from the matrix for this analysis and recovery rates exhibit values
between 99 and 103.
Keywords: Sulfite; Food aditive; Para-rosaniline
Introducción
Los sulfitos son frecuentemente usados como conservantes en los
alimentos. No obstante, a pesar de la eficiencia de los sulfitos en su
acción preservante, se ha determinado numerosos efectos adversos en el
ser humano, relacionados principalmente a su consumo. Por tal razón, la
Food and Drug Administration (FDA) requiere que la presencia de los
sulfitos en cantidades iguales o superiores a 10 ppm, en alimentos
procesados, deben ser declarados en la etiqueta.
La oxidación de sulfito es usualmente el primer método de detección
electroquímica y ha sido estudiado con una gran variedad de electrodos,
incluyendo platino (Gasana et al., 2003), oro (Li et al., 2002), varias
formas de carbón (Casella et al., 1995), óxidos metálicos (Corbo et al.,
2002), electrodo de platino modificado (Dadamos et al., 2009) y
biosensores (Dinckaya et al., 2007). El proceso de oxidación de
sulfitos, puede ser cuantificable en la mayoría de los electrodos y
ofrece una simple ruta de análisis, ya que tiende a ser métodos rápidos
y de bajo costos, en sustitución a los métodos de titulación (Isaac et
al., 2006).
Los electrodos de pasta de carbón modificado (EPCM), han presentado
gran interés en el desarrollo de sensores voltamétricos para
determinaciones analíticas, debido a su fácil preparación, baja
corriente de fondo y amplio rango de potencial (Kalcher et al., 1995).
En el presente trabajo se modificó un electrodo de pasta de carbón con
p-rosanilina-formaldehído, esta especie forma complejo con el sulfito y
ha sido usado como un método estándar para la detección de dióxido de
azufre en la atmósfera y sulfitos en alimentos usando técnicas
espectroscópicas. Estas especies fueron soportadas sobre alúmina neutra
y utilizada en la determinación de sulfito en muestras de vino blanco.
Parte experimental
Los reactivos utilizados fueron: Para-rosanilina (Aldrich), Sulfito
de sodio anhídrido (J.T. Baker), Aceite mineral o nujol (Aldrich),
Cloruro de potasio (Merck), Formaldehido (Merck), Grafito (Fischer
Chemical), Alúmina neutra para coluna (Merck), ácido tartárico
(Aldrich), ácido cítrico (Fischer Chemical), ácido ascórbico (Aldrich) y
todas las soluciones se prepararon con agua ultra pura (Mullipore, 18
MΩ).
El electrodo de pasta de carbón (EPC) fue preparado al mezclar
directamente polvo de grafito (G67-500) y nujol como aglomerante.
Mientras que el electrodo de pasta de carbón modificado (EPCM) a la
pasta de carbón se le agregó el modificador el cual está compuesto por
la mezcla PRA-formaldehído (1:1) soportado sobre alúmina neutra, en una
proporción 61,44%m/m carbón, 34,45%m/m nujol y 4,16%m/m modificador. La
mezcla se combinó hasta obtener la mayor uniformidad. El material
pastoso fue empacado en un cilindro hueco de PlexyGlass con una varilla
de acero, la cual se usó como contacto eléctrico con el circuito del
potenciotato.
El electrodo con una superficie fresca, fue colocado en la celda
electroanalítica en una solución acuosa de sulfito de sodio cuyas
concentraciones se varió entre 3 y 50 mM. Además, se utilizó como
electrolito de soporte un buffer fosfato a pH 7 y KCl a pH 7.
Para este estudio se utilizaron como técnicas de análisis
voltametría cíclica y de pulso diferencial. Las medidas electroquímicas
fueron realizadas en un Potenciostato/Galvanostato Autolab 30/PGSTAT 30,
acoplado a un procesador de datos. La celda electroanalítica consistió
en un sistema de tres electrodos, el electrodo de referencia (Ag/AgCl),
el contraelectrodo de Pt y el electrodo de trabajo (EPC y EPCM). Todos
los reactivos fueron de grado analítico
Resultados y Discusión
a. Preparación y caracterización de un electrodo pasta de carbón
modificado con PRA-formaldehído
En la figura 1, se muestra los voltagramas cíclicos de electrodo de
pasta de carbón sin modificar (EPC) y electrodo de pasta modificado
(EPCM) en ausencia de alúmina como soporte. El grafico muestra una
disminución en la corriente de oxidación del sulfito cuando se modifica
con PRA-formaldehido. Sin embargo, la corriente pico en el electrodo
modificado aparecen a valores menos positivos (aproximadamente 0,800V)
que aquellas observadas para el electrodo sin modificar (1,000V). Parece
que la modificación favorece energéticamente la oxidación de sulfito a
potenciales menores. La disminución de la corriente se debe a la poca
estabilidad del modificador en la pasta ya que se observó cómo el
PRA-formaldehido, el cual es coloreado, se escapa de la pasta por
difusión hacia el seno de la solución.
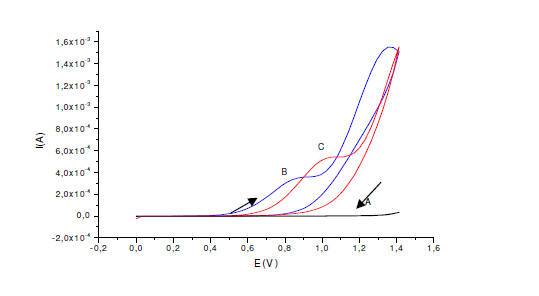
Figura 1. Oxidación del sulfito por voltametria cíclica en KCl 0.1 M a
pH 7, v=50mVs-1. A) En ausencia de sulfito, usando EPCM y EPC; B) EPCM
en Na2SO3 50mM; C) EPC sin modificar en Na2SO3 50mM
Se procedió a mejorar la estabilidad de EPCM mediante la adición de
alúmina. La alúmina retiene por adsorción al PRA-formaldehído en la
pasta. El porcentaje de modificador, PRA-formaldehido-alúmina, fue
incrementándose a medida que se registraba la respuesta del electrodo en
una solución de Na2SO3 3mM. La figura 2 resume los resultados. La
corriente de pico alcanzó un máximo para una composición
grafito-nujol-modificador de 61,44%m/m, 34,45%m/m y 4,16%m/m,
respectivamente. Para valores mayores del modificador (alúmina +
PRA-formaldehido) la corriente decrece debido a la disminución de la
coherencia mecánica de la pasta del electrodo. La corriente también
disminuye a porcentajes menores a 4,16 debido probablemente a la
disminución del PRA- formaldehido en la composición de la pasta.
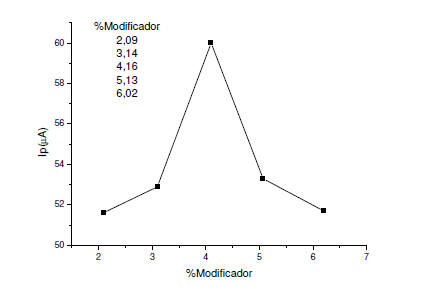
Figura 2. Ip en función al % de modificador en un EPCM en buffer de
fosfato pH 7 en Na2SO3 3mM. v = 8mVs-1. ΔE= 75mV.
El efecto de la incorporación de la alúmina a la pasta de carbón
sobre la oxidación de sulfito puede ser observado en la figura 3. En
este caso no se observó la difusión del modificador hacia el seno de la
solución. La incorporación de la alúmina como soporte origina mayores
corrientes en el EPCM que en el EPC. Sin embargo, el potencial pico
cuando se usó EPCM de la figura 3 aparece desplazado a valores más
positivos en el observado en la figura 1, donde no se usó alúmina.
Posiblemente, la resistencia del electrodo se incrementó con el aumento
de la proporción de alúmina. La oxidación de sulfito en el electrodo
modificado ocurre siempre a menor potencial que en los electrodos sin
modificar. El efecto del modificador es claro en presencia y en ausencia
de la alúmina, pues favorece energéticamente la oxidación del analito.
La presencia de la alúmina en la composición de la pasta del electrodo
no afecta significativamente la magnitud de la corriente, pero mejora la
estabilidad del electrodo, haciéndolo útil para determinaciones
analíticas.
En los voltagramas de pulso diferencial para el SO3-2 de la figura
4.A, se observa que la corriente pico aumenta linealmente con la
concentración de sulfito, siendo este comportamiento estable y
reproducible. En la figura 4.B se muestra la curva de calibración
correspondiente, la cual exhibe una zona lineal en el intervalo de
concentración comprendido 0,22 y 0,73mM SO3-2, obteniéndose un
coeficiente de correlación r = 0,9976, con una desviación estándar
(SY/X) de 0,55692. La ecuación de regresión es I = 20,57682 [SO3-2] -
0,49896, determinándose un límite de detección de 0,08 mM y el límite de
cuantificación 0,27 mM.
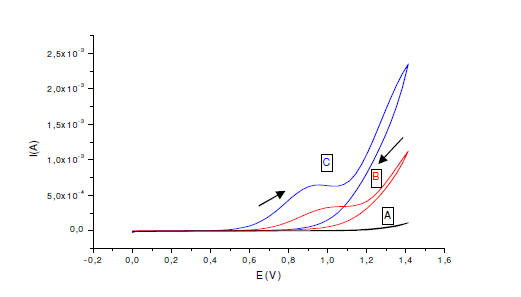
Figura 3. Oxidación del sulfito por voltametria cíclica en KCl 0.1 M a
pH 7, v=50mVs-1. A) buffer fosfato pH 7; B) EPC con alúmina en Na2SO3
50mM; C) EPCM en Na2SO3 50mM
El límite de detección alcanzado para este sistema electroquímico
fue 0,08mM, el cual es comparable con el reportado por García et al
(2005) en la determinación de sulfito sobre carbón vítreo modificado con
películas de hexacianoferrato de hierro (80 µM), pero más bajo que el
correspondiente al electrodo de aluminio modificado con hexacianoferrato
de níquel (3*10-6M) (Pournaghi- Azar, 2003).
Sin embargo, la modificación del presente trabajo del electrodo de
pasta de carbón es de fácil construcción, el electrodo es muy económico
y fácil de operar que el electrodo de aluminio o carbón vítreo y tiene
ventaja de tener superficies totalmente renovadas para cada medida.
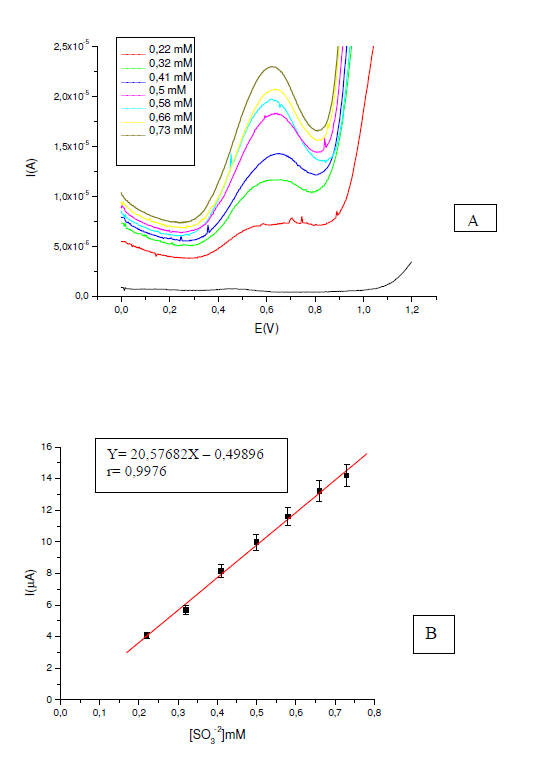
Figura 4. A) Voltagramas de pulso diferencial, para varias
concentraciones de SO3-2 en buffer fosfato a pH 8, v=8mVs-1. B) Curva de
calibración para SO3-2 construida a partir de los voltagramas de pulso
diferencial.
b. Estudio de interferencias
El estudio de interferencias fue realizado para evaluar el efecto
interferente del ácido tartárico, ácido cítrico, ácido ascórbico,
glucosa y sacarosa en el sistema utilizado. Estas sustancias fueron
analizadas porque acompaña al sulfito en las muestras reales, como es el
caso de bebidas y alimentos. Para poner a prueba el efecto de las
sustancias interferentes mencionadas anteriormente, se prepararon
soluciones de igual concentración de sulfito y del interferente. La
concentración de sulfito se mantiene constante y se le fue adicionando
alícuota o pequeños volúmenes de la especie interferente, lo que implica
el aumento de la concentración del interferente. Así, determinar el
rango de concentración donde estas especies interferentes, no
interfieren con la señal de oxidación del sulfito, y poder detectar la
concentración de sulfito en muestras reales, sin necesidad de realizar
un pretratamiento previo a la muestra; para ello, se graficaron las Ip
en función de la concentración de la especie interferente.
En la figura 5 y 6, se observa que en un rango de concentración 0,0
– 0,5 mM las especies interferentes como el ácido tartárico y el ácido
cítrico, no interfieren con la señal de oxidación sulfito, porque
permanece constante. Se puede inferir que a partir de 0,58 mM, el ácido
tartárico y el ácido cítrico puede comenzar a influir en la
determinación del sulfito en muestras reales.
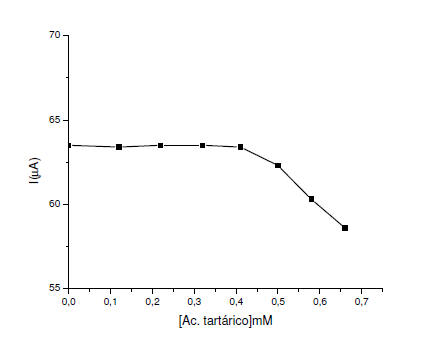
Figura 5. Efecto de la concentración ácido tartárico sobre la corriente
de pico en el EPCM con alúmina en buffer fosfato a pH 8. = 8mVs-1. ΔE=
75mV.
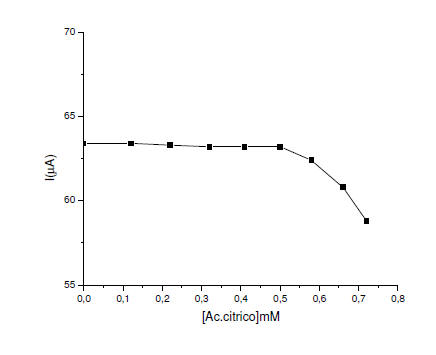
Figura 6. Efecto de la concentración ácido cítrico sobre la corriente de
pico en el EPCM con alúmina en buffer fosfato a pH 8. = 8mVs-1. ΔE=
75mV.
Mientras, en el análisis realizado para la especie interferente,
como el ácido ascórbico, se revela que esta especie estudiada interfiere
seriamente en la respuesta de oxidación del sulfito cuando está presente
en una concentración mayor a 0,32 mM, como se muestra en la figura 7.
Esto concuerda con lo reportado por Pournaghi- Azar, 2003 y Dadamos et
al, 2009; sin embargo, las muestras de alimentos no poseen generalmente
concentraciones tan elevadas de ácidos ascórbico por lo que no debería
ser un problema en la determinación de sulfitos (García et al, 2005).
En la figura 8 y 9 se observa que los azúcares (glucosa y sacarosa)
no interfieren en la determinación de sulfito, sino cuando está presente
en exceso con respecto al sulfito (Pournaghi- Azar, 2003)
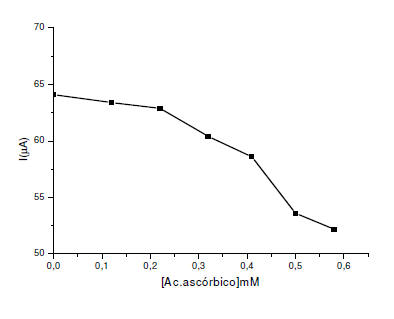
Figura 7. Efecto de la concentración ácido ascórbico sobre la corriente
de pico en el EPCM con alúmina en buffer fosfato a pH 8. = 8mVs-1. ΔE=
75mV.
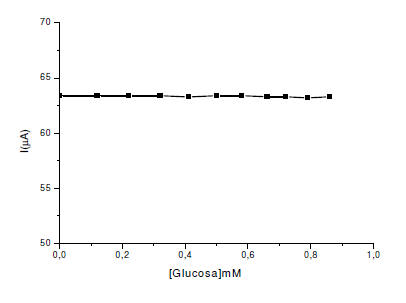
Figura 8. Efecto de la concentración glucosa sobre la corriente de pico
en el EPCM con alúmina en buffer fosfato a pH 8. = 8mVs-1. ΔE= 75mV.
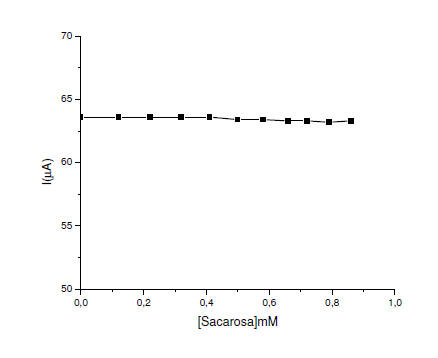
Figura 9. Efecto de la concentración sacarosa sobre la corriente de pico
en el EPCM con alúmina en buffer fosfato a pH 8. = 8mVs-1. ΔE= 75mV.
En el estudio de interferencia se puede concluir, que en una rango
de concentración de 0,0 – 0,5 mM las especies interferente estudiadas no
afecta significativamente la determinación de sulfito, a excepción, del
ácido ascórbico, cuando se encuentra en concentraciones elevadas.
c. Determinación de sulfito usando un electrodo modificado con
PRA-formaldehído en muestra de vino
Con el fin de examinar la aplicabilidad del EPCM, el dispositivo se
usó para la determinación de sulfito en muestra reales de vino blanco.
Para ello se aplicó el método de adición estándar y la curva de
calibración sencilla, tomando en consideración que las interferencias
más comunes que pueda presentar el vino no son significativas para el
intervalo concentraciones entre 0,0-0,5 mM de las interferentes.
Las muestras de vino blanco que se analizaron de dos vinos provienen
de dos marcas comerciales diferentes, el vino 1 el “Frontera” y el vino
2 de “Las Condes”, ambos de procedencia chilena. Se tomaron alícuotas de
10 ml, las cuales se ajustaron a pH 8 y sucesivamente se realizaron las
medidas por VPD.
El método de adición estándar se realizó con la finalidad de
verificar si existen interferencias provenientes de la matriz de las
muestras de vino blanco. Se realizaron curvas de adición estándar,
variando el volumen del estándar y manteniendo el volumen fijo de la
muestra, que se desee analizar. Cada curva de calibrado incluyó al menos
una serie de cuatro puntos, y se midieron un mínimo de tres veces cada
uno. En la figura 11.A y 11.B se muestra las gráficas de adición
estándar obtenida para ambas muestra de vino de blanco, obteniéndose la
concentración del sulfito en la muestras de vino blanco por
extrapolación de la línea segmentada. Los valores se muestran en la
tabla 1.
Tabla 1. Determinación de sulfito en muestras de vino blanco usando un
electrodo modificado con PRA-formaldehído
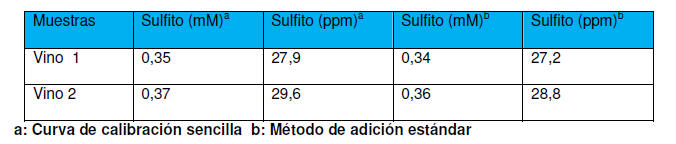
De los resultados obtenidos en la tabla 1 se puede inferir que la
cantidad de sulfito encontrada en las muestras de vino 1 y 2 están por
encima de los valores encontrados por Cardwell y Christophersen (2000)
para vino blanco, donde usaron un electrodo de platino acoplado a un
sistema de inyección de flujo. Mientras que la cantidad de sulfito
establecida en muestra de vino blanco oscila en un rango de 0,3 -1,8mM
según García et al (2005) y los valores encontrados usando el EPCM están
dentro de los niveles permitidos.
Al comparar el valor de la pendiente de la curva de calibración
sencilla que fue de 20,57 µA/mM, con los valores obtenidos de la
pendiente para las diferentes curvas del método de adición estándar de
las diferentes muestras de vino blanco (20,18 µA/mM y 20,20 µA/mM), se
observa que son muy reproducibles y no muestran diferencias
significativas para las dos muestras de vino blanco. Este comportamiento
permite concluir que no existen interferencias de matriz, en la
metodología aplicada para la determinación de sulfito en diferentes
tipos de muestras de vino blanco.
A
B
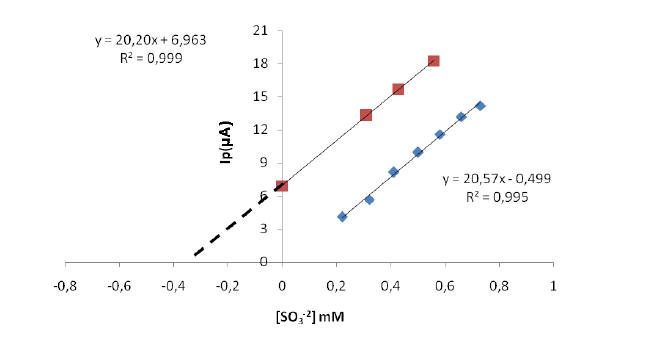
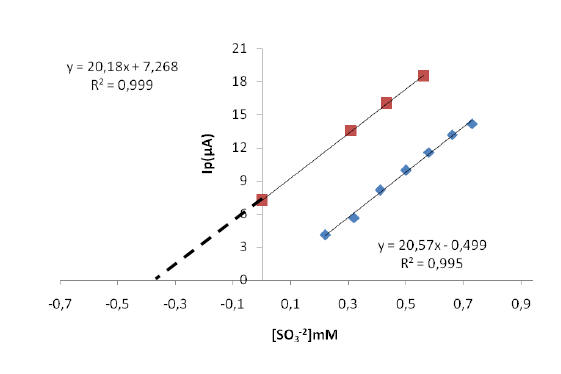
Figura 11. A) Curva de calibración por adición estándar, para el vino 1
(Frontera) en buffer fosfato a pH 8, v=8mVs-1. B) Curva de calibración
por adición estándar, para el vino 2 (Las Condes) en buffer fosfato a pH
8, v=8mVs-1.
d. Estudio de recuperación para diferentes muestras de vino blanco
Para validar el procedimiento analítico se prepararon tres
soluciones con una concentración de sulfito conocida de 0,5 mM. Estos
resultados se muestran en la tabla 2 donde se puede observar que la
recuperación oscila entre 98,92 y 102,95 %, con un CV< 3%, lo que nos
sugiere una exactitud aceptable del procedimiento analítico, sin
interferencias de la matriz.
Tabla 2. Porcentaje de recuperación encontrada en SO3-2 en diferentes
muestras de vino blanco

Conclusiones
Se ha diseñado un nuevo electrodo para la determinación de sulfito
basado en el uso de pasta carbón modificada con PRA-formaldehído,
encontrándose que la composición óptima para la elaboración de los
electrodos de pasta de carbón modificados fueron de 61,44%m/m carbón,
34,45%m/m nujol y 4,16%m/m modificador. La modificación favorece
energéticamente la oxidación de sulfito a potenciales menores.
La presencia de alúmina en la composición de la pasta del electrodo
mejora la estabilidad del sistema, de manera tal que este electrodo
podría ser utilizado en determinaciones analíticas. Este sensor exhibe
una zona lineal en el intervalo de concentración comprendido 0,22 y 0,73
mM SO3-2 con un coeficiente de correlación r = 0,9976, donde el límite
de detección es 0,08 mM y el límite de cuantificación es 0,27 mM.
Mediante el método de adición de estándar se determinó la
concentración de sulfito en dos muestras de vino blanco que oscila en un
rango de 0,34 y 0,36 mM y a su vez se demostró que las muestras no
presenta interferencias proveniente de la matriz y pueden utilizarse sin
tratamiento previo.
El estudio realizado con diferentes muestras de vino blanco,
empleando electrodo de pasta de carbón modificado con PRA-formaldehído,
mostraron en todos los casos una recuperación cuantitativa de 98,92 -
102,95 % y con un CV< 3%.La validación del método mostró que el nuevo
dispositivo tiene un rango lineal de 0,22-0,73 mM para el sulfito en
vino blanco, con un límite de detección y cuantificación comparable a
los reportados en la bibliografía.
Referencias
Casella. I. y Marchese R. (1995). Sulfite oxidation at a platinum glassy
carbon electrode. Determination of sulfite by ion exclusion
chromatography with amperometric detetion. Anal. Chim. Acta. 311:199
208.
Cardwell, T y Christophersen, M. (2000). Determination of sulfur dioxide
and ascorbic acid in beverages using a dual channel flow injection
electrochemical detection system. Anal. Chim. Acta. 416: 105-110
Corbo, D y Bertotti, M. (2002). Use of a copper electrode in alkaline
medium as an amperometric sensor for sulphite in a flow-through
configuration. Anal. Bional. Chem., 374:416 -420.
Dadamos, T y Teixeira, M. (2009). Electrochemical sensor for sulfite
determination based on a nanostructured copper-salen film modified
electrode. Electrochimica Acta. 54:4552.
Dinckaya, E, Sezginturk, M, Akyilmaz, E, Nil, F. (2007). Sulfite
dtermination using sulfite oxidase biosensor based glassy carbón
electrode coated with thin mercury film. Food Chemistry. 101: 1540-1544.
Gasana, E, Westbrock, P., Tommerman, E., Thum H,P. y Kickens, P. (2003).
A wall-jet disc electrode for simultaneous and continuous on-line
measurement of sodium dithionite, sulfite and indigo concentrations by
means of multistep chronoamperometry. Anal. Chim. Acta. 486:73.
García,T, Casero, E, Lorenzo, E, Pariente, F. (2005). Electrochemical
sensor for sulfite detrmination based on iron hexacyanoferrate film
modified electrodes. Sensors and Actuators B. 106:803-809
Isaac, A., Livingstone, C., Wain, A.C., Compton, R. G., y Davis, J.
(2006). Electroanalytical methods for the determination of sulfite in
food and beverages. Trends in Analytical Chemistry. 25:589 -598.
Kalcher, K., Kauffman, J.M., Svancara, I., Vytras, K., Neuhold, C., y
Yang, Z. (1995).Sensors based on carbon paste in electrochemical
analysis: A review with particular emphasis on the period 1990-1993.
Electroanalysis. 7:5-22.
Li, H., Wang, J.Q., Xu, J,M., Zhang, W y Jin, L, T. (2002). A novel
nano-Au-assembled amperometric SO2 gas sensor: preparation,
characterization and sensing behavior. Sensor Actuators B., 87:18.
Li, Y y Zhao, M. (2006). Simple methods for rapid determination of
sulfite in food products. Food Control. 17: 975-980.
Pournaghi- Azar, M.H., Hydarpour, M., Dastangoo, H. (2003). Voltametric
and amperometric determination sulfite using an aluminum electrode
modified by nickel pentacyanonitrosylferrate film. Application to the
analysis of some real samples. 497:133.
|
|
Revista QuímicaViva |