Ideas de los estudiantes sobre pilas galvánicas y
libros de texto de Química de Bachillerato
Joan Josep
Solaz-Portolés*, Beatriz Sanmartín y Vicent Sanjosé
Departament de Didàctica de les Ciències Experimentals i Socials.
Universitat de València. España.
*Joan.Solaz@uv.es
Recibido 18 de marzo Aceptado 22 de abril
Versión
para imprimir
![]()
Resumen
En este trabajo
se lleva a cabo se lleva una revisión bibliográfica en la que se
recogen las concepciones alternativas de los estudiantes
universitarios y de secundaria sobre celdas galvánicas. Además, se
analizan libros de texto de 2º de Bachillerato españoles para
conocer cómo se presentan los conceptos problemáticos relacionados
con dichas celdas. Se concluye que los libros de texto tienen muchas
deficiencias en esta cuestión que pueden dificultar el aprendizaje,
y que se deberían introducir metodologías instruccionales que
posibiliten la comprensión adecuada de los conceptos.
Palabras
clave: concepciones de los estudiantes, pilas galvánicas, libros
de texto, comprensión de conceptos.
Students’ ideas about
galvanic cells and high school chemistry textbooks
Abstract
In this paper we carry out a bibliographic review that picks up
high school and university students’ alternative conceptions about
galvanic cells. Moreover, we analyze high school Spanish textbooks
(Grade 12) in order to know how the problematic concepts about
galvanic cells are presented. We conclude that these textbooks have
many shortcomings which can obstruct students’ learning. On the
other hand, it must be introduced instructional methodologies that
facilitate an appropriate understanding of concepts
Keywords:
students’ conceptions, galvanic cells, textbooks, understanding of
concepts.
Introducción
En los años recientes, la literatura de educación científica
está repleta de trabajos relacionados con la identificación,
explicación y mejora de las dificultades de los estudiantes en la
comprensión de conceptos científicos. Tales dificultades han sido
denominadas de diferentes modos: concepciones erróneas o errores
conceptuales (misconceptions), esquemas alternativos (alternative
frameworks), creencias intuitivas (intuitive beliefs),
preconcepciones (preconceptions), razonamiento espontáneo (spontaneous
reasoning), ciencia de los niños (children’s science), creencias
ingenuas (naive beliefs), concepciones alternativas (alternative
conceptions), conocimiento del sentido común (common sense knowledge),
ciencia de los alumnos (pupils’ science), concepciones de los
estudiantes (students’ conceptions), representaciones de los alumnos
(pupils’ representations) o concepciones de los alumnos (pupils’
conceptions).
Es bien conocido que los estudiantes tienen ideas alternativas sobre
los conceptos científicos, que resultan resistentes de cambiar y que
constituyen uno de los principales problemas en el aprendizaje de la
química (Mbajiorgu y Reid, 2006). Las ideas de los estudiantes en
diferentes áreas de las ciencia han sido recogidas por diferentes
investigadores (Driver, Guesne y Tiberghien, 1989; Carrascosa, 2005;
Hierrezuelo y Montero, 2006). Existe un gran consenso entre ellos
sobre sus características:
Los estudiantes tienen ideas y puntos de vista en muchos temas de
las ciencias, incluso desde los primeros años de su vida y antes de
recibir cualquier tipo de educación formal sobre el tema.
Estas descripciones ingenuas y preconcepciones explicativas difieren
normalmente de las que mantienen los científicos, pero resultan
útiles y coherentes para los estudiantes.
Son comunes en estudiantes de diferentes países.
A pesar de que los preconceptos tienen una influencia decisiva en el
aprendizaje que se lleva a cabo en el aula, los profesores suelen
desconocerlos.
Son resistentes al cambio por métodos de instrucción tradicional.
Esto es, los esquemas alternativos suelen verse inalterados por la
instrucción recibida, si ésta no los tiene implícitamente en
consideración.
En algunos casos guardan cierto paralelismo con concepciones
vigentes en ciertos momentos de la historia de la ciencia
Puede encontrarse en la bibliografía una amplia cantidad de
hipótesis acerca de las causas de las concepciones alternativas de
los estudiantes. Una de ellas apunta hacia los libros de texto (Abimbola
y Baba, 1996; King, 2010) que, como se ha visto en el caso de los
modelos atómicos, pueden llegar a dar una imagen distorsionada del
conocimiento científico (Solaz-Portolés, Sanjosé y Civera, 2012) .
En opinión de Carrascosa (2005) el libro de texto puede actuar de
dos formas: a) no proporcionando la información adecuada sobre los
conceptos o proporcionarla deficientemente; y b) ofreciendo de forma
explícita errores conceptuales.
A pesar de todo lo señalado anteriormente son realmente pocas las
investigaciones que han intentado abordar el problema de los errores
conceptuales en electroquímica y proponer alternativas
instruccionales. Pueden citarse al respecto: la metodología de
enseñanza basada en el cambio conceptual (Sanger y Greenbowe, 2000);
la enseñanza mediante modelos (Hudle y White, 2000), o el uso de
animaciones computerizadas (Burke, Greenbowe y Windschitl, 1998).
En el presente trabajo nos vamos a centrar en las concepciones
alternativas de los estudiantes sobre las celdas galvánicas y los
libros de texto de química de Bachillerato. Nuestro objetivo es
llevar a cabo una revisión bibliográfica sobre las ideas de los
estudiantes sobre conceptos implicados en las celdas galvánicas y
analizar cómo se presentan dichos conceptos en los libros de texto
de Bachillerato. Nuestra hipótesis es que los libros de texto
presentan los contenidos relativos a celdas galvánicas de manera
parcial y que puede inducir a confusión.
Concepciones alternativas de los estudiantes sobre celdas
galvánicas
Los investigadores en la didáctica de la química han detectado
dificultades y concepciones alternativas en el aprendizaje de la
electroquímica. En concreto, Allsop y George (1982) han encontrado
que los estudiantes tienen dificultades en la utilización de los
potenciales estándar de reducción para predecir la espontaneidad de
las reacciones, y en la representación mediante diagramas de las
celdas electroquímicas. Briss y Truax (1990), por su parte, han
puesto de relieve las confusiones de estudiantes y de los libros de
texto en la enseñanza de la electroquímica. En los estudios Garnett,
Garnett y Treagust (1990a, 1990b) se pone de manifiesto poca
comprensión y muchos errores conceptuales en electroquímica, que los
autores atribuyen a las siguientes razones: desconocimiento de los
prerrequisitos, interpretaciones erróneas del lenguaje, uso de
múltiples definiciones y modelos, aprendizaje de conceptos y
algoritmos de resolución sin la comprensión adecuada.
En estudios posteriores, Garnett y Treagust (1992a, 1992b) llevaron
a cabo entrevistas clínicas a estudiantes de enseñanza secundaria
que revelaron ideas erróneas sobre: la identificación de cátodo y
ánodo, y sus funciones; el flujo de corriente de corriente en las
celdas electroquímicas, su origen y las partículas responsables; y
la función del puente salino en las celdas galvánicas. Ogude and
Bradley (1994) en un trabajo realizado con estudiantes de secundaria
y universitarios pudieron comprobar que un buen número de ellos
creen que los electrones circulan a través del puente salino y de
las disoluciones electrolíticas, e incluso no son capaces de señalar
el sentido del movimiento de iones y electrones de manera correcta.
Posteriormente estos mismos autores (Ogude y Bradley, 1996)
identificaron las dificultades de los estudiantes en las celdas
electroquímicas en relación a: sus componentes, fuerza
electromotriz, procesos en los electrodos y terminología.
Sanger y Greenbowe (1997a, 1997b) replicaron unos años después las
entrevistas sobre celdas galvánicas y electrolíticas efectuadas por
Garnett y Treagust (1992a, 1992b) y las ampliaron para el caso de
las celdas de concentración. Hallaron los mismos errores
conceptuales y señalaron algunos más, concluyendo, entre otras
cosas, que los estudiantes: no saben explicar cómo se origina la
corriente eléctrica; creen que ánodo y cátodo dependen de su
localización física; piensan que el cátodo siempre está cargado
positivamente y ánodo negativamente; sostienen que los electrones
fluyen por las disoluciones acuosas; y afirman que el flujo de
corriente iónico en los electrolitos y puente salino es debido
únicamente a los aniones. Estos mismo autores (Sanger y Greenbowe,
1999), efectuaron un análisis de libros de texto que les llevó a
concluir que dichos libros pueden ser origen de muchos de los
errores conceptuales en electroquímica. En particular, descubrieron
contenidos en los textos que no muestran las relaciones entre
conceptos, y que pueden inducir a creer que los electrones pueden
fluir por las disoluciones electrolíticas y el puente salino.
En el trabajo fin de Máster de Sanmartín (2012), se administró un
cuestionario de tres ítems sobre celdas galvánicas con el que se
pretendía conocer las ideas de los estudiantes sobre el flujo de
corriente eléctrica y el principio de electroneutralidad en las
disoluciones electrolíticas. En los resultados de ese trabajo se
obtienen porcentajes elevados de estudiantes, preuniversitarios y
universitarios, que cometen errores conceptuales relacionados con el
movimiento de electrones y de iones en las disoluciones
electrolíticas (incluyendo el puente salino), y el principio de
electroneutralidad.
Análisis de libros de texto de Química de Bachillerato
Metodología
Como ya se ha dicho, queremos buscar cómo se presentan en los
libros de texto de Bachillerato las cuestiones más problemáticas
para los estudiantes sobre celdas galvánicas (que, en el caso de
España se presentan en los libros de texto de química de 2º de
Bachillerato). Para ello, elaboramos una plantilla con siete ítems
ad hoc (Tabla 1). La validez de contenido de estos ítems fue
contrastada por dos expertos: un profesor de enseñanza secundaria
(doctor en química con más de 25 años de experiencia docente) y un
profesor universitario.
|
ÍTEMS |
SI |
Parcialmente |
NO |
|
1.¿Se especifica que una célula galvánica es un sistema multifásico que genera una diferencia de potencial entre sus terminales? |
|
|
|
|
2.¿Se indica que en una célula galvánica la reacción química produce un flujo de corriente eléctrica? |
|
|
|
|
3.¿Se describe en el texto que la corriente eléctrica producida, puede ser tanto de electrones como de iones? |
|
|
|
|
4.¿Se explica que la conducción eléctrica tanto en el puente salino como en las disoluciones electrolíticas, es debida al movimiento de iones? |
|
|
|
|
5.-¿Se razona para qué sirve el puente salino en una pila galvánica? |
|
|
|
|
6.¿Se discute qué partículas transportan la corriente eléctrica cuando se cierra el circuito, poniendo en contacto a través de un hilo conductor ambos electrodos, en cada parte de la célula galvánica? |
|
|
|
|
7.¿Se especifica el sentido del movimiento de los electrones y de los iones en cada parte de la pila galvánica y se explica el porqué? |
|
|
|
Tabla 1.Ítems
del cuestionario para el análisis de libros de texto
Los libros que fueron analizados mediante el cuestionario presentado
anteriormente pertenecen a la asignatura de química del 2º de
Bachillerato español (estudiantes de 17-18 años), que es el último
curso de enseñanza secundaria postobligatoria en España, y es
preparatorio para el ingreso en la universidad. En la Tabla 2
aparece el listado de libros sobre el que hemos realizado el
análisis.
|
1.-Cardona, A.R., Pozas, A., Martín, R. y Ruiz, A. (2003). Química 2 Bachillerato. Mc Graw-Hill: Madrid. |
|
2.-Del Barrio, J.I., Bárcena, A.I., Sánchez, A. y Caamaño, A.(2009). Química 2 Bachillerato. SM: Madrid. |
|
3.-VVAA (2009). Química 2 Bachillerato. EDEBÉ: Barcelona. |
|
4.-Fidalgo, J.A. y Fernández, M. R. (2009). Química 2 Bachillerato. Everest: León. |
|
5.-Quílez, J., Lorente, S., Sendra, F. y Enciso, E. (2009). Afinidad Química. Química 2 Bachillerato. ECIR: Paterna (València). |
|
6.-Peña. J. y Vidal, M.C. (2005). Química 2 Bachillerato. Oxford Educación: Madrid. |
|
7.-Morcillo, J. , Fernández, M.,y Carrión, E. (1998). Química 2 Bachillerato. Anaya: Madrid. |
|
8.-Andrés, D. M., Antón, J.L., Barrio, J., De la Cruz, M.C.y González, F. (2009). Química 2 Bachillerato. EDITEX: Madrid. |
|
9.-Masjuan, M.D. y Peregrín, J. (2009). Química 2 Bachillerato. Casals: Barcelona. |
Tabla 2. Libros de texto que han sido analizados.
Resultados
En la Figura 1 se muestran los porcentajes de respuestas a cada
uno de los 7 ítems de nuestro cuestionario de análisis de los libros
de texto
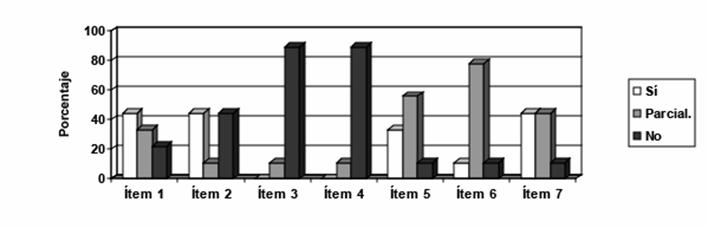
Figura 1. Representación gráfica de los porcentajes de respuestas de cada una de las categorías (Sí, Parcialmente y No) en los ítems del cuestionario de análisis de textos.
La representación gráfica refleja que:
Ítem 1. El 44% de los textos recoge como mínimo la información
“Una pila galvánica es un sistema electroquímico multifásico en el
que la diferencia de potencial entre sus terminales está originada
por las diferencias de potencial en la interfases. Estas diferencias
de potencial en las interfases resultan de las reacciones químicas
que se producen”. El 33% la recoge parcialmente.
Ítem 2. En el 44% de los textos aparece que “En la unión entre los
electrodos de una pila galvánica (en situación de circuito cerrado)
se produce una transferencia de electrones y, en consecuencia, un
flujo de electrones que provienen de la oxidación de una especie
química (que va siempre va acompañada de la correspondiente
reducción de otra especie química), esto es, de una reacción
química”. En el 11% aparece de manera parcial esta información.
Ítem 3. En ningún texto se explica que “En una pila galvánica todas
sus fases conducen la corriente eléctrica. Los terminales de metal
de la celda galvánica son conductores electrónicos, esto es, la
corriente eléctrica es transportada por electrones. Las disoluciones
electrolíticas son conductoras iónicas, es decir, son los iones los
que conducen la corriente eléctrica”. En el 11% de los textos se
introduce parcialmente esta información.
Ítem 4. Ninguno de los textos analizados refleja que “Tanto en las
disoluciones electrolíticas de ambas semiceldas, como en el puente
salino (que permite la transferencia iónica entre semiceldas y, por
tanto, cerrar el circuito) la conducción eléctrica es llevada a cabo
por iones”. El 11% refleja parcialmente esta información.
Ítem 5. En el 33% de los libros de texto puede leerse que “El puente
salino tiene una doble función: cerrar el circuito y que las
semiceldas mantengan la electroneutralidad (mismo número de cationes
que de aniones)”. En el 56% de los libros de texto puede leerse
parte de este contenido conceptual.
Ítem 6. En el 11% de los textos puede encontrarse que “Las
partículas que transportan la corriente eléctrica en una celda
galvánica son: los electrones en las partes metálicas y los iones en
las disoluciones electrolíticas (semiceldas y puente salino)”. En
cambio, en el 56% no se encuentra toda la información completa.
Ítem 7. En el 44% de los textos se razona que “El movimiento de los
electrones en una pila galvánica se produce desde el polo negativo
(ánodo, donde se produce la oxidación) hacia el positivo (cátodo,
donde se produce la reducción). El movimiento de los iones de las
disoluciones electrolíticas depende de su carga: los aniones se
dirigen hacia el ánodo y los cationes hacia el cátodo”. En otro 44%
de los textos el razonamiento es ofrecido incompleto.
Como puede observarse no hay un solo ítem en el que el porcentaje de
respuestas afirmativas a la pregunta del ítem supere el 50%, es
decir, en ningún ítem la mayoría de los textos ofrece la información
conceptual completa. Se destacan los ítems 3, 4, 5 y 6, cuyos
porcentajes no superan en ningún caso el 33%, siendo especialmente
relevantes los porcentajes de respuesta afirmativa de los ítems 3
(0%,), 4 (0%) y 6 (11,1%). Esto es, no hay ningún libro de texto
entre los analizados que mencione que la corriente eléctrica puede
ser tanto de electrones como de iones, y un solo libro explicita
claramente qué partículas conducen la corriente eléctrica en cada
una de las partes que constituyen una pila galvánica.
Se debe resaltar también que tampoco aparecen en los libros de texto
ilustraciones o diagramas que ayuden a visualizar y comprender de
una manera adecuada cada uno de los aspectos recogidos en el
cuestionario de análisis de textos. Todos los textos contienen
ilustraciones o diagramas pero, o bien no se recogen algunos de los
aspectos mencionados en este trabajo, o bien si se incluyen no se
acompañan de un contenido textual que ayude a la comprensión.
Conclusiones y discusión
Se ha visto que los estudiantes tienen problemas en la
comprensión de los procesos que ocurren en el seno de una pila
galvánica. También se han identificado los errores conceptuales que
frecuentemente cometen los estudiantes, y que se centran
principalmente en: generación y flujo de la corriente eléctrica y
partículas que transportan la corriente eléctrica en cada parte de
la pila. Tal y como preveíamos, los libros de texto no constituyen
una herramienta fiable para evitar que los estudiantes, tras la
instrucción, tengan concepciones alternativas sobre las celdas
galvánicas. En la mayoría de los textos no aparecen las oportunas
explicaciones, razonamientos o ilustraciones sobre:
El origen de la diferencia de potencial entre los terminales de la
celda electroquímica.
Características del flujo de corriente eléctrica generada
Movimiento de electrones y de iones en cada parte de la pila
Papel del puente salino en la celda electroquímica.
No nos debe, pues, resultar extraño que los estudiantes tengan
dificultades y errores conceptuales en electroquímica, como tampoco
no nos debe resultar sorprendente que los profesores en formación
también los tengan (Özkaya 2002; Özkaya, Üce y Sahim, 2003). No
obstante, incluso con libros de texto bien elaborados, y que
atiendan a las dificultades que presentan ciertos conceptos, la
investigación en la didáctica de la química nos muestra que es
necesario introducir en el aula una metodología de enseñanza que,
mediante actividades de aprendizaje que aborden situaciones
problemáticas, permita a los estudiantes construir su conocimiento a
partir sus ideas previas (Acar y Tarhan, 2006).
En este sentido, destacaremos la estrategia de enseñanza para el
cambio conceptual propuesta por Níaz y Chacón (2003) para mejorar la
comprensión de los estudiantes de secundaria en electroquímica. En
dicha estrategia se pone el acento en la presentación de situaciones
que generen un conflicto cognitivo en los estudiantes, es decir, que
pongan en evidencia sus ideas (erróneas normalmente) y posibiliten
su cambio hacia las aceptadas por la comunidad científica. Tampoco
resultaría desdeñable la aplicación de una metodología de
enseñanza/aprendizaje ABP (Aprendizaje Basado en Problemas) que ha
mostrado sus bondades en varios estudios (Solaz-Portoles, Sanjosé y
Gómez, 2011).
En relación con los libros de texto, el estudio de Özmen,
Demircioglu y Demircioglu (2011) pone de relieve que es posible
superar los errores conceptuales de los estudiantes de Química
mediante textos educativos basados en el modelo del cambio
conceptual, acompañados de animaciones computerizadas. En el caso
concreto de las pilas galvánicas, y partiendo de las características
básicas de un texto de ciencias que facilitan el aprendizaje (Solaz-Portolés,
2009), nuestra hipótesis es que un libro de texto puede ayudar mucho
a reducir errores conceptuales siempre que incluya todo el contenido
conceptual al que hacen referencia los siete ítems de nuestro
cuestionario de análisis de textos, junto con actividades de
aprendizaje para ser realizadas en un ambiente de aprendizaje
colaborativo y que:
Presenten situaciones teórico-prácticas donde los estudiantes
intenten explicar el funcionamiento de las pilas galvánicas y saquen
a la luz sus esquemas conceptuales
Pongan en evidencia las insuficiencias de los esquemas conceptuales
de los estudiantes
Acerquen a los estudiantes hacia las concepciones aceptadas por la
comunidad científica, mostrando sus mayores virtudes, su rigor y
coherencia de acuerdo con las teorías vigentes.
Bibliografía
Abimbola, I. O., & Baba, S. (1996). Misconceptions and
alternative conceptions in science textbooks: The role of teacher as
filter. The American Biology Teacher, 58(1), 14-19.
Acar, B. & Tarhan, L. (2006). Effect of cooperative learning
strategies on students’ understanding of concepts in
electrochemistry. International Journal of Science and Mathematics
Education, 5, 343-373.
Allsop, R. T., & George N. H. (1982). Redox in Nuffield advanced
chemistry. Education in Chemistry, 19, 57–59.
Birss, V. I., & Truax, R. (1990). An effective approach to teaching
electrochemistry. Journal of Chemical Education, 67(5), 403-408.
Burke, K. A., Greenbowe, T. J., & Windschitl, M. A. (1998).
Developing and using conceptual computer animations for chemistry
instruction. Journal of Chemical Education, 75, 1658-1661.
Carrascosa, J. (2005). El problema de las concepciones alternativas
en la actualidad (Parte I). Análisis de las causas que las originan
y/o mantienen. Revista Eureka sobre la Enseñanza y Divulgación de
las Ciencias, 2, 183-208.
Driver, R., Guesne, E., & Tiberghien, A. (1989) Ideas científicas en
la infancia y la adolescencia. Madrid: MEC/Morata.
Garnett, P.J., Garnett, P.J., & Treagust, D.F. (1990a). Implications
of research of students’ understanding of electrochemistry for
improving science curricula and classroom practice. International
Journal of Science Education, 12, 147-156.
Garnett, P.J., Garnett, P.J., & Treagust, D.F. (1990b). Common
misconceptions in electrochemistry: Can we improve students’
understanding of this topic? Chemeda: Australian Journal of Chemical
Education, 27, 3-11.
Garnett, P.J., & Treagust, D.F. (1992a). Conceptual difficulties
experienced by senior high school students of electrochemistry:
Electric circuits and oxidation-reduction equations. Journal of
Research in Science Teaching, 29, 121-142.
Garnett, P.J., & Treagust, D.F. (1992b). Conceptual difficulties
experienced by senior high school students of electrochemistry:
Electrochemical (galvanic) and electrolytic cells. Journal of
Research in Science Teaching, 29, 1079-1099.
Hierrezuelo, J. & Montero, A. (2006). La ciencia de los alumnos: su
utilización en la didáctica de la Física y Química. Fontamara:
México.
Hudle, P.A. & White, M.D. (2000). Using a teaching model to correct
known misconceptions in electrochemistry. Journal of Chemical
Education, 77(1), 104-110.
King, C. J. H. (2010). An analysis of misconceptions in science
textbooks: Earth sciences in England and Wales. International
Journal of Science Education, 32(5), 565-601.
Mbajiorgu, N., & Reid, N. (2006): Factors Influencing Curriculum
Development in Chemistry. The Higher Physical Education Sciences
Academy Center. University of Glasgow.
Níaz, M., & Chacón, E. (2003). A conceptual change teaching strategy
to facilitate high school students’ understanding of
electrochemistry. Journal of Science Education and Technology,
12(2), 129-134.
Ogude, A. N., & Bradley, J. D. (1994). Ionic conduction and
electrical neutrality in operating electrochemical cells. Journal of
Chemical Education, 71, 29–31
Ogude A. N., & Bradley, J. D. (1996). Electrode processes and
aspects relating to cell emf, current, and cell components in
operating electrochemical cells: pre-college and college student
interpretation. Journal of Chemical Education, 73, 1145-1149.
Özkaya, A. R. (2002). Conceptual difficulties experienced by
prospective teachers in electrochemistry: Half-cell potential, cell
potential, and chemical and electrochemical equilibrium in galvanic
cells. Journal of Chemical Education, 79(6), 735-738.
Özkaya, A. R., Üce, M., & Sahin, M. (2003). Prospective teachers’
conceptual understanding of electrochemistry: Galvanic and
electrolytic cells. University Chemistry Education, 7, 1-12.
Özmen, H., Demircioğlu, H., & Demircioğlu, G. (2009). The effects of
conceptual change texts accompanied with animations on overcoming
11th grade students’ alternative conceptions of chemical bonding.
Computers & Education, 52(3), 681-695.
Sanger, M. J., & Greenbowe, T. J. (1997a). Common student
misconceptions in electrochemistry: Galvanic, electrolytic, and
concentration cells. Journal of Research in Science Teaching, 34(4),
377-398.
Sanger, M. J., & Greenbowe, T. J. (1997b). Students’ misconceptions
in electrochemistry: Current flow in electrolyte solutions and the
salt bridge. Journal of Chemical Education, 74, 819-823.
Sanger, M. J., & Greenbowe, T. J. (1999) An analysis of college
chemistry textbooks as sources of misconceptions and errors in
electrochemistry. Journal of Chemical Education, 76, 853-860.
Sanger M. J. & Greenbowe T. J. (2000) Addressing student
misconceptions concerning electron flow in aqueous solutions with
instruction including computer animations and conceptual change
strategies. International Journal of Science Education, 22(5) ,
521–537.
Sanmartín, B. (2012). Estudio sobre celdas electroquímicas: ideas de
los estudiantes y análisis de libros de texto. Trabajo fin de Màster,
Universitat de València.
Solaz-Portolés, J. J. (2009). Aprender ciencias con textos: Bases
teóricas y directrices. Latin American Journal of Physics Education,
3(2), 376-379.
Solaz-Portolés, J. J., Sanjosé, V., & Civera, E. (2012) ¿Es adecuada
la presentación de los modelos atómicos desde el punto de vista
histórico y epistemológico en los libros de de texto de
bachillerato? Revista Química Viva, 11(3), 229-239. Recuperable de
http://www.quimicaviva.qb.fcen.uba.ar
Solaz-Portolés, J. J., Sanjosé, V., & Gómez, A. (2012). Aprendizaje
basado en problemas en la Educación Superior: una metodología
necesaria en la formación del profesorado. Didáctica de las Ciencias
Experimentales y Sociales, 25, 177-186.
|
|
Revista
QuímicaViva Número 1, año 12, Abril 2013 quimicaviva@qb.fcen.uba.ar |