Bacterias probióticas como suplemento dietario promisorio para la salud
Ivanna Novotny Nuñez1, Carolina Maldonado Galdeano1,2, Natalia Castillo3, Alejandra de Moreno de LeBlanc1 y Gabriela Perdigón1,2*
1-Centro de Referencia para Lactobacilos (CERELA-CONICET). Chacabuco 145, San Miguel de Tucumán (T4000ILC) Tucumán. Argentina.
2-Cátedra de Inmunología. Instituto de Microbiología. Facultad de Bioquímica, Química y Farmacia. Universidad Nacional de Tucumán. Argentina.
3- Planta Piloto de procesos Industriales Microbiológicos (PROIMI-CONICET). Av.
Belgrano y Pje. Caseros San Miguel de Tucumán CP: 4000. Tucumán. Argentina
*Corresponding autor: Gabriela Perdigón. perdigon@cerela.org.ar
Recibido 30 de noviembre de 2012 Aceptado: 4 de diciembre de 2012
Resumen
El ecosistema intestinal constituye un microambiente complejo donde las células inmunes e intestinales están en constante interacción con la microbiota normal.
La maduración y la modulación del sistema inmune intestinal se encuentran influenciadas por el establecimiento de la microbiota comensal, cuyo equilibrio puede ser afectado (benéficamente o no) por microorganismos que ingresan a través de la alimentación.
Entre estos microorganismos se encuentran los probióticos que se caracterizan por conferir un efecto beneficioso en la salud del hospedador. Entre las propiedades atribuidas a estos microorganismos, podemos mencionar la capacidad de reforzar la barrera intestinal y la de mejorar la respuesta inmune. Utilizando modelos experimentales en ratón, se demostró que los microorganismos probióticos y/o las leches fermentadas que los contienen pueden modular el sistema inmune sistémico y de mucosa, proporcionando protección contra bacterias enteropatógenas y actuando como adyuvantes de la respuesta inmune sistémica frente a una vacunación en hospedadores inmunodeprimidos por malnutrición.
Palabras clave: Probióticos, leche fermentada probiótica, sistema inmune, malnutrición, infección intestinal
Probiotic bacteria as a promising dietary supplement for health
Abstract
The intestinal ecosystem is a complex microenvironment where immune and intestinal cells are in constant interaction with the normal microbiota.
The maturation and modulation of the intestinal immune system are influenced by the establishment of commensal microbiota, whose balance can be affected by microorganisms that enter through the food.
Some of these microorganisms called probiotics, confer a health benefit on the host. Among the properties attributed to these microorganisms, it could be mentioned the ability to reinforce the intestinal barrier and enhance the immune response. Using experimental models performed in mice, it was demonstrated that the probiotic microorganisms and / or fermented milks containing them, could modulate the systemic and mucosal immune system, providing protection against enteropathogenic bacteria and acting as adjuvant of the systemic immune response against a vaccination in immunosuppressed hosts by malnutrition.
Key words: Probiotics, probiotic fermented milk, immune system, malnutrition, intestinal infectionIntroducción
Se conoce que el ecosistema intestinal presenta una compleja red de interacciones entre microorganismos que forman la microbiota intestinal y las células eucariotas (epitelio y células inmunes asociadas al intestino), donde la microbiota intestinal cumple un papel preponderante en la maduración y activación de las células inmunes intestinales (1). Este ecosistema es también responsable del mantenimiento de la tolerancia oral para antígenos alimentarios.
Existen diferentes propiedades atribuidas a la microbiota intestinal entre ellas: efectos metabólicos (síntesis de vitaminas y enzimas); y la protección del huésped contra los microorganismos patógenos (efecto barrera), entre otros.
El ecosistema intestinal puede ser influenciado por bacterias inocuas que ingresan con la alimentación, entre ellas se encuentran los microorganismos probióticos presentes en yogures y otros alimentos y bebidas fermentadas.
Desde hace varios siglos se conoce el papel beneficioso de las leches fermentadas sobre la salud. Pero fue en el siglo XX, cuando el científico ruso Ilya Metchnikoff (2) enfatizó los beneficios que proporcionaba el consumo de yogur a los pobladores de los Balcanes, asociando su gran longevidad y buena salud física al elevado consumo del mismo.
El término probiótico fue utilizado por primera vez en 1965 por Lilly y Stillwell para describir “las sustancias secretadas por un organismo capaz de estimular el crecimiento de los otros” (3). La palabra probiótico deriva del latín pro- que significa “por” o “en favor de”, y del griego –bios- que quiere decir “vida”.
La definición de este término fue sufriendo modificaciones a lo largo del tiempo. Actualmente la FAO/OMS define a los probióticos como “microorganismos vivos que, cuando son administrados en cantidades adecuadas confieren beneficios en la salud del hospedador” (4).
En la actualidad, el estilo de vida ha llevado a un aumento en la demanda de productos alimenticios por parte de los consumidores, que además de su aporte nutricional, sean capaces de promover una mejor calidad de vida. En este sentido se sabe que los microorganismos probióticos y los productos fermentados que los contienen, pueden reforzar la barrera intestinal y mejorar el balance de la microbiota, como también la respuesta inmune en procesos infecciosos y/o inflamatorios (5).
El efecto adyuvante de cepas probióticas y de leches fermentadas conteniendo estos microorganismos fue probado en animales de experimentación sin patología de base y en diferentes modelos experimentales, entre ellos en un modelo de desnutrición leve donde se encuentra afectada la barrera intestinal y la respuesta inmune y en un modelo de infección por Salmonella enterica serovar Typhimurium.
Efecto de la administración de una leche fermentada probiótica en un modelo de desnutrición leve en ratón
La malnutrición por déficit de ingesta es una alteración potencialmente reversible causada por un desequilibrio entre la ingesta de nutrientes y los requerimientos energéticos (6). Está relacionada principalmente con disminución del crecimiento y desarrollo, reducción de la capacidad de aprendizaje y disminución en las funciones del sistema inmune, lo que se manifiesta con una mayor susceptibilidad a contraer infecciones (7).
La malnutrición proteico-energética (MPE) se clasifica según la pérdida de peso en: leve (10-25%), moderada (25% -39%) y grave (> 40%).
La malnutrición puede ser revertida con una adecuada re-nutrición, restaurando las funciones inmunológicas, gastrointestinales y regenerando la mucosa intestinal.
Estudios previos demostraron que el yogur y las bacterias probióticas son útiles como suplementos dietarios en un modelo de malnutrición grave (8). Posteriormente se evaluaron los efectos de una leche fermentada probiótica (LFP) como suplemento en una dieta de re-nutrición en un modelo de MPE leve, en la recuperación de la barrera intestinal, alteraciones histológicas y las funciones del sistema inmune mucoso y sistémico; así como también su efecto protector frente a una infección con Salmonella enterica serovar Typhimurium (S. Typhimurium), para contar con las bases científicas y demostrar la inocuidad del consumo de microorganismos probióticos o de leches fermentadas probióticas en procesos de inmunodeficiencia en humanos
Modelo de malnutrición proteica-energética leve
Este modelo fue considerado debido a la elevada tasa de desnutrición no severa (10%) en nuestro medio. Por otra parte, en una desnutrición severa (marasmo y kwashiorkor1), la terapia de re-nutrición debe ser hospitalaria, por vía parenteral, con lo cual solo después de la recuperación podrían ser administrados los probióticos. En este modelo, ratones BALB/c recién destetados (21 días) fueron divididos en:
1) Grupo control bien nutrido (CN), estos animales recibieron dieta balanceada y agua ad libitum durante todo la experiencia. 2) Grupo control malnutrido (CM), estos animales recibieron durante 5 días dieta convencional y agua sin restricción, luego comenzó el período de desnutrición donde los animales recibieron alimentación restringida (25% menos que el grupo CN). Una vez alcanzada la desnutrición, cuando los animales perdieron el 25% del peso corporal con respecto al grupo CN, se les suplementó con las diferentes dietas de re-nutrición durante 5 días consecutivos: leche entera al 10%; leche fermentada probiótica (LFP) comercial la cual contiene los cultivos iniciadores del yogur (Lactobacillus (L.) delbrueckii subsp. bulgaricus 108 UFC/ml y Streptococcus thermophilus 108 UFC/ml) y la bacteria probiótica L. casei DN-114-001 (108 UFC/ml); o su sobrenadante libre de bacterias (SLB) obtenido a partir de la centrifugación de la LFP.
Después de los 5 días de re-nutrición, se determinaron parámetros histológicos e inmunológicos (9).
La administración de los tres suplementos dietarios a los ratones desnutridos incrementaron el peso corporal de los mismos en comparación al grupo CM.
En los animales alimentados con la LFP, el aumento de peso estuvo acompañado por cambios en la microbiota intestinal, principalmente en la población de bifidobacterias, donde se vio un incremento significativo en comparación al resto de los grupos, no mostrando diferencias significativas en el resto de las poblaciones estudiadas (lactobacilos, anaerobios totales y enterobacterias). Estos resultados son importantes ya que se ha descripto que la población de bifidobacterias podría ejercer un efecto benéfico sobre la microbiota intestinal (10).
A nivel histológico, la malnutrición produjo disminución en el número y longitud de las vellosidades intestinales, efecto que fue revertido con la administración de la LFP y en menor medida por la administración de la leche o del SLB. Estos cambios no sólo significaron una recuperación a nivel histológico sino también en la funcionalidad de las células inmunes asociadas al intestino, donde se observó que el número de células productoras de inmunoglobulina A (IgA) en la lámina propia de intestino delgado se incrementó significativamente en los animales que recibieron LFP en relación al resto de los grupos. Este aumento podría estar relacionado con la población de bifidobacterias (11). Sin embargo no se observaron cambios en otras células inmunes como linfocitos T CD4+ o CD8+ (Tabla 1). (Datos originales no publicados anteriormente)
Tabla 1. Efecto de la administración de una leche fermentada probiótica y de su sobrenadante libre de bacterias sobre células inmunes de intestino.
|
Muestras |
Grupos |
Células IgA+ |
Células CD4+ |
Células CD8+ |
|
Basal |
CN |
191±36 a |
43±11 a |
30±9 a |
|
|
CM |
147±44 a,b |
23±8 b |
17±6 b |
|
5 días de re-nutrición |
CN |
143±26 a,b |
47±9 a |
40±7 a |
|
CM |
106±33 b |
30±7 a |
24±7 a,b |
|
|
|
Leche |
100±32 b |
53±17 a |
26±10 a,b |
|
|
LFP |
163±31 a |
36±9 a |
20±5 a,b |
|
|
SLB |
124±39 a,b |
28±8 b |
24±8 a,b |
Después del período de desnutrición (pérdida del peso corporal de 25% con respecto al grupo CN), los ratones fueron re-nutridos con leche, LFP o su SLB durante 5 días. Las muestras obtenidas fueron: basal, antes del periodo de re-nutrición, y la muestra de 5 días post-re-nutrición con los diferentes suplementos. Las células inmunes se analizaron por inmunofluorescencia directa sobre cortes de tejidos de intestino delgado. Los resultados se expresaron como número de células positivas contados cada 10 campos de visión a 1000X de magnificación. Las letras indican las diferencias significativas con un (p <0,05) entre los diferentes grupos.
Con respecto a la producción de citoquinas por las células inmunes presentes en la lámina propia de intestino delgado, se observó que las células productoras de IL-2 e IL-12 disminuyeron en los animales malnutridos en comparación con el grupo bien nutrido. Sólo los animales alimentados con leche o LFP aumentaron significativamente el número de estas células, mientras que la administración del SLB sólo indujo aumentos de las células productoras de IL-2. Esta citoquina actúa como factor de crecimiento de la población de linfocitos T, por lo que su aumento posibilitaría una mejor respuesta inmune adaptativa.
En cuanto a dos citoquinas importantes en el diálogo que se establece entre las células del epitelio intestinal y las células inmunes, tales como el TNFα y el IFNγ, que disminuyen significativamente durante la malnutrición, observamos que la re-nutrición con leche o LFP lograron revertir estos valores. Lo mismo ocurrió con las citoquinas reguladoras IL-4 e IL-10 (9). La respuesta inmune sistémica, disminuida en la malnutrición, como así también la capacidad fagocítica de macrófagos de bazo y peritoneo antes y después de una inmunización con un antígeno proteico como la ovoalbúmina (OVA) se vieron incrementadas en los animales que recibieron las dietas de re-nutrición en forma previa y continua.
Estas observaciones indican que la administración de LFP previa a la inmunización con el antígeno es importante para incrementar la capacidad fagocítica de macrófagos, que son importantes como nexo de unión entre la respuesta inmune innata y la adaptativa, manteniendo niveles elevados de anticuerpos específicos.
Esta activación de la respuesta inmune tanto a nivel intestinal como sistémico por efecto de la administración de la LFP, permitió una mayor protección frente a una infección por Salmonella, disminuyendo la traslocación del patógeno a diferentes órganos (9). También observamos una recuperación en el timo que es otro de los órganos afectados durante la desnutrición (12).
Los resultados obtenidos mostraron que la suplementación de LFP durante la re-nutrición en un modelo de malnutrición leve fue capaz de mejorar la microbiota intestinal y aumentar el número y función de células inmunes, lo cual es importante para mantener la homeostasis intestinal. Estimuló la respuesta inmune sistémica actuando como adyuvante del sistema inmune previo a una vacunación y en la protección frente al patógeno Salmonella en un modelo de inmunodeficiencia producida por la desnutrición. Si bien los resultados obtenidos en ratón no siempre pueden extrapolarse al ser humano, en este modelo de malnutrición leve demostramos la efectividad e inocuidad de los alimentos probióticos como suplementos dietarios, por lo que podrían ser sugeridos como suplementos promisorios en grupos de riesgo con esta patología.
Probióticos en un modelo de infección intestinal
Entre los efectos benéficos atribuidos a los probióticos podemos mencionar la capacidad de los mismos para proteger contra enteropatógenos tanto en modelos experimentales como en humanos (13,14).
Se demostró el efecto de una bacteria probiótica, L. casei CRL 431 frente a una infección con Salmonella enterica serovar Typhimurium (S. Typhimurium) en un modelo experimental en ratones BALB/c desafiados con S. Typhimurium. Los resultados obtenidos fueron el soporte científico para el diseño de la Leche Bio por el Dr. Oliver, que fue aplicado en niños con gran efectividad (15).
Estudiamos el efecto de esta bacteria probiótica en un modelo de infección en ratones BALB/c adultos de 5 semanas que fueron divididos en los siguientes grupos:
Grupo 1: Control normal, estos animales recibieron una alimentación balanceada y agua ad libitum durante toda la experiencia.
Grupo 2: Control de infección, los animales recibieron una alimentación balanceada y agua ad libitum y fueron desafiados con S. Typhimurium (107 UFC/ml).
Grupo 3: Administración preventiva, los animales recibieron alimentación balanceada y una suspensión de la bacteria probiótica L. casei (108 UFC/ml) durante 7 días previos a la infección con S. Typhimurium.
Grupo 4: Administración continua, los animales recibieron alimentación balanceada y la bacteria probiótica L. casei (108 UFC/ml) en suspensión antes y después de la infección con Salmonella. A los 7 días post-desafío demostramos que:
La administración de L. casei tanto preventiva como continua disminuyó la severidad de la infección por S. Typhimurium, siendo la administración continua la que produjo el mejor efecto; disminuyendo los recuentos del patógeno en el intestino, así como su diseminación fuera de este órgano. Estos resultados nos llevaron a profundizar en los mecanismos inmunes inducidos por L. casei para disminuir la capacidad invasiva de Salmonella.
Observamos una disminución significativa de la respuesta inflamatoria intestinal en comparación con los ratones control de infección, en donde se observó una importante infiltración, evidenciada a través de cortes histológicos de intestino delgado teñidos con hematoxilina-eosina (Figura 1). Datos originales no publicados anteriormente.
Mediante la determinación de la actividad de la enzima mieloperoxidasa (MPO) en intestino delgado, se determinó que la infiltración observada correspondía a polimorfonucleares, debido a que esta enzima, liberada durante el proceso de fagocitosis e involucrada en la generación de mecanismos microbicidas dependientes del oxígeno, se encontraba incrementada en los animales control de infección. El probiótico disminuyó significativamente la actividad MPO a nivel intestinal e incrementó el número de macrófagos y células dendríticas en comparación al grupo control de infección. Esta fue la principal diferencia observada en los animales infectados con Salmonella, la cual induce un incremento de polimorfoncleares con mayor daño tisular, hecho que probablemente esté relacionado con el aumento de traslocación del patógeno a los diferentes órganos.
Figura 1. Efecto de L. casei CRL 431 en cortes histológicos de intestino delgado
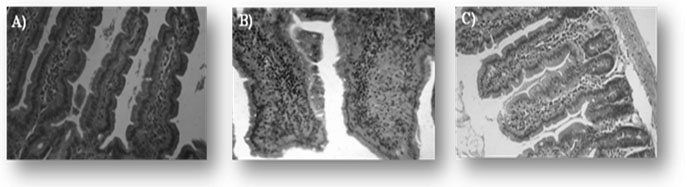
Cortes histológicos de intestino delgado fueron teñidos con hematoxilina-eosina. Las muestras corresponden: A) Control Normal B) Control de infección C) Tratado con L. casei CRL 431 en forma continua. Las microfotografías fueron tomadas a 1000X de magnificación.
La administración del probiótico produjo aumentó en el número de células IgA+ en lámina propia de intestino delgado y en el título de IgA-S total en fluído intestinal. Se observó además aumento en la capacidad fagocítica de los macrófagos de peritoneo, bazo y placas de Peyer. Ello indica que L. casei favoreció la barrera intestinal neutralizando al patógeno a nivel intestinal. También determinamos que el grupo que recibió la administración de L. casei CRL 431 indujo un incremento en los niveles de TNFα e IFNγ en placas de Peyer, sitio inductor de la respuesta inmune a nivel intestinal y principal sitio blanco de Salmonella. IFNγ es muy importante en la respuesta celular Th1 y TNFα como citoquina iniciadora del diálogo celular que lleva a la activación inmune. No se observaron aumentos de IL-10 en placa de Peyer lo cual podría estar relacionado con una fuerte respuesta tipo Th1a ese nivel. En lámina propia, sitio efector de la respuesta inmune, se observó que la administración continua de L. casei disminuyó la producción de TNFα, manteniendo los niveles de IL-6, responsable de la expansión clonal de linfocitos B, e incrementó los niveles de IL-10 y de IFNγ en comparación con el control de infección. El perfil de la citoquina mencionada está fuertemente asociado al efecto protector observado (16).
Por ensayos ex vivo determinamos que los animales que recibieron el probiótico mostraron un comportamiento diferente en las primeras 24h post-desafío, con incrementos en la secreción de IL-6 y de la quemoquina quimoatractante de macrófagos (MCP-1) por parte de la célula epitelial intestinal (CEI), en comparación con el control de infección, que aumento los niveles de IL-6 y MCP1 en forma desregulada en las etapas finales de la infección. Estos resultados fortalecen la hipótesis de que la administración oral de L. casei CRL 431 mantiene a las células del sistema inmune en un estado activo y a su vez regulado, de forma tal que el organismo estaría en un “estado de alerta” al momento de producirse la infección. Demostramos que la administración continua de L. casei CRL 431 (previo y post- infección con Salmonella) disminuyó la severidad de la infección, con mayor recuperación inmune y un mejor estado general, estimulando la producción y secreción de varias citoquinas, pero manteniendo una respuesta regulada a través de IL-10, la cual siempre se mantuvo elevada. Esto pone de manifiesto la importancia de la continuidad en la administración del probiótico así como también la inocuidad de su consumo durante el proceso infeccioso. Al determinar que el probiótico refuerza los mecanismos de la barrera intestinal y disminuye el estado inflamatorio permite proponer su uso como suplemento dietario para la prevención y tratamiento de enfermedades entéricas, especialmente frente a Salmonella (16). Debemos remarcar que no todos los microorganismos probióticos tienen el mismo efecto frente a una infección por Salmonella y que esta propiedad es cepa dependiente (17).
1.El Kwashiorkor es una enfermedad de los niños debida a la ausencia de nutrientes, como las proteínas en la dieta. El nombre de Kwashiorkor deriva de una de las lenguas Kwa de la costa de Ghana y significa "el que se desplaza", refiriéndose a la situación de los niños mayores que han sido amamantados y que abandonan la lactancia una vez que ha nacido un nuevo hermano. Wikipedia.
Referencias
1. Ouwehand A, Isolauri E, Salminen S, 2002. The role of the intestinal microflora for the development of the immune system in early childhood. European Journal of Nutrition 41, 1: 32-37
2. Metchnikoff E. (1908). The prolongation of life. 1st ed. New York: GP Putman’s Sons.
3. Lilly DM, Stillwell RH, 1965. Probiotics: growth-promoting factors produced by microorganisms. Science 147(3659):747-8.
4. FAO/WHO. (2001). Evaluation of health and nutritional properties of powder milk and live lactic acid bacteria. Food and Agriculture Organization of the United Nations and World Health Organization Expert Consultation Report. http://www.fao.org/es/ESN/probio/probio.htm.
5. Crooks NH, Snaith C, Webster D, Gao F, Hawkey P, 2012. Clinical review: Probiotics in critical care. Crit Care 5;16(6): 237.
6.Shils ME, Shike M, Ross AC, Caballero B, Cousins RJ,1999.Modern Nutrition in Health and Disease. Philadelphia: Lippincott Williams & Wilkins 9
7. Savino W, 2002. The thymus gland is a target in malnutrition. Eur J Clin Nutr 56(Suppl 3):S46-49.
8. Allori C, Aguero G, de Ruiz Holgado AP, de Nader OM, Perdigon G, 2000. Gut mucosa morphology and microflora changes in malnourished mice after renutrition with milk and administration of Lactobacillus casei. J Food Prot 63(1):83-90.
9. Maldonado Galdeano C, Novotny Núñez I, de Moreno de LeBlanc A, Carmuega E, Weill R and Perdigón G, 2011. Impact of a probiotic fermented milk in the gut ecosystem and in the systemic immunity using a non-sever protein-energy-malnutrition model in mice. BMC Gastroenterology 11:64.
10. Mitsuoka T, 1990. Bifidobacteria and their role in human health. J Ind Microbiol 81:131-136.
11. Park JH, Um JI, Lee BJ, Goh JS, Park SY, Kim WS, Kim PH, 2002. Encapsulated
Bifidobacterium bifidum potentiates intestinal IgA production. Cell Immunol 219(1):22-27.
12. Novotny Nuñez I, Maldonado Galdeano C, Carmuega E, Weill R, de Moreno de LeBlanc A y Perdigón G, 2012. Effect of a probiotic fermented milk on the thymus in Balb/c mice under non-severe protein-energy malnutrition. British Journal of Nutrition. En prensa.
13. de Moreno de LeBlanc A, Castillo NA, Perdigon G, 2010. Anti-infective mechanisms induced by a probiotic Lactobacillus strain against Salmonella enterica serovar Typhimurium infection. Int J Food Microbiol. 15,138(3): 223-31
14. Girardin M, Seidman EG, 2011. Indications for the use of probiotics in gastrointestinal diseases. Dig Dis 29(6):574-87.
15. Gaón D, Doweck Y, Gómez Zavaglia A, Ruiz Holgado A, Oliver G, 1995. Lactose digestion by milk fermented with Lactobacillus acidophilus and Lactobacillus casei of human origin. Medicina (B Aires) 55(3):237-42.
16. Castillo, N. A., Perdigón, G., and de Moreno de Leblanc, A. (2011) Oral administration of a probiotic Lactobacillus modulates cytokine production and TLR expression improving the immune response against Salmonella enterica serovar Typhimurium infection in mice, BMC Microbiol 11, 177.
17. Castillo NA, de Moreno de LeBlanc A, Maldonado Galdeano C and Perdigón G, 2012. Study of different immune mechanisms induced by lactobacilli strains involved in the prevention or amelioration of Salmonella infection in mice. Journal of Applied Microbiology. En prensa
|
|
Revista
QuímicaViva Número 3, año 11, Diciembre 2012 quimicaviva@qb.fcen.uba.ar |