Los agroquímicos y su impacto en los anfibios: un dilema de difícil solución
Rafael C. Lajmanovich1,2 , Paola M. Peltzer1,2, Andrés M. Attademo1,2, Mariana C. Cabagna-Zenklusen2 y Celina M. Junges1,2
1 Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET)
2 Cátedra de Ecotoxicología - Facultad de Bioquímica y Ciencias Biológicas (FBCB) - Universidad Nacional del Litoral (UNL), Paraje el Pozo s/n, (3000) Santa Fe, Argentina.
E-mail: lajmanovich @hotmail.com
Recibido: 7 de diciembre de 2012- Aceptado: 10 de diciembre de 2012
Resumen
En el presente trabajo se reseña la problemática ambiental relacionada con la aplicación de agroquímicos, en particular con respecto a su impacto sobre organismos no-blanco como los anfibios anuros de la región centro-este de la Argentina. Se detallan los principales biomarcadores no destructivos que permiten detectar la presencia de estresantes ambientales y su importancia como herramientas en los programas de monitoreo para la protección de la fauna silvestre. Se discute también sobre el polémico herbicida glifosato y las perspectivas para las generaciones futuras.
Palabras clave: anfibios, agroquímicos, impacto, biomonitoreo, glifosato
Summary: Agrochemicals and their impact on amphibians: A difficult dilemma to solve
In the present study the environmental problematic related to the application of agrochemicals, particularly with respect to its impact on non-target organisms, such as amphibians anurans of the central-eastern of Argentina were described. The main non-destructive biomarkers used to detect the presence of environmental stressors and their importance as tools in monitoring programs for the protection of wildlife were detailed. The controversial herbicide glyphosate and the prospects for future generations are also discussed.
Keywords: amphibians, agrochemicals, impact, biomonitoring, glyphosate
Contextualización del problema
Uno de los mayores desafíos a nivel mundial es el de lograr un uso racional de los insumos químicos que sustentan a los sistemas productivos. Esta dependencia de los agroquímicos se incrementó, en forma exponencial, en la denominada "revolución verde" de la década de 1960. En esos años, se especuló que se iba a terminar con el hambre en el mundo, lejos de cumplir su cometido; aun hoy, y luego de décadas de mejoramientos genéticos de las semillas y de la aparición de los organismos modificados genéticamente (OMG), se considera que los aumentos en toneladas de granos no solucionan esta pandemia. Esa situación ha sido reconocida por una de las revistas científicas más prestigiosas del mundo (Nature), que en su editorial de julio de 2010 se pregunta ¿Cómo alimentar a un mundo hambriento? y admite que la ciencia y la tecnología, por sí mismas, no son una panacea para liberar a la humanidad del hambre, su causa es la pobreza, no la falta de producción de alimentos [1]. Esta problemática, en un contexto internacional de suba de precios de los recursos alimenticios, impacta substancialmente en la economía argentina y en la de países considerados grandes productores de oleaginosas de América Latina como Brasil, Paraguay y Bolivia, que en los últimos años han aumentado sus superficies sembradas y en consecuencia, el uso de agroquímicos se ha incrementado extraordinariamente.
Luego de esta breve introducción, que a manera de prólogo intenta contextualizar globalmente el tema de este artículo, se brindará una síntesis de cuáles han sido algunos de los avances en la comprensión de los efectos de los agroecosistemas y los agroquímicos sobre la fauna silvestre - en especial en los anfibios (sapos y ranas) - del centro este de la Argentina.
Breve mención sobre algunos de los estudios realizados por la Cátedra de Ecotoxicología de la Facultad de Bioquímica y Ciencias Biológicas (FBCB)
En cuanto al grupo de investigación con sede en la Cátedra de Ecotoxicología de la (FBCB), son precursores, en la región centro este de la Argentina, sobre el tema de la caracterización del riesgo ambiental de los agroquímicos utilizados masivamente sobre larvas y adultos de anfibios. Para hacer un breve resumen, desde el año 1998 que estudian el efecto de herbicidas como el paraquat sobre larvas de anfibios [2] y realizan evaluaciones sobre la inducción que produce el insecticida cipermetrina en el desarrollo de procesos apoptóticos (muerte celular programada) de las células nerviosas [3,4]. Los tres trabajos antes mencionados fueron realizados en colaboración con la Facultad de Bioingeniería de la Universidad Nacional de Entre Ríos. Igualmente, comprobaron la acción del herbicida glifosato en la producción de modificaciones morfológicas y etológicas [5,6], el poder genotóxico del insecticida endosulfán e inhibitorio de los niveles enzimáticos de B-esterasas del fenitrotión [7,8]. Recientemente demostraron, por primera vez para las larvas de anfibios, que distintas formulaciones comerciales de glifosato inhiben la actividad de las enzimas colinesterasas y de stress oxidativo (butirilcolinesterasa, BChE; acetilcolinesterasa, AChE; y glutation-s-tranferasa, GST) y corroboraron la toxicidad diferencial de distintas marcas comerciales de este producto [9]. Asimismo, han caracterizaron los niveles basales de BChE, AChE y CbE en diversas especies de anfibios y reptiles representativas de los ecosistemas regionales [10-12]. Cabe mencionar, que estos estudios son los primeros en Sudamérica en utilizar metodologías no destructivas y técnicas de reactivación in vitro en estos vertebrados. Recientemente, también demostraron la interferencia de plaguicidas organofosforados (OFs) (fenitrotión) y fungicidas (trifloxistrobin) en las interacciones depredador-presa [13,14].
Por otra parte, en 2005 señalaron la implicancia de los anfibios en el control biológico de plagas dentro de los cultivos de soja, situación que los expone directamente a los agroquímicos y los hace excelentes modelos de estudio para sus efectos a campo [15,16]. De la misma forma, han permitido establecer la variación intraespecífica e interespecífica respecto de parámetros de estructura poblacional y de comunidad de anfibios en cultivos de soja, arroz y fragmentos de bosques nativos [17,18], así también han determinado el efecto de la eutrofización (aumento de materia orgánica producido principalmente por el uso masivo de fertilizantes) de lagunas agrícolas sobre el estado de salud y supervivencia en larvas de anfibios [19]. En último lugar, luego de diez años de muestreo realizaron la primera compilación sobre anormalidades de anuros para la Argentina [20] y observaron la relación de este fenómeno, respecto de los ambientes con actividad antrópica intensiva (suburbios y cultivos). En la figura 1 se ilustran algunos ejemplos de los temas tratados en este apartado.

Figura 1:Evidencias sobre los efectos de los agroquímicos en larvas y adultos de anfibios anuros. A. Letalidad y cola bifurcada en larvas de Lysapsus limellum expuestas a endosulfán. B. Cola bifurcada en larvas de Scinax nasicus en laguna agrícola. C. Polimelia (miembros extra) en Rhinella arenarum. D. Edemas abdominales y natación inversa en larvas de Dendropsophus nanus. E. Mortalidad de peces (Prochilodus platensis) y anfibios (Pseudis paradoxa). F. Ausencia de queratinización en zona ocular de Rhinella shneideri. G. Envase de fertilizante en áreas de cultivo de arroz.
Exposiciones directas (residuos de plaguicidas)
Los estudios sobre la presencia de residuos de plaguicidas son muy significativos, debido a que son uno de los pocos indicadores directos que se puede tener sobre la exposición de los animales a estos xenobióticos [21]. En las provincias de Santa Fe y Entre Ríos hace varios años que se vienen detectando residuos de plaguicidas en vertebrados de la fauna autóctona (peces y anfibios) [22-24]. Se destaca el hallazgo del insecticida clorado endosulfán, que con un rango de 5-39 ng/g se encontró en el 42,1 % de los anfibios evaluados (rana criolla, Leptodactylus latrans; rana chaqueña, L. chaquensis; rana del zarzal, Hypsiboas pulchellus y sapo buey, Rhinella schneideri). Este escenario es muy peligroso ya que el endosulfán tiene efectos estrogénicos [25,26] y autores como Park y col. [27] demostraron que bajos niveles de endosulfán (5 ppb) interfieren en los mecanismos ferohormonales de anfibios urodelos. Posteriormente, Lajmanovich y col. [7] comprobaron su efecto mutagénico para las larvas de anfibios y Peltzer y col. [19] hallaron residuos de endosulfán en cuerpos de agua de Entre Ríos (25.9 ng/l), por sobre los límites de protección para la fauna acuática de la Argentina (8 ng/l).
Estudios realizados a campo, en cuerpos de aguas someros de la región pampeana de la Republica Argentina, mostraron que algunos de los agroquímicos de uso frecuente en los cultivos de soja detallados en la Tabla 1, causan, en sectores puntuales y períodos limitados al momento de su aplicación y posteriores lluvias, mortalidad de invertebrados [28], peces [29] y larvas de anuros [30]. Con concentraciones de cipermetrina de 64,1 µg/l en agua y 480,1 µg/kg en sedimentos y del insecticida clorpirifós de 5,07 µg/l en agua y 50,5 µg/kg en sedimentos [31,32]. Asimismo, datos obtenidos al norte de la provincia de Buenos Aires [33] indican que los residuos de glifosato en agua varían desde 0,10 hasta 0,70 mg/l, mientras que en los sedimentos y los suelos, los valores están entre 0,5 y 5,0 mg/Kg. Del mismo modo, Jergentz y col. [34] y Peltzer y col. [19] observaron, en algunas regiones intensamente cultivadas de la Argentina que dos de los insecticidas más ampliamente usados (cipermetrina y endosulfán) eran detectados en sedimentos, partículas en suspensión y agua en concentraciones que exceden los niveles permitidos para la protección de la vida silvestre. Cabe destacar que el endosulfán y sus productos formulados son considerados por la Agencia de Protección Ambiental de los Estados Unidos (USEPA) como sustancias altamente peligrosas. El uso de este insecticida ha sido prohibido en la Comunidad Europea, Colombia, Belice y Singapur. Además, tiene un uso restringido en muchos otros países por su comprobada potencialidad mutagénica, teratogénica y cancerígena. Recientemente, también ha sido prohibido en la Argentina (resolución SENASA Nº 511/2011), no obstante esto, el propio organismo da permiso a las empresas hasta el 1º de julio de 2013 para comercializar los remanentes de mercaderías que tengan en depósito.
Tabla 1. Clasificación toxicológica de agroquímicos utilizados frecuentemente en los cultivos extensivos de la Republica Argentina.
| Agroquímico | Compuesto | N° CAS | Clase Química | IARC | USEPA | OMS |
| Herbicida | Glifosato | 1071-83-6 | Fosfonoglicina | NL | P | III |
| Insecticida | Cipermetrina | 67375-30-8 | Piretroide | NL | C | II |
| Clorpirifós | 2921-88-2 | Organofosforado | NL | E | II | |
| Dimetoato | 60-51-5 | Organofosforado | NL | C | II | |
| Endosulfán | 115-29-7 | Organoclorado | NL | NP | II | |
| Metamidofós | 10265-92-6 | Organofosforado | NL | E | Ib | |
| Permetrina | 54774-45-7 | Piretroide | 3 | S | II | |
| 51877-74-8 | ||||||
| Fungicida | Mancozeb | 8018-01-7 | Ditiocarbamato-Zinc | NL | B2 | U |
IARC (Agencia Internacional de Investigación de Cáncer)
Grupo 3: No clasificable como carcinógeno (datos incompletos) NL: No Listado.
Clasificación de USEPA (carcinogenicidad)
Grupo B2: Suficiente evidencia de carcinogenicidad; Grupo C: Posible carcinógeno humano; Grupo E: Evidencia de no-carcinogenicidad para humanos.
P: probable carcinógeno. NP: No probable S: Sugerido pero no suficiente para ser carcinógeno.
Clasificación de toxicidad aguda de la organización mundial de la salud (OMS)
Ib: Altamente peligroso; II: Moderadamente Peligroso; III: Levemente peligroso; U: es poco probable que produzca un peligro grave.
Los biomarcadores como herramientas de estudio
A diferencia de los insecticidas órganoclorados, los (OFs) y carbamatos (CBs) presentan una baja persistencia ambiental [35] y son difíciles de evaluar por medio de análisis químicos, tanto en tejidos o en matrices ambientales. Esta aparente dificultad es salvada con el empleo de biomarcadores, que son parámetros medibles en distintos organismos que se alteran por la exposición, en este caso a esos insecticidas. Dentro de estos, los biomarcadores no destructivos, en los cuales no es necesario sacrificar al individuo para la toma de muestra, han recibido especial atención en los programas de monitoreo biológico [36-41] debido a que pueden aplicarse en muestreos sucesivos a campo e inclusive, conocer estos parámetros en especies en vías de extinción o con escaso número de individuos.
Entre los distintos biomarcadores no destructivos utilizados, los análisis hematológicos (determinaciones químicas en plasma o suero y hemograma) son unos de los más usados para la prevención, diagnóstico, pronóstico y tratamiento de las enfermedades en los seres humanos y en otras especies animales.
Con el objetivo de desarrollar sistemas de monitoreo no destructivos en estudios herpetológicos (anfibios y reptiles), se ha empleado el análisis de la actividad de la BChE sanguínea para evaluar la exposición de la fauna de anfibios de Santa Fe y Entre Ríos a los OFs y CBs [40, 42, 11]. En lo que respecta a los reptiles, si bien se han utilizado las colinesterasas como biomarcadores bioquímicos de exposición en biomonitoreos [43], son escasos los estudios de este tipo que hayan implicado a especies de la Argentina como el lagarto overo (Tupinambis merianae) [12]. Cabe mencionar, que si bien los reptiles son indicadores ambientales sensibles, en regiones húmedas y templadas como en las provincias del Litoral Fluvial argentino, los anfibios por su mayor diversidad, abundancia y representatividad tienen una mayor relevancia ecológica.
Por otra parte, el hemograma, y dentro de este, los recuentos relativos de leucocitos en anfibios anuros, fueron propuestos para la evaluación del sistema inmune inespecífico [44], de individuos expuestos a situaciones de estrés [45-47] y como parámetro indicativo de poblaciones provenientes de sitios contaminados [48-50]. También se observaron alteraciones en la morfología de los eritrocitos en casos de exposición de aminas aromáticas, metales y estrés [49,51].
La existencia de núcleo en los hematíes de los anfibios incorpora un nuevo aspecto a tener en cuenta en la evaluación de la morfología sanguínea: la presencia o no de alteraciones nucleares. Dentro de éstas, la más ampliamente utilizada para evaluar genotoxicidad de sustancias es la generación de micronúcleos [7,51-56]. Como su nombre lo indica, los micronúcleos son masas de cromatina con forma de pequeños núcleos que pueden originarse de manera espontánea o como respuesta a la acción de determinados agentes. Cuando esto ocurre, el material genético que se desprende queda excluido y del núcleo de la célula hija, lo que origina uno o varios núcleos de menor tamaño que el primario denominados "micronúcleos", visibles fácilmente al microscopio óptico (Figura 2). El material genético desprendido puede derivar de cromosomas enteros o de fragmentos cromosómicos que quedan excluidos de los núcleos de las nuevas células durante anafase mitótica.
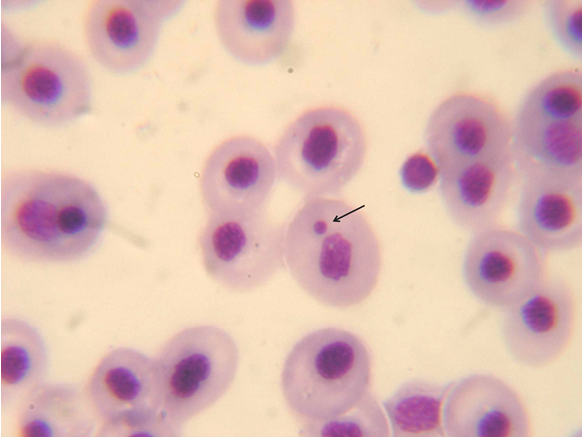
Figura 2: Micronúcleo (flecha) en eritrocitos de renacuajos de la ranita nadadora (Pseudis minuta).
Como para la mayoría de estos biomarcadores, no existen valores basales para la fauna silvestre, por lo tanto para su valoración, simultáneamente se recolectan (como controles) las mismas especies en reservas naturales o lugares no impactados por agroquímicos (islas del río Paraná, sitios inundables, etc.). Los animales son trasladados durante la noche al laboratorio en recipientes plásticos húmedos y oscuros tratando de evitar situaciones de estrés. Una vez en el laboratorio, se los aclimata durante unas horas y se realizan las extracciones de sangre, por punción cardíaca en el caso de los anfibios y por punción de una vena caudal en reptiles. Se determina el sexo y se registran las medidas biométricas de rutina como el largo y el peso del animal. Siguiendo las mismas precauciones de traslado, los especimenes se restituyen en a los mismos sitios donde fueron hallados. En caso de que las distancias al laboratorio no permitan seguir estas metodologías las extracciones se realizan en el lugar de recolección.
El herbicida glifosato, últimos descubrimientos y reflexión final
Sin lugar a dudas el herbicida glifosato es el químico más controvertido del modelo productivo de los OMG y en la Argentina tiene un uso declarado de aproximadamente unos 200 millones de litros [57]. A nivel mundial, existen alrededor de 400 citas de trabajos científicos sobre su toxicidad en distintos modelos animales (de laboratorio y de vida silvestre) que pueden ser consultadas en la base de datos de la Biblioteca Nacional de Medicina de los Estados Unidos (MEDLINE). Específicamente, sobre sus efectos en especies de anfibios locales, podemos destacar un trabajo de Lajmanovich y col. [58] que describe malformaciones morfológicas externas (craneofaciales, bucales, en los ojos y curvatura de la aleta caudal), además de efectos sobre el esqueleto hiobranquial (alteraciones en la estructura cartilaginosa por disrupción en la formación de colágeno) en renacuajos de una especie de rana ampliamente distribuida en la Argentina expuesta a dosis sub-letales de glifosato.
En suma, tal como se mencionó precedentemente, los monitoreos continuos realizados para evaluar el impacto de los agroecosistemas sobre la fauna silvestre de las provincias con mayor producción de soja de la Argentina (Córdoba, Santa Fe y Entre Ríos), permitieron realizar la primera recopilación a campo en Latinoamérica sobre la incidencia de malformaciones en anfibios [59]. En las conclusiones de este trabajo se hace una concreta mención [60] al posible efecto del ácido retinoico como una de las causas de estas teratologías; que sin lugar a duda ya están empezando a manifestarse en la naturaleza y dejaron de ser, como algunos autores opinan, meras especulaciones experimentales. Cabe mencionar que Paganelli y col. [60] demuestran el mecanismo por el cual el glifosato (a concentraciones de solo 430 µM), provoca efectos teratogénicos en vertebrados (malformaciones craneofaciales que incluyen a los cartílagos branquiales y ceratobranquiales, además de acortamiento del tronco embrionario, entre otros resultados que se vinculan con el incremento del ácido retinoico). En relación con lo publicado por estos autores, el efecto directo del glifosato en los mecanismos iniciales de la morfogénesis de los embriones de vertebrados, originaría preocupaciones sobre los resultados clínicos de la descendencia humana expuesta en los campos agrícolas.
A manera de reflexión final, vale la pena plantear que los organismos gubernamentales y organizaciones civiles tendrían que tender a promover investigaciones que tengan en cuenta el desarrollo sustentable y la búsqueda de alternativas ecológicamente sostenibles como motor de la economía argentina. Pero sin perder de vista que, por definición, este progreso tiene que asegurar para las generaciones futuras todos los servicios ambientales y componentes de la naturaleza (principalmente su biodiversidad) así como sus pautas culturales ancestrales. Considerando que en los actuales modelos productivos-industrializados, el denominado "desarrollo sustentable", se basa en la destrucción sistemática de los ecosistemas, en la disminución de la biodiversidad y en un enorme aporte energético de plaguicidas y fertilizantes que son una contradicción en si misma de este precepto.
Agradecimientos: Al Dr. Juan Claus y la Dra. Celia Coto por sus valiosas sugerencias y colaboración que permitieron realizar el presente
trabajo. A la Agencia Nacional de Promoción Científica y Tecnológica (ANPCyT) al CONICET y al Curso de Acción para la
Investigación y Desarrollo (CAI+D) de la UNL por el financiamiento recibido.
Referencias:
[1] Anonymous (2010). How to feed a hungry world. Nature 466: 531-532.
[2] Lajmanovich, R. C.; Izaguirre, M. F. y Casco, V. H. (1998). Paraquat tolerance and alteration of internal gill structure of Scinax nasica tadpoles (Anura: Hylidae). Archives of Environmental Contamination and Toxicology 34: 364-369.
[3] Izaguirre, M. F.; Lajmanovich, R. C.; Peltzer, P. M.; Soler, A. P. y Casco, V. H. (2000). Cypermethrin-induced apoptosis in the telencephalon of Physalaemus biligonigerus tadpoles (Anura: Leptodactylidae). Bulletin of Environmental Contamination and Toxicology 65: 501-507.
[4] Casco, V. H.; Izaguirre, M. F.; Marín, L.; Vergara, M. N.; Lajmanovich, R. C.; Peltzer, P. M. y Peralta Soler, A. (2006). Apoptotic cell death in the central nervous system of Bufo arenarum tadpoles induced by cypermethrin. Cell Biology and Toxicology 22: 199-211.
[5] Lajmanovich, R.; Lorenzatti, E.; de la Sierra, P.; Marino, F.; Stringhini, G. y Peltzer, P. (2003). Reduction in the mortality of tadpoles (Physalaemus biligonigerus, Amphibia: Leptodactylidae) exposed to cypermethrin: uptake by aquatic ferns. Fresenius Environmental Bulletin 12: 1558-1561.
[6] Lajmanovich, R. C.; Sandoval, M. T. y Peltzer, P. M. (2003). Induction of mortality and malformation in Scinax nasicus tadpoles exposed by glyphosate formulations. Bulletin of Environmental Contamination and Toxicology 70: 612-618.
[7] Lajmanovich, R. C.; Cabagna, M.; Peltzer, P. M.; Stringhini, G. A. y Attademo, A. M. (2005). Micronucleus induction in erythrocytes of the Hyla pulchella tadpoles (Amphibia: Hylidae) exposed to insecticide endosulfan. Mutation Research 587: 67-72.
[8] Lajmanovich, R. C.; Attademo, A. M.; Peltzer, P. M. y Junges, C. M. (2009). Inhibition and recovery of brain and tail cholinesterases of Odontophrynus americanus tadpoles (Amphibia: Cycloramphidae) exposed to fenitrothion. Journal of Environmental Biology 30: 923-926.
[9] Lajmanovich, R. C.; Attademo, A. M.; Peltzer, P.M.; Jungues, C.M. y Cabagna M. (2011). Toxicity of four herbicide formulations with glyphosate on Rhinella arenarum (Anura: Bufonidae) tadpoles: B-esterases and Glutathione S-transferase inhibitions. Archives of Environmental Contaminationand Toxicology 60: 681-689.
[10] Attademo, A. M; Peltzer, P. M; Lajmanovich, R. C.; Cabagna, M. y Fiorenza, G. (2007). Plasma B-esterases and Glutathione S-transferase activities in the toad Chaunus schneideri (Amphibia, Anura) inhabiting rice agroecosystems of Argentina. Ecotoxicology 16: 533-539.
[11] Attademo, A. M.; Cabagna Zenklusen, M.; Lajmanovich, R. C.; Peltzer P. M.; Junges C. M. y Bassó A. (2011). B-esterase activities and blood cell morphology in the Frog Leptodactylus chaquensis (Amphibia: Leptodactylidae) on rice agroecosystems from Santa Fe Province (Argentina). Ecotoxicology 20: 274-282.
[12] Bassó, A.; Attademo, A. M.; Lajmanovich, R. C.; Peltzer, P. M.; Junges, C. M.; Cabagna, M. C.; Fiorenza, G. S. y Sánchez-Hernández, J. C. (2012). Plasma esterases in the tegu lizard Tupinambis merianae (Reptilia, Teiidae): impact of developmental stage, sex, and organophosphorus in vitro exposure. Environmental Science and Pollution Research 19: 214-225.
[13] Junges, C. M.; Lajmanovich, R. C.; Peltzer, P. M.; Attademo, A. M. y Bassó, A. (2010). Predator-prey interactions between Synbranchus marmoratus (Teleostei: Synbranchidae) and Hypsiboas pulchellus tadpoles (Amphibia: Hylidae): importance of lateral line in nocturnal predation and effects of fenitrothion exposure. Chemosphere 81: 1233-1238.
[14] Junges, C. M.; Peltzer, P. M.; Lajmanovich, R. C.; Attademo, A. M.; Cabagna-Zenklusen, M. C.; Bassó, A. (2012) Toxicity of the fungicide trifloxystrobin on tadpoles and its effect on fish-tadpole interaction. Chemosphere 87: 1348-1354.
[15] Attademo, A. Peltzer, P. y Lajmanovich R. (2005). Amphibians occurring in soybean and implications for biological control in Argentina. Agriculture Ecosystem and Environment 106: 389-394.
[16] Peltzer, P. M.; Attademo, A. M.; Lajmanovich, R. C.; Junges, C. M.; Beltzer, A. H. y Sanchez, L. C. (2010). Trophic dynamics of three sympatric anuran species in a soybean agroecosystem from Santa Fe Province, Argentina. Herpetological Journal 20: 261-269.
[17] Peltzer, P. M.; Lajmanovich, R. C.; Attademo, A. M. y Beltzer, A. H. (2006). Diversity of anurans across agricultural ponds in Argentina. Biodiversity and Conservation 15: 3499-3513.
[18] Attademo, A. M. (2010) Diversidad de Anfibios (Amphibia: Anura) en Cultivos de Soja de la Republica Argentina: Implicaciones en el Control Biológico de Plagas. Tesis Doctoral. Universidad Nacional del Litoral, Facultad de Bioquímica y Ciencias Biológicas, 173 p.
[19] Peltzer, P. M.; Lajmanovich, R. C.; Sánchez-Hernández, J. C.; Attademo, A. M.; Bassó, A. y Cabagna, M. C. (2008). Effects of agricultural pond eutrophication on survival and health status of Scinax nasicus tadpoles. Ecotoxicology and Environmental Safety 70: 185-197.
[20] Peltzer, P. M.; Lajmanovich, R. C.; Sanchez, L. C.; Attademo, A. M.; Junges, C. M.; Bionda, C. L.; Martino, A. L. y Bassó, A. (2011). Morphological abnormalities in amphibian populations from the mid-eastern region of Argentina. Herpetological Conservation and Biology 6: 432-442.
[21] Zakrzewski, S. F. (1991). Principles of Environmental Toxicology. ACS, Washington.
[22] Lenardón, A. y Enrique, S. (1998). Insecticidas organoclorados en el Río Paraná. Natura Neotropicalis 29: 111-116.
[23] Lajmanovich, R.; Lorenzatti, E.; de la Sierra, P.; Marino, F. y Peltzer, P. (2002). First registrations of organochlorines pesticides residues in amphibians of the Mesopotamic Region, Argentina. Froglog 54: 4.
[24] Lajmanovich, R.; de la Sierra, P.; Marino, F.; Peltzer, P.; Lenardón A. y Lorenzatti, E. (2005). Determinación de residuos de organoclorados en vertebrados silvestres del litoral fluvial de Argentina. En: Aceñolaza, F. G. (Ed.) Temas de la Biodiversidad del Litoral Fluvial Argentino II. INSUGEO, Miscelánea, Tucumán, Argentina. p: 255-262.
[25] Soto, A.M.; Chung, K.L. y Sonnenschein, C. (1994). The pesticides endosulfan, toxaphene, and dieldrin have estrogenic effects on human estrogen-sensitive cells. Environmental Health Perspectives 102: 380-383.
[26] Arnold, S. ; Vonier, P. ; Collins, B. ; Klotz, D. ; Guillette, L. y Mclachlan, J. (1997). In vitro synergistic interaction of alligator and human estrogen receptors with combinations of environmental chemicals. Environmental Health Perspective 105: 615-618.
[27] Park, D.; Hempleman, S. y Propper, C. (2001). Endosulfan exposure disrupts pheromonal systems in the red-spotted newt: A mechanism for subtle effects of environmental chemicals. Environmental Health Perspectives 109: 669-673.
[28] Jergentz, S.; Pessacq, P.; Mugni, H.; Bonetto, C. y Schulz, R. (2004). Linking in situbioassays and population dynamics of macroinvertebrates to assess agricultural contamination in streams of the Argentine pampa. Ecotoxicology and Environmental Safety 59: 133-141.
[29] Carriquiriborde, P.; Díaz, J.; Mugni, H.; Bonetto, C. y Ronco, A. E. (2007). Impact of cypermethrin on stream fish populations under field use in biotec-soybean production. Chemosphere 68: 613-621.
[30] Natale, G. y Ronco, A. (2003). Impacto del uso de pesticidas asociado a la siembra directa sobre especies no-blanco: Anuros autóctonos. Memorias Conferencia Internacional Usos del Agua, Agua 2003, Cartagena de Indias, 36-39.
[31] Peruzzo, P.; Marino, D.; Cremonte, C.; Da Silva, M.; Porta, A. A. y Ronco, A. E. (2003). Impacto de plaguicidas en aguas superficiales y sedimentos asociado a cultivos por siembra directa. Memorias Conferencia Internacional Usos del Agua, Cartagena de Indias, Colombia, 35-42.
[32] Marino, D. y Ronco, A. (2005). Cypermethrin and chlorpiryfos concentration levels in surface water bodies of the Pampa Ondulada, Argentina. Bulletin of Environmental Contamination and Toxicology 75: 820-826.
[33] Peruzzo, P. J.; Porta, A. A. y Ronco, A. E. (2008.) Levels of glyphosate in surface waters, sediments and soils associated with direct sowing soybean cultivation in north pampasic region of Argentina. Environmental Pollution 156: 61-66.
[34] Jergentz, S.; Mugni, H.; Bonetto, C. y Schulz, R. (2005). Insecticides in runoff and stream water of small agricultural streams in the main soybean area of Argentina. Chemosphere 61: 817-826.
[35] Racke, K. D. (1992). Degradation of organophosphorus insecticides in environmental matrices. En: Organophosphates: Chemistry, Fate, and Effects. (Eds.: Chambers, J.E. y Levy, P.Z.). Academic Press, San Diego, USA. p. 48-78.
[36] Sánchez-Hernández, J. C. (2001). Wildlife exposure to organophosphorus insecticides. Reviews of Environmental Contamination and Toxicology 172: 21-63.
[37] Sánchez-Hernández, J. C. (2003). Evaluating reptile exposure to cholinesteraseinhibiting agrochemicals by serum butyrylcholinesterase activity. Environmenta Toxicology and Chemistry 22: 296-301.
[38] Venturino, A.; Rosenbaum, E.; De Castro, A. C.; Anguiano, O. L.; Gauna, L.; De Schroeder, T. F. y Pechen de D'Angelo, A. M. (2003) Biomarkers of effect in toads and frogs. Biomarkers 8: 167-186.
[39] Venturino, A. y Pechen de D'Angelo, A. M. (2005) Biochemical targets of xenobiotics: biomarkers in amphibian ecotoxicology. Applied Herpetology 2: 335-353.
[40] Lajmanovich, R. C., Sánchez-Hernández, J. C., Stringhini, G., Peltzer, P. M. (2004). Levels of serum cholinesterase activity in the rococo toad (Bufo paracnemis) in agrosystems of Argentina. Bull. Environ. Contam. Toxicol. 72: 586-591.
[41] Attademo, A. M.; Lajmanovich, R. C.; Peltzer, P. M.; Bassó, A.; Junges, C. M. y Cabagna Zenklusen, M. (2012). Plasma B-esterase and Glutathione-S-transferase activities in the South American reptiles Caiman latirostris (Crocodylia, Alligatoridae) and Phrynops hilarii (Testudines, Chelidae). Water, Air, & Soil Pollution 223: 3321-3331.
[42] Lajmanovich, R. C.; Sánchez-Hernández, J. C.; Peltzer, P. M.; Attademo, A. M.; Fiorenza, G. S.; Cabagna, M. C. y Bassó, A. (2008). Levels of plasma B-esterase and Glutathione-S-transferase activities in three South American toads. Journal of Toxicological and Environmental Chemistry 90: 1145-1161.
[43] Sánchez-Hernández, J. C.; Borghini, F.;Corral, A. y Grimalt, J. O. (2004) Field uptake rates of hydrophobic organic contaminants by semipermeable membrane devices: environmental monitoring considerations. Journal of Environmental Monitoring 6: 919-925.
[44] Davis, A. K.; Keel, M. K.; Ferreira, A. y Maerz, J. C. (2010). Effects of chytridiomycosis on circulating white blood cell distributions of bullfrog larvae (Rana catesbeiana). Comparative Clinical Pathology 19: 49-55.
[45] Davis, A. K.; Maney, D. L. y Maerz, J. C. (2008). The use of leukocyte profiles to measure stress in vertebrates: a review for ecologists. Functional Ecology 22: 760-772.
[46] Davis, A. K. y Maerz, J. C. (2008). Comparison of hematological stress indicators in recently captured and captive paedomorphic mole salamanders, Ambystoma talpoideum. Copeia (3): 613-617.
[47] Davis, A. K. y Maerz, J. C. (2009). Effects of larval density on hematological stress indices in salamanders. Journal of Experimental Zoology 311A: 1-8.
[48] Cabagna, M.; Lajmanovich, R. C.; Stringhini, G.; Sánchez-Hernández, J. C. y Peltzer, P. M. (2005). Hematological parameters of health status in common toad Bufo arenarum in agroecosystems of Santa Fe Province, Argentina. Applied Herpetology 2: 373-380.
[49] Barni, S.; Boncompagni, E.; Grosso, A.; Bertone, V.; Freitas, I.; Fasola, M. y Fenoglio, C. (2007). Evaluation of Rana snk esculenta blood cell response to chemical stressors in the environment during the larval and adult phases. Aquatic Toxicology 81: 45-54.
[50] Zhelev, Z. M. (2007). Investigation on the blood differential formula in Rana ridibunda (Anura, Amphibia) from the Area of the Maritsa - Iztok 1 Steam Power Plant. Acta Zoologica Bulgarica 59: 181-190.
[51] Krauter, P. W. (1993) Micronucleus incidence and hematological effects in bullfrog tadpoles (Rana catesbeiana) exposed to 2-acetylaminofluorene and 2-aminofluorene. Archives of Environmental Contamination and Toxicology 24: 487-493.
[52] Fernandez, M.; L'Haridon, J.; Gauthier, L. y Zoll-Moreux, C. (1993) Amphibian micronucleus test(s): a simple and reliable method for evaluating in vivo genotoxic effects of freshwater pollutants and radiations. Initial assessment. Mutation Research 292: 83-99.
[53] Zoll-Moreux, C. y Ferrier, V. (1999). The Jaylet Test (Newt Micronucleus Test) and the Micronucleus Test In Xenopus: two in vivo tests on amphibia evaluation of the genotoxicity of five environmental pollutants and of five effluents. Water Research 33: 2301-2314.
[54] Djomo, J. E.; Dauta, A.; Ferrier,V.; Narbonne, J. F.; Monkiedje, A.; Njine, T. y Garrigues, P. (2004) Toxic effects of some major polyaromatic hydrocarbons found in crude oil and aquatic sediments on Scenedesmus subspicatus. Water Research 38: 1817-1821.
[55] Cabagna, M.; Lajmanovich, R. C.; Peltzer, P. M.; Attademo, M.; Ale, E. (2006) Induction of micronucleus in tadpoles of Odontophrynus americanus (Amphibia: Leptodactylidae) by the pyrethroid insecticide cypermethrin. Toxicological and Environmental Chemistry 88: 729-737.
[56] Burliba?a, L. y Gavril?, L. (2011) Amphibians as model organisms for study environmental genotoxicity. Applied Ecology and Environmental Research 9: 1-15.
[57] López, S.L.; Aiassa, D.; Benítez-Leitec, S.; Lajmanovich, R.C.; Mañas, F.; Poletta, G.; Sánchez N.; Simoniello, M. F. y Carrasco A.E. (2012). Pesticides used in South American GMO-based agriculture: a review of their effects on humans and animal models. Advances in Molecular Toxicology 6: 41-75.
[58] Lajmanovich, R.; Lorenzatti, E.; Maitre, M. I.; Enrique, S. y Peltzer, P. (2003). Comparative acute toxicity of the commercial herbicides glyphosate to neotropical tadpoles Scinax nasicus (Anura: Hylidae). Fresenius Environmental Bulletin 12: 364-367.
[59] Peltzer, P. M.; Lajmanovich, R. C.; Sanchez, L. C.; Attademo, A. M.; Junges, C. M.; Bionda, C.; Martino, L. y Bassó, A. (2011). Morphological abnormalities in amphibian populations from the mid-eastern of Argentina. Herpetological Conservation and Biology 6: 432-442.
[60] Paganelli, A.; Gnazzo, V.; Acosta, H.; López, S.L. y Carrasco, A. E. (2010) Glyphosate-based herbicides produce teratogenic effects on vertebrates by impairing retinoic acid signaling. Chemical Research in Toxicology 23: 1586 - 1595.
|
Revista QuímicaViva Número 3, año 11, Diciembre 2012 quimicaviva@qb.fcen.uba.ar |