El agua: un recurso esencial
Alicia Fernández Cirelli
Instituto Centro de Estudios Transdisciplinarios del Agua (CETA)
Universidad de Buenos Aires. afcirelli@fvet.uba.ar
Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET)
Recibido 13 de octubre 2012- Aceptado 16 de octubre 2012
Resumen
El agua es esencial para la vida y para el desarrollo de las sociedades. Posee propiedades únicas. En este trabajo se describen: la composición de las aguas naturales; la calidad de agua para los diferentes usos y su deterioro y los parámetros físico-químicos y biológicos usados como indicadores de calidad. Por último, se resalta la importancia de la representatividad del muestreo y la calidad de las mediciones químicas para que los resultados obtenidos permitan conclusiones válidas.
Palabras clave: agua, propiedades del agua, calidad de agua, parámetros de calidad
Water, an essential resource
Abstract
Water is essential for life and development due to its unique properties. In this manuscript a description of the following items is found: fresh water composition; water quality for different uses and its deterioration, as well as physicochemical and biological parameters used as indicative of water quality. The importance of sampling as well as chemical determinations quality is emphasized in order to arrive to right conclusions.
Keywords: water, water properties, water quality, quality parameters
Introducción
El agua cubre más del 70 % de la superficie del planeta; se la encuentra en océanos, lagos, ríos; en el aire, en el suelo. Es la fuente y el sustento de la vida, contribuye a regular el clima del mundo y con su fuerza formidable modela la Tierra. Posee propiedades únicas que la hacen esencial para la vida. Es un material flexible: un solvente extraordinario, un reactivo ideal en muchos procesos metabólicos; tiene una gran capacidad calorífica y tiene la propiedad de expandirse cuando se congela. Con su movimiento puede modelar el paisaje y afectar el clima.
Los océanos dan cuenta de casi el 97,5 % del agua del planeta. Únicamente un 2,5% es agua dulce. Los glaciares, la nieve y el hielo de los cascos polares representan casi el 80% del agua dulce, el agua subterránea 19% y el agua de superficie accesible rápidamente sólo el 1%. Esta baja cantidad de agua de superficie fácilmente accesible, se encuentra principalmente en lagos (52%) y humedales (38%). (ver Figura 1)
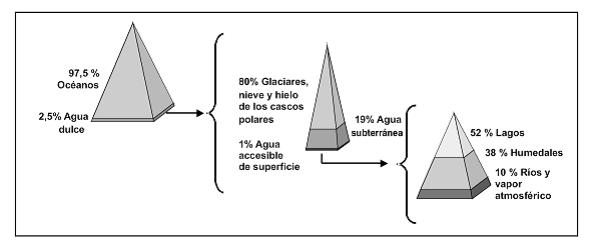
Figura 1: Distribución del agua.
El agua es un recurso renovable pero finito. Se calcula que al año se evaporan aproximadamente 505.000 km3 1de agua de los océanos. Sin embargo, la mayor parte se precipita nuevamente sobre los mismos océanos, no pudiendo ser utilizada como recurso de agua dulce. La precipitación anual sobre tierra firme se estima en 120.000 km3. Ese movimiento masivo del agua, esencialmente causado por la energía del sol se conoce como ciclo hidrológico. Este ciclo es un proceso complejo que incluye la precipitación, el escurrimiento, la evapotranspiración y la infiltración. Ver 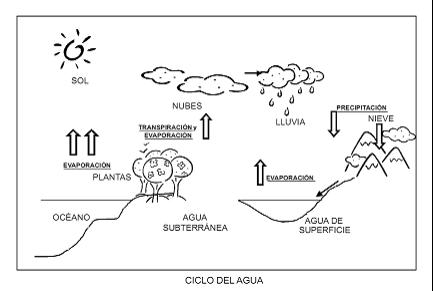
Figura 2. Ciclo del agua.
No habrá sustentabilidad si no se conocen y tienen en cuenta todas las fases de este ciclo. Para ello, es necesario no solo velar por la utilización y la distribución eficiente del agua dulce sino también salvaguardar el estado de la cuenca de captación y las aguas subterráneas (antes del consumo), así como el tratamiento y la eliminación adecuada de las aguas de desecho (después del consumo). Es necesario privilegiar el conocimiento del vínculo existente entre el uso del agua y los ecosistemas que la abastecen.
En la medida en que usamos el agua, hemos generado ciclos antrópicos. Captamos el agua de las fuentes naturales en condiciones mejores a las que habitualmente la devolvemos a esos mismos cuerpos de agua.

Figura 3: Usos del agua.
El agua posee propiedades únicas que la hacen esencial para la vida
· Existe en las tres fases, sólida, líquida y gaseosa dentro de los límites de temperatura y presión naturales en la tierra.
· Tiene una gran capacidad calorífica. Puede absorber una cantidad de calor importante sin aumentar demasiado su temperatura. Un gramo de agua absorbe una caloría para elevar su temperatura en 1º C. Debido a esta elevada capacidad calórica, se necesita una gran cantidad de calor para cambiar apreciablemente la temperatura de una masa de agua y, por lo tanto, un cuerpo de agua puede tener un efecto estabilizante sobre la temperatura de las regiones geográficas cercanas. Esta propiedad impide grandes cambios súbitos en la temperatura de los cuerpos de agua, protegiendo a los organismos acuáticos del shock que supondrían abruptas variaciones de temperatura. El contenido del agua de las células es aproximadamente el 80% y esta propiedad del agua protege a las moléculas que están disueltas o contenidas por ella.
· Tiene las propiedad de expandirse cuando se congela (en realidad, la expansión comienza a los 4º C). Esto permite que el hielo flote. Si eso no sucediera y quedara debajo del agua no podría fundirse tan fácilmente.
· Alta constante dieléctrica: permite la disolución de sustancias iónicas y favorece su ionización.
· Alto calor latente de fusión: estabiliza la temperatura de los cuerpos de agua en el punto de congelación. Evita efectos de las bajas temperaturas sobre el ecosistema de los cuerpos de agua.
· Alto calor de vaporización: influye en la transferencia del calor del vapor de los cuerpos de agua y el vapor atmosférico.
· Alta tensión superficial. Esto significa que el agua es pegajosa y elástica y tiende a unirse en gotas en lugar de separarse en una capa delgada y fina. La tensión de la superficie es la responsable de la acción capilar, de que el agua pueda moverse (y disolver substancias) a través de las raíces de plantas y a través de los pequeños vasos sanguíneos en nuestro cuerpo.
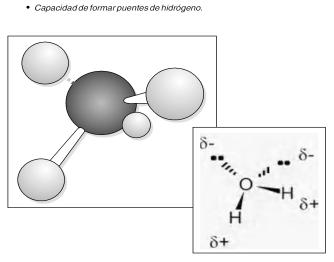
Figura 4: Molécula de agua
Los átomos de hidrógeno se "unen" a un lado del átomo de oxígeno, resultando en una molécula de agua, teniendo una carga eléctrica positiva en un lado y una carga negativa en el otro. Ya que las cargas eléctricas opuestas se atraen, las moléculas de agua tienden a atraerse unas a otras.
Composición de las aguas naturales: iones mayoritarios, minoritarios y trazas
La salinidad total de las aguas superficiales continentales está determinada normalmente por la presencia de los cationes sodio, calcio, magnesio y potasio y de los aniones cloruros, sulfato y bicarbonato-carbonato. La media mundial de salinidad de las aguas continentales es de alrededor de 120 mg/L pero varía de un continente a otro (Livingstone, 1963) y se debe principalmente a los procesos de meteorización de rocas de la cuenca de drenaje, a la precipitación atmosférica y al equilibrio precipitación-evaporación. A su vez, la meteorización se produce mayormente como consecuencia de procesos de disolución, hidrólisis, de óxido reducción y de formación de complejos con sustancias inorgánicas u orgánicas (Kilham, 1990).
Las relaciones de equivalentes entre los principales iones en el orden mundial, tienden a ser, Ca2+ > Mg2+ > Na+ > K+ y HCO3- > SO42- > Cl-, aunque en regiones costeras, estas relaciones pueden variar significativamente. Las concentraciones de K+ y Cl- son relativamente conservativas, es decir sufren pequeñas variaciones inducidas por cambios ambientales o por su utilización por seres vivos (Manaham, 1991, a y b). En cambio, las concentraciones de HCO3-, el SO42- y el Ca2+ dependen de procesos de precipitación-disolución, del metabolismo microbiano y de cambios climáticos. Algunos elementos minoritarios como el silicio, el nitrógeno, el fósforo, el hierro, tienen una gran importancia desde el punto de vista biológico, aunque no influyen en forma significativa en la salinidad de un cuerpo de agua (Wetzel, 1983). La rapidez de los procesos biológicos, en contraste con los procesos físico-químicos, hace que el tiempo de residencia de estos nutrientes en los cuerpos de agua sea mucho menor que el de los iones responsables de la salinidad.
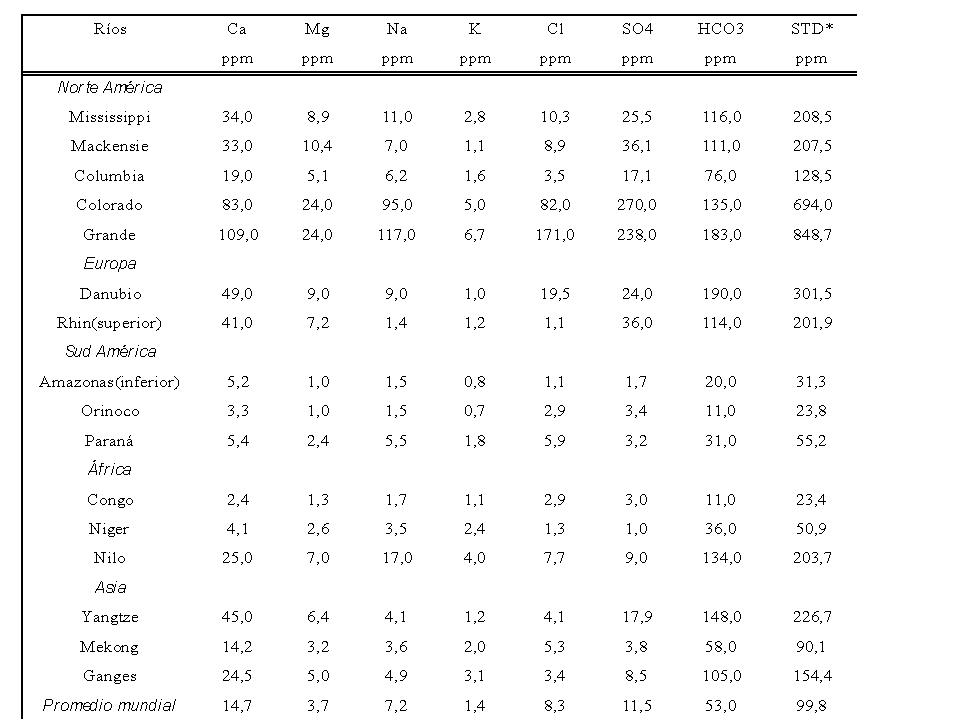
STD= sólidos totales disueltos
Tabla 1: Composición en iones mayoritarios de ríos de diferentes regiones del mundo.
En general, un elemento es considerado minoritario en medios naturales cuando su concentración está comprendida entre el 1 y el 0,01 %, de la misma manera, se denomina traza al elemento cuya concentración es menor del 0,01 % (Stumm y Morgan, 1995).
Calidad del agua para distintos usos
La disponibilidad de agua es de suma importancia para la vida y el desenvolvimiento económico de cualquier región del mundo. Los recursos disponibles deben repartirse entre numerosos usuarios además de tener en cuenta las necesidades del medio ambiente. Durante muchos años, todos los recursos eran considerados disponibles para cualquier uso antrópico, sin tener en cuenta la calidad o las necesidades para los usos ambientales. Cuando se considera la distribución del agua entre los distintos usuarios, la agricultura aparece como el sector de mayor demanda. Las dos terceras partes de los recursos hídricos se destinan al uso agrícola, con una demanda creciente para el turismo, usos urbanos e industriales, compitiendo por un acceso a un recurso cada vez menos disponible.
Normalmente los recursos hídricos se obtienen de aguas superficiales o de aguas subterráneas. El uso de unas u otras depende de muchos factores, inicialmente de la disponibilidad de cada recurso. Normalmente las aguas superficiales ofrecen cantidades mayores de agua a corto plazo, mientras que las subterráneas son un recurso más constante, al menos, a mediano plazo.
Existen diversas áreas en el mundo donde la demanda de agua supera la oferta. En ellas se apela a los recursos no convencionales, como por ejemplo el agua de lluvia, usada como recurso desde la época bíblica. Otra solución frecuente consiste en la desalinización del agua de mar o el tratamiento del agua residual. Otras soluciones son las aguas de escorrentía y el agua procedente del rocío o escarcha. Existe una relación estrecha entre el uso de aguas residuales sin tratar y los problemas sanitarios. La creciente competencia por el agua está llevando a un mejor uso de este enorme recurso.
El agua es usada para muchas finalidades y en cada caso se requiere una calidad particular, siendo importante no utilizar agua de calidad superior para un uso que no lo requiera.
El aprovisionamiento de agua para uso doméstico es el más exigente, en términos de calidad y seguridad del suministro. La calidad de agua tiene consecuencias directas en la salud humana, situación que se torna más grave por la demanda creciente. El agua potable es necesaria para la vida, para la salud y para una existencia productiva. La salud humana depende no sólo de la cantidad de agua suministrada, sino principalmente de la calidad. Según la OMS (Organización Mundial de la Salud), casi la cuarta parte de las camas disponibles en los hospitales del mundo están ocupadas por enfermos cuyas dolencias se deben a la insalubridad del agua.
La Década Internacional del Agua Potable y Saneamiento de las Naciones Unidas, en los años ochenta, fue proclamada por la Conferencia del Agua de las Naciones Unidas (Mar del Plata, 1977). Se enfocó en el mejoramiento de la salud pública mediante la ampliación de la cobertura de servicios, bajo el lema: “agua y saneamiento para todos”. Si bien hubo grandes avances y las metas se reiteraron en 1990, aún quedan sectores sin acceso a agua segura y la situación es aún más critica en lo referente a saneamiento.
La población mundial asciende aproximadamente a 7000 millones, de los cuales el 20 % no bebe agua potable y el 40 % no tiene acceso a medios de saneamiento.
La Asamblea General de las Naciones Unidas, en 2010, estableció el derecho al agua potable y saneamiento como un derecho humano esencial para el pleno disfrute de la vida y de todos los derechos humanos.
Los criterios de calidad para agua potable han sido desarrollados tomando en cuenta el empleo de agua de primer uso o sin contaminantes tóxicos sintéticos. En las últimas tres décadas, se incrementó la preocupación por la producción, uso y destino final de numerosos productos químicos empleados en la industria, agricultura, ganadería, medicina, etc. Las investigaciones realizadas han demostrado que estas sustancias pueden incorporarse en el medio ambiente, dispersarse y persistir en extensiones mucho más grandes que las esperadas. Algunas de ellas, como por ejemplo los agroquímicos y en particular los pesticidas, son esparcidos intencionalmente sobre vastas regiones para proteger los distintos tipos de cultivos de plagas; otras, como los subproductos industriales, son vertidas al agua o al aire de manera directa o indirecta.
Los productos farmacéuticos y cosméticos, son elementos importantes dentro de la vida moderna, y se emplean tanto en la medicina humana como veterinaria. Estas sustancias, se incorporan a las aguas superficiales a través de los residuos cloacales, que pueden estar o no tratados previamente, en forma directa. La eficiencia del tratamiento de las aguas residuales, no permite eliminar totalmente este tipo de compuestos; por lo tanto, pueden alcanzar las aguas superficiales con relativa facilidad.
Algunos de los potenciales problemas que puede provocar esta contaminación, denominada silenciosa, son: procesos fisiológicos anormales, disminución de la capacidad de reproducción, aumentos de los casos de cáncer, desarrollo de cepas bacterianas con extremada resistencia a los antibióticos, potencial incremento de la toxicidad de los compuestos presentes en el medio ambiente por efectos sinérgicos. Los efectos pueden acumularse de manera lenta sin poder detectarse, de allí su denominación silenciosa, hasta un determinado nivel donde los efectos se evidencian y producen cambios irreversibles por efecto cascada.
El agua potable es normalmente garantizada por las autoridades, y su existencia es absolutamente esencial para asegurar la presencia de población en un lugar determinado. Existen normativas de calidad que se deben cumplir para el agua potable en todos los países y ésta no puede provenir de cualquier fuente. La definición legal de agua potable consiste en proporcionar una lista de compuestos y asociarlos con un nivel tolerable. Desde el punto de vista práctico, la cantidad de sustancias seleccionadas debe ser limitada. En las legislaciones de los diferentes países se consideran entre 80 y 130, a pesar de que se sabe que el número de compuestos sintéticos que el hombre maneja es mayor que 70.000, y para muchos de ellos se desconoce el grado de toxicidad. De esta manera, aún cuando un agua pueda cumplir con las normas de potabilización no se puede asegurar que no exista algún otro contaminante. Cabe mencionar, que los criterios de calidad para agua potable han sido desarrollados tomando en cuenta el empleo de agua de primer uso o sin contaminación por tóxicos sintéticos.
Con el 15% del comercio mundial los productos agrícolas y comestibles son uno de los vectores básicos del intercambio del agua. La disminución de la calidad del agua utilizada en agricultura está causando lentamente una disminución de la productividad de los sistemas agrícolas. Hay otras consideraciones que derivan de la capacidad contaminante de la agricultura, como el exceso de fertilización, del uso de plaguicidas y de una gestión deficiente de los residuos ganaderos, biosólidos y otros residuos aplicados al suelo. El uso de agua en ganadería como bebida animal debe cumplir normas de calidad para no poner en riesgo la salud de los animales y ante el riesgo que ciertos elementos tóxicos puedan ser transferidos a la cadena agroalimentaria.
Las industrias requieren en mayor o menor medida agua para sus procesos y los vertidos son una fuente de contaminación, ya que se realizan muchas veces sin tratamiento a las corrientes de agua, estuarios y mar. La industria es también una fuente de fósforo y nitrógeno, pero en menor proporción que las aguas residuales municipales y agrícolas. Las industrias alimentarias y agroalimentarias, proveen grandes cantidades de materia orgánica residual. El origen de la emisión de muchos microcontaminantes es industrial. Las aguas de refrigeración de las industrias producen contaminación térmica, ya que retornan al medio acuático a mayor temperatura en grandes cantidades, causando una disminución de la solubilidad del oxígeno. La minería es una industria extractiva que requiere grandes volúmenes de agua y que trae aparejados problemas de acidificación.
El uso del agua para fines recreacionales está siendo cada vez más importante, ya que el aumento del nivel económico, permite a la comunidad realizar más actividades de ocio. En el caso de las actividades que implican contacto directo del hombre con el agua, su calidad es más importante que su cantidad.
La generación de energía hidroeléctrica produce impactos sociales y ambientales, considerando la reinstalación de la población que vive en las zonas que se inundarán, la pérdida de tierras fértiles, los bosques, la destrucción del paisaje causado por las instalaciones y el efecto sobre la flora y la fauna, en general. También puede acarrear conflictos entre los distintos usuarios del agua, por ejemplo, entre generación de electricidad y uso agrícola. Las consecuencias ecológicas son difíciles de prever y pueden ser muy complejas.
El agua envasada ha generado durante la última década una importante industria, creando un negocio específico. La Unión Europea, por ejemplo, define al agua mineral como agua subterránea, con una calidad de acuerdo a las leyes y normas respectivas, sin necesidad de tratamiento.
Deterioro de la calidad del agua
El deterioro de la calidad del agua es un gran problema que va en aumento, y es considerado uno de los principales problemas ambientales (Salgot et al., 1999). Las principales causas, tanto para el agua dulce como la salada, son los vertidos incontrolados de las aguas residuales urbanas e industriales, muchas veces sin tratamiento, así como las prácticas agrícolas deficientes. La contaminación atmosférica, la acumulación de sustancias químicas en suelos y sedimentos, el exceso de bombeo de aguas subterráneas, la minería y otras industrias de extracción, la destrucción de zonas pantanosas, también contribuyen a su deterioro.
Los principales efectos que produce el agua contaminada en el medio ambiente son: contaminación microbiológica del agua, con la transmisión hídrica de enfermedades; pérdida de los ecosistemas acuáticos; riesgo de infecciones crónicas en el hombre, asociadas a la contaminación química; pérdida de la capacidad productiva en suelos regados, a causa de procesos de salinización, pérdida de la reserva de proteínas de los peces; pérdida de suelos por erosión
Se puede considerar que casi todos los usos pueden contaminar el recurso y convertirlo en no disponible para otros usos, siendo indispensable un tratamiento (Escobar y Schafer, 2010).
Hay que considerar que no todos los problemas de calidad de agua son únicamente consecuencia del impacto del hombre. Las características geoquímicas naturales pueden aportar cantidades elevadas de hierro reducido, flúor, arsénico y sales a las aguas subterráneas, reduciendo su uso como agua de bebida. Las erupciones volcánicas y sus consiguientes torrentes de lava, las inundaciones y sequías pueden provocar un deterioro local y regional del ambiente acuático. No obstante, cualquiera de estos eventos, impacta menos que cualquier actividad desarrollada por el hombre (Pepper et al., 1996).
Los principales contaminantes del agua subterránea son: amplia gama de compuestos orgánicos e inorgánicos procedentes de fuentes puntuales urbanas, industriales, mineras, áreas militares, vertederos de escombros (basureros) ; lixiviación de nitratos; lixiviación de plaguicidas; acidificación; sales originadas por intrusiones de origen marino; sales procedentes del uso de aguas salinas para regar.
Los contaminantes de las aguas superficiales son: amplia gama de compuestos orgánicos e inorgánicos procedentes de fuentes puntuales urbanas, industriales y áreas de ganadería; nutrientes de origen difuso, en áreas agrícolas y urbanas; contaminantes derivados de problemas de eutrofización; acidificación; filtraciones de vertederos de escombros (basureros); filtraciones de embalses
En todos los casos el exceso de captación contribuye a incrementar los efectos de la contaminación.
Es posible establecer una diferencia entre la contaminación de origen puntual y la de origen difuso o no puntual, en función de la forma de llegada a la fuente de agua.
La contaminación de origen puntual es fácil de detectar y es posible limitarla. En cambio, no es posible afirmar lo mismo sobre la contaminación de origen no puntual , que proviene en gran parte de la agricultura y de los habitantes rurales. Los contaminantes agrícolas, con los sedimentos provenientes del suelo erosionado, el fósforo adsorbido a las partículas del suelo, las bacterias en suspensión, los nitratos disueltos y otros minerales y los plaguicidas en suspensión o soluciones no se pueden asociar fácilmente con una fuente u origen concreto.
Tanto en un caso como en el otro, lo que se produce es una degradación del recurso. Normalmente se intenta primero solucionar el problema de las fuentes puntuales, para después establecer una estrategia de limitación de las fuentes no puntuales. El manejo de las fuentes de contaminación puntuales se soluciona con medidas estructurales, donde la limitante normalmente es económica. En el caso de las fuentes no puntuales, deben aplicarse medidas no estructurales de difusión y concientización.
Indicadores de calidad
El concepto de calidad de agua es complejo y difícil de definir. Hay dos aspectos que son intrínsecos al agua: ¿qué contiene? ¿en qué cantidad?
El tercer aspecto es extrínseco: cada uso del agua requiere una calidad determinada.
Un indicador es la manifestación o traducción de una cualidad o propiedad del objeto de la evaluación. Nuestro objeto de evaluación es la calidad del agua. Utilizaremos parámetros físicos, químicos y biológicos como indicadores de la calidad.
Entre los indicadores físicos describiremos: turbidez; sólidos en suspensión; color; olor y sabor; temperatura y conductividad.
La materia presente en el agua se puede encontrar disuelta, en suspensión (particulada) o coloidal. La turbidez es un parámetro usado habitualmente en aguas naturales como indicador de la presencia de sólidos, especialmente coloidales. Proviene de la erosión y transporte de materia coloidal (arcilla, fragmentos de roca, sustancias del lecho, etc.) por parte de los ríos en su recorrido, de los aportes de fibras vegetales y de los aportes de aguas residuales domésticas o industriales que puedan recibir (ej: jabones). Se mide la extensión con la que un rayo de luz es reflejada en su paso por el agua con un ángulo de 90°. Esta reflexión se produce debido al efecto Tyndall que caracteriza a los sistemas coloidales.
La presencia de color indica la existencia de sustancias extrañas. Parte puede deberse a materia en suspensión y parte a la presencia de sustancias disueltas. Fundamentalmente lo producen compuestos orgánicos de origen natural (taninos, ácidos húmicos, etc.) o artificial aportados por vertidos de industrias. Se determina por métodos espectrofotométricos, analizando el color de la luz que atraviesa una muestra de agua previamente filtrada para poder determinar el color verdadero.
Las aguas naturales pueden contener disueltos compuestos que les confieren olor y sabor. Estos parámetros son muy sensibles a las apreciaciones personales y es difícil sistematizar las medidas.
La temperatura afecta la mayoría de los procesos biológicos que tienen lugar en los ecosistemas acuáticos. Afecta la solubilidad de los gases disueltos en el agua. Las variaciones de temperatura del agua se producen debido a las variaciones de la temperatura ambiente originadas en el ciclo natural de las estaciones. El impacto antropogénico más importante es el uso del agua como elemento refrigerante, especialmente en las centrales térmicas
La conductividad es la capacidad que presenta el agua para conducir la electricidad. Se debe a las sales que lleva disueltas. No es un parámetro específico de una especie concreta sino que engloba al conjunto de iones. La conductividad es afectada por el tipo de terreno que atraviesa el agua y por la presencia o no de vertidos de aguas residuales ya que los iones que contienen no son eliminados por los procesos de depuración. Este parámetro sirve para determinar la existencia de algunos vertidos y la posibilidad de reutilización del agua para regar. Las medidas se realizan mediante un conductímetro.
Entre los indicadores químicos describiremos: pH, dureza, oxígeno disuelto, materia orgánica, nutrientes, plaguicidas y metales pesados.
La concentración de iones hidrógeno (pH=-log[H+]) interviene en los equilibrios de diferentes sustancias químicas que pueden encontrarse en diferentes formas de acuerdo a la acidez, por ejemplo en la solubilidad de los metales. El intervalo de acidez idóneo para la vida es muy estrecho y crítico. El pH de las aguas naturales se encuentra en un rango comprendido entre 6 y 9.
La dureza se define como la suma de todos los cationes multivalentes presentes en el agua. Los más importantes son calcio y magnesio y suele calcularse su valor como la suma de ellos.
Químicamente, el índice de dureza se define como: dureza = [Ca2+] + [Mg2+]. La dureza se expresa, no en concentración molar de iones, sino como la masa en miligramos (por litro) de carbonato de calcio que contiene el mismo número de iones dipositivos (+2). Así por ejemplo, una muestra de agua que contenga un total de 0,0010 moles de Ca2+ + Mg2+ por litro, tendría un valor de la dureza de 100 miligramos de CaCO3, ya que la masa molar del CaCO3 es 100 gramos y, por tanto, 0,0010 moles pesan 0,1 g o 100 mg. La manifestación más evidente de la dureza del agua es la precipitación de sales insolubles de los jabones. La aguas se clasifican como: blandas: 0-60 mg/L CaCO3, moderadamente blandas: 60-120 mg/l CaCO3, duras: > 120 mg/l CaCO3. La dureza se determina mediante una valoración con EDTA. Si fuera necesario determinar calcio y magnesio individualmente se recomienda realizar las determinaciones por absorción atómica.
El oxígeno disuelto es uno de los indicadores más utilizados para el medio fluvial ya que participa en un gran número de procesos que tienen lugar en el medio acuático. Es aportado por intercambio con la atmósfera y por la acción fotosintética de los productores primarios. Es consumido por los microorganismos en los procesos de oxidación de la materia orgánica e inorgánica y en los de respiración. Se determina por el método de Winkler que involucra la precipitación del oxígeno como óxido de manganeso su redisolución en medio ácido y la valoración mediante una yodometría (Baird, 2001; Peral, 2006).
De lejos, el más importante agente oxidante en las aguas naturales es el oxígeno molecular disuelto, O2. En la reacción, cada uno de sus átomos de oxígeno se reduce desde su estado de oxidación cero hasta el estado –2 en el H2O o en el OH-. La hemirreacción que tiene lugar en disolución ácida es:
O2 + 4 H+ + 4 e- ® 2 H2O
mientras que la que ocurre en disolución básica es:
O2 + 2 H2O + 4e- ž 4OH-
La concentración de oxígeno disuelto en agua es pequeña a causa de su baja solubilidad y, por tanto, es precaria desde el punto de vista ecológico. Para la reacción:
O2 (g) ↔ O2 (ac)
la constante de equilibrio que debe considerarse es la constante de la Ley de Henry, KH, que para el oxígeno a 25ºC es 1,3 x 10-3 mol L-1 atm-1:
KH = [O2 (ac)]/PO2 = 1,3 x 10-3 mol L-1 atm-1
Puesto que en el aire seco la presión parcial de oxígeno, PO2, es de 0,21 atm, se tiene que la solubilidad del O2 es 8,7 miligramos por litro de agua (87 ppm). Debido a que las solubilidades de los gases aumentan al disminuir la temperatura, la cantidad de O2 que se disuelve a 0ºC (14,7 ppm) es mayor que la cantidad que se disuelve a 35ºC (7,0 ppm).
Se define como materia orgánica a un conjunto de compuestos de composición y estructura química bastante diferente, pero que presentan una característica común: su capacidad para reaccionar con el oxígeno en un proceso de oxidación. El oxígeno disuelto en agua oxida la materia orgánica. Si se supone, por simplicidad, que ésta es un hidrato de carbono polimérico (por ejemplo, los tejidos de las plantas), con una fórmula empírica aproximada de CH2O, la reacción de oxidación puede formularse como:
CH2O(ac) + O2(ac) ® CO2 (g) + H2O (ac)
El oxígeno disuelto en agua también puede consumirse por la oxidación del amoníaco (NH3) y del amonio (NH4+) disuelto, que son sustancias que, igual que la materia orgánica, están presentes en agua como resultado de la actividad biológica y por oxidación dan lugar a la formación de ión nitrato (NO3-).
La materia orgánica puede ser transportada a partir de las interacciones con el cauce o generada en el seno de la propia masa de agua. Es un componente característico de los vertidos de aguas servidas y es un indicador de contaminación doméstica.
La capacidad de la materia orgánica en una muestra de agua natural a consumir oxígeno, se denomina demanda bioquímica de oxígeno (DBO). Se evalúa experimentalmente, determinando la concentración de oxígeno disuelto al comienzo y al final de un período de cinco días en el que una muestra sellada de agua permanece en la oscuridad a una temperatura constante, usualmente 20 ó 25ºC. Las reacciones de oxidación están catalizadas en la muestra por la acción de microorganismos presentes en el agua natural. La demanda de oxígeno determinada con este ensayo, a menudo designada por DBO5, corresponde a un 80% de la que se determinaría si el experimento hubiese ocurrido durante un tiempo más prolongado.
Puede realizarse una determinación más rápida de la demanda de oxígeno evaluando la demanda química de oxígeno, DQO, de una muestra de agua. El ión dicromato en lugar del O2, se utiliza para determinar los valores de DQO. La hemirreacción de reducción para el dicromato cuando oxida la materia orgánica es:
Cr2O7-2 + 14 H+ + 6 e- ® 2Cr3+ + 7 H2O
ióndicromato ióncromo III
En la práctica, se añade a la muestra un exceso de dicromato, y este exceso se valora con un reductor, el Fe+2, hasta el punto final. El número de moles de O2 que la muestra necesita para completar la oxidación corresponde a un 6/4 (= 1,5) veces el número de moles de dicromato, ya que este último acepta seis electrones por ion, mientras que el O2 acepta sólo cuatro.
La dificultad de la DQO como parámetro de medida de la demanda de oxígeno es que la disolución ácida de dicromato es tan oxidante, que oxida sustancias que en aguas naturales consumen oxígeno muy lentamente y, por tanto, no representan una amenaza real a sus contenidos en oxígeno. En otras palabras, el dicromato oxida sustancias que no serían oxidadas por el O2 en la determinación de DBO.
No es raro que aguas contaminadas por sustancias orgánicas asociadas a animales, a residuos de alimentos o a aguas residuales, tengan una demanda de oxígeno que exceda la solubilidad máxima de equilibrio del oxígeno disuelto. En estas circunstancias, excepto que el agua esté continuamente aireada, rápidamente el oxígeno disuelto se agota y los peces mueren.
Finalmente, hay otros dos parámetros utilizados para determinar la cantidad de sustancias orgánicas presentes en las aguas naturales. El carbono orgánico total, COT, se utiliza para la materia orgánica disuelta y suspendida en el agua; por ejemplo, para el agua subterránea este parámetro tiene un valor de aproximadamente un miligramo por litro, es decir 1 ppm de carbono. El parámetro carbono orgánico disuelto, COD, se utiliza para caracterizar el material orgánico que está disuelto. Para aguas superficiales, el COD es de unos 5 ppm en promedio, aunque en aguas pantanosas puede alcanzar valores diez veces superiores, y para aguas residuales no tratadas, los valores típicos de COD son de cientos de ppm.
Resumiendo, las determinaciones de materia orgánica se realizan por: a) oxidación por parte de microorganismos, que se denomina demanda bioquímica de oxígeno (DBO); b) oxidación por medio de un oxidante químico estandarizado, que puede ser dicromato de potasio:, en cuyo caso se denomina demanda química de oxígeno (DQO), o permanganato de potasio: en cuyo caso se denomina oxidabilidad; c) oxidación total de la materia orgánica: Carbono orgánico total (COT).
La demanda bioquímica de oxígeno (DBO) es el más aproximado a los procesos que tienen lugar en el medio acuático. Se asume que en la muestra ya hay microorganismos que pueden facilitar la oxidación de la materia orgánica por parte del oxígeno disuelto en el agua. La cantidad de oxígeno consumido, que es lo que se mide y se informa en mg de O2, depende del tiempo. Por eso la determinación se realiza a los 5 días: DBO5. Es necesaria una temperatura de referencia, que se fija en 20ºC. Como se mide diferencia de oxígeno, la reacción se lleva a cabo en la oscuridad. El valor de saturación de oxígeno a 20ºC es 9 mg/L. Esto hace necesario que se realicen diluciones, lo que constituye una fuente de error en la determinación.
Este método presenta variabilidad intrínseca: es una reacción entre compuestos que no se sabe cuáles son con unos microorganismos no identificados. Se mide un parámetro global: diferentes concentraciones de compuestos pueden dar la misma DBO. En experiencias entre laboratorios, los valores pueden oscilar entre un 112% de exceso y un 58% de defecto. Para aguas naturales: DBO es del orden de 10 mg/L, para aguas residuales urbanas tratadas: 500 mg/L, llegando en el caso de excretas de cerdos a valores de 15000 mg/L.
Si bien es la medida más representativa de lo que acontece en el medio natural, debe tenerse en cuenta que no es una medida inmediata (5 días) y la materia orgánica no es el único consumidor de oxígeno. La oxidación de amonio es significativa a partir de 7 días.
Los métodos de oxidación química incluyen la oxidación con dicromato de potasio (DQO), o con permanganato de potasio (Oxidabilidad). El oxidante químico reacciona con sustancias difíciles de biodegradar, por lo que los valores de DQO son en general mayores, y la relación entre DBO y DQO no es lineal. En general, la relación DQO/DBO para un agua residual urbana es aproximadamente 2 y valores superiores indicarían la presencia de aguas residuales industriales con productos químicos de difícil biodegradación. La DQO es de más fácil estandardización y reproducibilidad y se realiza en un tiempo menor (2 h). Tiene menor sentido físico para evaluar el impacto de agua residual en un medio receptor.
En las determinaciones de carbono orgánico total (COT) se oxida en forma total la muestra y se determina el carbono como dióxido de carbono. El proceso de oxidación se lleva a cabo por combustión catalítica, que permite efectividad en la oxidación de compuestos más resistentes, como son las proteínas o la materia particulada. Es el más utilizado en el tratamiento de aguas. La cuantificación del dióxido de carbono generado se puede realizar volumétricamente, por conductividad térmica o una sonda específica. Este método es de más fácil automatización y aunque los equipos disponibles son costosos, se requiere menor tiempo y permite el análisis simultáneo de muchas muestras.
Con el término de nutrientes nos referimos fundamentalmente a los compuestos de nitrógeno y de fósforo. Estos compuestos acompañan a la materia orgánica en los efluentes domésticos, y pueden provenir también de fertilizantes y de excretas ganaderas.
Existen varias formas ambientalmente importantes de nitrógeno, que difieren en el grado de oxidación del átomo de nitrógeno. Las formas más reducidas son el amoníaco, NH3 y su ácido conjugado, el ión amonio, NH4+. La forma más oxidada es el ión nitrato, el cual existe en sales sólidas, en disoluciones acuosas y en el ácido nítrico, HNO3. En disolución, los intermedios más importantes entre estos extremos son el ión nitrito, NO-2, y el nitrógeno molecular, N2.
En el proceso de la nitrificación catalizado por microorganismos, el amoníaco y el ión amonio se oxidan a nitrato, mientras que en el correspondiente proceso de desnitrificación, el nitrato y el nitrito se reducen a nitrógeno molecular. (El óxido nitroso, N2O, es un subproducto minoritario en ambos casos). Los dos procesos son importantes tanto en suelos como en aguas naturales. En ambientes aeróbicos, como la superficie de lagos, el nitrógeno está en su estado de oxidación más alto: en forma de nitrato, mientras que en ambientes anaeróbicos, como el fondo de los lagos estratificados, existe en su estado más reducido: en las formas amoníaco y de ión amonio. El ión nitrito existe en ambientes anaeróbicos como suelos anegados que no están demasiado reducidos para convertir todo el nitrógeno a amoníaco. La mayoría de las plantas pueden absorber nitrógeno sólo en la forma más oxidada, como nitrato, con lo que el amoníaco o el ión amonio utilizados como fertilizantes deben, primero oxidarse por medio de microorganismos antes de ser útiles para la vida de las plantas. Estos procesos de oxido-reducción entre las diferentes especies de nitrógeno, catalizados por microorganismos se conoce como ciclo del nitrógeno.
Las determinaciones de Nitrógeno Total se realizan por el método de Kjeldahl. El nitrato puede determinarse espectrofotométricamente en aguas subterráneas. Existen kits comerciales para la determinación de las diferentes especies de nitrógeno. La cromatografía iónica es un método adecuado y preciso para la determinación simultánea de las diferentes formas iónicas. El procesamiento previo depende de la matriz ambiental.
Debido a su carga negativa el ión nitrato no es adsorbido por los coloides del suelo y es altamente móvil. Por lo tanto, pasa a la zona no saturada y de allí a aguas subterráneas.
El nitrato provoca metahemoglobinemia ya que puede reducirse a nitrito e interferir con el transporte de oxígeno por la hemoglobina (enfermedad del bebé azul, frecuentemente fatal para bebés menores de 6 meses).
El fósforo presenta un número menor de compuestos solubles que el nitrógeno. En los fertilizantes, se aplica normalmente como sales de calcio o amonio. Es tomado por plantas o microorganismos como H2 PO4- o H PO42-. Reacciona con Al, Fe o Ca en los suelos para formar compuestos insolubles. Queda normalmente retenido por los constituyentes del suelo, por lo que a menos que los aportes sean excesivos no llega a las aguas subterráneas. Puede afectar el agua subterránea en acuíferos someros en zonas de suelos arenosos.
Las determinaciones de fósforo se realizan espectrofotométricamente. Se determina P total (previa digestión) y P soluble.
Los aportes excesivos de nitrógeno y fósforo pueden ocasionar fenómenos de eutrofización.
La urbanización y la explotación agropecuaria intensiva producen aportes excesivos de nutrientes a cuerpos lénticos como lagos y embalses, promoviendo la proliferación algal y otros síntomas de eutrofización. Este proceso tiene un efecto adverso en la calidad de agua, ya que grandes cantidades de plantas acuáticas causan disminución del oxígeno hipolimniótico, aumentando la turbidez, afectando la biodiversidad de peces, e interfiriendo en los procesos de potabilización de agua. El fósforo es normalmente el factor limitante para el crecimiento de algas y plantas en aguas superficiales, ya que una concentración de 10 ppb puede causar eutrofización.
Se denomina metales pesados a aquellos elementos químicos que poseen un peso atómico comprendido entre 63,55 (Cu) y 200,59 (Hg), y que presentan un peso específico superior a 4 (g cm-3). Cabe destacar que en esta categoría entran prácticamente todos los elementos metálicos de interés económico, por tanto, de interés minero. Lo que hace tóxicos a los metales pesados no son en general sus características esenciales, sino el tipo de especie que forman en un determinado medio y las concentraciones en las que pueden presentarse. Cabe recordar que de hecho los seres vivos necesitan (en pequeñas concentraciones) a muchos de estos elementos para funcionar adecuadamente. Ejemplos de metales requeridos por el organismo incluyen el cobalto, cobre, hierro, manganeso, molibdeno, vanadio, estroncio, y zinc. El caso del hierro es notable entre éstos, siendo vital para la formación de hemoglobina.
Los metales pesados pueden encontrarse en aguas naturales, aunque sus concentraciones, en ausencia de contaminación, son muy bajas. Los metales pesados pueden encontrarse como coloides, sólidos en suspensión o disueltos, presentando diferente grado de biodisponibilidad.
A su vez la química del sistema acuoso regula las tasas de adsorción-absorción en el sistema agua-sedimento. La adsorción remueve el metal de la columna de agua; la desorción lo incorpora nuevamente a ésta. Los parámetros que regulan el sistema son: la salinidad, el potencial redox (Eh), y el pH:
a) Un incremento de la salinidad conlleva una competencia, entre metales pesados y los cationes mayoritarios (metales de los grupos I y II), por los sitios de interacción con las arcillas, lo que se traduce en la expulsión de los metales pesados, y su devolución a la columna de agua.
b) Un incremento del Eh genera la inestabilidad de los compuestos reducidos, por ejemplo, sulfuros, poniendo el metal en solución.
c) Un decrecimiento del pH tiene dos efectos favorece la solubilidad de los metales.
El desarrollo tecnológico, el consumo masivo e indiscriminado y la producción de desechos principalmente urbanos, ha provocado la presencia de muchos metales en cantidades importantes en el ambiente, provocando numerosos efectos sobre la salud y el equilibrio de los ecosistemas. Los metales son persistentes en el ambiente. Pueden cambiar de especie química, o de matriz. Se incorporan con los alimentos o como partículas que se respiran y se van acumulando en el organismo, hasta llegar a límites de toxicidad. Si la incorporación es lenta se producen intoxicaciones crónicas, que dañan los tejidos u órganos en los que se acumulan.
Un caso particular es el arsénico, que es un metaloide. Es un elemento altamente tóxico y que es de origen natural en aguas subterráneas en nuestro país. La llanura chaco pampeana es una de las regiones más extensas del mundo, que presenta aguas subterráneas con altos contenidos de este elemento. El límite recomendado por la Organización Mundial de la Salud para consumo humano es de 10 µ/L (10ppb).
Las bajas concentraciones a las que muchos de estos metales pesados o metaloides pueden presentar toxicidad involucra la necesidad de utilizar instrumentación compleja para obtener resultados confiables. Los métodos más utilizados para determinar metales pesados son la espectrometría de absorción atómica, la espectrometría de emisión de plasma (ICP) y el ICP acoplado a un espectrómetro de masas, que es el método más sensible.
Cada elemento tiene una estructura atómica única con electrones en niveles energéticos bien definidos. El movimiento de los electrones entre estos niveles, que requiere la absorción o emisión de energía también está bien definido, estando aquí la clave de la espectroscopia de emisión. Si se excitan los átomos en una muestra utilizando una fuente energética muy alta –una llama, chispa o un plasma- muchos de los electrones de los átomos se excitarán a niveles superiores. Casi inmediatamente, estos electrones en estado excitado se relajarán retornando al estado fundamental, por medio de la emisión de un fotón cuya energía corresponda a la diferencia entre los niveles energéticos del estado excitado y del fundamental. La energía de promoción está bien definida, es decir, que sólo pueden absorberse energías específicas para un átomo en particular, la energía liberada en esta relajación –y el fotón que contiene esta energía- es muy específica. Puesto que la energía del fotón está estrictamente relacionada con la longitud de onda , una forma de detección de la luz emitida por una muestra después de que los átomos de ésta se exciten de algún modo: esta luz es característica de los átomos excitados en la muestra.
En caso de ICP, la fuente de excitación es un plasma a temperatura muy elevada. La luz de una muestra de átomos inyectados en el plasma es recogida mediante lentes y espejos y focalizada sobre una rejilla de difracción. Esta rejilla separa las longitudes de onda individuales (tal como lo hace un prisma) y focaliza la luz en un tubo fotomultiplicador (TFM), el cual convierte la luz en señales electrónicas. Las longitudes de onda de la luz son específicas de los elementos en el plasma que emiten los fotones, y la intensidad de la luz, medida por el TFM, da la concentración del elemento presente en la muestra.
Los plaguicidas son sustancias químicas o mezclas de sustancias, destinadas a matar, repeler, atraer, regular o interrumpir el crecimiento de seres vivos considerados plagas.
Los plaguicidas no son necesariamente venenos, pero pueden ser tóxicos para los humanos u otros animales. De acuerdo a la Convención de Estocolmo sobre Contaminantes Orgánicos Persistentes, 9 de los 12 más peligrosos y persistentes compuestos orgánicos son plaguicidas.
El término plaguicida está más ampliamente difundido que el nombre genérico exacto: biocida (literalmente: matador de la vida). El término plaguicida sugiere que las plagas pueden ser distinguidas de los organismos no nocivos, que los plaguicidas no lo matarán, y que las plagas son totalmente indeseables.
Los plaguicidas pueden clasificarse atendiendo a diversos aspectos.
Según el destino de su aplicación pueden considerarse: a) Plaguicidas de uso fitosanitario destinados a su utilización en el ámbito de la sanidad vegetal o el control de vegetales; b) Plaguicidas de uso ganadero: destinados a su utilización en el entorno de los animales o en actividades relacionadas con su explotación; c) Plaguicidas de uso en la industria alimentaria: destinados a tratamientos de productos o dispositivos relacionados con la industria alimentaria; d) Plaguicidas de uso ambiental: destinados al saneamiento de locales o establecimientos públicos o privados; e) Plaguicidas de uso en higiene personal: preparados útiles para la aplicación directa sobre el ser humano; f) Plaguicidas de uso doméstico: preparados destinados para aplicación por personas no especialmente calificadas en viviendas o locales habitados.
Según su acción específica pueden considerarse: insecticidas; acaricidas; fungicidas; bactericidas; herbicidas; rodenticidas.
Según su constitución química, los plaguicidas pueden clasificarse en varios grupos, los más importantes son: órganoclorados, órganofosforados, carbamatos, triazinas, piretroides, derivados de urea. Algunos de estos grupos engloban varias estructuras diferenciadas, por lo que, en caso de interés, es posible efectuar una subdivisión de los mismos.
El uso de plaguicidas crea una serie de problemas para el medio ambiente. Más del 98% de los insecticidas fumigados y del 95% de los herbicidas llegan a un destino diferente del buscado, incluyendo especies vegetales y animales, aire, agua, sedimentos de ríos y mares y alimentos. La deriva de pesticidas ocurre cuando las partículas de pesticidas suspendidas en el aire son llevadas por el viento a otras áreas, pudiendo llegar a contaminarlas.
Estos compuestos pueden ser tóxicos a muy bajas concentraciones. Por otra parte, dada su estructura son en general poco solubles en agua y propensos a bioacumularse en la biota (Schwarzenbach et al., 1993). Para poder cuantificarlos a las bajas concentraciones en que se encuentran en el ambiente se utilizan métodos instrumentales, particularmente cromatográficos.
Entre los indicadores biológicos, podemos mencionar métodos microbiológicos, ecológicos, fisiológicos y bioquímicos y ecotoxicológicos.
Cuando nos referimos a métodos microbiológicos, involucramos a bacterias, parásitos, virus presentes en agua. La contaminación microbiológica es un factor que no puede ponerse en riesgo en el caso del agua de consumo humano por sus efectos extensos y agudos (Frioni, 2011).
Las bacterias, como componentes de la cadena trófica, pueden usarse como indicadores de la calidad de agua en general, pero su uso como indicadores se centra en la determinación de la contaminación fecal. Debe seleccionarse un tipo de microorganismo que esté siempre presente en la materia fecal que asegure que su ausencia represente la ausencia de otros microorganismos presentes en la materia fecal. Los organismos seleccionados son las bacterias coliformes, más específicamente la Escherichia coli.
Existe la tendencia de ir incorporando otros organismos cuya presencia involucre la necesidad de tratamientos especiales.
Los métodos ecológicos se basan en el hecho de que cada organismo ocupa de forma preferencial determinados hábitats que vienen definidos por un conjunto de condiciones físicas, químicas y biológicas. La aplicación de este criterio se basa en establecer índices que definan la calidad del agua en función de las especies presentes, que se denominan índices bióticos.
Es necesario definir índices locales debido a la dificultad de hallar especies que sean representativas en todo el mundo. Los índices bióticos se basan en la presencia/ausencia de determinados grupos de organismos indicadores. Estos índices no indican cuál es la sustancia o sustancias que provocan la alteración y/o contaminación, únicamente proporcionan información sobre el estado general del ecosistema.
Los métodos fisiológicos se basan en la medida de la velocidad con que los organismos presentes en una masa de agua son capaces de crecer, degradar un sustrato o generar un producto. Los métodos bioquímicos se usan como alternativa para efectuar el seguimiento de los microorganismos de interés utilizando técnicas de biología molecular.
Los métodos ecotoxicológicos evalúan la calidad de un agua respecto a su potencial tóxico. No interesa identificar unívocamente la composición del agua, sino cuál será su impacto sobre un medio receptor. Se establecen dos tipos de toxicidad: a) aguda: causada por exposición a una dosis elevada del compuesto en un período breve de tiempo; b) crónica: causada por dosis muy bajas de compuesto tóxico en un período de tiempo relativamente largo, provocando la muerte o alguna alteración a nivel biológico y/o fisiológico. Se han desarrollado diferentes protocolos en los que varían los organismos utilizados como test.
Muestreo, Análisis, Interpretación y Confiabilidad de los Datos Químicos
Los contaminantes químicos son de variada naturaleza y estructura. Los métodos para su determinación están debidamente estandardizados y las metodologías existentes permiten su determinación a nivel de trazas (APHA, 1998; EPA, 1996; Krantzberg et al., 2010). En el caso de trazas inorgánicas, los métodos de determinación por absorción atómica o espectrometría de emisión por inducción de plasma acoplado (ICP de emisión) permiten la detección de partes por billón. En el caso de trazas orgánicas, las cromatografías gas-líquido o líquida de alta resolución alcanzan los mismos niveles de sensibilidad. En el caso de contaminantes orgánicos persistentes, como por ejemplo los compuestos organoclorados (bifenilos policlorados, plaguicidas) se usan detectores específicos de captura electrónica en los cromatógrafos gas-líquido. Estos compuestos de variada estructura, son en general hidrofóbicos, por lo cual los niveles en agua son muy bajos, concentrándose en sedimentos y biota.
La toma de muestras o muestreo debe ser estadísticamente representativa del conjunto total que se quiere medir, para que los resultados que se obtengan de su análisis permitan conclusiones objetivas y defendibles.
Para desarrollar un plan de muestreo debe decidirse cuándo y dónde deben ser tomadas las muestras. El diseño del muestreo dependerá de los objetivos.
En muestreos bidimensionales, se debe determinar la posición (coordenadas espaciales) y lo podemos hacer de varias maneras: a) muestreo al azar: la zona a muestrear se divide en áreas mínimas representativas (p.ej. parcelas de 1m² y se eligen n posiciones al azar; b) muestreo en transecta: se elige la posición de partida y la longitud de la transecta y luego las muestras se toman sobre ella, c) muestreo en dos etapas: se divide la zona de muestreo en subunidades regulares, por pendiente, tipo de suelo u otra característica física, y luego se toman muestras en cada subunidad; d) muestreo en grilla: se toman muestras a intervalos regulares de espaciado fijo.
En el caso de muestreos tridimensionales, debe además tenerse en cuenta la dimensión vertical, como es el caso para muestras en profundidad o en la atmósfera.
La distribución temporal también ofrece variantes. Muchos fenómenos tienen características cíclicas, las muestras afectadas por actividad biológica pueden exhibir grandes cambios en el tiempo.
El sistema de toma de muestra variará según el origen del agua. Por ejemplo, para el análisis físico-químico, en el caso de una cisterna o de un depósito, la botella será sumergida a una cierta distancia del fondo (50 cm) y de la superficie, bastante lejos de las orillas o de los bordes, así como de los obstáculos naturales o artificiales, evitando remover el fondo. En el caso de un lago, de un río o de un cuerpo de agua natural, hay que escoger varios puntos de toma, y en cada uno de ellos, tomar varias muestras a diferentes profundidades. En el caso de una bomba, las tomas se harán normalmente, al término de una prueba de bombeo ininterrumpida. En el caso que el agua sea proveniente de un grifo será indispensable dejar correr el agua durante por lo menos 10 minutos y lavar el grifo con alcohol antes de tomar la muestra. En cuanto al recipiente, se utilizan botellas de plástico, lavadas y enjuagadas tres veces con el agua de muestreo. El tapón se ha de poner de tal forma que no quede ninguna burbuja de aire. En todos los casos, la muestra debe ser representativa y homogénea. Las muestras deberán conservarse en la heladera (4º C) hasta su envío al laboratorio.
Para análisis especiales, como por ejemplo de metales pesados o contaminantes orgánicos, deben consultarse los protocolos específicos.
Se denomina exactitud de un análisis químico a la diferencia entre el valor de la magnitud obtenido en la determinación química y el valor verdadero, mientras que la precisión de una serie de mediciones de una misma magnitud describe la diferencia entre los valores individuales de cada medición. En general, se distinguen dos tipos de errores con respecto a los análisis químicos: los errores en la precisión o errores estadísticos, que se reflejan en fluctuaciones en los procedimientos analíticos y errores en la exactitud, o errores sistemáticos que se deben a procedimientos erróneos o a la presencia de interferencias durante los análisis. La precisión puede ser calculada repitiendo los análisis de una misma muestra, la exactitud sólo puede ser comprobada analizando muestras de patrones de referencia o por comparación de los resultados de distintos laboratorios. Cuando las concentraciones son muy bajas, los análisis por duplicado igual pueden presentar variaciones cuando la sensibilidad del método es insuficiente.
Se acepta internacionalmente que la calidad de las mediciones químicas y la comparabilidad de los resultados están basados en los siguientes aspectos: uso de métodos analíticos validados, equipos debidamente mantenidos y calibrados, uso de materiales de referencia para las calibraciones, control de calidad interno efectivo, participación en esquemas de ensayos interlaboratorios, auditorías independientes de los procedimientos, personal debidamente entrenado.
Estos aspectos son fundamentales pues para determinar la calidad del agua debemos saber para cada uso, que contiene y en que cantidad, pues no debe exceder un límite determinada para considerarla apta para ese uso especifico. Por lo tanto, debemos asegurar la representatividad del muestreo y la calidad de las mediciones químicas para que los resultados obtenidos nos permitan conclusiones válidas.
1. El kilómetro cúbico es una unidad de volumen. Se corresponde con el volumen de un cubo de mil metros (un kilómetro) de lado. Equivale a un teralitro (un billón de litros) y es el tercer múltiplo del metro cúbico.
Referencias
APHA (1998) American Public Health. Stándar Methods for the Examination of Water and Waster. Washington Dc, USA.
Baird, C. (2001), Química Ambiental, Editorial Reverté S.A., España.
EPA´s (1996) Lawrence H. Keith Compilation of EPA´s Sampling and Analysis Methods Washington Dc, USA.
Escobar y Schafer, A. I. (2010). Sustainable Water for the Future: Water Recycling versus Desalination. Elsevier.
Frioni, L. (2011).Microbiología: básica, ambiental y agrícola. Orientación Grafica Editora.
Kilham, P. (1990). Mechanisms controlling the chemical composition of lakes and rivers: Data from Africa. Limnology and Oceanography, 35 (1) 80:83.
Krantzberg G, Tanik A, Antunes do Carmo J, Indarto A, Ekda, A. (2010). Advances in Water Quality Control. Scientific Reseach Publishing, USA
Livingstone (D. 1963). Chemical composition of rivers and lakes. US Geol Surv Prof Paper 440 G, pp.1-63.
Manahan, S., (1991 a), Environmental Chemistry, Tomo I, Lewis Publishers, 5th ed., USA.
Manahan, S., (1991 b), Environmental Chemistry, Tomo II, Lewis Publishers, 5th ed., USA.
Pepper, I.L., Gerba, Ch. P. y Brusseau, M.L. (Eds). (1996). Pollution Science, Academic Press, UK.
Peral, X. D. J. (2006) Química ambiental de sistemas terrestres. Editorial Reverté, S.A.
Salgot, M., Sanchez, X. y Torrens, A. (Eds). (1999), Recursos d´aigua, Fundación Agbar, España.
Schwarzenbach, R.P., Gschwend, P.M. y Imboden, D. M. (1993) Environmental Organic Chemistry, John Wiley & Sons, Inc., USA.
Stumm, W. y Morgan, J.J. (1995). Aquatic Chemistry, 3rd, ed., John Wiley & Sons, Inc., USA.
Wetzel R. (1983). Limnology, 2nd ed. Saunders, Philadelphia.
|
|
Revista
QuímicaViva Número 3, año 11, Diciembre 2012 quimicaviva@qb.fcen.uba.ar |