Preparación de un adsorbente basado en la ectodermis de los cladodios de tuna (Opuntia ficus) para la remoción del colorante Safranina
Cristóbal Lárez Velásquez1, Víctor Quiñonez2, Deivis Suárez2, Iris Santos2
1Grupo de Polímeros, Departamento de Química. Facultad de Ciencias.
Universidad de los Andes. Mérida, 5101. Venezuela.
2Laboratorio de Análisis
Orgánico, Departamento de Química. Facultad de Ciencias. Universidad de los
Andes. Mérida, 5101. Venezuela.
e-mail: clarez@ula.ve
Recibido: 4 de noviembre de 2011
Aceptado: 1 de diciembre de 2011
Resumen
Este trabajo describe un método sumamente sencillo para la preparación y caracterización por espectroscopia de FTIR de un adsorbente basado en la ectodermis de Opuntia ficus. El material obtenido en forma de polvo fue utilizado para estudios de adsorción del colorante catiónico Safranina en soluciones acuosas. El proceso de adsorción puede ser descrito cualitativamente mediante la isoterma sigmoidal de Frumkin–Fowler–Guggenheim (una modificación de la isoterma de Langmuir) cuyos valores de KL y b son 4,4121 y 3,8791, respectivamente. La sencillez del método de preparación del adsorbente puede servir de modelo para el estudio de sistemas similares.
Palabras clave: bioadsorbente, Safranina, remoción de contaminantes, colorantes, Opuntia ficus
Summary
This paper describes a simple method for preparation and FTIR spectroscopy characterization of a bioadsorbent based on the ectoderm of cactus (Opuntia ficus) cladodes. The material obtained, in powder form, was used for adsorption studies of the cationic Safranine dye in aqueous solutions. Adsorption process can be described qualitatively by the sigmoidal isotherm of Frumkin–Fowler–Guggenheim, which is a modification of the Langmuir isotherm. Obtained values for KL and b are 4.4121 and 3.8791, respectively. The simplicity of the adsorbent preparation method could serve as model for studies on similar systems.
Keywords: Bioadsorbents, Safranine, pollutant removal, dyes, Opuntia ficus
Introducción
La
búsqueda de materiales amigables con el ambiente, preferentemente de origen
natural, renovable y de bajo costo o, mejor aún, que se puedan obtener de
desechos de este tipo de recursos, ha venido tomado auge en los últimos
años. En ese sentido, se puede apreciar un creciente número de trabajos
relacionados con el uso per se de materiales de desecho para la adsorción de colorantes en
el tratamiento de agua1 (por ejemplo bagazos de caña de azúcar2,
conchas de coco3, cáscaras de arroz4, tuzas de maíz5,
conchas de maracuyá6, etc.) o como materiales de partida para la
preparación de carbón activado7.
Los colorantes son uno de los tipos de sustancias contaminantes del agua más problemáticos debido a que pueden causar diversos problemas a la salud humana y al medio ambiente. Por ejemplo, la Safranina (S) es un colorante catiónico soluble en agua, de amplio uso en la industria textil y alimentaria así como también en laboratorios biológicos para la diferenciación de bacterias (Gram positivas de Gram negativas). Es considerada una sustancia peligrosa para organismos acuáticos8 por lo que se han usado diversas metodologías para su remoción de aguas contaminadas, como por ejemplo ultrafiltración9, flotación10, degradación fotoquímica8, adsorción11, etc. En lo que se refiere a los proceso de adsorción se ha comprobado que la remoción de Safranina de medios acuosos es posible usando adsorbentes de variada naturaleza, incluyendo hidrogeles12, materiales de desecho como cáscara de arroz13 y carbón activado preparado de las tuzas de maiz14.
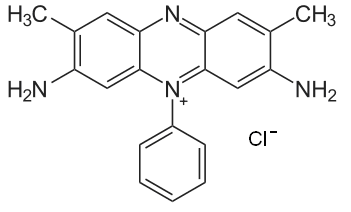
Estructura de la Safranina
En este trabajo se plantea la preparación de un adsorbente basado en la piel de los cladodios (pencas) de la tuna y su posterior estudio como adsorbente para la remoción de Safranina en soluciones acuosas. Se enfatiza especialmente en la sencillez del proceso de preparación del adsorbente y de su uso, lo cual podría permitir que este sistema sirva de modelo para el estudio de sistemas similares en laboratorios de docencia medianamente equipados.
Materiales y métodos
Material vegetal: las pencas (cladodios) de tuna (Opuntia ficus) se colectaron en los alrededores de la población se San Juan de Lagunillas, estado Mérida, Venezuela, a finales del mes de junio de 2011. Se trasladaron al laboratorio, luego de quitarle las espinas con un cuchillo, y almacenadas en bolsas de papel.
Preparación del bioadsorbente: las pencas de tuna se lavaron con agua destilada el día siguiente de colectadas; luego, con un sacabocado de aproximadamente 1cm de diámetro se cortaron discos de su corteza exterior (ectodermis) que fueron raspados manualmente con un cuchillo, por su parte interna, para desprender la sustancia muciláginosa que les queda adherida. Los discos se lavaron 5 veces con agua destilada, con cambios cada 5 horas, y secados en una estufa a 50oC por 48 horas. Posteriormente, los discos fueron agitados magnéticamente en 150mL de una solución 0,01N de NaOH (Riedel de Haen, 99%) durante 6 horas, se lavaron 6 veces con agua destilada (hasta que no se observó el color amarillo pálido en la solución), cambiando el agua cada 8 horas, y se dividieron en dos partes: (a) conservados en agua destilada para ser usados como discos, (b) convertidos en polvo luego de secar durante dos horas a 100oC y moler en un molino de granos casero tradicional (marca Corona) para ser usados como bioadsorbente en polvo.
Caracterización del bioadsorbente: se prepararon pastillas en KBr de la muestra tratada con NaOH (y también sin tratamiento) para la caracterización espectroscópica por FTIR (espectrómetro Perkin Elmer RX1) del bioadsorbente en polvo. Adicionalmente, se hicieron microfotografías (microscopio electrónico de barrido Hitachi S-2500) para las muestras en forma de disco del bioadsorbente, equilibradas tanto en agua como en soluciones acuosas de Safranina (Riedel de Haën, usada como viene del proveedor).
Estudios de adsorción: 50mg del bioadsorbente en polvo se dejaron equilibrar durante 48 horas (tiempo de equilibrio pre-establecido) con soluciones de Safranina (50mL) de concentraciones 21, 45, 90, 150, 201, 249, 300 y 350 mg/L. Se midieron las absorbancias de las soluciones iniciales (Ao) y en equlibrio (Aeq) del colorante y la concentración de Safranina adsorbida (Sad eq, meq/g bioadsorbente) se obtuvo mediante la ecuación:
Sad eq = (SSo–SSeq).Vsol/mbad (1)
donde SSo y SSeq son las concentraciones (en meq/L) para las soluciones iniciales y en equilibrio de Safranina, respectivamente; Vsol es el volumen (en litros) de la solución de colorante y mbad es la masa (en gramos) del bioadsorbente. En todos los casos SSo y SSeq fueron obtenidas mediante una curva de calibración sencilla [Absorbancia (A) vs. concentración de Safranina (S)] construida previamente por espectroscopia visible (l =520nm; A = 0,0868S+0,0009; R2 = 0,9990) usando un espectrómetro Shimadzu, modelo mini1240. Para las soluciones que mostraron absorbancias fuera del intervalo lineal de la curva de calibración se realizaron las diluciones necesarias.
Resultados y discusión
La parte fibrosa de los cladodios de Opuntia ficus está compuesta básicamente por una mezcla compleja de celulosa, hemicelulosa, lignina y pectina15, pero también se ha reportado la presencia de colorantes tipo betalaínas como la indicaxantina16. En la figura 1(a) se puede apreciar el espectro de FTIR para la muestra del bioadsorbente sin tratar con NaOH, el cual es muy similar al reportado por Bernal-Martínez y col.17 para la muestra de ectodermis de Opuntia ficus obtenida luego de un lavado con agua, secado a 65oC, molienda y tamizado. Por su parte, la figura 1(b) presenta el espectro de FTIR de la muestra luego del tratamiento con NaOH.
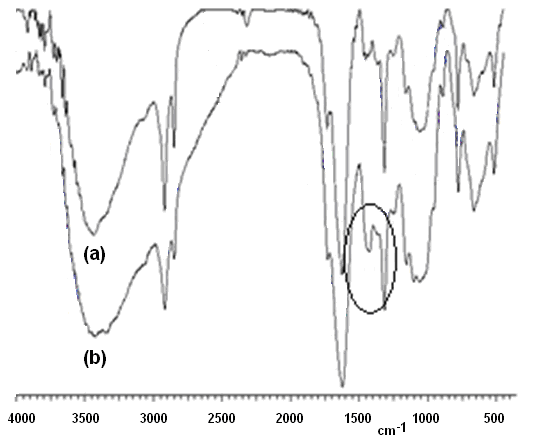
Figura 1: Espectros de FTIR para la piel de los cladodios de Opuntia ficus (a) antes y (b) después del tratamiento con NaOH 0,01N acuoso.
Se puede observar que ambos espectros son muy similares entre sí, diferenciándose ligeramente solo por el crecimiento de la señal a 1428 cm-1 en el espectro 1(b). Esta señal ha sido atribuida a la vibración simétrica en el plano H-C-H de los grupos CH2-OH en la celulosa18. En este caso, se estima que el crecimiento de esta señal luego del tratamiento con NaOH se debe a la posible extracción de hemicelulosa, por ser ésta soluble en medio alcalino19, lo cual conllevaría a una fracción relativamente mayor de los grupos metilenos en la muestra tratada con NaOH. Como se sabe, la hemicelulosa presenta en su estructura monosacáridos como la xilosa, que no poseen el grupo CH2OH.
Por otro lado, es importante indicar que durante el tratamiento con NaOH la solución se vuelve levemente amarilla, lo que permitió detectar la presencia de un colorante amarillo que torna a incoloro al acidificarse la solución con HCl. Aparentemente dicho colorante está presente en una proporción pequeña que no permite distinguir sus señales en el espectro de FTIR. La figura 2 muestra el espectro UV-visible obtenido para (a) la solución alcalina y (b) la solución alcalina neutralizada con HCl, notándose claramente un desplazamiento hipsocrómico de las señales al pasar del medio alcalino al medio ácido. De acuerdo con el λmax ~400nm (en la región visible) la estructura del colorante pareciera corresponder a un compuesto tipo ácido betalámico; sin embargo, son necesarios estudios adicionales para confirmar su estructura. Inicialmente se supuso que el colorante podría ser la indicaxantina, cuya presencia se ha comprobado en esta planta16, pero su λmax ~ 475nm la descarta completamente.
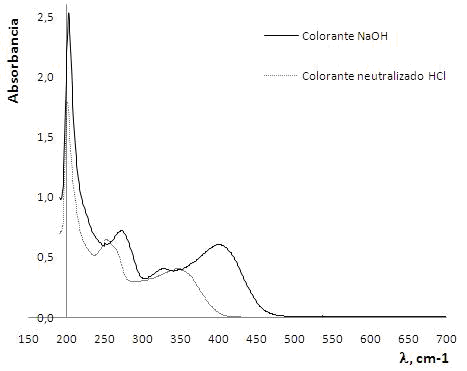
Figura 2: Espectros de UV-visible para el colorante extraído de la ectodermis de los cladodios de Opuntia ficus con (a) NaOH acuoso y (b) luego de neutralizar con HCl (b)
Por otra parte, la figura 3 muestra una curva de la concentración de equilibrio de la Safranina adsorbida sobre el bioadsorbente en polvo (Sad eq, meq/g bioadsorbente) en función de la concentración de equilibrio de la Safranina en la solución externa (Sseq, eq/L).
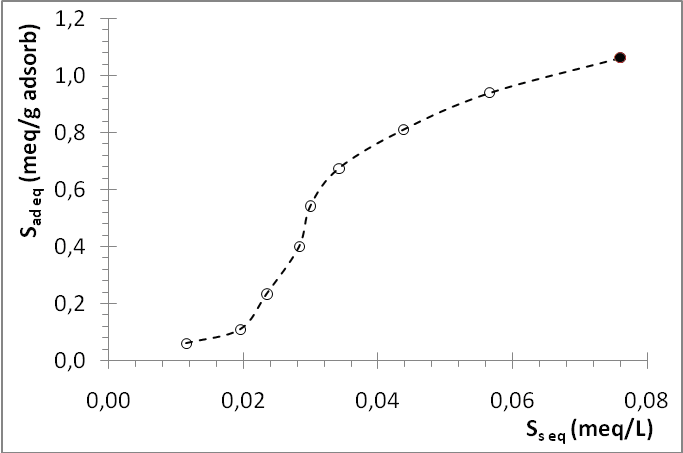
Figura 3: Gráfico de la concentración de Safranina adsorbida sobre el bioadsorbente en polvo (Sad eq) en función de la concentración de equilibrio de S en la solución externa (SS eq).
El punto (•) mostrado en el gráfico es un valor añadido para manejar la data experimental de acuerdo al modelo de isoterma que se describe más abajo. Su escogencia se realizó de la siguiente manera:
(a) Se encontró una ecuación polinomial que fija la curva obtenida para los puntos experimentales de SSeq. vs. SSo. La ecuación encontrada es:
SSeq = 0,1080x10-1(SSo)5–0,4103x10-1(SSo)4+0,6718x10-1(SSo)3–0,48566x10-1(SSo)2
+0,1697x10-1(SSo)+0,00338 (R² = 0,9974)
(b) Con la ecuación anterior se probaron valores de SSo > 1meq/L y se obtuvieron valores para SSeq; con estos valores se obtienen los correspondientes valores para Sad eq.(ec. 1).
(c) Se probaron valores de Sad eq así obtenidos (como máxima concentración de adsorción o concentración de saturación, Sad sat) para definir valores de θ, escogiéndose el valor de Sad sat que genera la mejor correlación lineal para el gráfico de Ln(SS eq) vs. Ln[θ/(1-θ)]/β - θ].
De acuerdo con la clasificación dada por Butt, Graff y Kappl para los diferentes tipos de isotermas de adsorción20, el comportamiento mostrado en la figura 3 por el sistema bajo estudio parece corresponder al descrito por una isoterma sigmoidal (tipo D), la cual está marcada por la aparición de efectos cooperativos. Teóricamente, en este tipo de sistemas la molécula de adsorbato tiene mayor facilidad para unirse a la superficie si interacciona con otra molécula vecina previamente adsorbida, implicando esta interacción lateral la ocurrencia de una condensación bidimensional.
Una aproximación sencilla para tomar en cuenta las interacciones laterales se realiza modificando la ecuación de Langmuir:
θ/(1-θ) = KLSs eq (2)
donde θ = Sad eq/Sad sat; Sad sat = concentración de saturación de S sobre el bioadsorbente y KL = constante de Langmuir.
En la isoterma de Frumkin-Fowler-Guggenheim21 se considera que KL se hace dependiente de θ y se define un nuevo valor para KL:
KL =KL´enEpθ/RT (3)
donde KL´ es la constante Lagmuir modificada, nθ es el número promedio de sitios vecinos que interactúan con el adsorbato, Ep es la energía adicional de interacción entre un par de moléculas vecinas, R la constante universal de los gases y T la temperatura.
Sustituyendo el valor de KL en la ecuación 2 queda:
θ/(1-θ) = KL´eβθ Ss eq (4)
donde se ha hecho β = nEp/RT. Colocando la ecuación 4 en su forma logarítmica:
Ln[θ/(1-θ)] = Ln[KL´] + βθ + Ln[Ss eq] (5a)
La ecuación 5a se puede reordenar de la forma siguiente:
Ln[θ/(1-θ)]/β - θ = Ln[KL´]/β + Ln[Ss eq]/β (5b)
De esta manera, un gráfico de Ln[θ/(1-θ)]/β - θ vs. Ln[Ss eq] debería producir una línea recta cuya pendiente será 1/β y el punto de corte Ln[KL´]/β. La figura 4 muestra el gráfico generado con los datos experimentales obtenidos, luego de probar valores de β para obtener una pendiente cuyo valor sea igual al valor de 1/β introducido (valor hallado β = 3,8791).
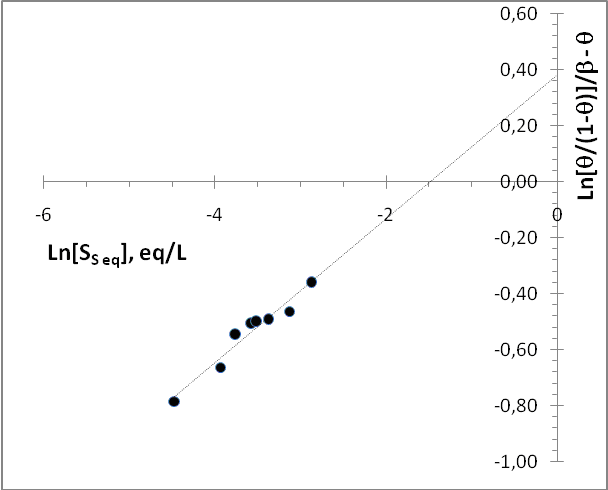
Figura 4: Gráfico de Ln[θ/(1-θ)]/β - θ vs. Ln[Ss eq] para los datos obtenidos durante la adsorción de Safranina sobre el bioadsorbente en polvo usando un valor de β = 3,8791.
En estas condiciones se obtuvo un valor de KL´= 4,412087, aunque se debe destacar que la recta obtenida no muestra un coeficiente de correlación muy elevado (R2 = 0,9539). Probablemente, esta baja correlación lineal sea ocasionada por la heterogeneidad del bioadsorbente en polvo, especialmente en lo que se refiere al tamaño de partícula y a su composición, pero se debe considerar también que la dependencia de LnKL con θ podría no ser lineal en todo el intervalo de θ. A pesar de ello, la isoterma que se genera con los valores obtenidos para KL y β describe el comportamiento experimental observado para este sistema de manera cualitativa (Figura 5), con lo cual el mecanismo de adsorción parece estar marcado por dos tipos de interacción: (a) interacción del adsorbato con la superficie desnuda, (b) interacción del adsorbato con moléculas de Safranina previamente adsorbidas.
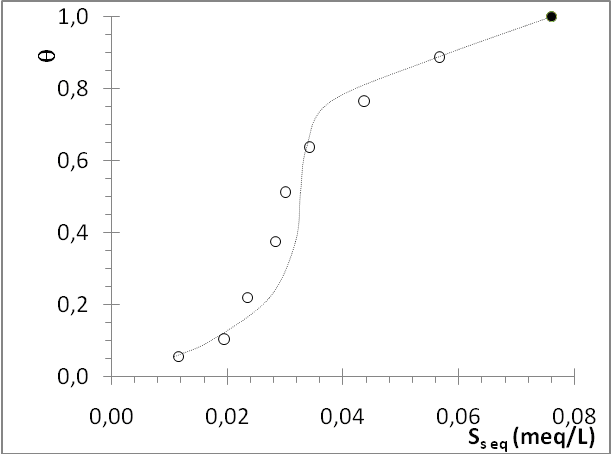
Figura 5: Comparación de los datos experimentales obtenidos durante la adsorción de S sobre el bioadsorbente en polvo (o) con los predichos por la isoterma sigmoidal de Frumkin–Fowler–Guggenheim (línea) obtenida para valores de KL = 4,4121 y β = 3,8791.
Finalmente es importante indicar que las microfotografías de la ectodermis de la tuna tratada con NaOH (discos) y dejada equilibrar en soluciones de Safranina parecen confirmar la ocurrencia del mecanismo de adsorción que propone la isoterma obtenida. Entre otras cosas, en dichas microfotografías se pueden observar varias situaciones interesantes, entre las que vale la pena resaltar:
- El cambio de los discos desde su ambiente de preservación (agua) a un medio acuoso que posee el colorante iónico disuelto, parece hacer variar la rugosidad de su superficie, observándose también como se cierran los estomas en respuesta a la presencia de la Safranina en el medio (Fig. 6a, 6b y 6c)
- La adsorción de Safranina sobre los discos parece ocurrir tanto a nivel de la superficie desnuda como en sitios donde ya se ha depositado Safranina previamente, a juzgar por los distintos tamaños de las partículas que se observan depositados en la superficie del disco equilibrado en solución acuosa de 100 ppm de Safranina (Fig. 6d).

Figura 6: Microfotografías de la ectodermis de Opuntia ficus (discos) tratada con NaOH y dejadas equilibrar en agua (a) y en soluciones acuosas de 10 ppm (b) y 100 ppm (c) de Safranina, con mayor acercamiento para esta última (d)).
Conclusiones
Se desarrolló un procedimiento sencillo y de bajo costo para obtener un adsorbente natural a partir de la ectodermis de los cladodios de tuna (Opuntia ficus). El estudio de adsorción del colorante iónico Safranina sobre este bioadsorbente mostró que el proceso puede ser cualitativamente descrito mediante la isoterma sigmoidal de Frumkin–Fowler–Guggenheim descrita cualitativamente por los valores KL = 4,4121 y β = 3,8791.
Agradecimientos
Los autores agradecen al Vicerrectorado Administrativo de la Universidad de Los Andes por el soporte económico brindado al Laboratorio de Química Orgánica (Docencia) para la realización de estos proyectos y al Laboratorio de Microscopía Electrónica de la Facultad de Ciencias (ULA) por las microfotografías realizadas. Este trabajo se realizó como un proyecto especial del curso A-2011 de Análisis Orgánico.
Referencias
1. Gupta, V; Suhas. (2009). Application of low-cost adsorbents for dye removal - A review. J. Environmental Management. 90(8): 2313-2342.
2. Raymundo A; Zanarotto R; Belisário M; Pereira M; Ribeiro J; Flores A. (2010). Evaluation of Sugar-Cane Bagasse as Bioadsorbent in the Textile Wastewater Treatment Contaminated with Carcinogenic Congo Red Dye. Braz. Arch. Biol. Technol. 53(4): 931-938.
3. Gupta V; Jain R; Shrivastava M. (2010). Adsorptive removal of cyanosine from wastewater using coconut husks. J. Colloid Interface Sci. 347(2): 309-314
4. Moreno A; Hormaza A. (2010). Adsorción de rojo básico 46 usando cascarilla de arroz. Análisis mediante diseño factorial. Memorias del XXIX CONGRESO LATINOAMERICANO DE QUIMICA, 2010. Disponible en: http://es.scribd.com/doc/53967523/Adsorcion-de-Rojo-Basico-46-Usando-Cascarilla-de-Arroz-Analisis-Mediante-Diseno-Factorial. Consultado el 27/10/2011
5. Suteu D; Malutan T; Bilba D. (2011). Agricultural Waste Corn Cob as a Sorbent for Removing Reactive Dye Orange 16: Equilibrium and Kinetic Study. Cellulose Chem. Technol. 45(5-6): 413-420.
6. Pavan F; Lima E; Dias S; Mazzocato A. (2008). Methylene blue biosorption from aqueous solutions by yellow passion fruit waste. J. Hazardous Materials. 150(3): 703-712.
7. Menéndez J; Martín-Gullón I. (2006). Types of carbon adsorbents and their production. En: Activated carbon surfaces in environmental remediation (Interface science and technology series, 7) T. Bandosz Ed., Elsevier.
8. Gupta V; Jain R; Mittal A; Mathur M; Sikarwar S. (2007). Photochemical degradation of the hazardous dye Safranin-T using TiO2 catalyst. J. Colloid and Interface Science. 309(2): 464-469.
9. Zaghbani N; Hafiane A; Dhahbi M. (2008). Removal of Safranin T from wastewater using micellar enhanced ultrafiltration. Desalination. 008: 222, 348-356.
10. Lu C; Chen C; Su Y; Chen K. (2005). Removal of Safranine from Aqueous Solution by Using Adsorptive Bubble Separation Techniques. Chinese Chemical Letters. 16(5): 701-704.
11. Kumar K. (2007). Pseudo-second order models for the adsorption of safranin onto activated carbon: Comparison of linear and non-linear regression methods. J. Hazardous Materials. 142(1-2): 564-567.
12. Solpan D; Duran S; Torun M. (2008). Removal of cationic dyes by poly(acrylamide-co-acrylic acid) hydrogels in aqueous solutions. Radiations Physics and Chemistry. 77: 447-452.
13. Chowdhury S; Mishra R; Kushwaha P; Saha P. (2011). Removal of Safranin from aqueous solutions by NaOH-treated rice husk: thermodynamics, kinetics and isosteric heat of adsorption. Asia-Pacific Journal of Chemical Engineering. 6, n/a doi: 10.1002/apj.525.
14. Preethi S; Sivasamy A; Sivanesan S; Ramamurthi V; Swaminathan G. (2007). Removal of Safranin Basic Dye from Aqueous Solutions by Adsorption onto Corncob Activated Carbon. Ind. Eng. Chem. Res. 45(22): 7627-7632.
15. Ribeiro E; da Silva N; Lima J; Brito J; Silva M. (2010). Study of carbohydrates present in the cladodes of Opuntia ficus-indica (fodder palm), according to age and season. Ciênc. Tecnol. Aliment., Campinas, 30(4): 933-939.
16. Gandia-Herrero F; Jimenez-Atienzar M; Cabanes J; Garcia-Carmona F; Escribano J. (2010). Stabilization of the Bioactive Pigment of Opuntia Fruits through Maltodextrin Encapsulation - A Study. J. Agric. Food Chem. 58(19):10646-10652.
17. Bernal-Martínez L; Barrera-Díaz C; Hernández-López S. (2006). Modificación de la ectodermis de Opuntia sp. con grupos funcionales amino NH2 para remover Pb (II) en soluciones acuosas. X Congreso Internacional y I Nacional de Ciencias Ambientales. Memorias. Disponible en: http://www.uaemex.mx/Red_Ambientales/docs/memorias/Extenso/CA/EC/CAC-37.pdf. Consultado: 01/12/2011.
18. Orea-Igarza U.; Cordero-Machado E.; Pérez Díaz N.; Gómez Marín R (2006). Composición química de la corteza de tres especies de eucaliptos, a tres alturas del fuste comercial. Parte 2 Eucalyptus pellita F. Muell. Revista Forestal Venezolana. 50(1): 53-58.
19. Muñoz R; Calderón A; Cruz-Orea A; Sánchez Sinencio F; Tomas S; González G. (1999). Estudio de la Influencia del Ca(OH)2 en las Películas de Pericarpio de Maíz Nixtamalizado mediante Técnicas Fototérmicas. Superficies y Vacío. 8: 80-84.
20. Butt H.; Graf K.; Kappl M. (2003). Adsorption. En: Physics and Chemistry of Interfaces. Editorial: Wiley-VCH Verlag GmbH & Co.KGaA, Weinheim, Alemania. Chapter 9, pp. 180.
21. Fowler R, Guggenheim E. Statistical Thermodynamics, Cambridge University Press, 1965, p. 431.
|
Revista QuímicaViva Número 3, año 10, Diciembre 2011 quimicaviva@qb.fcen.uba.ar |