Un nuevo enfoque del 'diálogo' materno-fetal: Los beneficios del reconocimiento de aloantígenos
Esteban Grasso, Federico Baudou, Laura Fraccaroli, Vanesa Hauk, Daniel Paparini, Claudia Pérez Leirós y Rosanna Ramhorst.
Laboratorio de Inmunofarmacología, Departamento de Química Biológica. Facultad de Ciencias Exactas y Naturales, Universidad de Buenos Aires.
* Autor para Correspondencia: Dra. Rosanna Ramhorst
Laboratorio de Inmunofarmacología, dpto de Quimica Biológica, Facultad de Ciencias Exactas y Naturales, Universidad de Buenos Aires, Cdad Autonoma de Buenos Aires, Argentina
Tel/Fax: + 54 (11) 4576-3300 int209
rramhorst@qb.fcen.uba.ar
Recibido: 17 de febrero de 2011
Aceptado: 27 de marzo de 2011
Resumen
Durante el embarazo, el feto está en continuo contacto con el sistema inmune materno, y a pesar de que expresa proteínas distintas a las de la madre, el sistema inmune materno lo tolera. La hipótesis original sostenía que el sistema inmune no debía reconocer como extraño al feto para que este sobreviviera. Las evidencias actuales indican que el reconocimiento de los aloantígenos fetales por parte de la madre y de aloantígenos maternos no heredados por parte del feto es crucial para la generación de una respuesta inmune que permita la correcta implantación del embrión y la invasión de la placenta. Tanto la falta de reconocimiento de los aloantígenos, como la incapacidad de controlar la respuesta inmune hacia ellos por parte de la madre y/o del feto, son causas inmunológicas de problemas del embarazo.
Palabras clave: inmunotolerancia – aloantígenos – complicaciones de la gestación – linfocitos T regulatorios
Summary
During pregnancy the fetus is tolerated by the mother immune system even though it expresses proteins that are different from maternal proteins. From the original idea that the immune system would need to ignore the fetus for its survival, the actual hypothesis proposes that the recognition of fetal alloantigens by the mother and of maternal alloantiogens by the fetus is crucial for the generation of an immune response that allows embryo implantation and placental invasion and, at the same time, that it must be highly controlled to avoid rejection. Both the failure to recognize alloantigens and the failure to control the immune response against them are immunological causes of gestational complications.
Keywords: immunotolerance – alloantigens – gestational complications – regulatory T cells
La hipótesis de la falta de respuesta inmune materna hacia antígenos fetales
En la década de los 80, se arraigó la hipótesis de que el feto se comporta como un semi-injerto frente al cual la madre genera una respuesta de rechazo y que dicha respuesta debía bloquearse para lograr un embarazo exitoso. Las bases para esta proposición habían sido presentadas por primera vez en 1953, por Sir Medawar y Billingham quienes observaron una potente respuesta de rechazo luego del transplante de explantos de piel en cruzas de ratones de distintas cepas [1]. De esto se desprende que el sistema inmune de la madre puede reconocer y potencialmente atacar a las células del feto que expresan estos aloantígenos de origen paterno. Este ataque conduciría al rechazo del feto y a la pérdida del embarazo y por lo tanto, si esto sucediera, el sistema inmune sería incompatible con la reproducción.
Se propusieron cuatro posibles explicaciones de la falta de rechazo materno al feto: la inmadurez antigénica del feto; una disminución de la respuesta inmune sistémica materna; que el útero era un sitio inmunoprivilegiado; y que la placenta podría actuar como barrera frente al sistema inmune.
Ninguna de estas hipótesis pudo ser completamente aceptada ya que, por ejemplo, el feto expresa moléculas del CMH de origen materno y paterno comportándose éstas últimas, desde el punto de vista materno, como aloantígenos. Por otro lado, no todas las moléculas HLA maternas son heredadas por el feto: aquellas que no hayan sido heredadas serán aloantígenos desde el punto de vista del feto ver figura 1 [4].
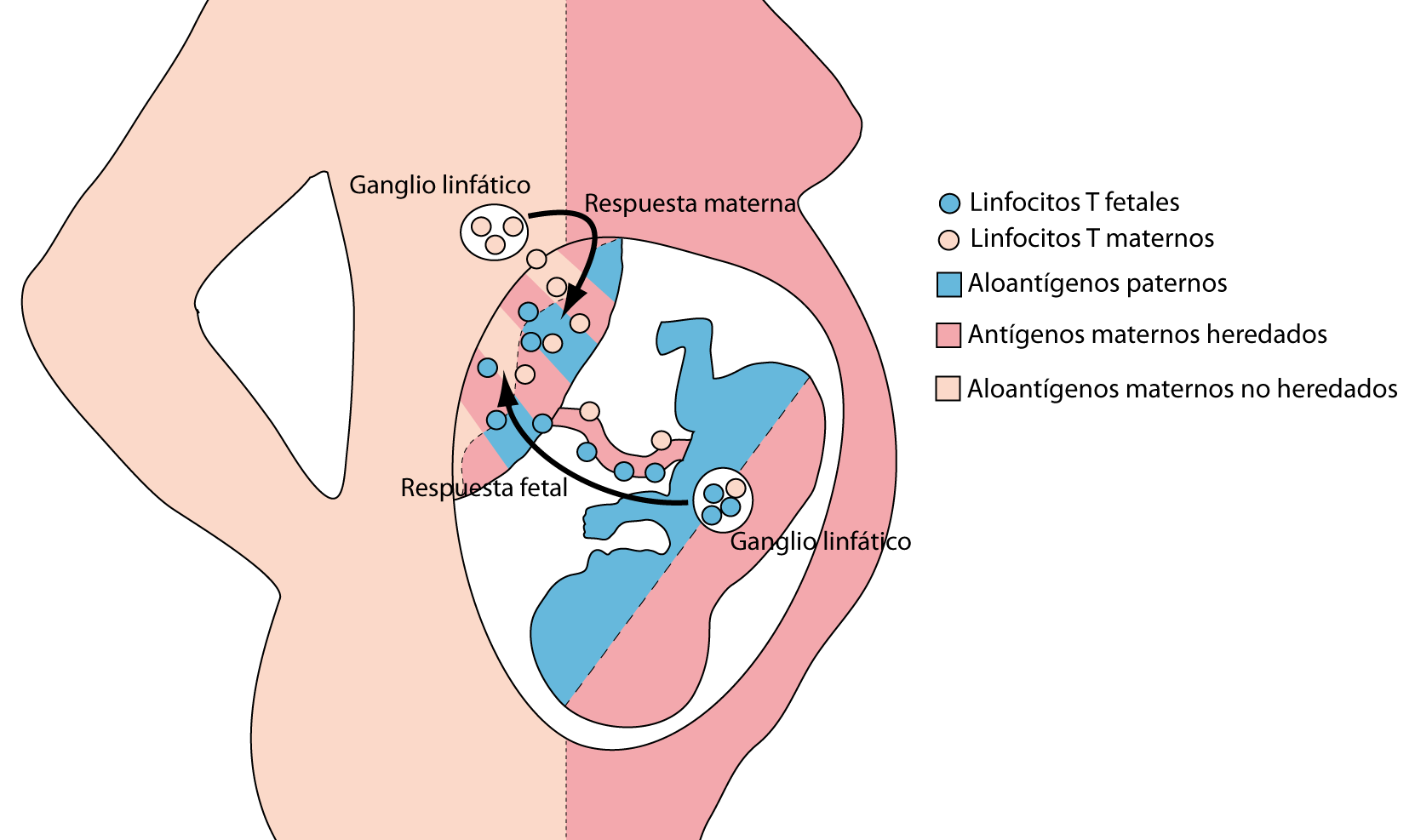
Figura 1: Reconocimiento de aloantígenos por linfocitos T. Los linfocitos T maternos que reconocen aloantígenos paternos expresados en las células trofoblásticas mientras que los linfocitos T fetales que reconocen aloantígenos maternos no heredados expresados en la decidua.
El embarazo transcurre en tres fases inmunológicas con diversas células y mediadores involucrados
Actualmente, desde el punto de vista inmunológico, se pueden identificar en el embarazo tres fases diferentes: la fase temprana, la media y la tardía, caracterizadas por procesos biológicos, perfiles de respuesta inmune y mediadores particulares de cada fase (ver figura 2)[6].
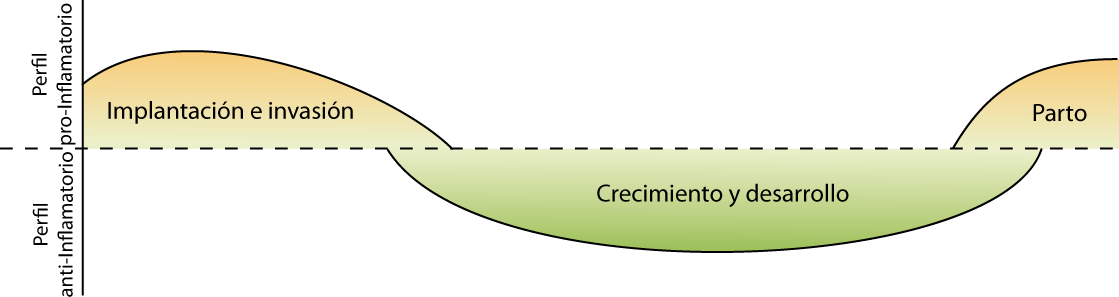
Figura 2: Fases inmunológicas del embarazo. La fase temprana se caracteriza por un perfil pro-inflamatorio: el embrión debe implantarse en el útero (invasión del trofoblasto) dañando el epitelio, la matriz endometrial y la capa de endotelial de los vasos. Así alcanza la vasculatura materna, se asegura el adecuado suministro de nutrientes, oxígeno y la eliminación de desechos tóxicos. Este microambiente inflamatorio, provocado por la producción de diferentes mediadores, también implica la reparación y remoción de células dañadas durante esta etapa. La segunda fase coincide con un estado tolerogénico/ anti-inflamatorio, de crecimiento y desarrollo fetal con interacciones inmunes y endocrinas altamente controladas. La última fase es corta y nuevamente signada por un ambiente pro-inflamatorio que promueve la contracción del útero y la expulsión del bebé y la placenta [7].
En el embarazo normal, entonces, se suceden cambios en la respuesta inmune local y sistémica sujetos a una regulación fina que asegura el adecuado desarrollo del feto. Cuando existen fallas en esta regulación inmune, sobrevienen distintas complicaciones gestacionales: El Aborto recurrente espontáneo de causa inmunológica, la Pre-eclampsia y las Fallas reiteradas en la implantación embrionaria son algunas de las más prevalentes [8].
Distintas poblaciones celulares participan en el control de la respuesta inflamatoria inicial y en el cambio a una respuesta tolerogénica o anti-inflamatoria: los macrófagos deciduales, las células Natural killers uterinas, las células dendríticas y los linfocitos T regulatorios (Tregs) [9, 10] contribuirían a mantener un perfil tolerogénico materno a través de distintas estrategias. A continuación enfocaremos el rol de los linfocitos T regulatorios en la respuesta inmune contra aloantígenos (ver Recuadro 2). Esta subpoblación ha sido estudiada ampliamente por su participación en gran cantidad de enfermedades autoinmunes, y en los últimos años se ha estudiado en detalle su papel en la tolerancia materno-fetal, donde se postula que cumplirían un rol clave [11].
La hipótesis de la tolerancia en la interfase materno-fetal
En el contexto del embarazo, el concepto de células T regulatorias naturales e inducibles puede traducirse en que las nTregs modularían la respuesta inmune contra los antígenos fetales heredados de la madre, mientras que las iTregs modularían la respuesta frente a aloantígenos fetales de origen paterno.
Las iTregs son originadas en los ganglios drenantes de la interfase materno-fetal a partir de linfocitos T vírgenes que reconocen a aloantígenos en un contexto tolerogénico [11]. Dependiendo del origen de los linfocitos T y de los aloantígenos que estos reconocen, las iTregs pueden tener dos orígenes: linfocitos T maternos que reconocen aloantígenos paternos expresados en las células trofoblásticas y linfocitos T fetales que reconocen aloantígenos maternos no heredados [15]. Las proposiciones actuales entonces son:
I- Generación de iTregs maternas hacia aloantígenos paternos
La exposición de los linfocitos T maternos a los aloantígenos paternos se produce principalmente en dos etapas: un contacto inicial durante el coito dado por las células en el fluido seminal, y luego un segundo contacto dado por las células trofoblásticas al invadir el endometrio [16].
El semen contiene varios antígenos HLA de clase I (clásicos y no clásicos) y de clase II, asociados al esperma, leucocitos seminales o a células epiteliales descamadas [17]. Estos conducen a la activación y proliferación de linfocitos T maternos. El líquido seminal contiene además, TGF-β y prostaglandina E2 que crean un microambiente anti-inflamatorio propicio para la diferenciación de linfocitos T vírgenes a iTregs [18]. Estos aloantígenos paternos son capturados y procesados por células dendríticas (CDs), que en presencia de las mencionadas citoquinas supresoras mantienen un perfil semi-maduro caracterizado por baja expresión de moléculas coestimulatorias (las proteínas de membrana CD80 y CD86). Las CDs semi maduras migran a los ganglios linfáticos regionales donde los presentan los aloantígenos capturados a linfocitos T vírgenes. Al reconocer su antígeno específico en un contexto tolerogénico, los linfocitos T se diferencian a iTregs. De esta manera, el semen contribuiría a la generación y mantenimiento de una población de iTregs antígeno-especificas contra los aloantígenos paternos previo a la implantación del embrión [17].
Las células trofoblásticas expresan aloantígenos de origen paterno y antígenos propios que son reconocidos por los linfocitos T maternos como extraños, en un ambiente tolerogénico. Esto conduce a la activación y diferenciación de estos linfocitos a iTregs de la misma forma que ocurre ante los aloantígenos paternos presentes en el semen (ver figura 3) [15]. Asimismo, las células trofoblásticas secretan quimioquinas (citoquinas con capacidad de atraer distintas poblaciones celulares inmunes), que reclutan a las iTregs originadas por contactos previos, así como también a nTregs maternas con alta capacidad supresora [19].
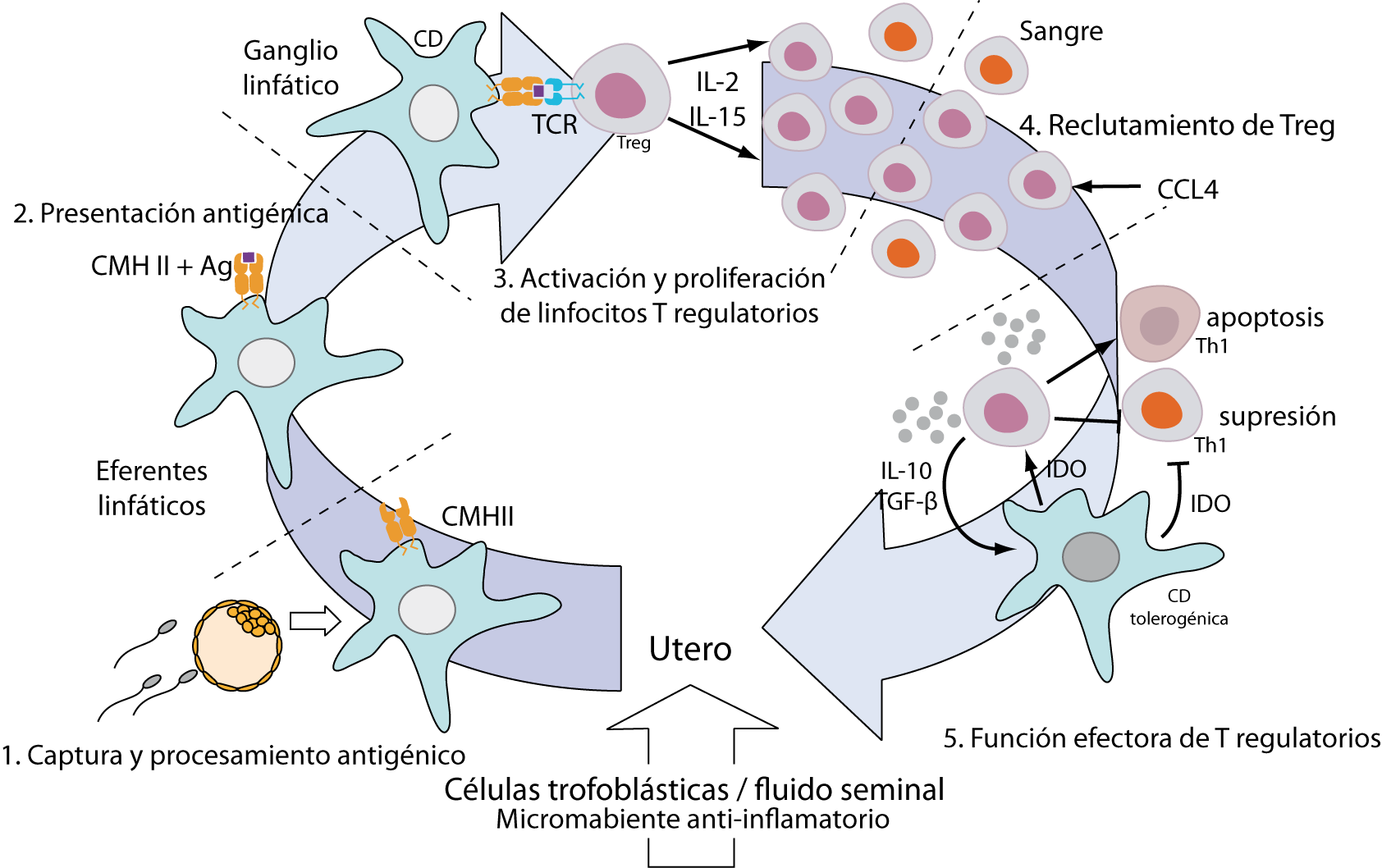
Figura 3: Generación de iTregs maternas. Células dendríticas (CD) tolerogénicas capturan y procesan antígenos procedentes del fluido seminal o de las células trofoblásticas en un microambiente anti-inflamatorio/tolerogénico. Estas migran a los ganglios linfáticos drenantes del útero donde presentan su antígeno tanto a nTregs como a linfocitos T vírgenes, diferenciando estos últimos a iTregs y promoviendo la expansión y activación de ambos. Los Tregs luego son reclutados por el trofoblasto al sitio de implantación por medio de distintas quimioquinas, allí suprimirán la respuesta de linfocitos T efectores o inducirán su apoptosis al mismo tiempo que favorecen la diferenciación de CDs a un perfil tolerogénico. Figura adaptada de Guerin et al 2009 [20].
II- Generación de iTregs fetales hacia aloantígenos maternos no heredados
Desde el punto de vista del feto, las células maternas presentan una serie de aloantígenos que no fueron heredados y por lo tanto le resultan extraños [21]. A partir de la semana 10 de gestación ya se pueden detectar células inmunes fetales. Evidencias recientes muestran que, en la semana 20 de embarazo, el sistema inmune del feto ya es maduro, activo y capaz de generar una respuesta inmune contra antígenos extraños. Sin embargo, en esta etapa, el sistema inmune del feto está principalmente orientado a generar una respuesta tolerogénica, a través de la generación de iTregs fetales [22].
Recientemente se ha propuesto que durante el embarazo, células inmunes fetales, migran a la placenta donde se encuentran con células maternas que expresan aloantígenos no heredados. Estas células se activan y migran al ganglio linfático fetal donde activan a los linfocitos T fetales y, debido al ambiente altamente tolerogénico y supresor donde esto ocurre, los diferencian a iTregs fetales. Luego, los iTregs fetales migran a la placenta donde suprimen la respuesta inmune fetal hacia los aloantígenos maternos no heredados por los mismo mecanismos que lo hacen los Tregs maternos [21]. Por otra parte, evidencias recientes indican que los linfocitos T maternos son capaces de migrar desde la placenta hacia los nódulos linfáticos del feto, y allí estimular la activación y diferenciación de los linfocitos T vírgenes fetales a iTregs (ver figura 4) [23].
La relevancia de la generación de los iTregs fetales se ve reflejada en la evidencia que el número de niños con una mutación totalmente nula de FoxP3, el factor de transcripción indispensable para la generación de Tregs, es prácticamente cero. Se postula que, posiblemente al no regularse la respuesta inmune fetal, ésta dañaría la placenta y por tanto al suministro de oxígeno y nutrientes generando que el embarazo sea inviable [15].
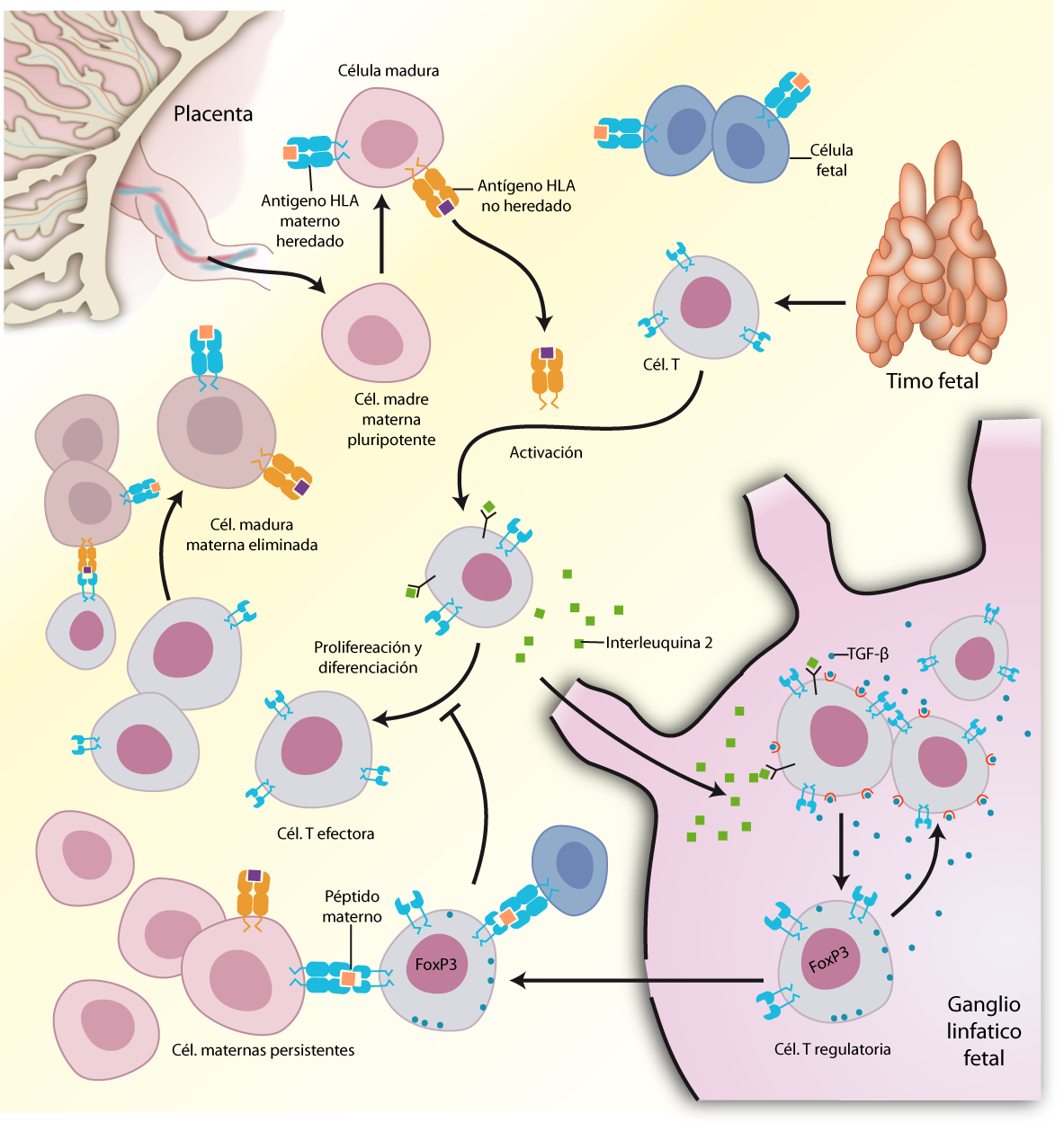
Figura 4: Generación de iTregs fetales. Los linfocitos T vírgenes del feto reconocen a los aloantígenos maternos no heredados, activándose. Estos pueden migrar al ganglio linfático del feto, donde el ambiente tolerogénico los diferencia a iTregs fetales. Estos iTregs fetales regresan a la placenta, donde suprimen la respuesta inmune fetal de los linfocitos T fetales efectores. Adaptado de Burlingham 2009 [23]
Conclusiones
De la idea original de que el sistema inmune no debía reconocer como extraño al feto para que este sobreviviera, se ha pasado a una hipótesis donde el reconocimiento de los aloantígenos fetales por parte de la madre y de los aloantígenos maternos no heredados por parte del feto, es crucial para la generación de una respuesta inmune que permita la correcta implantación del embrión y la invasión de la placenta. Tanto la falta de reconocimiento de los aloantígenos, como la incapacidad de controlar la respuesta inmune hacia ellos por parte de la madre y/o del feto, son causas inmunológicas de problemas del embarazo.
Por otra parte, del concepto de la “placenta como una barrera pasiva” pasamos a la “placenta como un órgano inmune altamente activo en la generación de la inmuno-tolerancia”. Asimismo, hoy en día se sabe que el feto tampoco tiene un rol pasivo, sino que presenta un sistema inmune maduro y participa activamente en la generación de células inmunes regulatorias.
Desde la
ciencia básica se nos plantea entonces, como desafío para los próximos años,
el estudio de los mecanismos implicados en la interacción entre el sistema
inmune materno, fetal y la placenta involucrados en la generación de
tolerancia, con el objetivo de desarrollar nuevas técnicas de diagnóstico y
posibles tratamientos médicos.
Referencias:
[1] R.E. BILLINGHAM, L. BRENT, and P.B. MEDAWAR, “Actively acquired tolerance of foreign cells,” Nature, vol. 172, Oct. 1953, pp. 603-606.
[2] R.M. Zinkernagel, “The Nobel Lectures in Immunology. The Nobel Prize for Physiology or Medicine, 1996. Cellular immune recognition and the biological role of major transplantation antigens,” Scandinavian Journal of Immunology, vol. 46, Nov. 1997, pp. 421-436.
[3] H. Hutter and G. Dohr, “HLA expression on immature and mature human germ cells,” Journal of Reproductive Immunology, vol. 38, Jul. 1998, pp. 101-122.
[4] A. Moffett and C. Loke, “Immunology of placentation in eutherian mammals,” Nature Reviews. Immunology, vol. 6, Aug. 2006, pp. 584-594.
[5] H. Huddleston and D.J. Schust, “Immune interactions at the maternal-fetal interface: a focus on antigen presentation,” American Journal of Reproductive Immunology (New York, N.Y.: 1989), vol. 51, Apr. 2004, pp. 283-289.
[6] G. Mor, “Inflammation and pregnancy: the role of toll-like receptors in trophoblast-immune interaction,” Annals of the New York Academy of Sciences, vol. 1127, Apr. 2008, pp. 121-128.
[7] S. Fest, P.B. Aldo, V.M. Abrahams, I. Visintin, A. Alvero, R. Chen, S.L. Chavez, R. Romero, and G. Mor, “Trophoblast-macrophage interactions: a regulatory network for the protection of pregnancy,” American Journal of Reproductive Immunology (New York, N.Y.: 1989), vol. 57, 2007, pp. 55-66.
[8] G. Mor and I. Cardenas, “The immune system in pregnancy: a unique complexity,” American Journal of Reproductive Immunology (New York, N.Y.: 1989), vol. 63, Jun. 2010, pp. 425-433.
[9] V.A. Fontana, “Citoquinas: el lenguaje del dialogo materno-embrionario,” Quimica Viva, vol. 7, Jul. 2008, pp. 80-102.
[10] Loke Y, “Uterine mucosal leucocytes,” Human Implantation, Cambridge University Press, 1995.
[11] V.R. Aluvihare, M. Kallikourdis, and A.G. Betz, “Regulatory T cells mediate maternal tolerance to the fetus,” Nature Immunology, vol. 5, Mar. 2004, pp. 266-271.
[12] E.M. Shevach, “CD4+ CD25+ suppressor T cells: more questions than answers,” Nature Reviews. Immunology, vol. 2, Jun. 2002, pp. 389-400.
[13] D.A.A. Vignali, L.W. Collison, and C.J. Workman, “How regulatory T cells work,” Nature Reviews. Immunology, vol. 8, Jul. 2008, pp. 523-532.
[14] M. Kallikourdis and A.G. Betz, “Periodic accumulation of regulatory T cells in the uterus: preparation for the implantation of a semi-allogeneic fetus?,” PloS One, vol. 2, 2007, p. e382.
[15] A.G. Betz, “Immunology. Have you seen your mother, baby..,” Science (New York, N.Y.), vol. 330, Dec. 2010, pp. 1635-1636.
[16] S.A. Robertson, L.R. Guerin, L.M. Moldenhauer, and J.D. Hayball, “Activating T regulatory cells for tolerance in early pregnancy - the contribution of seminal fluid,” Journal of Reproductive Immunology, vol. 83, Dec. 2009, pp. 109-116.
[17] M. Johansson, J.J. Bromfield, M.J. Jasper, and S.A. Robertson, “Semen activates the female immune response during early pregnancy in mice,” Immunology, vol. 112, Jun. 2004, pp. 290-300.
[18] W. Chen, W. Jin, N. Hardegen, K.-J. Lei, L. Li, N. Marinos, G. McGrady, and S.M. Wahl, “Conversion of peripheral CD4+CD25- naive T cells to CD4+CD25+ regulatory T cells by TGF-beta induction of transcription factor Foxp3,” The Journal of Experimental Medicine, vol. 198, Dec. 2003, pp. 1875-1886.
[19] M. Kallikourdis, K.G. Andersen, K.A. Welch, and A.G. Betz, “Alloantigen-enhanced accumulation of CCR5+ ‘effector’ regulatory T cells in the gravid uterus,” Proceedings of the National Academy of Sciences of the United States of America, vol. 104, 2007, pp. 594-599.
[20] L.R. Guerin, J.R. Prins, and S.A. Robertson, “Regulatory T-cells and immune tolerance in pregnancy: a new target for infertility treatment?,” Human Reproduction Update, vol. 15, Oct. 2009, pp. 517-535.
[21] J.E. Mold, J. Michaëlsson, T.D. Burt, M.O. Muench, K.P. Beckerman, M.P. Busch, T.-H. Lee, D.F. Nixon, and J.M. McCune, “Maternal alloantigens promote the development of tolerogenic fetal regulatory T cells in utero,” Science (New York, N.Y.), vol. 322, Dec. 2008, pp. 1562-1565.
[22] J.E. Mold, S. Venkatasubrahmanyam, T.D. Burt, J. Michaëlsson, J.M. Rivera, S.A. Galkina, K. Weinberg, C.A. Stoddart, and J.M. McCune, “Fetal and adult hematopoietic stem cells give rise to distinct T cell lineages in humans,” Science (New York, N.Y.), vol. 330, Dec. 2010, pp. 1695-1699.
[23] W.J. Burlingham, “A lesson in tolerance--maternal instruction to fetal cells,” The New England Journal of Medicine, vol. 360, Mar. 2009, pp. 1355-1357.
|
Revista QuímicaViva Número 1, año 10, Diciembre 2011 quimicaviva@qb.fcen.uba.ar |